Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Способы выражения концентрации растворов
Содержание
- 1. Способы выражения концентрации растворов
- 2. Тема урока:«Способы выражения концентраций растворов»
- 3. Цели урока:расширить и систематизировать представления о способах
- 4. Концентрация — величина, характеризующая количественный состав раствора.Согласно
- 5. Способы выражения концентрации растворов 1 Массовая доля
- 6. Процентная концентрация, массовая доля растворённого веществаМассовая доля
- 7. В бинарных растворах часто существует однозначная зависимость
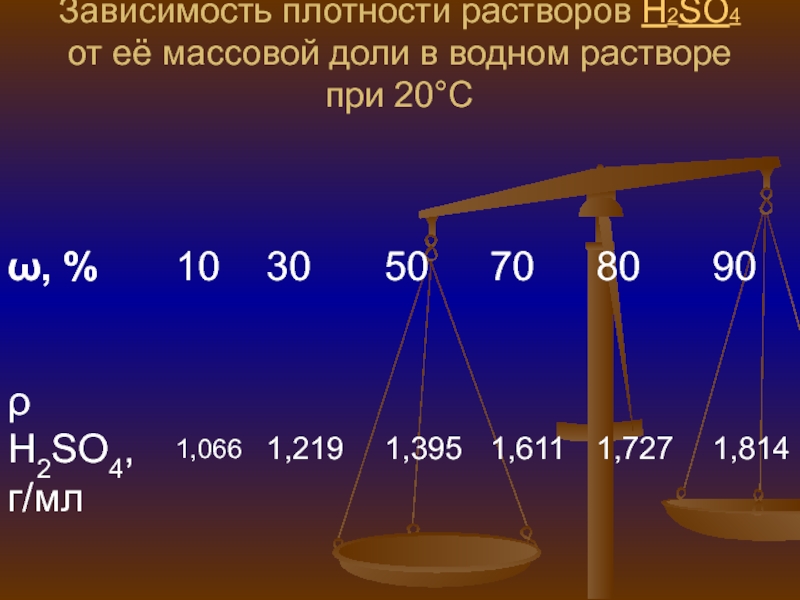
- 8. Зависимость плотности растворов H2SO4 от её массовой доли в водном растворе при 20°C
- 9. Объёмная доля Объемная доля — отношение
- 10. Молярность (молярная концентрация) Молярность — число
- 11. Мольная доля Мольная доля (X) — отношение
- 12. Моляльность (моляльная концентрация) Моляльность
- 13. Титр раствора Титр раствора — масса растворённого
- 14. Нормальность (молярная концентрация эквивалента) Нормальность (Сн)— число
- 15. Коэффициент растворимостиОчень часто концентрацию насыщенного раствора, наряду
- 16. Задачи1.Определите молярную концентрацию хлорида натрия в 24%-ном
- 17. 6. К воде массой 200 г прилили
- 18. Скачать презентанцию
Тема урока:«Способы выражения концентраций растворов»
Слайды и текст этой презентации
Слайд 1Что обозначается этими величинами в химии?
ω, См, X
Выполнила учитель
химии МБОУ Климовской СОШ№1 Буданкова Валентина Михайловна
Слайд 3Цели урока:
расширить и систематизировать представления о способах выражения концентрации растворов;
изучить
новые способы выражения концентраций растворов;
учиться применять полученные теоретические знания при
решении задач;развивать интеллектуальные умения и навыки.
Слайд 4Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАКСогласно правилам
ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества
растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями.Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Слайд 5Способы выражения концентрации растворов
1 Массовая доля (весовые проценты,
процентная концентрация)
2 Объёмная доля
3 Молярность (молярная концентрация)
44
Мольная доля5 5 Моляльность (моляльная концентрация)
6 Титр раствора
7 7 Нормальность (молярная концентрация эквивалента)
8 Растворимость вещества
Слайд 6Процентная концентрация, массовая доля растворённого вещества
Массовая доля растворённого вещества-это отношение
массы растворённого вещества к массе раствора.
Для расчёта процентной концентрации
используется формула: Раствор состоит из растворённого вещества и растворителя. Массу раствора можно определить по формуле:
Слайд 7В бинарных растворах часто существует однозначная зависимость между плотностьюВ бинарных
растворах часто существует однозначная зависимость между плотностью раствора и его
концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметраВ бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометраВ бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметраВ бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометраВ бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спиртаВ бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жираВ бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Часто для выражения концентрации (например, серной кислотыВ бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Часто для выражения концентрации (например, серной кислоты в аккумуляторах) пользуются просто их плотностью. Распространены ареометры предназначенные для определения концентрации растворов веществ.Слайд 9Объёмная доля
Объемная доля — отношение объёма растворённого вещества
к объёму раствора. Объёмная доля измеряется в долях единицы или
в процентах.где: V (в-ва) — объём растворённого вещества, л;
V(р-ра) — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора.
Слайд 10Молярность
(молярная концентрация)
Молярность — число молей растворённого
вещества в единице объёма раствора.
где ν- количество
растворённого вещества, моль;V- объём раствора, л
Молярность чаще выражают в моль/л или ммоль/л. Возможны следующие обозначения молярной концентрации - С, См, М.
Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным (0,5М).
Слайд 11Мольная доля
Мольная доля (X) — отношение количества молей данного
компонента к общему количеству молей всех компонентов. Мольную долю выражают
в долях единицы.X = ν(в-ва)\ ∑ν(в-в)
ν — количество компонента, моль;
∑ν — сумма количеств всех компонентов,
моль.
Слайд 12Моляльность
(моляльная концентрация)
Моляльность — число молей растворённого вещества
в 1кг
растворителя. Измеряется в моль/кг, Так, раствор с концентрацией
0,5 моль/кг называют 0,5-моляльным.
Св = ν /m(р-ля),
где: ν— количество растворённого вещества, моль;
m (р-ля) — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярность и моляльность величины различные. Прежде всего, при выражении концентрации в моляльности, в отличие от молярности, расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярности, не зависит от температуры.
Слайд 13Титр раствора
Титр раствора — масса растворённого вещества в
1 мл раствора.
Т=m(в-ва)/V(р-ра),
где: m(в-ва) — масса растворённого вещества, г;
V(р-ра) — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Слайд 14Нормальность (молярная концентрация эквивалента)
Нормальность (Сн)— число эквивалентов данного вещества в
одном литре раствора. Нормальность выражают в моль-экв/л. Часто концентрацию таких
растворов выражают как «н». Например, раствор содержащий 0,1 моль-экв/л называют децинормальным и записывают как 0,1н.Сн =Э/ V (р-ра), где:
Э — эквивалент, моль-экв;
V — общий объём раствора, л;
Сн(щёлочи) ∙V(щёлочи)= Сн(кислоты)∙ V(кислоты)
Слайд 15Коэффициент растворимости
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками,
выражают через так называемый коэффициент растворимости или просто растворимость вещества.
Отношение
массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости: Кр = m(в-ва) / m(р-ля)
Растворимость вещества показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
р = (mв-ва / mр-ля) ∙ 100%
Слайд 16Задачи
1.Определите молярную концентрацию хлорида натрия в 24%-ном растворе его плотностью
1,18 г/мл. (Ответ - 4,84 М )
2. Определите молярную
концентрацию соляной кислоты в 20%-ном растворе плотностью 1,098. (Ответ - 6М) 3. Определите молярную концентрацию азотной кислоты в 30%-ном растворе ее плотностью 1,18 г/мл. (Ответ - 5,62 М )
4. Вычислите массовую долю гидроксида калия в водном растворе с концентрацией 3М и плотностью 1,138 г/мл. (Ответ - 15 %)
5. Сколько мл 56 %-ного раствора серной кислоты ( плотность-1,46г/мл) нужно для приготовления 3 л 1М раствора? (Ответ - 360 мл)
Слайд 176. К воде массой 200 г прилили 2М раствор хлорида
калия объемом 40 мл и плотностью 1,09 г/мл. Определите молярную
концентрацию и массовую долю соли в полученном растворе, если его плотность оказалась равна 1,015 г/мл. (Ответ - 0,33М, 2,45%)7. Сколько г гидроксида калия нужно для нейтрализации 300 мл 0,5 М раствора серной кислоты? ( Ответ - 16,8 г )
8. Какой объем 2 М раствора гидроксида калия вступит в реакцию: а) с 49 г серной кислоты б) с 200 г 24,5%-ного раствора серной кислоты? В) с 50 г 6,3%-ного раствора азотной кислоты?
9. Какой объем 3М раствора хлорида натрия плотностью 1,12 г/мл надо прилить к воде массой 200 г , чтобы получить раствор с массовой долей соли 10%? (Ответ - 315 мл)
10. Какой объем 3М раствора хлорида калия потребуется для приготовления 200 мл 8%-ного раствора соли с плотностью 1,05 г/мл? (Ответ - 75,2 мл)
11. 2,8 л аммиака растворили в воде, объем раствора довели до 500 мл. Какое количество вещества аммиака содержится в 1 л такого раствора? (Ответ - 0,25 моль)