Слайд 11 вариант
2 вариант
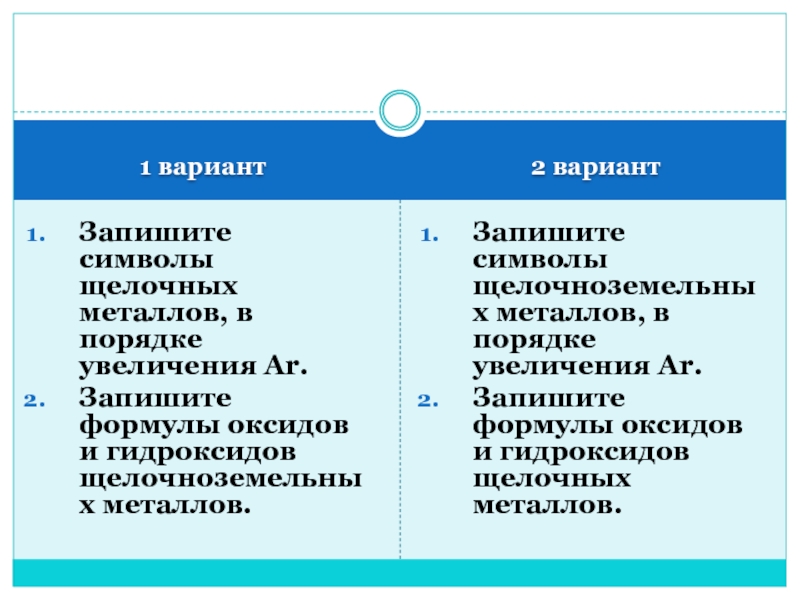
Запишите символы щелочных металлов, в порядке увеличения Ar.
Запишите
формулы оксидов и гидроксидов щелочноземельных металлов.
Запишите символы щелочноземельных металлов, в
порядке увеличения Ar.
Запишите формулы оксидов и гидроксидов щелочных металлов.
Слайд 21 вариант
2 вариант
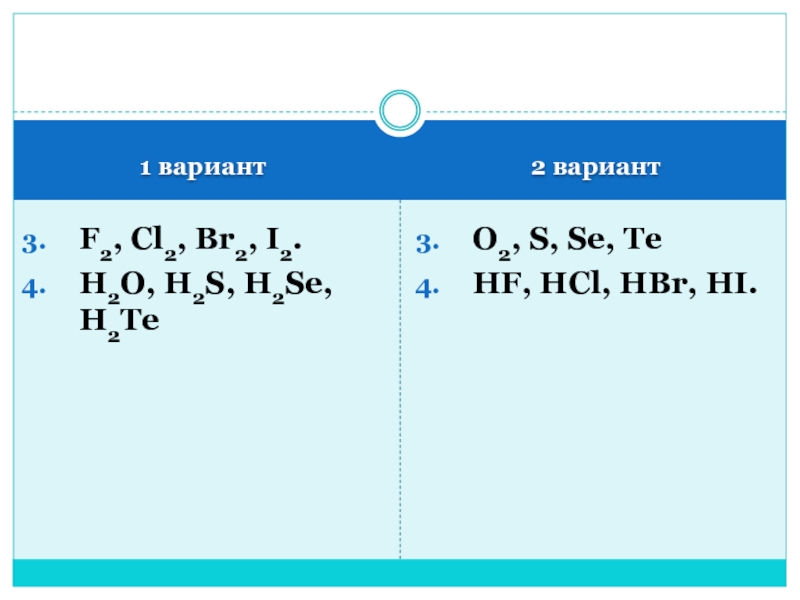
Запишите символы галогенов, в порядке увеличения Ar.
Запишите формулы
водородных соединений халькогенов.
Запишите символы халькогенов, в порядке увеличения Ar.
Запишите формулы
водорородных соединений галогенов.
Слайд 31 вариант
2 вариант
Li, Na, K, Rb
MgO, CaO, SrO, BaO, Mg(OH)2,
Ca(OH)2, Sr(OH)2, Ba(OH)2
Mg, Ca, Sr, Ba
Li2O, Na2O, K2O, Rb2O,
LiOH, NaOH, KOH, RbOH
Слайд 41 вариант
2 вариант
F2, Cl2, Br2, I2.
H2O, H2S, H2Se, H2Te
O2, S,
Se, Te
HF, HCl, HBr, HI.
Слайд 504.03.2013 г.
Периодический закон Д.И. Менделеева
Слайд 6Работы предшественников
Й. Берцелиус (Металлы и неметаллы)
И.В. Деберейнер (Триады)
Д.А.Р. Ньюлендс (Октавы)
Л.Мейер
Слайд 7Й. Берцелиус
Металлы
Неметаллы
Классификация химических элементов
Слайд 8И.В. Деберейнер
Закон триад явно указывал на наличие взаимосвязи между
атомной массой и свойствами элементов и их соединений. Все дальнейшие
попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
Закон триад
Слайд 9Д.А.Р. Ньюлендс
Закон октав
Ньюлендс показал, что в ряду элементов, размещённых в
порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами
первого. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест.
Слайд 10Л.Мейер
Опубликовал свою первую таблицу, в которую включены 42 элемента (из
63), размещённые в шесть столбцов согласно их валентностям. Мейер намеренно
ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов.
Слайд 11В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому
химическому обществу периодический закон химических элементов, изложенный в нескольких основных
положениях.
В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
Слайд 12Д.И. Менделеев расположил элементы в порядке возрастания атомных масс в
ряд:
Li, Be, … O, F,
Na, Mg, … S, Cl,
K, Ca,
… Se, Br
Rb, Sr, … Te, I.
Слайд 13Свойства элементов, а также и свойства образуемых ими простых и
сложных веществ находятся в периодической зависимости от их атомных масс
Периодический
закон Д.И. Менделеева
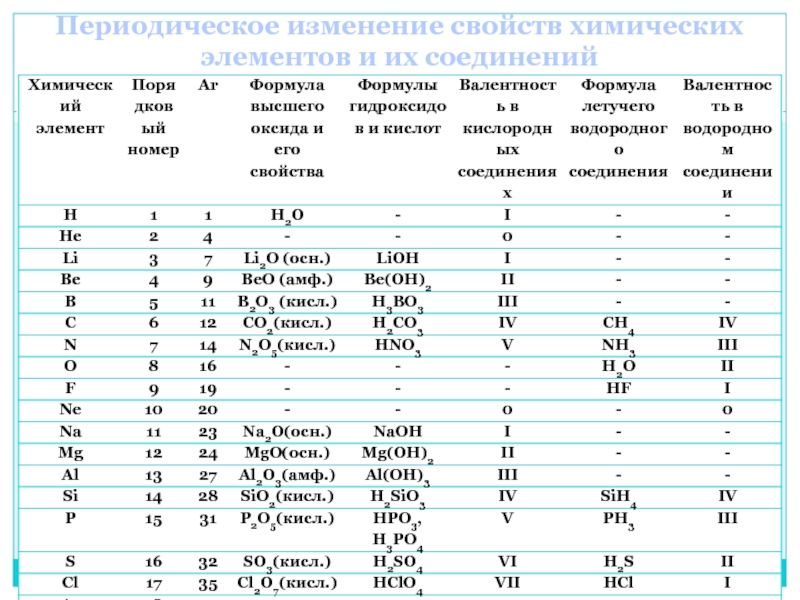
Слайд 14Периодическое изменение свойств химических элементов и их соединений
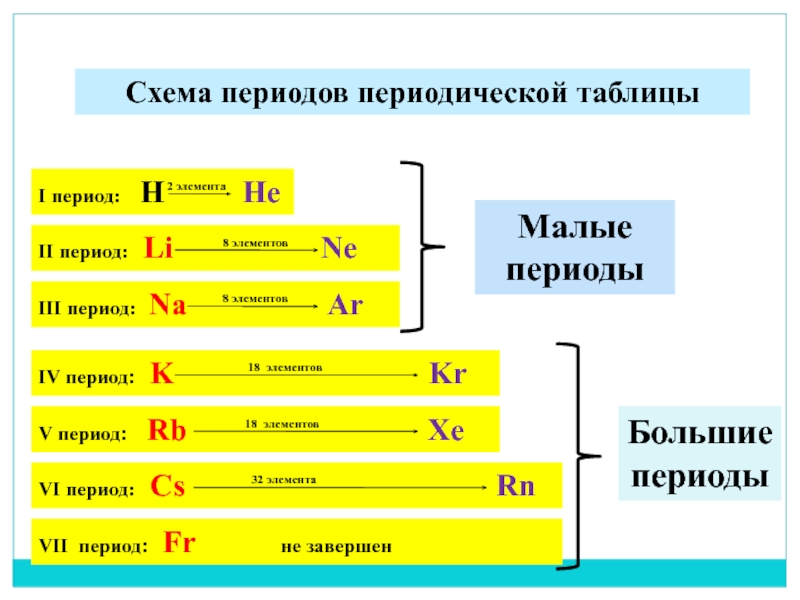
Слайд 15Период
Ряд химических элементов, расположенных в прядке возрастания атомных масс.
Период начинается металлом и заканчивается инертным элементом
элемента
Схема периодов периодической таблицы
II период: Li
Ne
8 элементов
III период: Na Ar
Малые периоды
8 элементов
IV период: K Kr
18 элементов
V период: Rb Xe
18 элементов
VI период: Сs Rn
32 элемента
VII период: Fr не завершен
Большие периоды
Слайд 17В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов
и применение её к указанию свойств неоткрытых элементов", в котором
предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций).
Слайд 18Периодическая система химических элементов Д.И. Менделеева
Слайд 19В приведенном ряду химических элементов:
Li – Be – В –
C – N – O – F – Na
При переходе
от лития к фтору происходит ослабление _________ свойств.
Значение высшей валентности элементов ___________.
При переходе от фтора к натрию происходит ___________ изменение свойств и валентности.
Натрий по свойствам похож на ______.
металлических
увеличивается
закономерное
литий
Слайд 20Найдите в ПСХЭ элементы с порядковыми номерами: 11, 12, 13,
14:
Как изменяются химические свойства простых веществ, образованных этими элементами?
Напишите формулы
оксидов и гидроксидов этих элементов. Как изменяется характер их свойств?
У какого вещества ярче выражены металлические свойства?
Слайд 21Проверяем:
Металлические свойства уменьшаются, валентность возрастает;
Na2O, NaOH, MgO, Mg(OH)2, Al2O3, Al(OH)3,
SiO2, H2SiO3
Металлические свойства ярче выражены у натрия.
Слайд 22Домашнее задание
§ 52 прочитать;
Стр. 139 № 4-7.