Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
13-лек-РАВ.ppt
Содержание
- 1. 13-лек-РАВ.ppt
- 2. Примеры1) Kb→0; Ka→ ∞CuSO4 → Cu2+ +
- 3. 6.7 Произведение растворимости[Kat+]= x·C [моль/л] [An-]= y·C [моль/л]
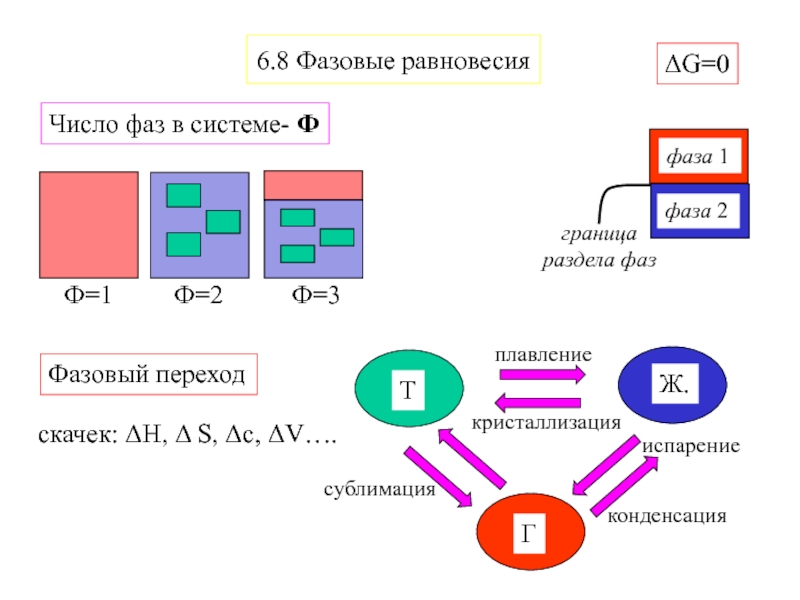
- 4. 6.8 Фазовые равновесияΔG=0Фазовый переходскачек: ΔH, Δ S, Δc, ΔV….Число фаз в системе- Ф
- 5. Число компонентов - К Число видов молекул,
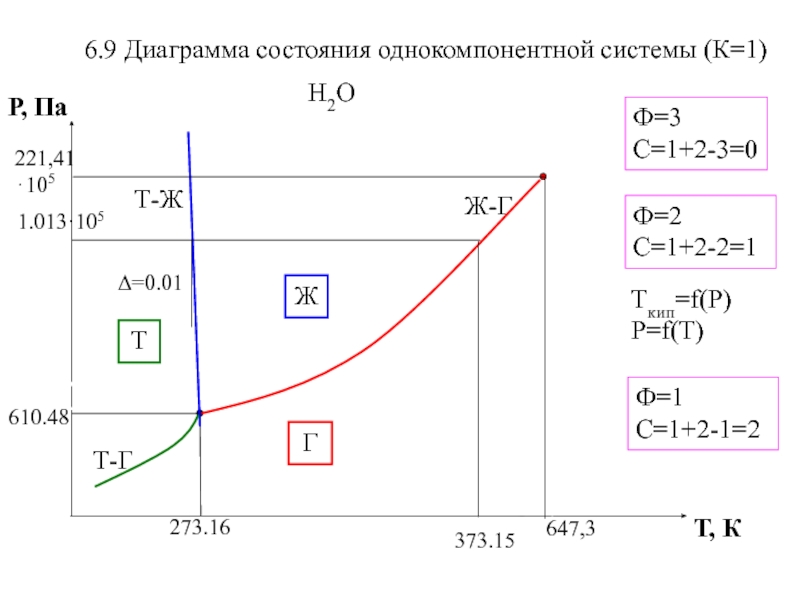
- 6. 6.9 Диаграмма состояния однокомпонентной системы (К=1)Н2ОФ=2 С=1+2-2=1Ф=3С=1+2-3=0Ф=1 С=1+2-1=2ЖГ ТTкип=f(Р) Р=f(T)
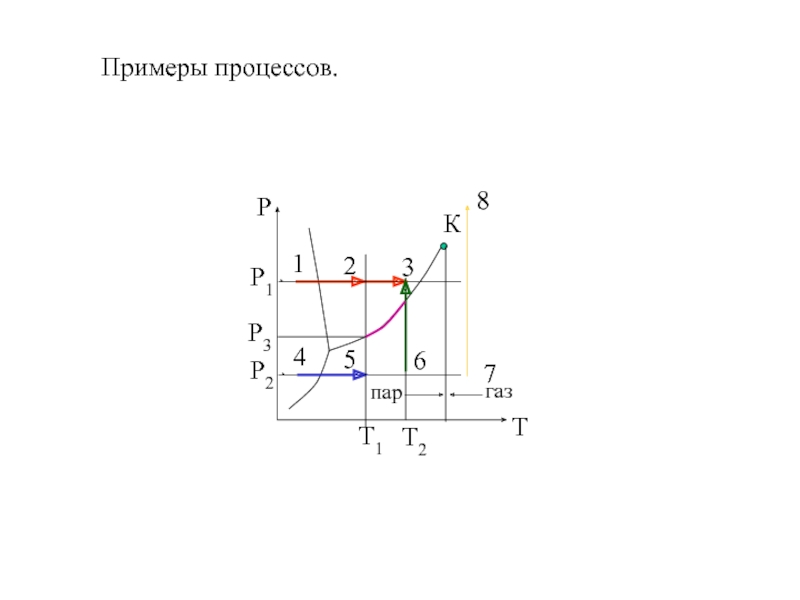
- 7. Примеры процессов.
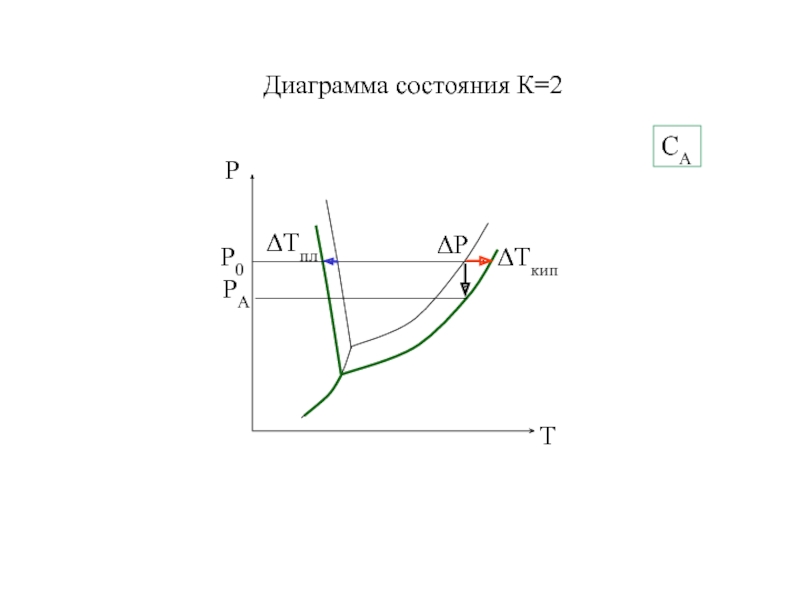
- 8. 6.10 Двухкомпонентная система (К=2)α→0Двухфазное равновесие С =
- 9. Диаграмма состояния К=2СА
- 10. Кипение и кристаллизация растворов Повышение температуры кипения
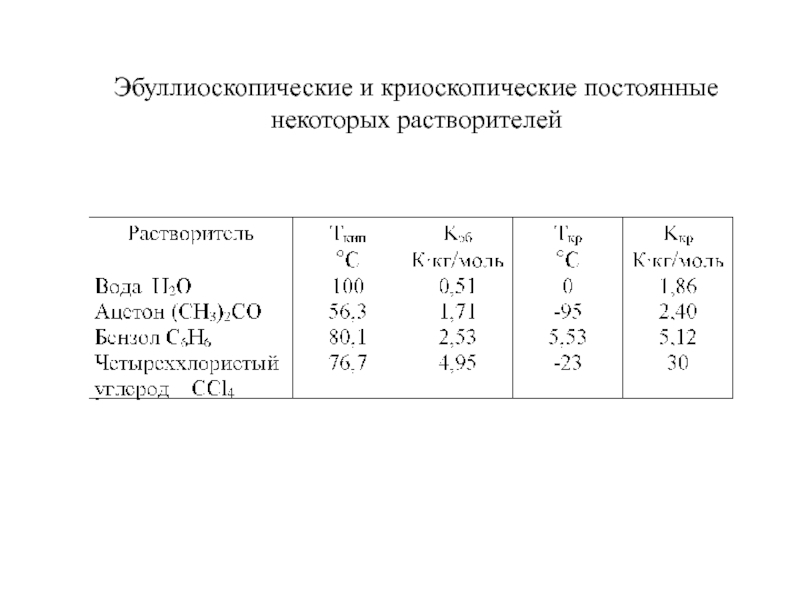
- 11. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- 12. 6.11 Изотонический коэффициент - i - показывает
- 13. Скачать презентанцию
Слайды и текст этой презентации
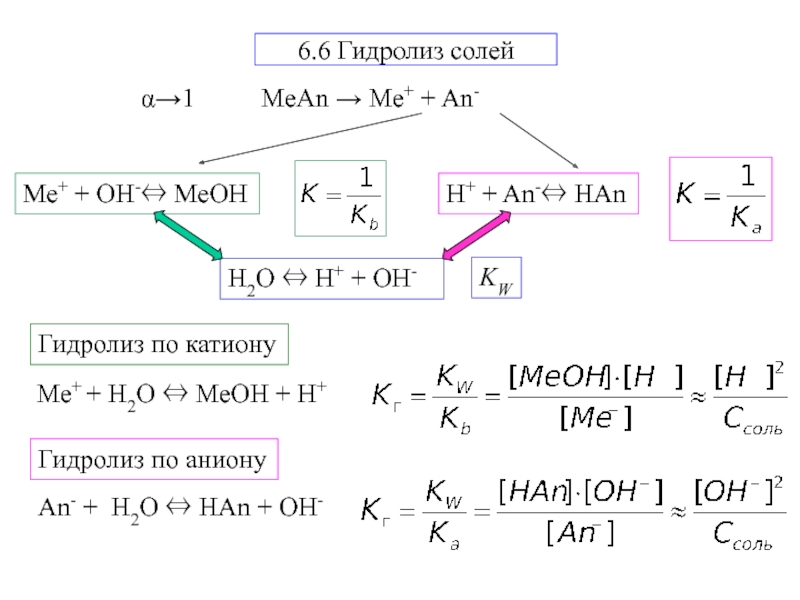
Слайд 2Примеры
1) Kb→0; Ka→ ∞
CuSO4 → Cu2+ + SO42-
2 CuSO4+
2 H2O ⇔ [CuOH]2 SO4 + H2 SO4
2) Ka→0; Kb→
∞pH <7
4) Ka→ ∞; Kb→ ∞
3) Ka→0; Kb→ 0
Na3РO4 → 3Na+ + РO43-
Na3РO4+ H2O ⇔ Na2HРO4+ NaOH
pH >7
Гидролиза нет
pH=7
NH4NO2 → NH4+ + NO2-
pH≈7
(Na++Cl-)
Cu2+ + H2O ⇔ CuOH+ + H+
РO43- + H2O ⇔ HРO42-+ OH-
NH4+ + H2O ⇔ NH4OH + H+
NO2- + H2O ⇔ НNO2 + OH-
Слайд 5Число компонентов - К
Число видов молекул, необходимое и достаточное
для образования всех фаз системы, за вычетом числа независимых реакций
в системеК=3
К=3–1=2
N2+3H2 ⇔ 2NH3
Число термодинамических степеней свободы - С
Число параметров равновесия (p, T, C), которые могут произвольно изменяться при этом не изменяется число фаз в системе и ее строение
Правило фаз Гиббса - С = К + 2 – Ф
Слайд 66.9 Диаграмма состояния однокомпонентной системы (К=1)
Н2О
Ф=2 С=1+2-2=1
Ф=3
С=1+2-3=0
Ф=1 С=1+2-1=2
Ж
Г
Т
Tкип=f(Р)
Р=f(T)
Слайд 86.10 Двухкомпонентная система (К=2)
α→0
Двухфазное равновесие
С = 2 + 2
– 2 = 2
1) Т⇔Ж; Ж ⇔ Г
2) Т⇔
Г Ф=3 С = 2 + 2 – 3 = 1
Слайд 10Кипение и кристаллизация растворов
Повышение температуры кипения раствора по сравнению
с чистым растворителем (ΔТкип) прямо пропорционально концентрации растворенного вещества
См
[моль/кг] – моляльная концентрацияKэб [К⋅кг/моль]– эбуллиоскопическая постоянная растворителя
Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества
Kкр [К⋅кг/моль]– криоскопическая постоянная растворителя
ΔТкип = Kэб⋅См
ΔТкр = Kкр⋅См
Слайд 126.11 Изотонический коэффициент - i
- показывает увеличение числа частиц
в растворе электролита по сравнению с раствором не электролита той
же концентрацииАxВy ⇔ x А+ + y В-
α - степень диссоциации
N0 - число молекул растворенного вещества
m = x + y
![13-лек-РАВ.ppt Примеры1) Kb→0; Ka→ ∞CuSO4 → Cu2+ + SO42- 2 CuSO4+ 2 Примеры1) Kb→0; Ka→ ∞CuSO4 → Cu2+ + SO42- 2 CuSO4+ 2 H2O ⇔ [CuOH]2 SO4 + H2](/img/thumbs/bd586af400615b0edc2729ac3400c39e-800x.jpg)
![13-лек-РАВ.ppt 6.7 Произведение растворимости[Kat+]= x·C [моль/л] [An-]= y·C [моль/л] 6.7 Произведение растворимости[Kat+]= x·C [моль/л] [An-]= y·C [моль/л]](/img/thumbs/da7d93fea1ee1ad38f5cfabb8cdf61c8-800x.jpg)