Слайд 18.5. УДАЛЕНИЕ ОРГАНИЧЕСКИХ ВЕЩЕСТВ, ПРИВКУСОВ И ЗАПАХОВ
Слайд 2Содержащиеся в воде природных источников различные вещества, а также микроорганизмы
могут придавать ей неприятные запахи и привкусы, ухудшающие качество воды
и препятствующие использованию ее для питьевых целей.
Весьма часто наличие запахов и привкусов в природной воде обусловливается выделением в результате жизнедеятельности и отмирания находящихся в воде микроорганизмов и водорослей пахнущих веществ. Для борьбы с этими запахами и привкусами можно применять хлорирование. Малые дозы хлора, вызывая отмирание микроорганизмов, могут увеличить запах; лишь увеличенные дозы хлора, достаточные для окисления органических веществ и микроорганизмов, приводят в некоторых случаях к уничтожению запахов и привкусов.
Слайд 3Если хлорирование воды проводится для целей обеззараживания, то уничтожение запахов
и привкусов, имеющихся в природной воде, может быть проведено попутно.
Однако при назначении дозы хлора должно быть учтено и количество его, необходимое для окисления микроорганизмов.
Для борьбы с запахами и привкусами, которые вызываются наличием в воде микроорганизмов, применяют также метод сорбционного фильтрования. Воду фильтруют через слой активированного угля, который сорбирует вещества, дающие запахи и привкусы. Объем загрузки фильтра из активированного угля в этом случае составляет 0,06—0,12 м3 на 1 м3/ч фильтруемой воды.
Слайд 4Для тех же целей применяют порошкообразный активированный уголь, который вводят
в воду в количестве от 1 до 5 мг/л или
непосредственно перед фильтрами, или частично в смеситель и частично перед фильтрами. Опыты показали, что введение всего угля перед фильтрами значительно сокращает его расход. При периодическом появлении в природной воде запахов и привкусов применение угольного порошка имеет экономические преимущества по сравнению с фильтрованием воды на угольных фильтрах.
Уничтожению привкусов и запахов природной воды может способствовать введение в нее перманганата калия (0,1—2 мг/л).
Запахи и привкусы в воде могут быть вызваны наличием в ней не только микроорганизмов или органических веществ, но и некоторых неорганических веществ, например сероводорода и железа. Уничтожение этих запахов и привкусов производят одновременно с очисткой воды от этих веществ при ее обезжелезивании и удалении сероводорода.
Слайд 6Стабильной называют воду, не вызывающую коррозии поверхностей, с которыми она
соприкасается, и не выделяющую на этих поверхностях осадка карбоната кальция.
Нестабильными
бывают как природные воды, так и вода после ее обработки на очистных сооружениях.
Степень стабильности воды можно оценивать несколькими способами. Экспериментальное определение стабильности воды сводится к тому, что исследуемую воду встряхивают вместе с введенным в нее карбонатом кальция в течение 1—2 ч на специальной машине. При этом до и после встряхивания замеряют общую щелочность воды или рН.
Слайд 7Сущность этих испытаний заключается в том, что если в воде
имеется избыток свободной углекислоты (признак коррозийности воды), то такая вода
будет переводить часть соприкасающегося с ней карбоната кальция в бикарбонат кальция. Это приведет к повышению общей щелочности и рН воды. Если же, наоборот, вода представляет собой пересыщенный раствор карбоната кальция, то последний выделится на зернах карбоната кальция, введенного в воду перед ее встряхиванием. При этом общая щелочность воды и ее рН понизятся.
Слайд 8Значения показателя стабильности выражаются следующим образом:
Если значение С0 или Св
равно единице, то это свидетельствует о стабильности воды; при значении
С0 или Св большем единицы, вода нестабильна и способна к отложению карбоната кальция на омываемых поверхностях; при значении С0 или Св меньшем единицы, вода обладает коррозионной способностью.
Q и S – общая щелочность исследуемой воды, соответственно, до и после встряхивания ее с карбонатом кальция, мг-экв/л; рНис и рНн – величины рН исследуемой воды, соответственно, до и после встряхивания ее с карбонатом кальция.
Слайд 9При отсутствии таких опытных данных стабильность воды можно вычислить по
так называемому индексу насыщения:
Если J = 0, то вода стабильна;
при J > 0 вода способна отлагать карбонат кальция; при J < 0 вода обладает коррозионными свойствами.
Нестабильную воду необходимо подвергать стабилизации в следующих случаях:
1) если J превышает +0,5 в течение более десяти месяцев в году;
2) если J < 0 более восьми месяцев в году.
рН0 – рН исследуемой воды; рНs – рН равновесного насыщения воды карбонатом кальция.
Слайд 10Стабилизация воды при положительном значении индекса насыщения сводится к добавлению
в нее кислоты (обычно серной или соляной), т.е. к понижению
рН0 до такого значения, чтобы значение J стало близким к нулю, вода стала стабильной и отложение карбоната кальция на омываемых поверхностях (стенки труб и др.) прекратилось.
Если вода агрессивна, т.е. pH0
Слайд 11При нестабильности воды в обоих случаях может быть применен гексаметафосфат
натрия. При коррозийной воде добавка к ней гексаметафосфата натрия дает
возможность образовать на внутренней поверхности стенок труб тонкую, но плотную метафосфатную пленку, которая предохраняет металл, труб от непосредственного соприкосновения с водой. В случае способности воды отлагать карбонат кальция добавка в нее гексаметафосфата натрия предотвращает рост кристаллов карбоната кальция и их осаждение на стенках.
Слайд 13Железо в природных водах может содержаться либо в ионной форме
(в виде двухвалентного железа, а также в виде неорганических и
органических коллоидов), либо в форме комплексных соединений двух-и трехвалентного железа или тонкодисперсной взвеси гидрата окиси железа.
В подземных водах железо чаще всего встречается в виде растворенного двухвалентного железа, а в поверхностных водах — в виде комплексных соединений либо в виде коллоидных или тонкодисперсных взвесей.
Слайд 14Выбору метода обезжелезивания воды должно предшествовать ее пробное обезжелезивание, так
как количественное содержание железа, указываемое в анализах, не дает представления
о форме, в которой железо присутствует в воде. Пробное обезжелезивание воды заключается в моделировании обезжелезивающей установки по тому или иному существующему методу устранения из воды железа, а именно:
аэрацией воды с последующим ее фильтрованием или отстаиванием и фильтрованием;
коагулированием;
известкованием;
хлорированием и коагулированием.
По результатам пробного обезжелезивания воды выбирают такой метод, при котором достигается требуемый эффект обезжелезивания воды при наименьших строительных и эксплуатационных затратах.
Слайд 15Для обезжелезивания подземных вод чаще всего применяют аэрацию воды без
добавления реагентов.
Упрощенную аэрацию допускается применять при следующих показателях качества воды:
- содержание железа (общего) до 10 мг/л;
в том числе двухвалентного (Fе2+) не менее 70 %,
- рН не менее 6,8;
- щелочности более (1+Fе2+/28) мг-экв/л;
- содержание сероводорода не более 2 мг/л.
Слайд 16Упрощенную аэрацию следует предусматривать изливом воды в карман или центральный
канал открытых фильтров (высота излива над уровнем воды 0,5—0,6 м).
При применении напорных фильтров надлежит предусматривать ввод воздуха в подающий трубопровод (расход воздуха 2 л на 1 г закисного железа).
При содержании в исходной воде свободной углекислоты более 40 мг/л и сероводорода более 0,5 мг/л следует перед напорными фильтрами предусматривать промежуточную емкость со свободным изливом в нее воды без ввода воздуха в трубопровод.
Станция обезжелезивания воды, работающая по методу «упрощенной аэрации», состоит из фильтров, загруженных песком, антрацитом, керамической крошкой и т. п.
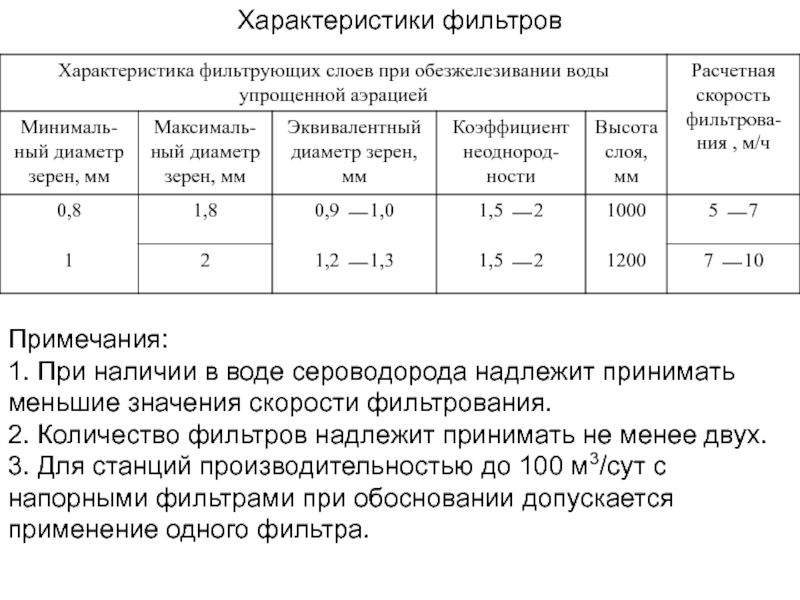
Слайд 17Характеристики фильтров
Примечания:
1. При наличии в воде сероводорода надлежит принимать
меньшие значения скорости фильтрования.
2. Количество фильтров надлежит принимать не менее
двух.
3. Для станций производительностью до 100 м3/сут с напорными фильтрами при обосновании допускается применение одного фильтра.
Слайд 18Если пробным обезжелезиванием определено, что метод «упрощенной аэрации» и фильтрования
не дает необходимых результатов, то можно применить более интенсивную аэрацию,
сущность которой заключается в насыщении воды кислородом воздуха. За счет этого кислорода происходит окисление двухвалентного железа, содержащегося в воде, в трехвалентное. При определенных значениях рН воды трехвалентное железо гидролизуется и образовавшаяся гидроокись железа коагулирует.
Скорость процессов окисления, гидролиза и коагуляции гидроокиси железа возрастает с увеличением рН воды. Указанные процессы быстро завершаются при рН = 7,5. Значение рН воды подземных источников часто ниже этой величины. Для поднятия значения рН воды до 7,5 из нее должно быть удалено некоторое количество свободной углекислоты.
Слайд 19Аэрация воды с целью удаления углекислоты может осуществляться либо на
вентиляторных дегазаторах, либо на так называемых контактных градирнях, работающих при
естественной вентиляции. Так как на вентиляторных дегазаторах допускается плотность орошения насадки в 4—5 раз большая, чем на контактных градирнях, последние следует применять лишь для установок небольшой производительности (примерно до 75 м3/ч).
Аэрацию на специальных устройствах (аэраторах) или введение реагентов-окислителей следует принимать при необходимости увеличения количества удаляемого железа и повышения рН воды.
Слайд 20Расчетные дозы реагентов-окислителей надлежит принимать:
хлора Дх, мг/л:
Дх = 0,7(Fе2+);
перманганата
калия Дп, мг/л, считая по КМnО4:
Дп = (Fе2+).
Ввод реагентов-окислителей
следует производить в подающий трубопровод перед фильтрами.
Конструкцию фильтров для обезжелезивания подземных вод следует принимать аналогично фильтрам для осветления воды. Характеристики принимаются аналогично скорым фильтрам.
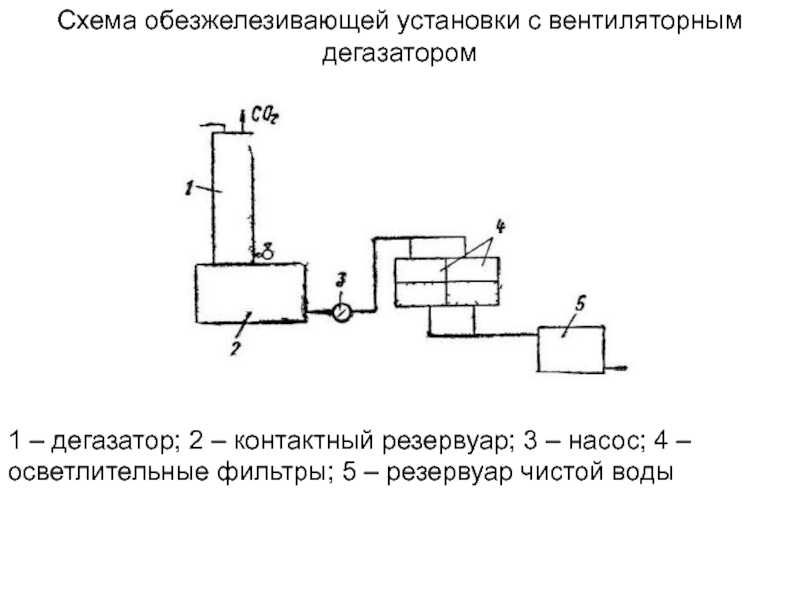
Слайд 21Схема обезжелезивающей установки с вентиляторным дегазатором
1 – дегазатор; 2
– контактный резервуар; 3 – насос; 4 – осветлительные фильтры;
5 – резервуар чистой воды
Слайд 22Обезжелезивание воды поверхностных источников следует предусматривать одновременно с ее осветлением
и обесцвечиванием, при этом дозу извести, Ди, мг/л, считая по
СаО, следует определять по формуле
Ди = 28(СО2/22 +Fе2+/28 + Дк/ек)
СО2 — содержание свободной двуокиси углерода в исходной воде, мг/л; Fе2+ — содержание двухвалентного железа в исходной воде, мг/л; Дк — доза коагулянта (по безводному веществу), мг/л; ек — эквивалентная масса коагулянта (безводного), мг/мг-экв.
Слайд 23В последние годы для обезжелезивания подземных вод начали применять катализаторы.
В качестве катализаторов применяют либо природный минерал пиролюзит, либо обычный
кварцевый песок, обработанный окислами марганца («черный песок»). Сущность этого способа заключается в том, что в присутствии окислов марганца процесс окисления двухвалентного железа в трехвалентное значительно ускоряется и может быстро осуществляться даже при пониженных рН воды.
Установка по обезжелезиванию воды в этом случае состоит из двух последовательных групп фильтров. Первую группу фильтров загружают либо пиролюзитом, либо омарганцованным песком. Крупность зерен загрузки принимают 0,7—1,5 мм, высоту слоя загрузки — 900 мм, скорость фильтрования—15 м/ч. Для восстановления окислительных свойств «черного песка» следует предусматривать периодическое добавление в обезжелезиваемую воду перманганата калия из расчета 2—3 мг/л. Фильтры второй группы — песчаные, такие же, как и при обезжелезивании воды аэрацией.
Слайд 24При необходимости удаления железа из воды поверхностных источников чаще всего
прибегают к коагулированию, которое иногда приходится комбинировать с предварительным хлорированием
воды для разрушения органических соединений железа или защитных коллоидов, препятствующих коагуляции коллоидных соединений железа.
Обычно обезжелезивание поверхностных вод проводят одновременно с их осветлением на тех же сооружениях.
Если необходимо одновременное обезжелезивание и частичное умягчение воды, то прибегают к ее известкованию. Известкование является надежным универсальным методом обезжелезивания воды и приводит в то же время к снижению ее карбонатной жесткости.
Слайд 258.8. Удаление из воды растворенных газов
Слайд 26Чаще всего в процессе водоподготовки требуется удаление углекислоты, кислорода и
сероводорода. Все три газа относятся к коррозийно-агрессивным газам, обусловливающим или
усиливающим процессы коррозии металлов. Углекислота, кроме того, агрессивна по отношению к бетону. Свойство этих газов обусловливать и усиливать коррозийные процессы, а также неприятный запах, который сообщает воде сероводород, во многих случаях вызывают необходимость наиболее полного удаления их из воды.
Комплекс мероприятий, связанных с удалением из воды растворенных в ней газов, называется дегазацией воды.
Применяются химические и физические методы дегазации воды.
Слайд 27Сущность первых заключается в использовании определенных реагентов, которые связывают растворенные
в воде газы. Например, обескислороживание воды может быть достигнуто путем
введения в нее сульфита натрия, сернистого газа или гидразина. Сульфит натрия при введении его в воду окисляется растворенным в воде кислородом до сульфата натрия:
2Na2S03 + 02 → 2Na2S04.
В случае применения сернистого газа образуется сернистая кислота:
S02 + Н20 → H2S03,
которая кислородом, растворенным в воде, окисляется до серной кислоты:
2H2S03+ 02→2H2S04.
Химическим реагентом, при помощи которого удается достичь практически полного обескислороживания воды, является гидразин.
Слайд 28При введении его в воду происходит связывание кислорода и выделение
инертного азота:
N2H4 + 02→2H20 + N2↑.
Последний химический способ обескислороживания
воды является наиболее совершенным, но вместе с тем и наиболее дорогим ввиду высокой стоимости гидразина. Поэтому этот способ применения в основном для окончательного удаления кислорода из воды после физических методов ее обескислороживания.
Примером химического метода удаления из воды сероводорода может служить обработка воды хлором:
а) с окислением до серы:
H2S + Cl2→S + 2HCl;
б) с окислением до сульфатов:
H2S + 4Сl2 + 4Н20 → H2S04 + 8НСl
Слайд 29Эти реакции (так же как промежуточные реакции образования тиосульфатов и
сульфитов) протекают параллельно в определенных соотношениях, зависящих в первую очередь
от дозы хлора и рН воды. Химическим методам газоудаления свойственны следующие недостатки:
а) необходимость применения реагентов, усложняющих и удорожающих процесс обработки воды;
б) возможность ухудшения качества воды при нарушении дозировки реагентов. Вследствие этого химические методы газоудаления применяются значительно реже физических.
Слайд 30Физические методы удаления из воды растворенных газов могут осуществляться двумя
способами:
вода, содержащая удаляемый газ, приводится в соприкосновение с
воздухом, если парциальное давление удаляемого газа в воздухе близко к нулю;
создаются условия, при которых растворимость газа в воде становится близкой к нулю.
При помощи первого способа, т. е. при помощи аэрации воды, обычно удаляются свободная углекислота и сероводород, поскольку парциальное давление этих газов в атмосферном воздухе близко к нулю.
Ко второму способу обычно приходится прибегать при обескислороживании воды, так как при значительном парциальном давлении кислорода в атмосферном воздухе аэрацией воды кислород из нее удалить нельзя. Для удаления из воды кислорода ее доводят до кипения, при котором растворимость всех газов в воде падает до нуля. Вода доводится до кипения либо ее нагреванием (термические деаэраторы), либо путем понижения давления до такого значения, при котором вода кипит при данной ее температуре (вакуумные дегазаторы).
Слайд 31Удаление из воды растворенных газов в процессе водоподготовки осуществляется на
дегазаторах различных типов, которые по их конструктивному устройству, характеру движения
воды и воздуха и по обстановке, в которой осуществляется процесс дегазации, можно классифицировать следующим образом:
1. пленочные дегазаторы, представляющие собой колонны, загруженные той или иной насадкой (деревянной, кольцами Рашига и др.), по которой вода стекает тонкой пленкой. Насадка служит для создания развитой поверхности соприкосновения воды и воздуха, нагнетаемого вентилятором навстречу потоку воды;
2. барботажные дегазаторы, в которых через слой медленно движущейся воды продувается сжатый воздух;
3. вакуумные дегазаторы, где при помощи специальных устройств (вакуум-насосов или водоструйных эжекторов) создается такое давление, при котором вода кипит при данной температуре.