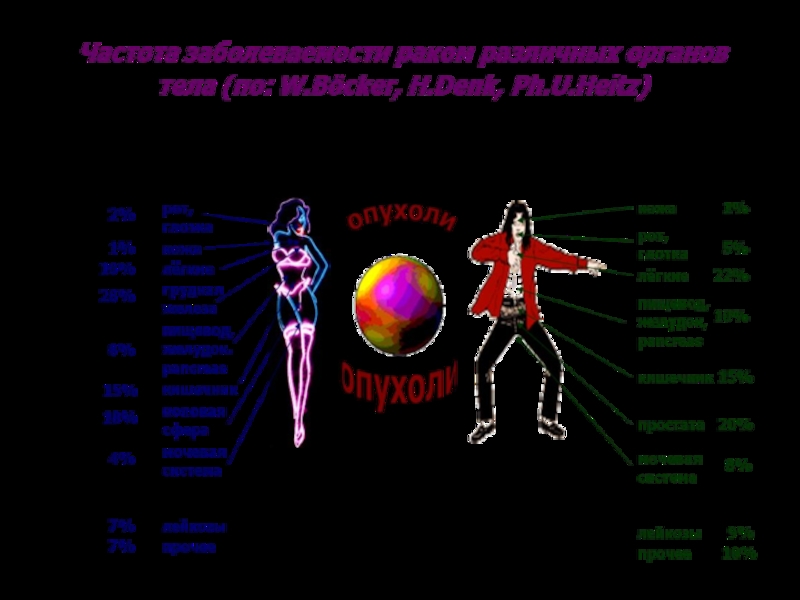
Слайд 1Патофизиология злокачественных опухолей I-II
Слайд 3
Опухоль (tumor – лат, новообразование, neoplasma – греч., бластома –
blastoma – лат.) – есть избыточное
(продолжающееся после прекращения действия
вызвавших его причин)
некоординированное с организмом,
патологическое разрастание тканей,
состоящее из клеток,
ставших атипичными в отношении дифференцировки и роста, и
передающие эти свойства своим производным – (Л. М. Шабад).
Слайд 4ТЕРМИНОЛОГИЯ
Blastoma - (гр. blastos - зародыш, oma - опухоль).
Oncos - (гр. опухоль).
Cancer - (лат. краб, омар, рак).
Tumor - (лат. припухлость, опухоль).
Carcinoma - (гр. cancer - краб, рак) - злокачественная опухоль из клеток эпителия.
Sarcoma - (гр. sarkoc мясо рыбы, oma - опухоль) злокачественная опухоль из производных мезенхимы.
Слайд 5Условия, способствующие росту злокачественных заболеваний (медико-социальные условия)
Улучшение диагностики.
Более тщательный учет
онкологических больных – диспансеризация, причем, и больных с повышенными факторами
риска (предраковые заболевания).
Увеличение средней продолжительности жизни:
М (70 лет) вероятность неоплазий в 100 раз >;
Ж (70 лет) вероятность неоплазий в 70 раз >,
чем в 30 лет.
Слайд 6
«Неопластические ростки на разных стадиях формирования присутствуют в любом организме:
в молодом – в меньшем числе и менее «подвинутые»,
в
пожилом – в большем числе и более «подвинутые» (Sporn S.)
4. Ухудшение экологической обстановки (загрязнение окружающей среды химическими и физическими канцерогенами), то есть увеличение канцерогенной нагрузки.
5. Особенности социально-экономического и психоэмоционального состояния населения (усиление промоторного эффекта – бедность, стресс).
Слайд 7
Неопластические процессы распространенны убиквитарно
ubigue – лат. везде, повсюду
Слайд 8ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ВОСПРОИЗВЕДЕНИЯ
ЗЛОКАЧЕСТВЕННОГО РОСТА
1. Метод индукции (лат. inductio –
наведение, побуждение):
индукция опухоли химическими веществами. 1916 г. Ишикава и Ямагива
вызвали рак кожи у кроликов каменноугольной смолой
индукция опухоли вирусами. 1908 г. Элерман и Банг вызвали лейкоз у кур бесклеточным фильтратом из лейкозных лейкоцитов
индукция опухоли физическими факторами. Ионизирующая радиация (рентгеновские лучи, радиоактивные изотопы, ультрафиолетовые лучи и др.)
Слайд 9
2. Метод эксплантации (лат. еx вне + plantare – сажать)
– выращивать злокачественных клеток вне организма, т.е. культурой тканей.
3. Метод
трансплантации (лат. transplantare – пересаживать) – пересадки злокачественной опухоли от одного животного другому.
1876 г. Новицкий М.А. трансплантировал опухоль взрослой собаки щенкам. Фактически это послужило началом экспериментальной онкологии.
4. Выведение раковых линий
Слайд 10БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
1. Относительная автономность и нерегулируемость роста опухоли организмом.
2. Снижение уровня дифференцировки опухолевых клеток – атипизм, анаплазия (греч.
anaplasis преобразование в смысле обратного развития).
Данные преобразования (упрощения) сближают их с эмбриональной тканью.
Различают:
Слайд 11
биохимическую анаплазию;
тканевую и клеточную
анаплазию;
физико-химическую анаплазию;
функциональную анаплазию;
иммунологическую анаплазию.
3. Наследуемость изменений.
4. Инвазивный и дестуктивный рост.
5. Метастазирование.
6. Прогрессия.
Слайд 12Относительная автономность и нерегулируемость роста опухоли организмом
Это строго обязательный,
универсальный признак, любой злокачественной опухоли.
Означает независимость скорости роста опухоли
от координирующего влияния целостного организма,
не подчиняемость ему – «функциональная глухота» (А.С. Салямон).
Опухоль приобретает способность к самоуправлению
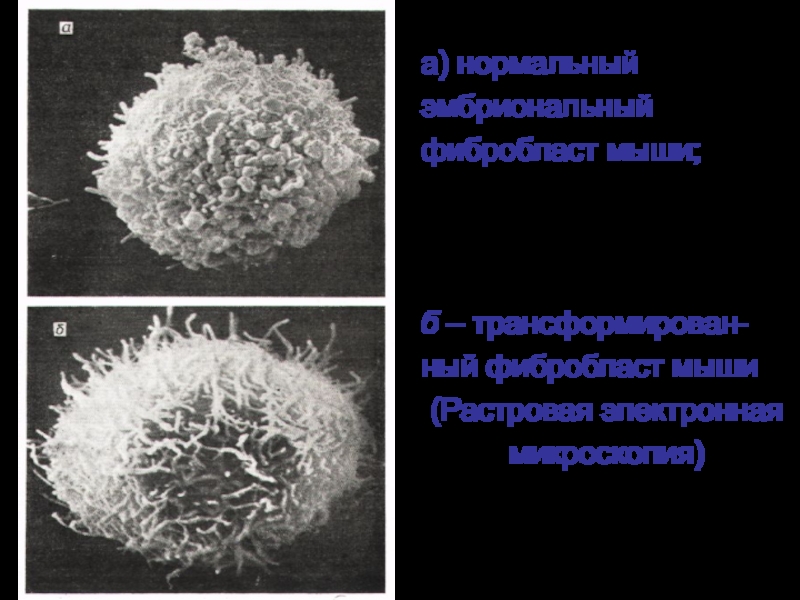
Слайд 13а) нормальный
эмбриональный
фибробласт мыши;
б – трансформирован-
ный фибробласт
мыши
(Растровая электронная
микроскопия)
Слайд 14Варианты биохимической (метаболической анаплазии)
Монотонизация или изоферментное упрощение
Биохимическое усложнение
Изоэнзимная перестройка
Слайд 15Характеристика обмена веществ в злокачественной клетке
Белковый обмен:
интенсивно извлекаются из притекающей
крови аминокислоты («ловушка для азота»);
преобладают процессы анаболизма над процессами катаболизма;
резко
повышен синтез ДНК, РНК;
нарушены процессы переаминирования и дезаминироавния аминокислот;
синтезируются белки, свойственные эмбриональному периоду развития или тканям других органов.
Слайд 16Характеристика обмена веществ в злокачественной клетке
2. Углеводный обмен:
интенсивно извлекается глюкоза
из притекающей крови («ловушка для глюкозы»);
увеличивается активность анаэробного гликолиза на
фоне нормального содержания О2 (отрицательный эффект Пастера);
снижается окислительное фосфорилирование и тканевое дыхание;
часто отмечается развитие метаболического ацидоза (рН 6,4).
Слайд 17Характеристика обмена веществ в злокачественной клетке
3. Жировой обмен:
активно извлекаются из
притекающей крови жирные кислоты, различные липопротеиды, холестерин («ловушка для липидов»);
активируется синтез липидных структур клеток;
активируются процессы липопероксидации
Слайд 18 «Каждая отдельная опухолевая клетка, в отношении к прочим частям
тела живет, как бы, жизнью паразита» Р. Вирхов, 1867
Майер-Абих
(1965) ввел термин «холябионты» - т.е. клетки вышедшие из-под системного влияния организма и перешедшие к вторичному паратизму
Слайд 19
Метаболический атипизм злокачественных клеток в целом создает условия для
существенного
(значительного) повышения их
«конкурентноспособности» и выживаемости в организме
Слайд 20
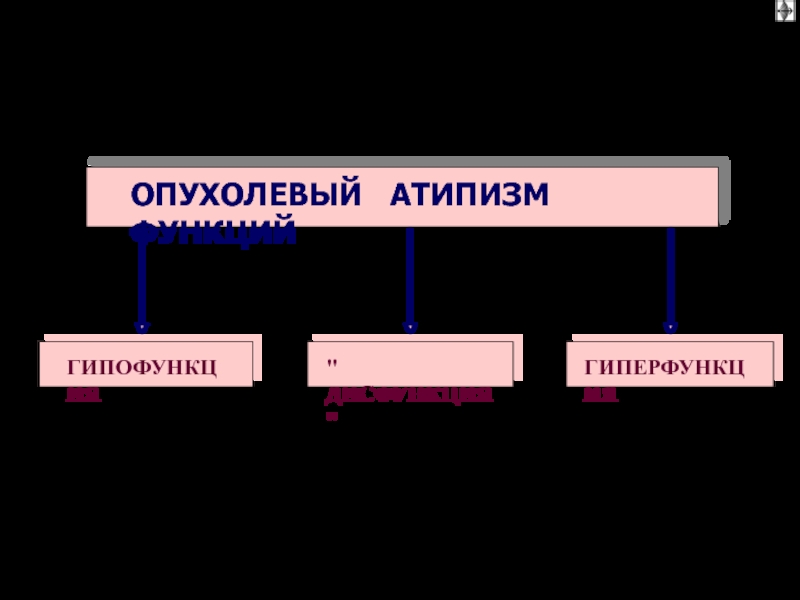
Функциональная анаплазия
– утрата, извращение или чаще несоответствие,
неподчинение функции
опухолевых клеток
регуляторным влияниям организма
Слайд 21ИММУНОЛОГИЧЕСКАЯ АНАПЛАЗИЯ ОПУХОЛЕВЫХ КЛЕТОК
Антигенное упрощение – характеризуется уменьшением АГ в
злокачественных клетках
в сравнении
с клетками,
из которых они трансформировались.
Антигенное усложнение – появление новых АГ,
например, связанных с наличием в клетке онкогенного вируса.
Слайд 22
Антигенная дивергенция (лат. divergere –обнаруживать расхождение) –
характеризуется синтезом опухолевыми
клетками таких АГ,
которые не производились тканями, из которых они
произошли.
Однако, данные АГ вырабатываются другими нормальными тканями.
Например, синтез гепатомой органоспецифических АГ селезенки, почек и др. органов.
Антигенная реверсия (лат. reversio - возвращение, возврат) –
синтез злокачественными клетками эмбриональных АГ.
Например, α-фетопротеин, фетальный белок, появляется в крови при опухолях печени и др. органов.
Слайд 23
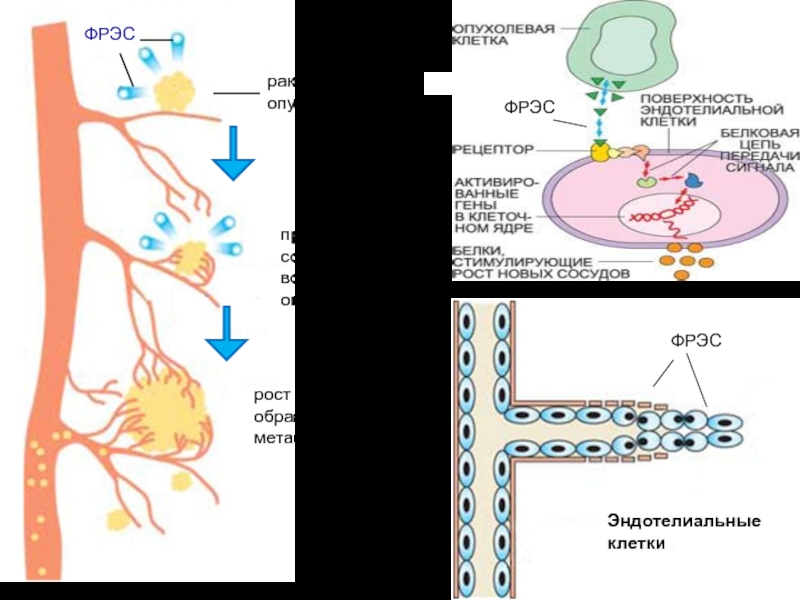
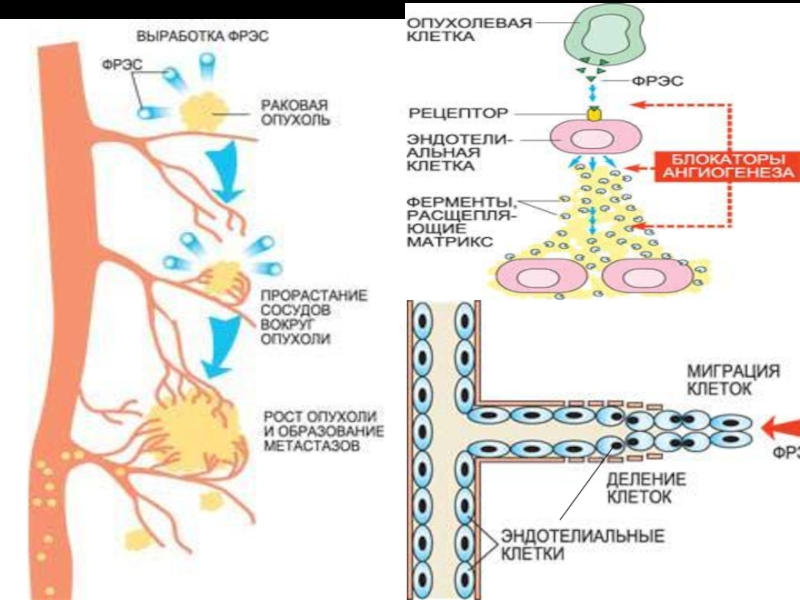
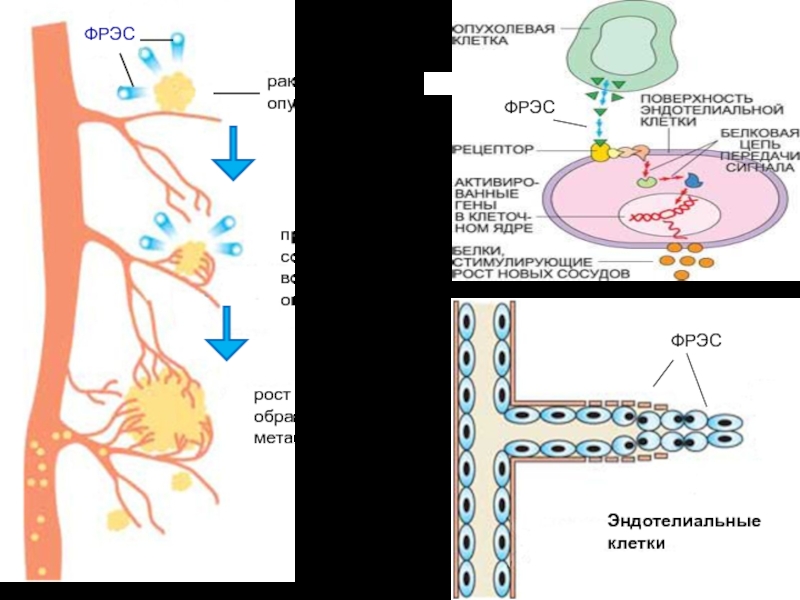
раковая опухоль
ФРЭС
прорастание сосудов вокруг опухоли
рост опухоли и образование метастазов
Слайд 24
ПЕРВИЧНАЯ ОПУХОЛЬ
Трансформированная клетка
Базальная мембрана
Лимфоцит
Тромбоциты
ЭТАПЫ МЕТАСТАЗИРОВАНИЯ (“метастатический
каскад”)
√ Интравазация – 4 этап
√ Эмбол опухолевых клеток -5
этап
√ Экстравазация – 7 этап
МЕТАСТАЗ ОПУХОЛИ (приживление метастаза)
*Синтез собственных ФР
√ Ангиогенез
Метастазирующий пул клеток,
Адгезия к баз.мембр.- 1 этап
√ Инвазия через базальную мембрану-2 этап
√Проникновение через внеклеточный матрикс- 3 этап
Взаимодействие с лимфоцитами
√ Адгезия к базальной мембране сосуда – 6 этап
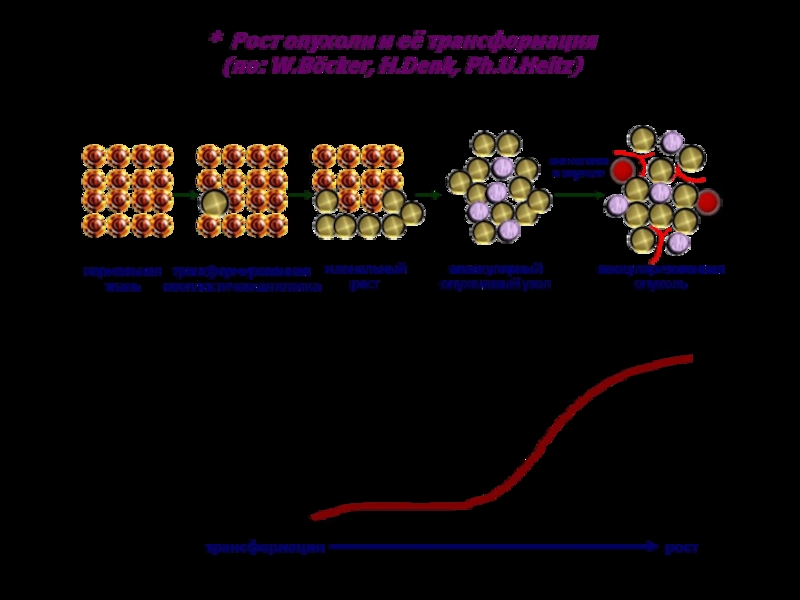
Слайд 25Опухолевая прогрессия –
это
генетически закрепленное,
наследуемое и необратимо измененное
свойство
или несколько свойств опухолевой клетки
Слайд 26Общая характеристика опухолевой прогрессии
Фенотипические ее проявления заключаются в изменении биохимических,
морфологических, электрофизиологических и функциональных признаков опухоли
Изменение свойств (признаков) происходит независимо
друг от друга
Появление и изменение новых свойств опухолей происходит независимо друг от друга и без какой либо хронологической закономерности
Появление злокачественных клеток с различной комбинацией новых свойств способствует:
- формированию новых субклонов, существенно отличающихся друг от друга и,
- клетки - родоначальници клона
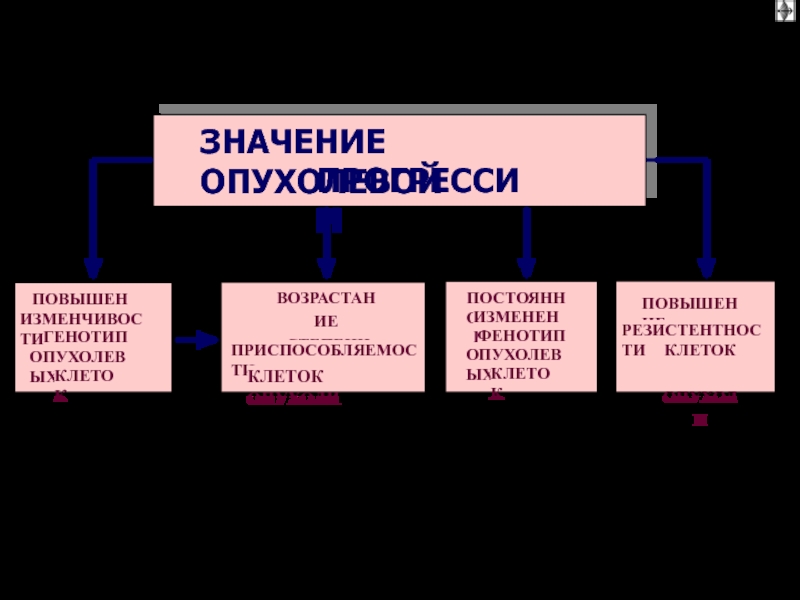
Слайд 27Значение опухолевой прогрессии
Определяет гетерогенность опухолевой болезни
Способствует адаптации злокачественных клеток к
меняющимся условиям:
- недостатку кислорода,
- субстратов обмена веществ,
-действию лекарственных
средств и др.
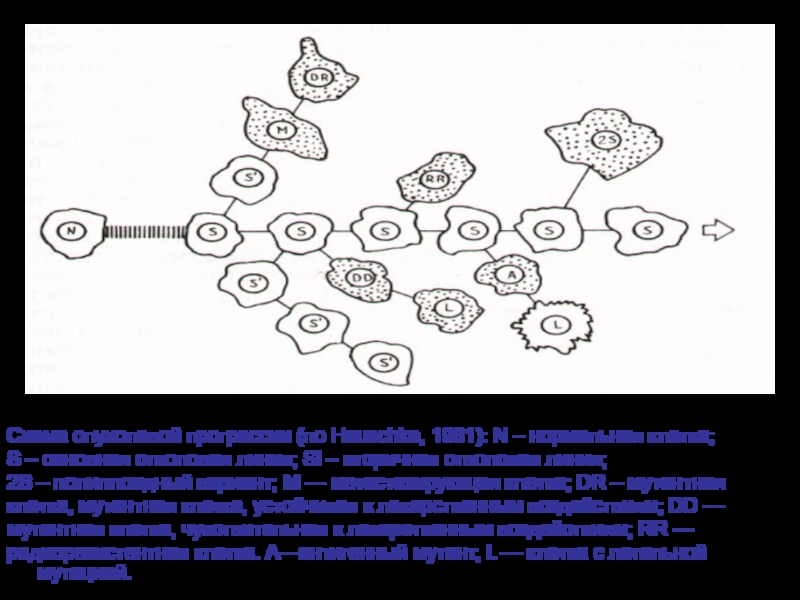
Слайд 28Схема опухолевой прогрессии (по Hauschka, 1961): N – нормальная клетка;
S – основная стволовая линия; Si – вторичная стволовая линия;
2S – полиплоидный вариант; М — метастазирующая клетка; DR – мутантная
клетка, мутантная клетка, устойчивая к лекарственным воздействиям; DD —
мутантная клетка, чувствительная к лекарственным воздействиям; RR —
радиорезистентная клетка. А—антигенный мутант, L — клетка с летальной мутацией.
Слайд 30
Опухоль (tumor – лат, новообразование, neoplasma – греч., бластома –
blastoma – лат.) – есть избыточное
(продолжающееся после прекращения действия
вызвавших его причин)
некоординированное с организмом,
патологическое разрастание тканей,
состоящее из клеток,
ставших атипичными в отношении дифференцировки и роста, и
передающие эти свойства своим производным – (Л. М. Шабад).
Слайд 31Установлено:
малигнизация клеток – процесс многостадийный (многошаговый),
причем,
каждый последующий «шаг»
может быть спровоцирован разными факторами;
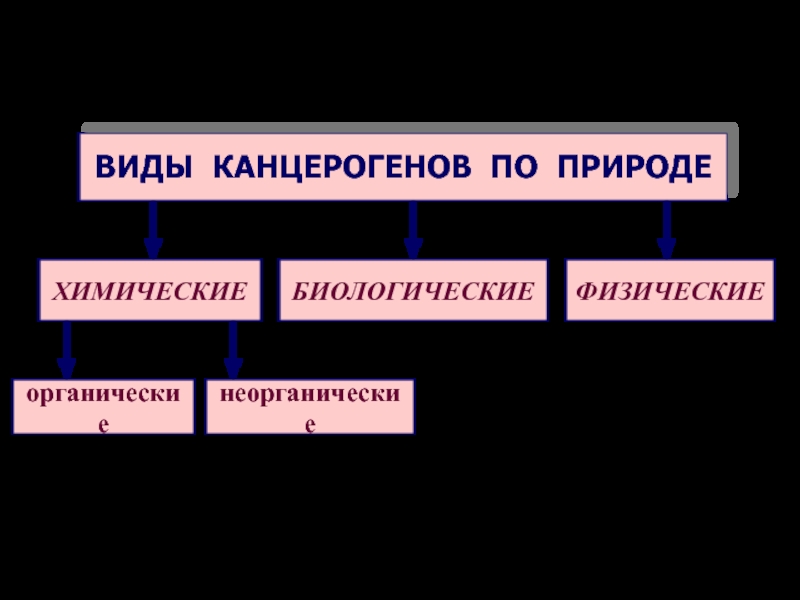
почти все этиологические факторы (канцерогены) генотоксичны
– «рак болезнь генов».
Слайд 33
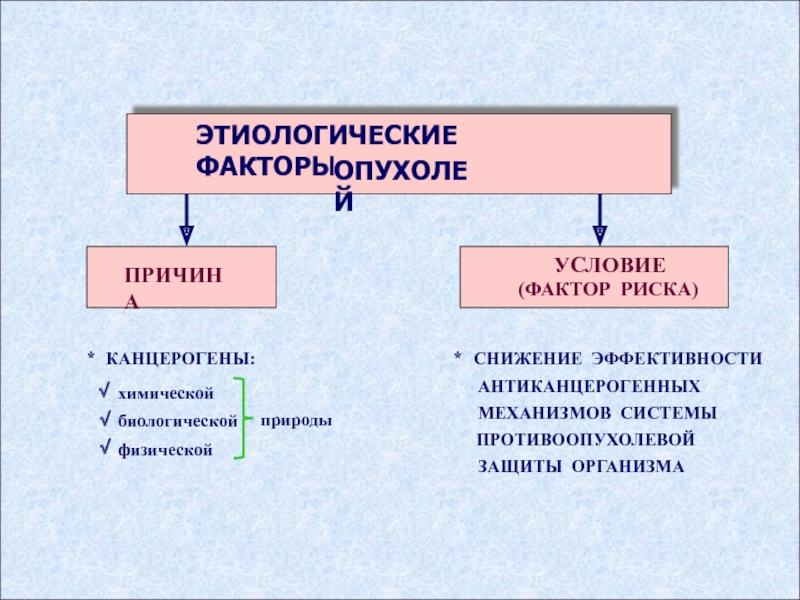
ЭТИОЛОГИЧЕСКИЕ ФАКТОРЫ
ОПУХОЛЕЙ
ПРИЧИНА
УСЛОВИЕ
(ФАКТОР РИСКА)
Слайд 34ТРАНСФОРМАЦИЯ И РЕАЛИЗАЦИЯ
КАНЦЕРОГЕННОГО ДЕЙСТВИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ
трансформация
в организме
∙
алкилирующие агенты
∙
эпоксиды,
диолэпоксиды
ПРОКАНЦЕРОГЕНЫ
(ПОТЕНЦИАЛЬНО КАНЦЕРОГЕННЫЕ
ХИМИЧЕСКИЕ ВЕЩЕСТВА)
ГЕНОМ КЛЕТКИ
“ИСТИННЫЕ” (“КОНЕЧНЫЕ”) ХИМИЧЕСКИЕ КАЦЕРОГЕНЫ
∙
свободнорадикальные
формы веществ
ОПУХОЛЕВАЯ
ТРАНСФОРМАЦИЯ
КЛЕТКИ
Слайд 36Канцерогены обладают следующими свойствами:
Мутагенностью, т.е. способностью
прямо или косвенно влиять
на геном клетки;
2. Проникать через внешние и внутренние
барьеры;
3. Органотропностью,
т.е. проявлять
канцерогенность в определенных органах и
тканях;
4. Способностью подавлять тканевое
дыхание и функцию иммунной системы;
Слайд 37продолжение
5. Дозированностью действия, что обеспечи-
вает незначительные повреждения клетки.
Для получения канцерогенного эффекта
имеют значение доза и токсичность
канцерогена
небольшие дозы приводят к увеличению числа возникновения опухолей;
дальнейшее повышение дозы сопровождается преобладанием токсического эффекта и гибелью клетки до их злокачественного перерождения
Слайд 38продолжение
Представление о дозированности
действия канцерогена позволило
установить следующее:
субпороговых доз канцерогена
не существует (увеличивается лишь время образования опухоли);
для канцерогенов характерен эффект
суммации и куммуляции;
действие канцерогенов необратимо.
Слайд 39продолжение
6. Синканцерогенностью – ускоренной бластной
трансформацией клеток при воздействии нескольких
канцерогенов;
7. Коканцерогенез, комутогенез – способность некоторых
факторов, не являющихся канцерогенами, усиливать
эффект канцерогенов;
8. Особенности эндогенных канцерогенов:
обладают сравнительно слабым онкогенным эффектом;
действуют медленнее, с более длительным латентным периодом;
опухолевая болезнь, вызванная ими, протекает более доброкачественно, имеет сравнительно слабую способность к метастазированию.
Слайд 40Факторы риска (основные группы)
Дурные привычки:
табакокурение
прием алкоголя
диетические нарушения
многочисленные, случайные
половые связи (промискуйтет)
2. Условия труда (профессиональные вредности)
3. Неблагоприятные экологические факторы
Слайд 42Основные положения патогенеза бластной трансформации клеток
Опухолевая болезнь – полиэтиологическая, но
монопатогенетическая патология;
Наиболее общие механизмы и закономерности неопластической трансформации клетки едины
для всех форм злокачественных опухолей;
Инициальные явления (пусковые моменты) осуществляются на молекулярно-генетическом уровне –
основные нарушения возникают в клеточных программах, контролирующих клеточный и тканевой гомеостаз.
Сущность изменения клеточного/тканевого гомеостаза заключается:
в усилении процессов пролиферации (размножения) злокачественных клеток и,
угнетении их дифференцировки и смерти (апоптоза)
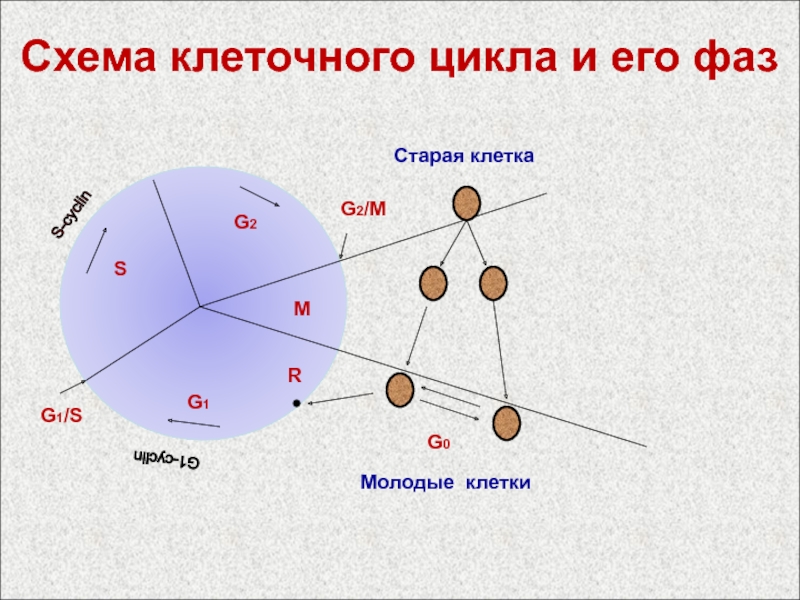
Слайд 43Схема клеточного цикла и его фаз
G1
G2
S
M
G2-cyclin
G1-cyclin
S-cyclin
G1/S
G2/M
R
Старая
клетка
Молодые клетки
G0
Слайд 44
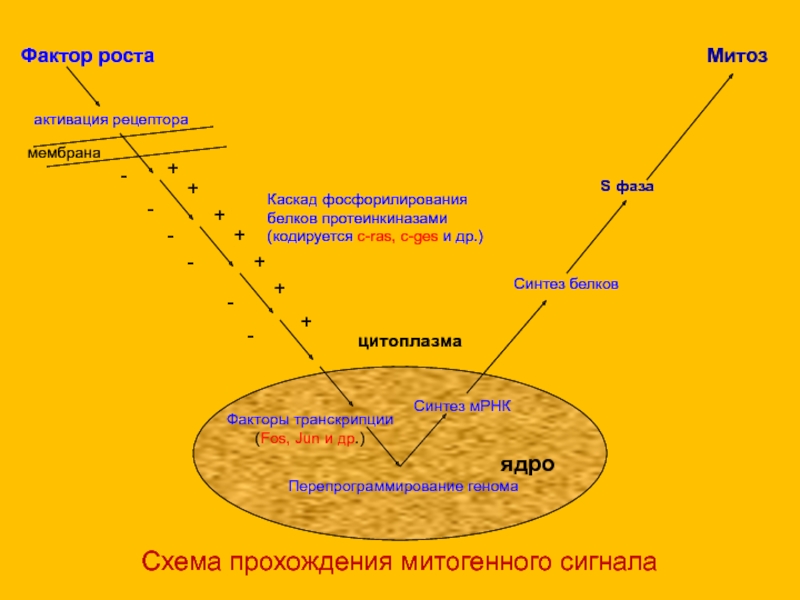
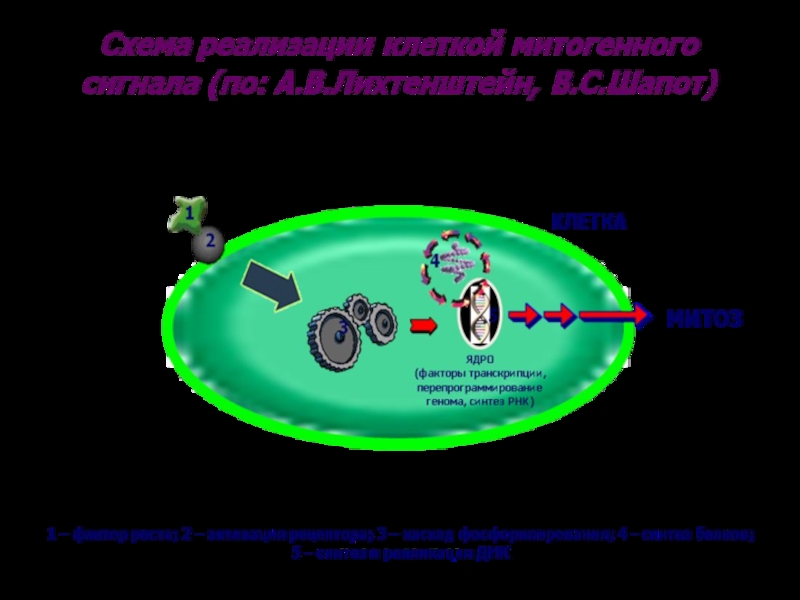
Схема прохождения митогенного сигнала
Фактор роста
Митоз
Перепрограммирование генома
ядро
Синтез мРНК
Синтез белков
S
фаза
цитоплазма
Факторы транскрипции (Fos, Jun и др.)
активация рецептора
мембрана
+
+
+
+
+
+
+
-
-
-
-
-
-
Каскад фосфорилирования белков протеинкиназами
(кодируется c-ras, c-ges и др.)
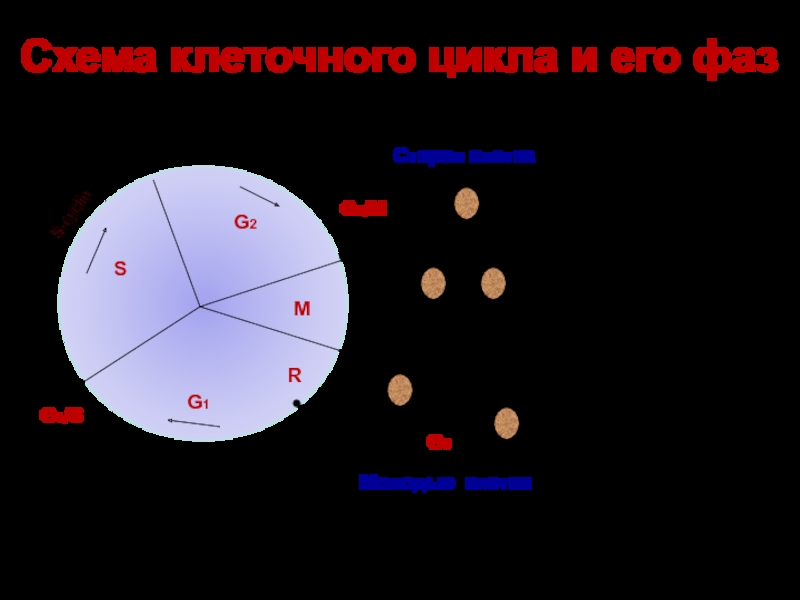
Слайд 45Схема клеточного цикла и его фаз
G1
G2
S
M
G2-cyclin
G1-cyclin
S-cyclin
G1/S
G2/M
R
Старая
клетка
Молодые клетки
G0
Слайд 46
Основные группы генов, участвующие в
поддержании клеточно-тканевого гомеостаза
Гены, стимулирующие
деление клеток – протоонкогены (гены роста и пролиферации клеток) –
Sis, N-ras и др.
Гены ингибирующие деление клеток – антионкогены (гены супрессоры роста и пролиферации) – р53, Rb и др.
Гены, отвечающие за апоптоз:
гены отменяющие «смерть» клетки (Bcl 2, Bcl-х и др.)
гены «смерти» (семейство Вах)
Слайд 47МЕХАНИЗМЫ ПЕРЕХОДА ПРОТООНКОГЕНА В ОНКОГЕН
Дефект регуляции транскрипции (инсерция гетеротопного
промотора) – включение (вставка) промотора.
Промотор – участок ДНК предназначенный для подсадки РНК-полимеразы, которая инициирует транскрипцию гена, в том числе и онкогена.
Промоторами могут быть ДНК-копии онковирусов, «транспозоны» (прыгающие гены). Возможна их большая роль в онкогенезе детей.
2. «Амплификация протоонкогенов – увеличение числа протоонкогенов обуславливает гиперэкспрессию.
Это проводит к неадекватному по месту и времени избыточному синтезу соответствующих онкобелков (в 30-50 раз больше).
Пример, С-myc, N-myc (мелкоклеточный рак легкого, нейробластома).
Слайд 48
3. Транслокация протоонкогена – перемещение протоонкогена в участок другой хромосомы
с функционирующим геном (генами).
В данной ситуации структурная часть протоонкогена лишается своих нормальных регуляторных механизмов
и попадает под контроль «чужого» окружения (промотора, сильного промотора-энхансера).
Таков механизм активации C-myc при лимфоме Беркита.
4. Точечная мутация и деления – структурные повреждения, которые обуславливают синтез сигнального белка (онкогена) в активной конформации.
Например, рак желудка, мочевого пузыря точковая мутация c-Ha-ras 1.
5. Деметилирование ДНК – под влиянием химических канцерогенов и активных радикалов деметилированный участок становиться активным и может приводить к стимуляции деления клеток
ВНИМАНИЕ! Достаточно замены одного основания (т.е. замены одной аминокислоты в белке,
чтобы протоонкоген превратился в онкоген).
При этом, кодируемый мутированным геном белок, находится в постоянно возбужденном (активном) состоянии,
т.е. не зависит от состояния рецепторов и др.
Слайд 49
Схема прохождения митогенного сигнала
рецептор
Митоз
Перепрограммирование генома
ядро
Синтез мРНК
Синтез белков
S фаза
цитоплазма
Факторы
транскрипции (Fos, Jun и др.)
мембрана
+
+
+
+
+
-
-
-
-
Каскад фосфорилирования белков протеинкиназами (кодируется c-ras,
c-ges и др.)
мутация
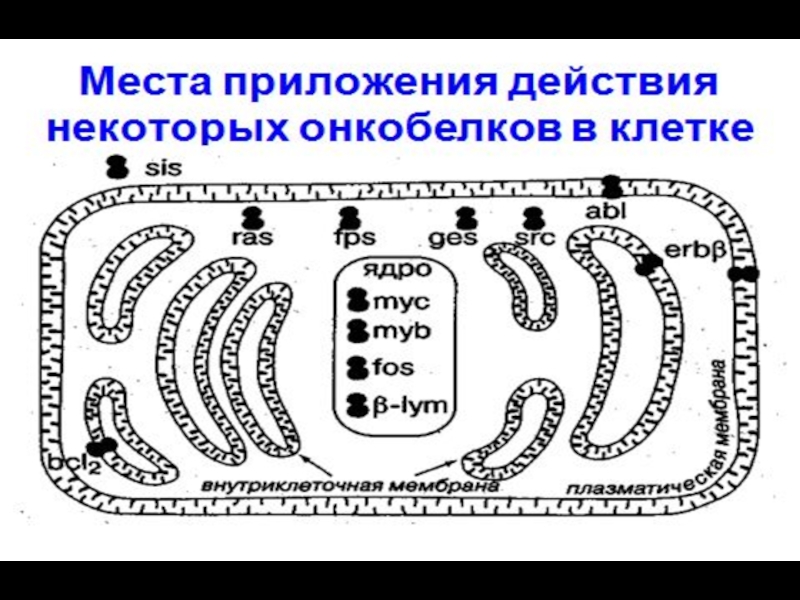
Слайд 51ПРОТООНКОГЕНЫ (1)
Ростовые факторы (РФ)
Sis (22)
Аналог тромбоцитарного фактора роста
Глиомы
Аналог ФРФ
Карциномы пищевода, молочной железы
Внутри-клеточные посредники ростового сигнала
Ret
Тирозин-протеинкиназа
Карцинома щитовидной железы
Src (20)
Тирозин-протеинкиназа
Тирозин-протеинкиназа
Саркомы
Хронический миелолейкоз с филадельфийской транслокацией t9-22
Карцинома легких, поджелудочной железы, кишечника
Лейкозы
ГТФ-связывающий белок
ГТФ-связывающий белок
AbI (9)
Ki-ras (11)
N-ras (11)
Слайд 52ПРОТООНКОГЕНЫ (2)
Рецепторы РФ
Int, hst
Erd B (7)
Her2/neu
Гомолог рецептора
ЭФР
Карцинома молочной железы, рак яичника, желудка
Транскрип-ционные факторы
C-myc
(8)
Ключевые белки – ядерные дерепрессоры ростовой программы
Лейкозы, карциномы молочной железы и кишечника
n-myc
I-myc
-"-"-
-"-"-
Нейробластома
Рак легких
Переключатели клеточного цикла
PRADI (bcI-1)
Кодирует циклин D1
Рак молочной железы плоскоклеточный рак кожи
Блокатор апоптоза
BcI-2
Mdm-2
Блок впрыскивания Са при апоптозе
Блок действия р53
В-лимфоциты
Лейкозы
Слайд 53
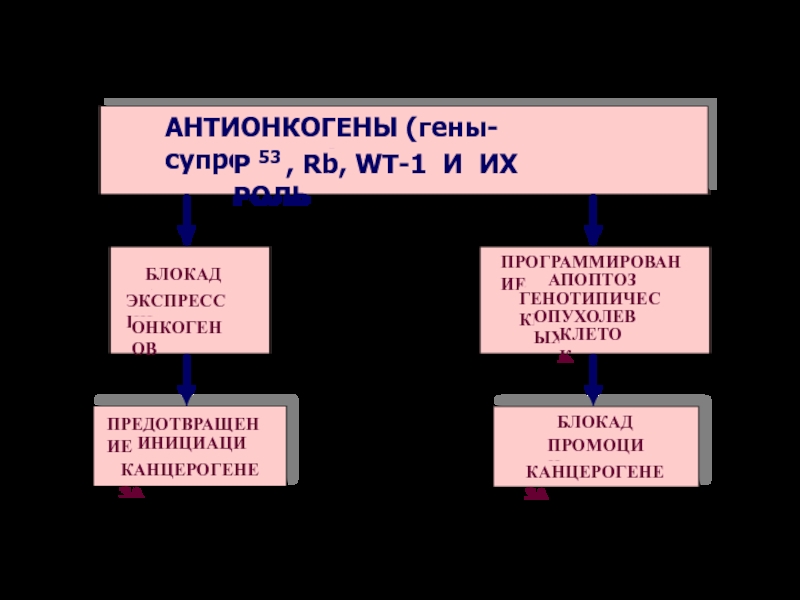
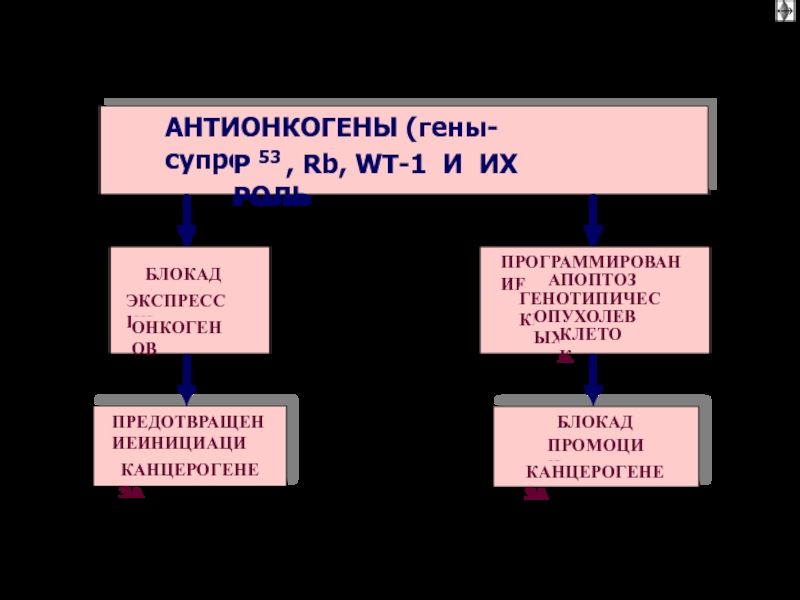
АНТИОНКОГЕНЫ (гены-супрессоры)
P 53 , Rb, WT-1 И ИХ РОЛЬ
БЛОКАДА
ЭКСПРЕССИИ
ОНКОГЕНОВ
ПРЕДОТВРАЩЕНИЕ
ИНИЦИАЦИИ
КАНЦЕРОГЕНЕЗА
ПРОГРАММИРОВАНИЕ
АПОПТОЗА
ГЕНОТИПИЧЕСКИ
ОПУХОЛЕВЫХ
КЛЕТОК
БЛОКАДА
ПРОМОЦИИ
КАНЦЕРОГЕНЕЗА
Слайд 54
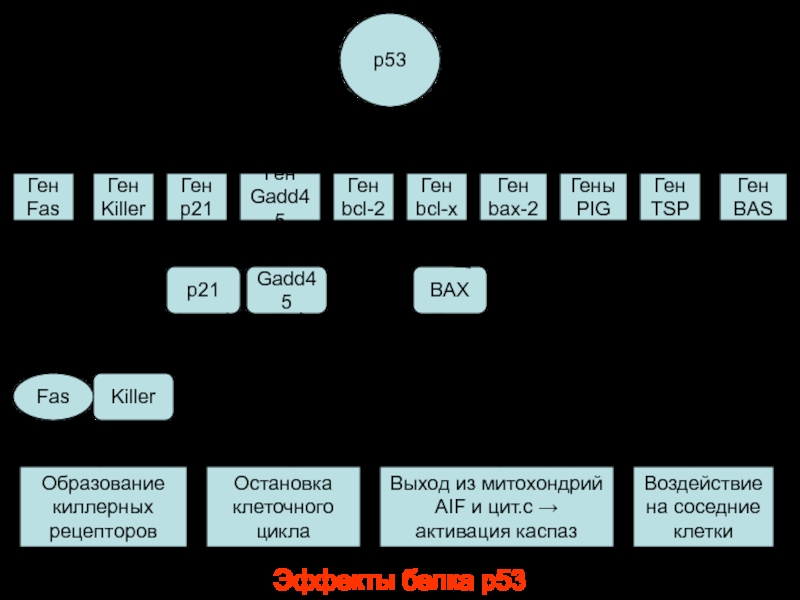
Эффекты белка р53
р53
Ген
Fas
Образование
киллерных
рецепторов
Ген
BAS
Ген
TSP
Гены
PIG
Ген
bax-2
Ген
bcl-x
Ген
bcl-2
Ген
Gadd45
Ген
p21
Ген
Killer
Ядро
+
+
+
+
+
+
+
+
–
–
–
–
–
+
Остановка
клеточного
цикла
Выход из митохондрий
АIF
и цит.с →
активация каспаз
Воздействие
на соседние
клетки
Fas
Killer
р21
Gadd45
ВАХ
Ц-D-Cdk4
Ц-B-dk1
РСNА
Каналы митох.
Окисли-тели
Мембраны митох.
Слайд 55НЕКОТОРЫЕ АНТИОНКОГЕНЫ (1)
Прерыватели клеточного цикла
Р53 (17р13)
Индуктор апоптоза
Многие (например,
карцинома мочевого пузыря, легкого, яичника, ретинобластома)
Rb (13p14)
Связывает вирусные промоторы роста
E2F и E1A, мишень каспаз при апоптозе. Прерыватель клеточного цикла
Ретинобластома, остеомаркома, мелкоклеточный рак легкого
MTS1 (p16)
Меланомы, рак яичника
Слайд 56НЕКОТОРЫЕ АНТИОНКОГЕНЫ (2)
ГТФ-азные активаторы и G-белки
NF1 (17g11)
Выключатель G-белков, антогонист
ras
Саркома, глиомы, MEN 1-синдром
MCC (5g21)
Ослабляет передачу ростового сигнала
G-белками
Рак толстого кишечника
Репараторы ДНК
hMSH2 (2p16)
hMLH1 (3p21)
PMS1, PMS2
Репаразы
Карциномы толстого кишечника
Рак эндотелия
Адгезивные молекулы
VHL (3p25)
Рецептор адгезии
Гемангиобластома, феохромоцитома, рак почки
DCC (18g21)
Рецептор адгезии
Рак толстого кишечника
NF-2 (22g12)
Прикрепление цитоскелета к мембране
Шваннома
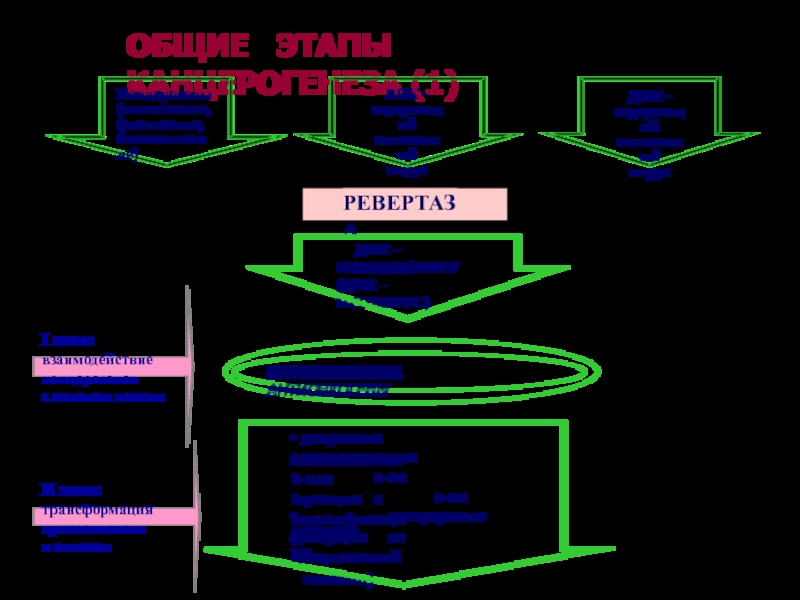
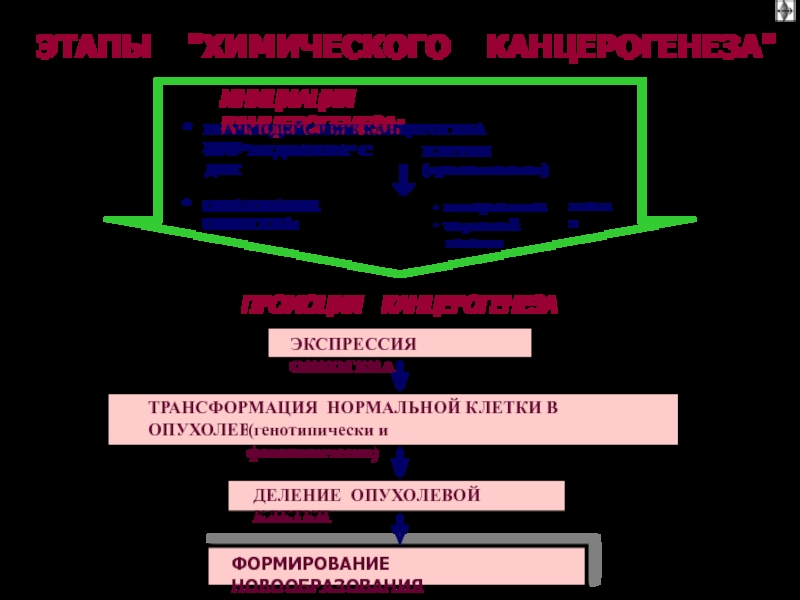
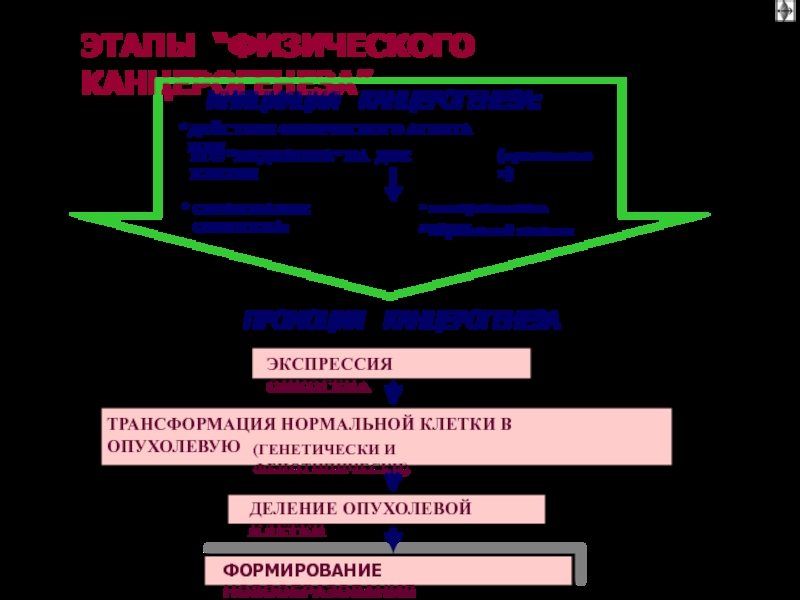
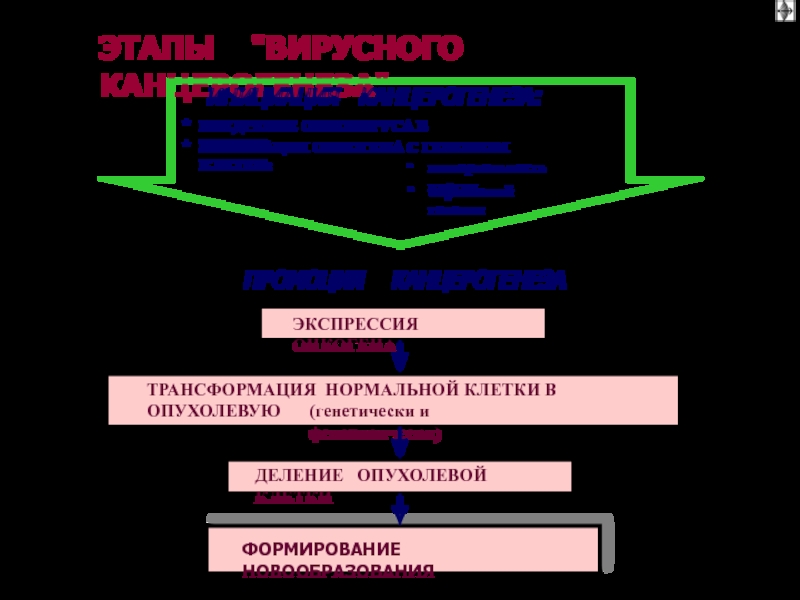
Слайд 57ОБЩИЕ ЭТАПЫ КАНЦЕРОГЕНЕЗА (1)
I этап:
взаимодействие
канцерогенов
с геномом клетки
II этап:
трансформация
протоонкогена
в
онкоген
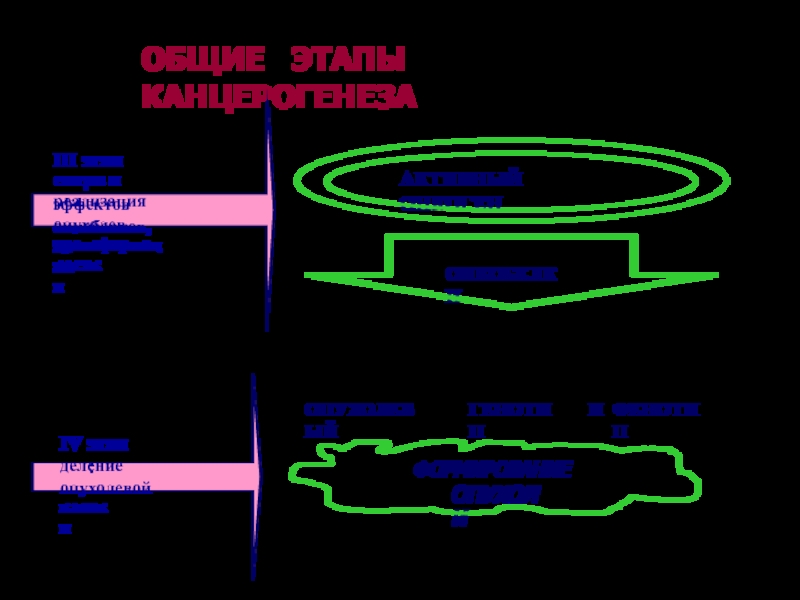
Слайд 58ОБЩИЕ ЭТАПЫ КАНЦЕРОГЕНЕЗА
III
этап:
синтез и реализация
эффектов онкобелков,
опухолевая
трансформация
клетки
IV
этап:
деление
опухолевой
клетки
Слайд 59
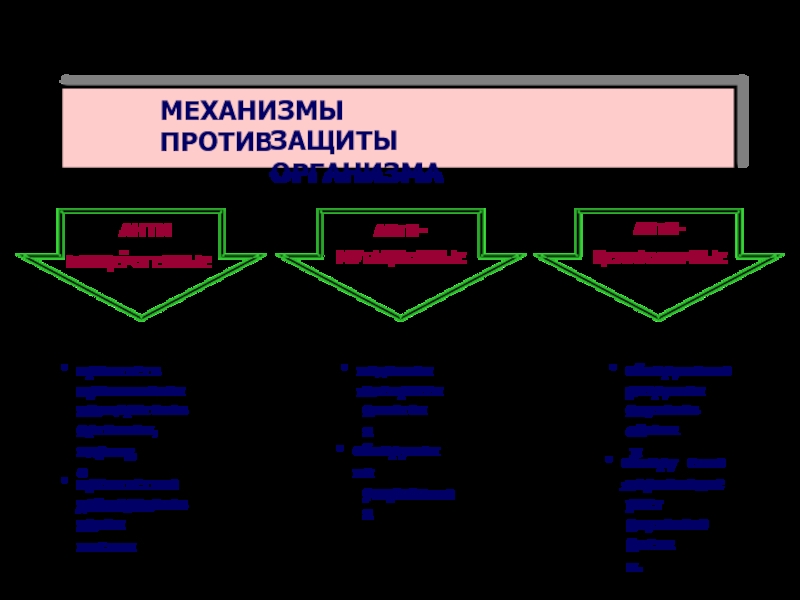
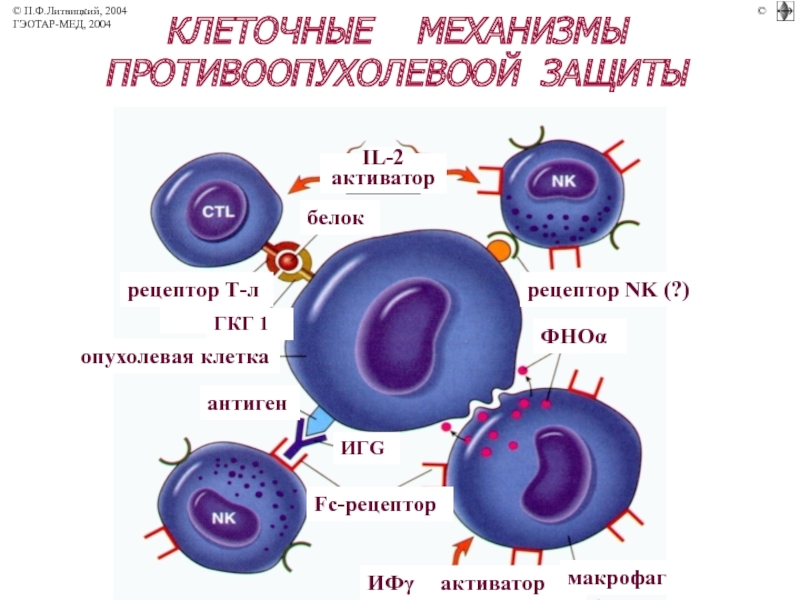
МЕХАНИЗМЫ ПРОТИВООПУХОЛЕВОЙ
ЗАЩИТЫ ОРГАНИЗМА
АНТИ-
КАНЦЕРОГЕННЫЕ
АНТИ-
МУТАЦИОННЫЕ
АНТИ-
ЦЕЛЛЮЛЯРНЫЕ
Слайд 60
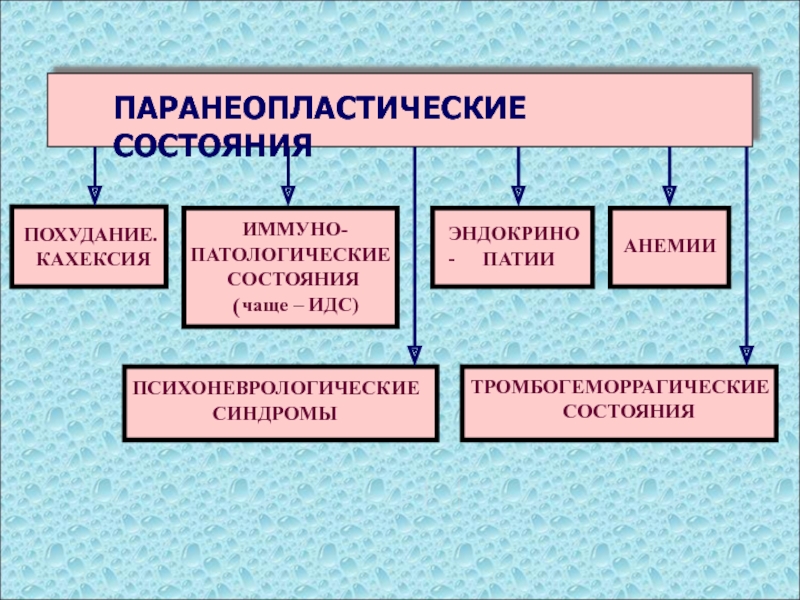
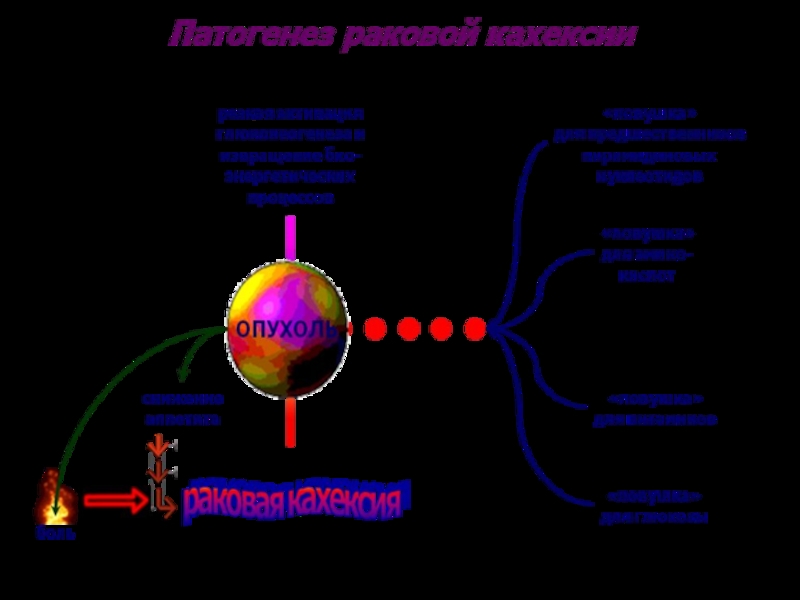
ПАРАНЕОПЛАСТИЧЕСКИЕ СОСТОЯНИЯ
ПОХУДАНИЕ.
КАХЕКСИЯ
ИММУНО-
ПАТОЛОГИЧЕСКИЕ
СОСТОЯНИЯ
(
чаще – ИДС)
ПСИХОНЕВРОЛОГИЧЕСКИЕ
СИНДРОМЫ
ТРОМБОГЕМОРРАГИЧЕСКИЕ
СОСТОЯНИЯ
ЭНДОКРИНО-
ПАТИИ
АНЕМИИ
Слайд 62
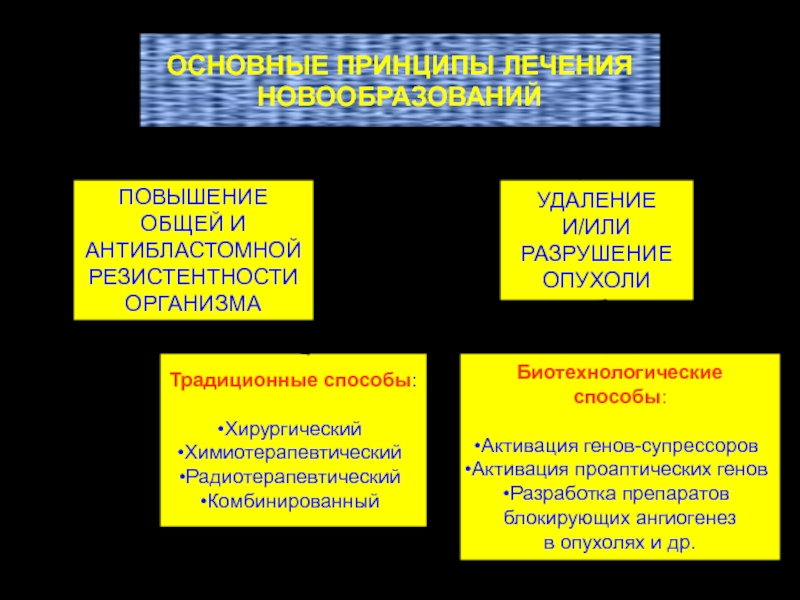
ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ
НОВООБРАЗОВАНИЙ
ПОВЫШЕНИЕ
ОБЩЕЙ И
АНТИБЛАСТОМНОЙ
РЕЗИСТЕНТНОСТИ
ОРГАНИЗМА
УДАЛЕНИЕ
И/ИЛИ
РАЗРУШЕНИЕ
ОПУХОЛИ
Традиционные способы:
Хирургический
Химиотерапевтический
Радиотерапевтический
Комбинированный
Биотехнологические способы:
Активация генов-супрессоров
Активация проаптических
генов
Разработка препаратов
блокирующих ангиогенез
в опухолях и др.
Слайд 63
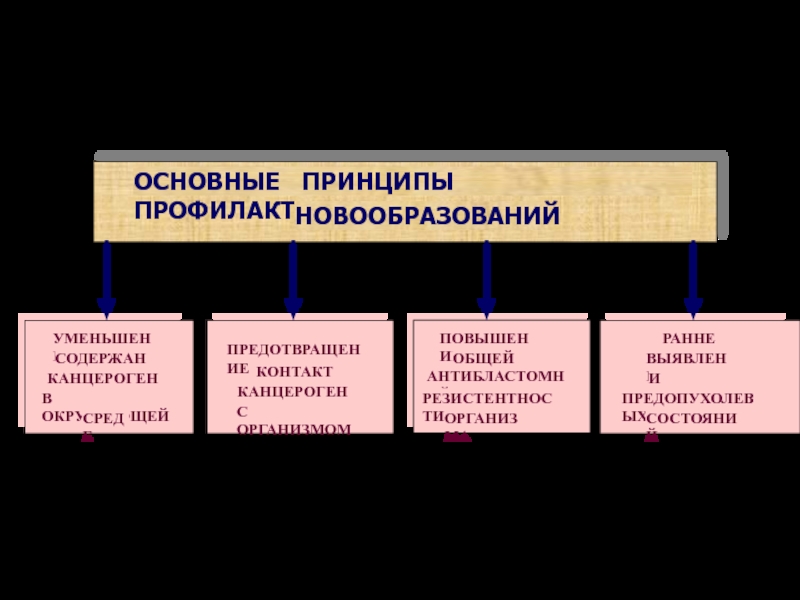
ОСНОВНЫЕ ПРИНЦИПЫ ПРОФИЛАКТИКИ
НОВООБРАЗОВАНИЙ
ПРЕДОТВРАЩЕНИЕ
КОНТАКТА
КАНЦЕРОГЕНОВ
С ОРГАНИЗМОМ
УМЕНЬШЕНИЕ
СОДЕРЖАНИЯ
КАНЦЕРОГЕНОВ
В ОКРУЖАЮЩЕЙ
СРЕДЕ
ПОВЫШЕНИЕ
ОБЩЕЙ И
АНТИБЛАСТОМНОЙ
РЕЗИСТЕНТНОСТИ
ОРГАНИЗМА
РАННЕЕ
ВЫЯВЛЕНИЕ
И ЛЕЧЕНИЕ
ПРЕДОПУХОЛЕВЫХ
СОСТОЯНИЙ
Слайд 64АНТИБЛАСТОМНАЯ РЕЗИСТЕНТНОСТЬ:
* свойство организма
* препятствовать проникновению
канцерогенных агентов в
клетку, её ядро
и/или их действию на геном;
* обнаруживать
и устранять онкогены
или подавлять их экспрессию;
* обнаруживать и разрушать опухолевые клетки,
тормозить их рост (феномен cancer in situ).
Слайд 66
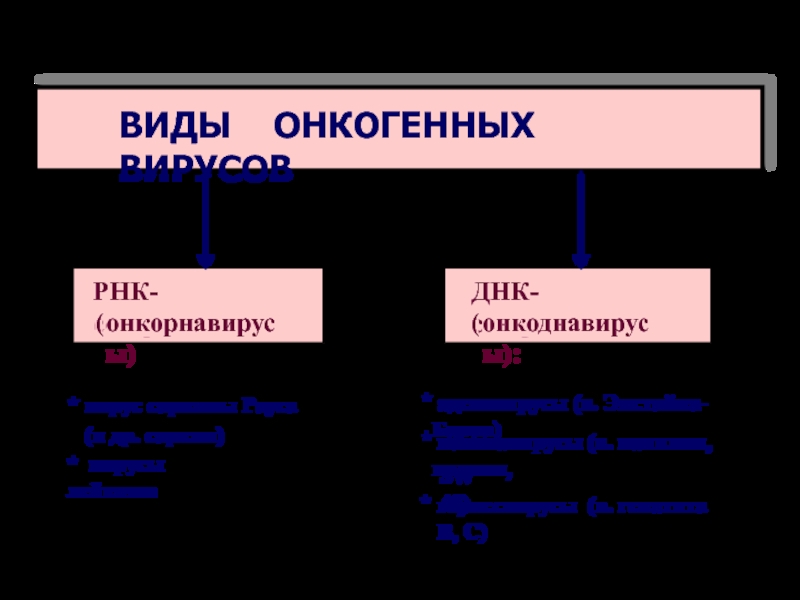
ВИДЫ ОНКОГЕННЫХ ВИРУСОВ
ДНК-содержащие
(
онкоднавирусы):
РНК-содержащие
(
онкорнавирусы)
* вирус саркомы Рауса
(и
др. сарком)
* вирусы лейкозов
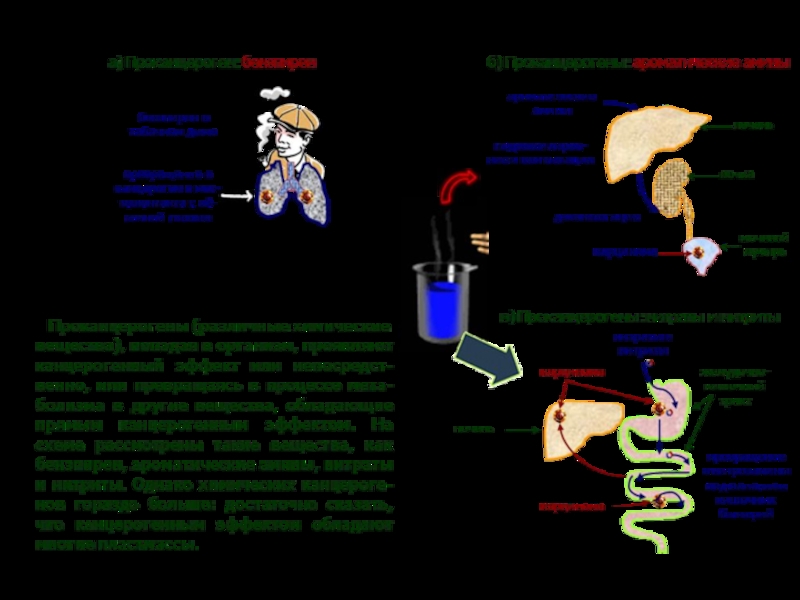
Слайд 67Источники и кругооборот 3,4-бензпирсна в природе (по А.
И. Гнатышаку, 1975).
Слайд 78ФАКТОРЫ, РЕГУЛИРУЮЩИЕ АПОПТОЗ
р53 – клеточный фосфопротеин - проапоптотический фактор.
Он индуцирует апоптоз путем:
1. Активации экспрессии внутриклеточного белка
– Ваx и Fas-рецептора (СD95) (рецептор к FasL – лиганду антигена апоптоза)
2. Подавление экспрессии антиапоптотического белка Всl-2
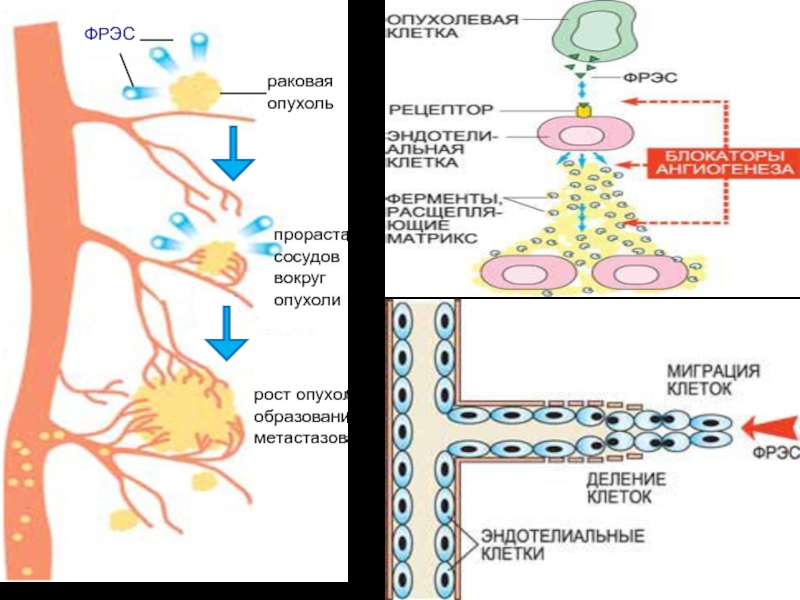
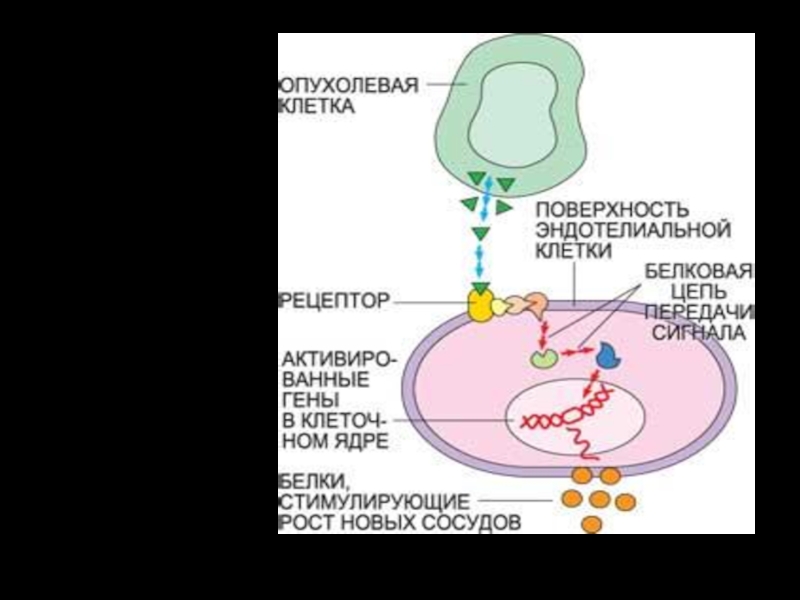
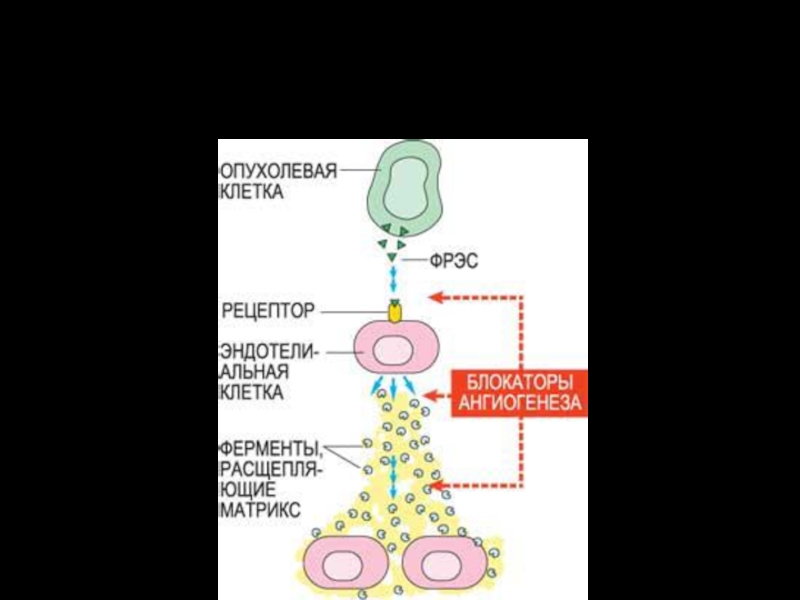
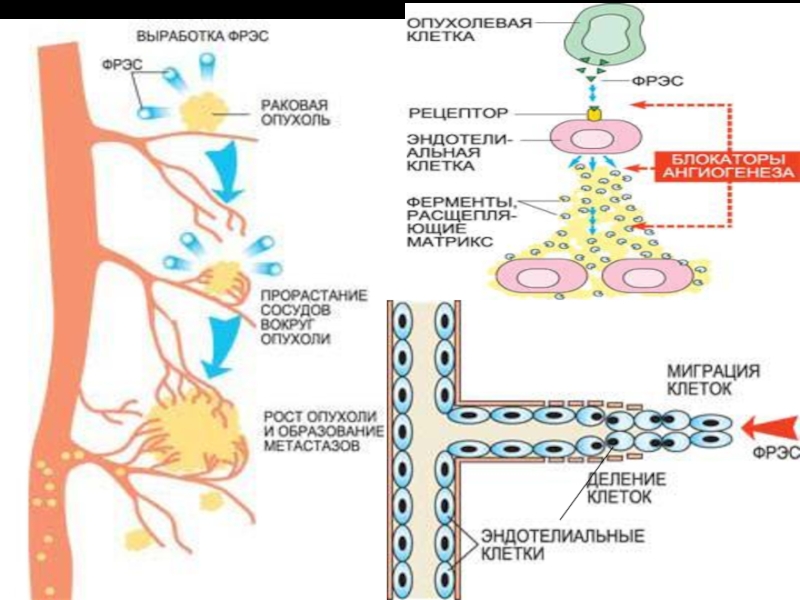
Слайд 84Фактор роста эндотелия сосудов (ФРЭС) синтезируется в растущей раковой опухоли.
На поверхности эндотелиальных клеток, выстилающих кровеносные сосуды, ФРЭС взаимодействует с
рецепторами. Сигнал с рецептора с помощью цепи биохимических реакций передается внутрь клетки на клеточное ядро, активируя гены, отвечающие за выработку белков – стимуляторов роста новых сосудов
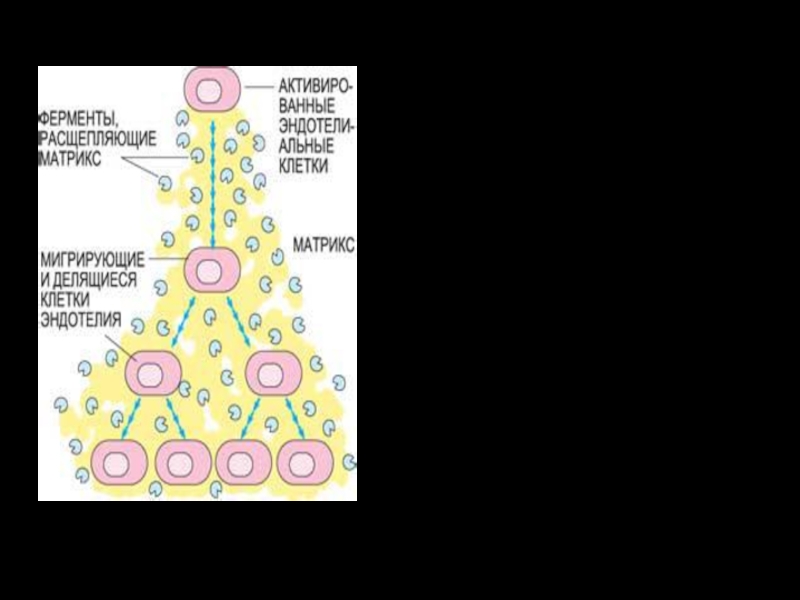
Слайд 85Активированные ФРЭС эндотелиальные клетки производят специальные ферменты – металлопротеиназы, расщепляющие матрикс
оболочки сосуда, «сделанный» из белков и полисахаридов. В результате эндотелиальные
клетки получают возможность мигрировать и делиться
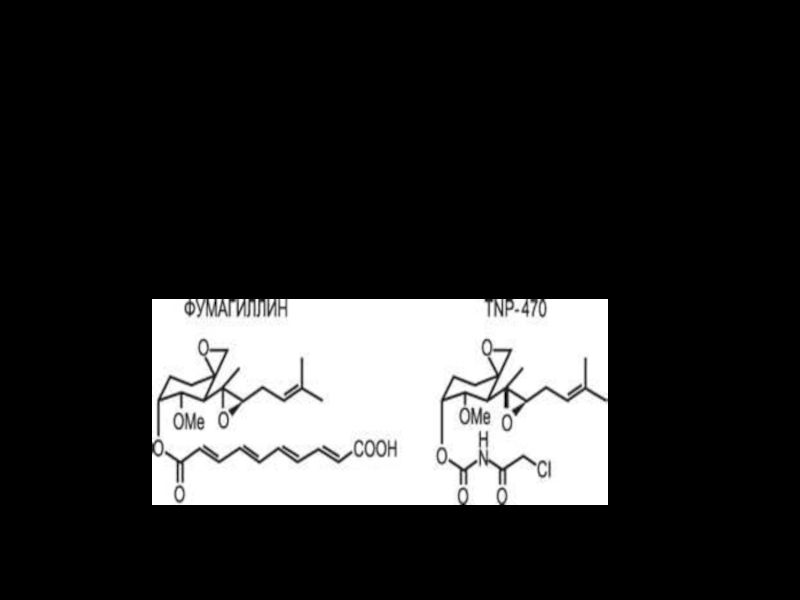
Слайд 87Продукт метаболизма грибковых микроорганизмов фумагиллин - один из наиболее сильных блокаторов
роста сосудов. Его синтетический аналог TNP-470 стал первым ангиостатическим препаратом,
прошедшим клинические испытания
Слайд 88На фотографии показано, как природный ангиостатический препарат фумагиллин предотвращает развитие
новых кровеносных сосудов на препарате ткани цыпленка (Б). А -
контрольный образец
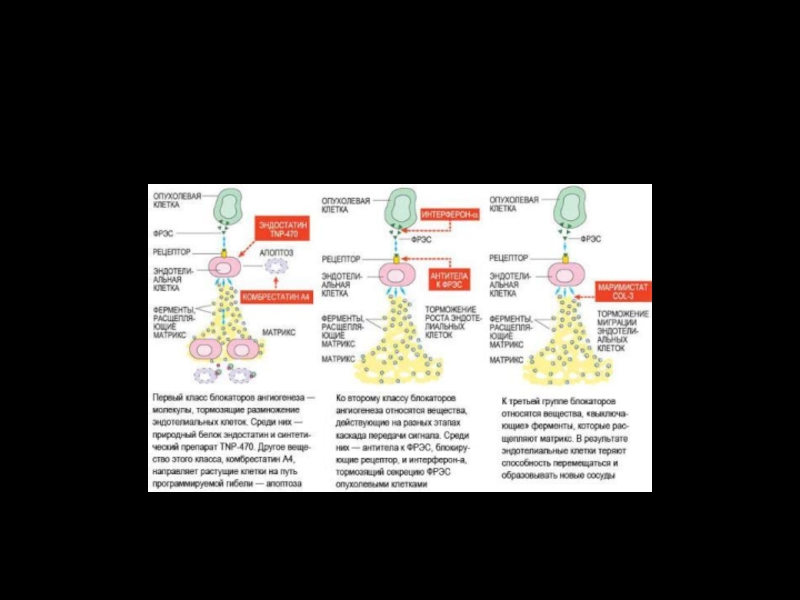
Слайд 89В настоящее время ученые проверяют возможность применения различных блокаторов ангиогенеза
в лечении рака. Блокаторы (ангиостатики) подразделяются на разные категории в
зависимости от механизма их действия
Слайд 91План лекции (I-II)
Определение понятий: опухоль злокачественная, доброкачественная опухоль.
Условия, способствующие
росту злокачественных новообразований, этиологические факторы опухолей.
Экспериментальные методы воспроизведения злокачественного роста.
Биологические
особенности опухолей.
Патогенез бластной трансформации клеток.
Основные принципы терапии и профилактики новообразований.
Слайд 92
раковая опухоль
ФРЭС
прорастание сосудов вокруг опухоли
рост опухоли и образование метастазов
Эндотелиальные клетки
ФРЭС
ФРЭС
Слайд 95
раковая опухоль
ФРЭС
прорастание сосудов вокруг опухоли
рост опухоли и образование метастазов
Эндотелиальные клетки
ФРЭС
ФРЭС
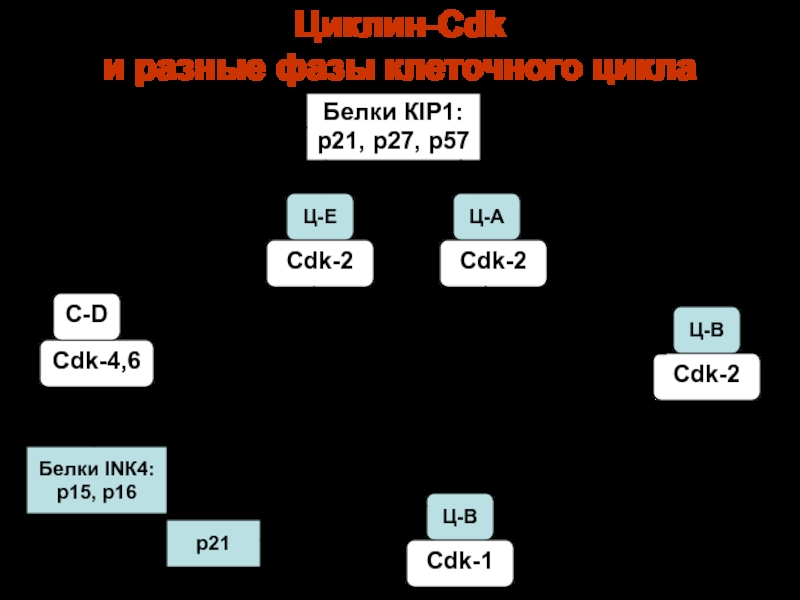
Слайд 96Циклин-Сdk
и разные фазы клеточного цикла
Белки КIР1:
р21, р27, р57
G1
S
G2
М
Ц-В
Ц-А
Ц-Е
Ц-В
Сdk-1
Сdk-2
Сdk-2
Сdk-2
Сdk-4,6
С-D
р21
МРF
+
+
–
–
–
–
Белки
INК4:
р15, р16
–
+
+
+
G0
+
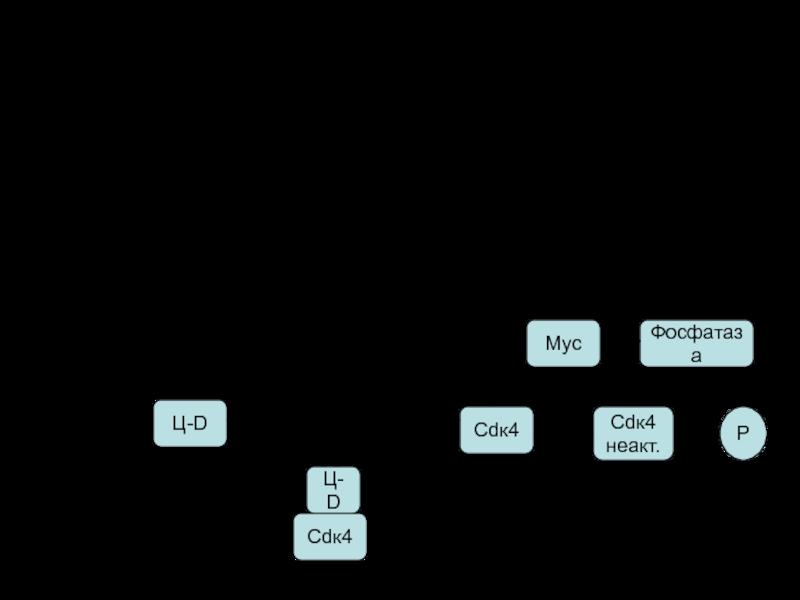
Слайд 97
Инициация пролиферации
ЯДРО
Транскрипционные факторы генов раннего ответа
+
+
+
+
–
Гены замедленного ответа
Ген Ц-D
Ген Сdк4
Ген
Мус
Ген Сdс25а
Ген р27
Гены FOS и JUN
Транскрипционные факторы генов замедленного ответа
Ц-D
Ц-D
Сdк4
Сdк4
Сdк4
неакт.
Фосфатаза
Мус
Р
Активный комплекс
Слайд 98
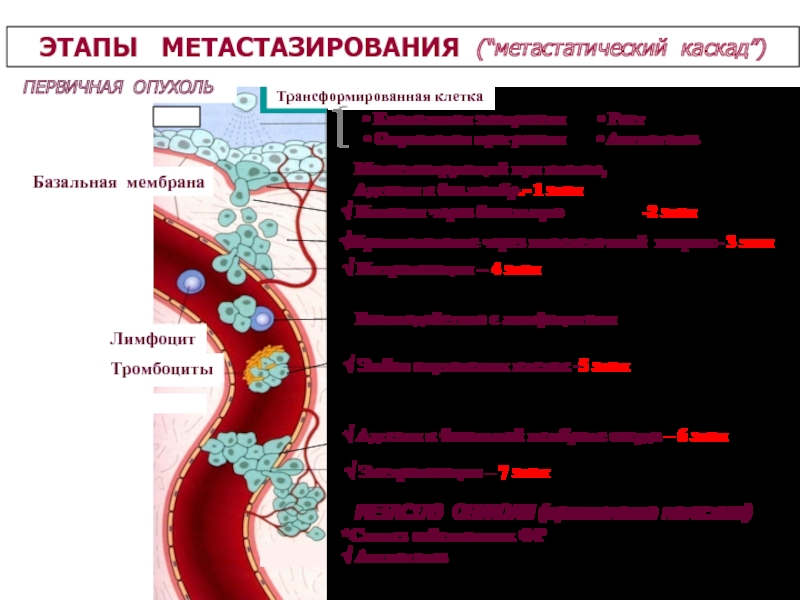
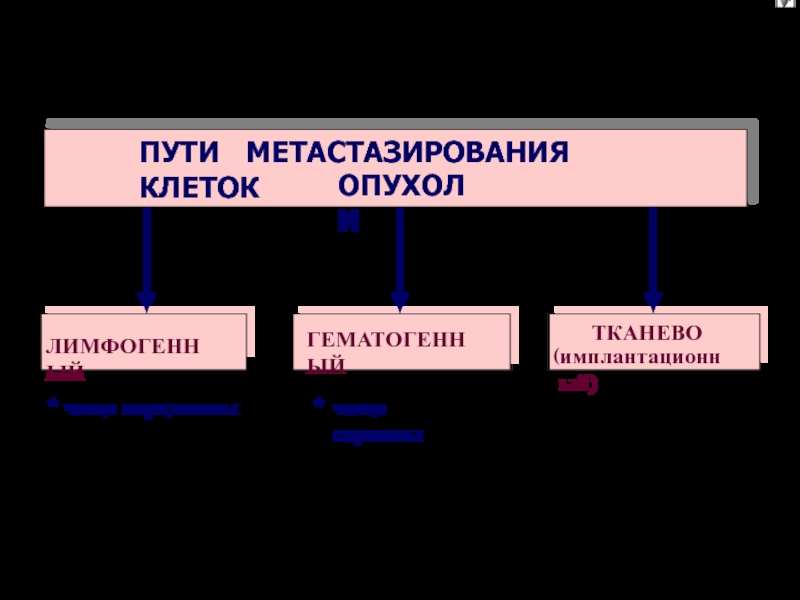
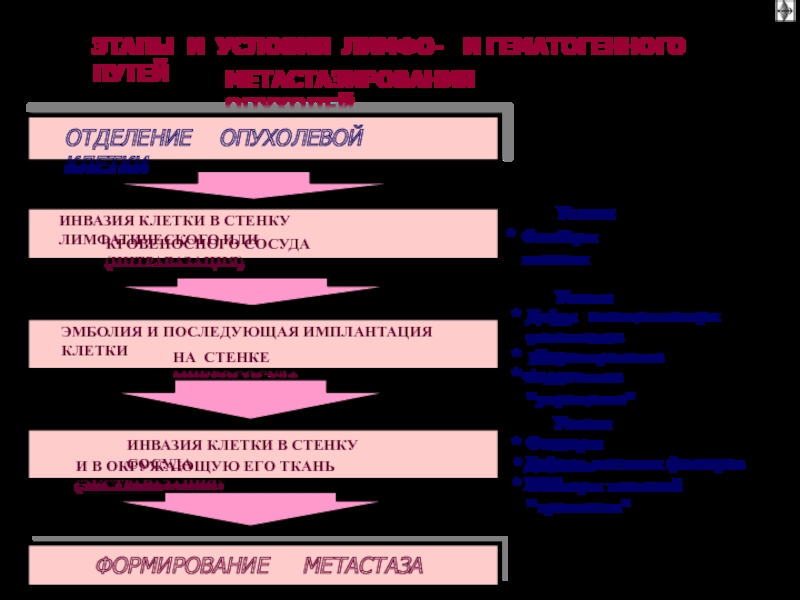
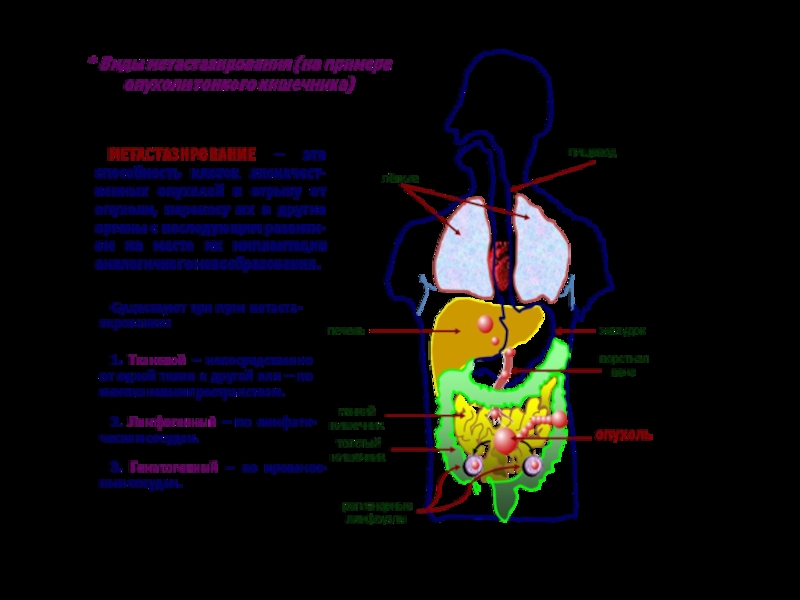
Инвазивно-метастатический процесс имеет свои этапы
развития. Каждый из них осуществляется на фоне супрессивных и цитотоксических
влияний иммунной системы, воздействия лекарственных препаратов и в условиях конкуренции с локальными нормальными клеточными клонами. Лишь миллионные доли от всего числа выселившихся из злокачественной ткани клеток «укореняются» и формируют очаг (колонии) на удалении от родоначальной опухоли, т.е. метастаз. Метастаз – это спонтанный аутотрансплантат опухоли.
Типовые стадии метастазирования (Льотта и соав. 1988).
Адгезия к базальной мембране. Опухолевый субклон, способный к инвазии и местазированию экспрессирует и даже секретирует протеины интегративного семейства и свободный ламинин. Они обеспечивают прикрепление злокачественных клеток к коллагену базальной мембраны.
Инвазия через базальную. Формирование базальной мембраны. Усиленное преодоление этого этапа зависит от способности неоплазмы расщеплять компоненты мембраны (коллаген IV). Данный процесс осуществляется с помощью гидролаз (например желатиназа, плазмин, эластаза и др.). Гидролазы секретируются неоплазмой или нормальными клетками, окружающие новообразование, которые начинают их выделять под влиянием опухолевых цитокинов – опухолеуправляемые клетки хозяина.

Слайд 99
3. Проникновение через внеклеточный матрикс. Миграция неопластических клеток сквозь
соединительную ткань. Проникновение в соединительную ткань и ее прохождение злокачественными
клетками осуществляется путем повторных актов локомоции и переваривания межклеточного вещества. Последнее происходит под влиянием стромолизинов – металлосодерзащих коллагенез. Они так же синтезируются опухолевыми клетками и опухолеуправляемыми (мезенхимальными) клетками хозяина. Продвижение неоплазмы зависит о работы циоскелета. Опухолевые клетки подвижны, отвечают хематаксисом на компоненты разрушаемого межклеточного вещества, многие из них аутокринно стимулируют собственную подвижность.
В данном процессе большое значение имеет онкоген с-srс, активирующий ряд белков в том числе винкумин (цитоскелетный протеин). Данные нарушения способствуют изменению формы клеток, утрате связи с матриксом, снимает контактное ингибирование клеточного роста и др.
4. Интравазация. Используются те же механизмы, что и при формировании базальной мембраны. Проникновение опухолевых клеток даже происходит в артериальные сосуды.

Слайд 100
5. Опухолевая эмболия – внутрисосудистый этап метастатического процесс. Здесь важное
значение имеет взаимодействие злокачественных клеток с системой гемостаза. Трансформированные клетки,
благодаря имеющихся у них адгезивных белков (тромбогенный муцин и др.) покрываются фибрином и тромбоцитами → микротромбоэмбол с неопластической «сердцевиной». Данное строение, как предполагают обеспечивает защиту неоплазм от иммунных антиканцерогенных механизмов.
Опухолевые клетки эмбола, с помощью вырабатываемых ими цитокинов «заставляют» тромбоциты выделять факторы роста, что обеспечивает выживаемость неоплазмы и ее приживае6мость. Микротромбы обычно задерживаются в прекапиллярах, капиллярах, посткапиллярных венулах. Цитокины этого эмбола вынуждают эндотелий микрососудов сокращаться. Что приводит к контакту злокачественных клеток с базальной мембраной, т.е. развитию адгезии.
6. Экстравазация. Применяются те же механизмы, что и при интравазации и при перемещении по межклеточному пространству.
7. Приживление метастаза. Здесь необходимо два основных момента:
Стимуляция роста опухолевых клеток на новом месте
Синтез собственных факторов роста (аутокринной стимуляции)

Слайд 101
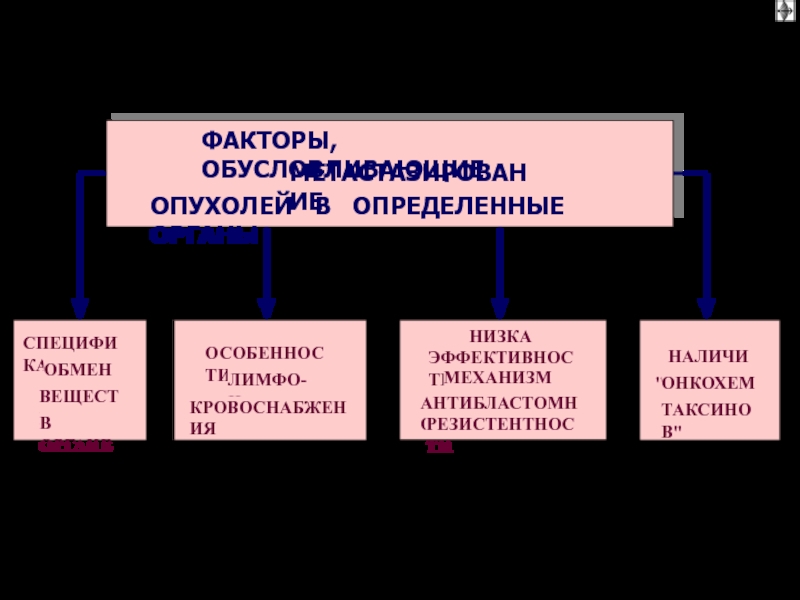
Способность собственных факторов аутотрансплантанта отвечать на хемокины и факторы роста
местных тканей. например, клетки рака молочной железы реагируют на цитокины
легочного происхождения, отсюда – избирательный характер метастазирования в легочной ткани.
2) Васкулязация метастазов – главное звено в приживание злокачественного аутотрансплантанта.
Цитокины, стимулирующие ангиогенез
ангиогенин
Фактор роста гепатоцитов
Трансформирующие ростовые
факторы α и β
Интерлейкин 8
Простагландина Е1 и Е2
Цитокины, тормозящие ангиогенез
Ангиостатин
Ингибитор хрящевой ткани
Гепариназа
Интерферон α и β
тромбоспондин
Слайд 104
АНТИОНКОГЕНЫ (гены-супрессоры)
P 53 , Rb, WT-1 И ИХ РОЛЬ
БЛОКАДА
ЭКСПРЕССИИ
ОНКОГЕНОВ
ПРЕДОТВРАЩЕНИЕ
ИНИЦИАЦИИ
КАНЦЕРОГЕНЕЗА
ПРОГРАММИРОВАНИЕ
АПОПТОЗА
ГЕНОТИПИЧЕСКИ
ОПУХОЛЕВЫХ
КЛЕТОК
БЛОКАДА
ПРОМОЦИИ
КАНЦЕРОГЕНЕЗА