Слайд 1Неклассическое естествознание
Квантовая механика
Слайд 2Излучения абсолютно черного тела
Любое нагретое тело излучает ЭМ волны (свет)
в широком диапазоне, причем интенсивность излучения сильно зависит от его
частоты.
«Абсолютно черное тело» - тело, способное поглощать при любой температуре все падающее на него ЭМ излучение. Внутри АЧ полости тепловое излучение непрерывно поглощается и излучается стенками полости, не выходя из нее. При этом энергия, излучаемая нагретым телом в единицу времени, равна поглощаемой им энергией.
Слайд 3Излучения абсолютно черного тела
Английские «классические физики» лорд Рэлей (1842-1919) и
сэр Джеймс Джинс (1877-1948), использовав те же самые теоретические положения,
что и Максвелл при создании МКТ, получили для спектральной плотности энергии (тепловой энергии, излучаемой единицей площади в единичном спектральном интервале) выражение
Это выражение хорошо описывало ход экспериментальной зависимости при низких частотах, но предсказывало бесконечный рост интенсивности в ультрафиолетовой области («ультрафиолетовая катастрофа»).
Слайд 4Рождение квантовой механики
Макс Планк (1858-1947) - член Прусской академии, всецело
стоявший на позициях классической физики, двадцать лет занимавшийся изучением проблем
термодинамики.
Исследуя необратимый процесс установления равновесия между веществом и излучением, Планк сделал предположение о том, что испускание и поглощение ЭМ энергии происходит не непрерывно, а отдельными порциями -«квантами». 14 декабря 1900 года Планк представил результаты своей работы Берлинскому физическому обществу – родилась квантовая механика.
Введенный Планком в физику квант света имеет энергию
E = hν, (h=6.63 10-34 Дж с).
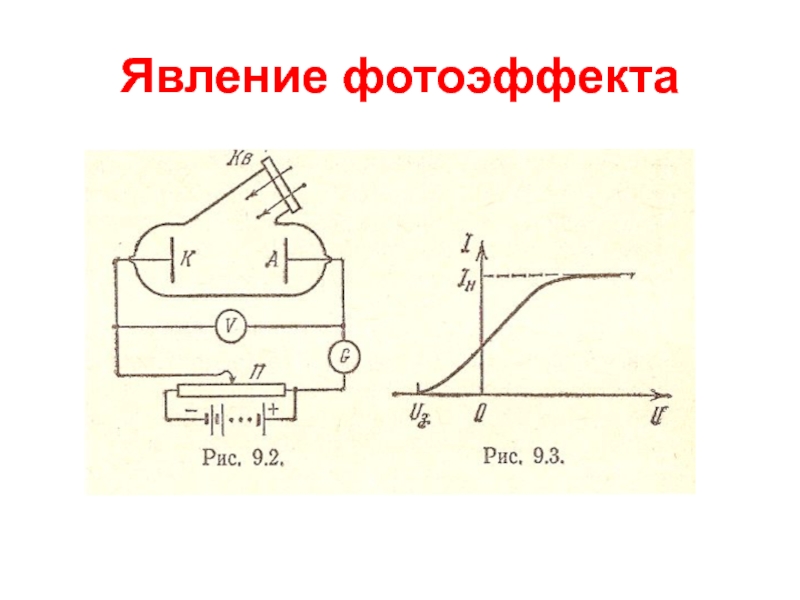
Слайд 5Явление фотоэффекта
Явление внешнего фотоэффекта было открыто в 1887 г.
Генрихом Герцем.
В 1888- 1889 г. А.Г.Столетов (1839-1896) систематически исследовал
фотоэффект и обнаружил его основные закономерности:
1) наибольшее действие оказывают ультрафиолетовые лучи;
2) сила тока возрастает с увеличением освещенности пластины;
3) испускаемые под действием света заряды имеют отрицательный знак.
Спустя 10 лет в 1898 г. Леннард и Томсон, измерив удельный заряд испускаемых частиц, установили, что это электроны.
Слайд 7Явление фотоэффекта
Внешний фотоэффект представляет собой испускание электронов поверхностью металла,
освещаемого светом. Эксперимент показал, что энергия фотоэлектронов не зависит от
интенсивности падающего света, а определяется только его частотой.
В 1905 г. А.Эйнштейн показал, что все закономерности фотоэффекта можно объяснить, если предположить, что свет поглощается некоторыми порциями
( квантами).
Слайд 8Явление фотоэффекта
Уравнение фотоэффекта
hν = Aвых +mV2макс/2
Для каждого конкретного металла, характеризуемого своим
значением Авых, существует некоторая минимальная частота падающего света (или, соответственно, максимальная длина волны), при которой фотоэффект возможен. Это граничное значение определяет «красную границу» фотоэффекта
νкр=Авых/h; λкр=hc/ Авых.
Таким образом, свет не только испускается, но и поглощается в виде квантов.
Слайд 9Корпускулярно-волновой дуализм
Эйнштейн выдвинул радикально новое понятие: дуализм «волна-частица»
Свет
представляет собой сложный материальный объект, который обладает как волновыми, так
и корпускулярными свойствами.
Волновые и корпускулярные характеристики связаны соотношениями:
E = hν, p =E/c=h/λ
Слайд 10Корпускулярно-волновой дуализм
В 1923 году выпускник Парижской Сорбонны принц Луи
де Бройль обобщил идею Эйнштейна о дуализме «волна-частица» со света
на материю.
Соотношение, связывающее импульс с длиной волны, справедливо и для частиц вещества. Любой частице, имеющей импульс р, может соответ-ствовать волна, длина которой определяется соотношением
λ = h/p.
Вскоре в опытах по дифракции электронов на кристаллической решетке были доказаны волновые свойства электронов.
Слайд 12
Теория атома
Закономерности в атомных спектрах
В 1885
г. швейцарский школьный учитель математики Йохан Бальмер обнаружил, что длины
волн серии линий атома водорода, лежащей в области видимого спектра связаны соотношением
ν = R (1/n2 – 1/m2),
R=3.29 1015 Гц – постоянная Ридберга,
n и m – целые числа.
Исходя из полученной формулы, Бальмер предсказал существования спектральных серий водорода в ультрафиолетовой и инфракрасной области, которые были обнаружены спустя 20 лет.
Слайд 13Теория атома
Открытие радиоактивности
В первые годы ХХ
века были обнаружены новые типы излучений - радиоактивные, названные α,
β, и γ-излучением. Явление радиоактивности занимались Антуан Беккерель (1852-1908) и супруги Пьер (1859-1906) и Мари (1867-1934) Кюри
Слайд 14Теория атома
Опыты Резерфорда
В 1907 г. профессор физики Манчестерского университета
Эрнст Резерфорд (1871-1937), изучавший проблемы радиоактивности, и его сотрудники исследовали
прохождение α-частиц через тонкую металлическую фольгу.
Основываясь на экспериментальных данных Резерфорд в 1911 г. предложил ядерную модель атома:
в центре атома расположено тяжелое положительно заряженное ядро с зарядом Ze и размерами, не превышающими 10-12 м;
вокруг ядра расположено Z электронов, распределенных по всему объему, занимаемому атомом, размеры атома порядка 10-10 м.
Слайд 15Теория атома
Ядерная модель оказалась в противоречии с законами классической механики
и электродинамики.
Поскольку система неподвижных зарядов не может находиться в
состоянии устойчивого равновесия, Резерфорду пришлось предположить, что электроны движутся вокруг ядра по криволинейным траекториям.
Но в этом случае электрон движутся с ускорением, и согласно законам классической электродинамики он должен излучать электромагнитные волны, теряя при этом энергию, в результате чего должен в конечном счете упасть на ядро.
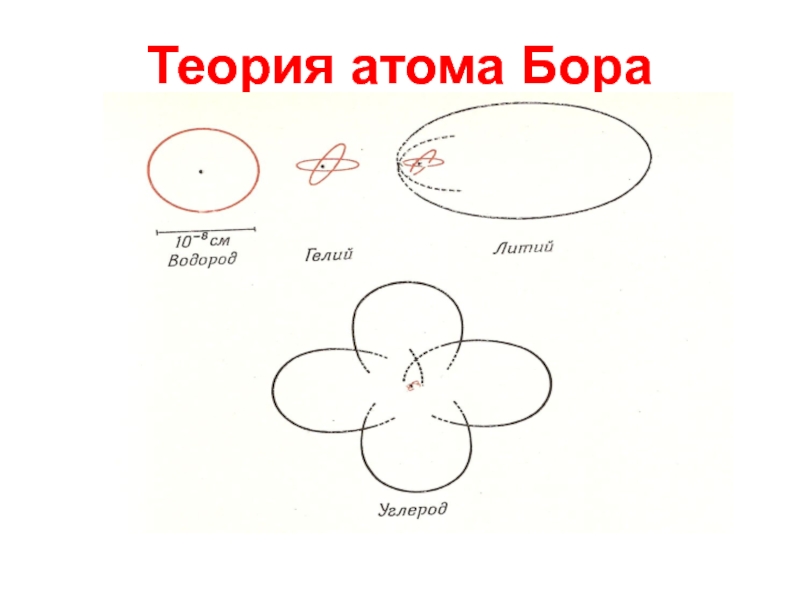
Слайд 16Теория атома Бора
Молодой датский студент Нильс Бор в начале 1912
года подготовил для Резерфорда работу «О строении атомов и молекул».
Два постулата:
Из бесконечного числа электронных орбит, разрешенных классической механикой, реализуются только некоторые дискретные орбиты, удовлетворяющие определенным квантовым условиям. Электрон, находясь на такой орбите, не излучает ЭМ волн.
Излучение испускается или поглощается в виде светового кванта при переходе электрона из одного стационарного состояния в другое. Величина кванта энергии hν = Е1 – Е2
Слайд 17Теория атома Бора
Согласно постулату Бора осуществляются только те электронные орбиты,
для которых момент импульса кратен постоянной Планка
L = mvR = n h/2π
Квантовые условия Бора получили простое объяснение на основе дуализма «волна-частица», примененного к находящимся на стационарных орбитах электронам. На длине орбиты должно укладываться целое число волн
2πR = n λ.
Использую соотношение де Бройля, легко получить условие квантования момента импульса.
Слайд 18Теория атома Бора
Используя классическое описание движения электрона как вращения в
кулоновском поле ядра, Бор получил аналитические выражения для радиусов стационарных
орбит и энергий соответствующих состояний атома:
, где r1=0.53 A= 0.53 10-10 м
Ry=-13.6 эВ.
Теория Бора позволила объяснить спектры атома водорода. Рассчитанное теоретически значение постоянной Ридберга лишь на несколько процентов отличалось от полученного Бальмером.
Слайд 19Теория атома
Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
главным
n (
n=1, 2, …)
азимутальным l ( l=1, 2, …, n-1)
магнитным ml ( ml=-l,…,-1,0,+1,…,+l )
спиновым ms ( ms=+1/2, -1/2)
В нормальном (невозбужденном) состоянии атома электроны должны располагаться на самых низких доступных для них энергетических уровнях.
Швейцарский физик-теоретик Вольфганг Паули (1900-1958)
Согласно принципу Паули, в одном и том же атоме
( или другой квантовой системе ) не может быть двух электронов, обладающих одинаковой совокупностью квантовых чисел.
Слайд 20Теория атома
В атоме каждому n состоянию могут соответствовать
n=1
– 2 электрона,
n=2 – 8 электронов,
n=3
– 18 электронов и т.д.
Совокупность электронов, имеющих одинаковые значения главного квантового числа n, образует оболочку.
Значение n 1 2 3 4 …
Обозначение оболочки K L M N …
Принцип Паули дает объяснение повторяемости свойств атомов. Аналогичными свойствами обладают атомы с одинаковым количеством электронов во внешней оболочке - см. периодическую систему элементов Менделеева
Слайд 21Квантовая механика
«Старая» квантовая теория, созданная Планком, Эйнштейном, де Бройлем, Резерфордом,
Бором, Зоммерфельдом, Паули и др., смогла объяснить:
спектр атома водорода;
квантование энергии
в стационарных состояниях атома;
периодическую систему Менделеева.
Рождение новой квантовой механики.
С июня 1925 года по июнь 1926 года, было опубликованы три оригинальных и независимо сделанных варианта полной квантовой теории:
Матричная квантовая механика – Вернер Гейзенберг (1901-1976)
Волновая механика – Эрвин Шредингер (1877-1961)
Квантовая алгебра – Пауль Дирак (1902-1984)
Слайд 22Квантовая механика
Теория Шредингера, основанный на концепции волн де Бройля.
Шредингер сопоставил движению микрочастицы комплексную функцию координат и времени, которую
он назвал волновой функцией и обозначил греческой буквой Ψ.
Явный вид Ψ-функции получается из решения уравнения Шредингера (1926 г.), которое является основным уравнением нерелятивистской квантовой механики и играет для описания явлений микромира такую же роль, как и законы динамики Ньютона при описании движения в макромире.
Слайд 23Квантовая механика
Для стационарных состояний
Физическую интерпретацию Ψ-функции дал М.Борн в
1926 г. квадрат модуля Ψ-функции определяет вероятность того, что частица
будет обнаружена в пределах некоторого объема
Интеграл от этого выражения по всему объему должен быть равен единице, т.к. выражает вероятность того, что частица находится в одной из точек пространства (условие нормировки).
Таким образом, квантовая механика имеет статистический характер.
Слайд 24Квантовая механика
Одним из основных положений квантовой механики является принцип
суперпозиции состояний.
Пусть некоторая квантовомеханическая система может находиться в состоянии
Ψi, i=1,2,3... Тогда состояние существует состояние системы
Ψ= c1 Ψ1 + c2Ψ2+…
где cn – некоторые постоянные. Квадраты модулей коэффициентов cn дают вероятность того, что при измерениях, производимых над системой, будут получены результаты, соответствующие нахождению системы в состоянии Ψn.
Слайд 25Квантовая механика
Атом водорода
Решение уравнение Шредингера, где U= Ze2/r -силовое поле,
в котором движется электрон.
Собственные волновые функции Ψ=Rnl(r) Ylm(θ,ϕ)
Энергия электрона
зависит только от главного квантового числа n, следовательно, каждому собственному значению энергии ( кроме Е1) соответствует несколько собственных волновых функций, отличающихся значениями квантовых чисел l и m.
при переходе электрона с одного энергетического уровня на другой для азимутального квантового числа должно выполняться правило отбора Δl = ±1
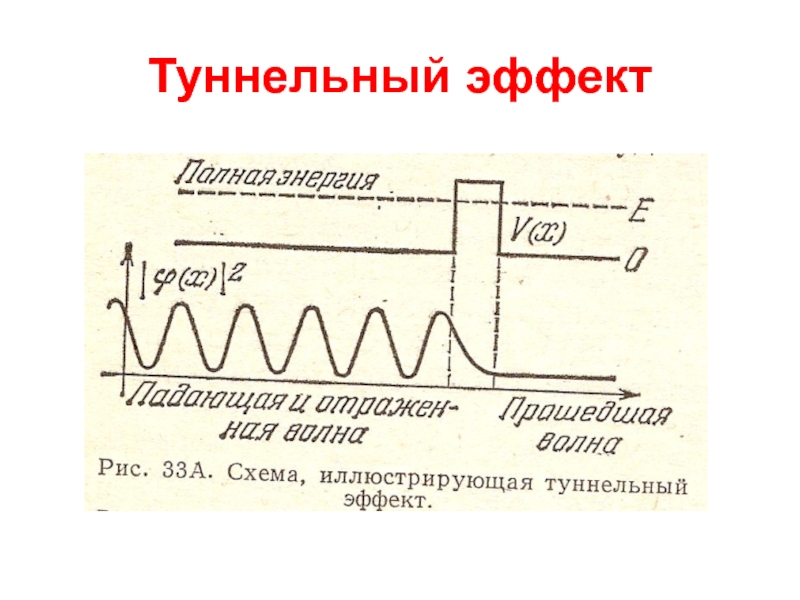
Слайд 28Квантовая механика
Туннельный эффект
Частица, движущаяся слева направо, встречает на своем
пути потенциальный барьер высоты U.
По классическим представлениям, если энергия
частицы больше высоты барьера, частица беспрепятственно проходит над барьером, Если же энергия частицы меньше высоты барьера, то частица отражается от барьера и летит в обратную сторону.
Согласно квантовой механике, имеется отличная от нуля вероятность, что частица отразится от барьера с UE. Эта вероятность сильно зависит от ширины барьера. Также коэффициент прохождения резко уменьшается при увеличении массы.