Слайд 1Липиды и обмен липидов
Липиды – гидрофобные вещества, эфиры жирных кислот
и спиртов.
Классификация:
Простые: нейтральные жиры (глицерофосфолипиды) и воска
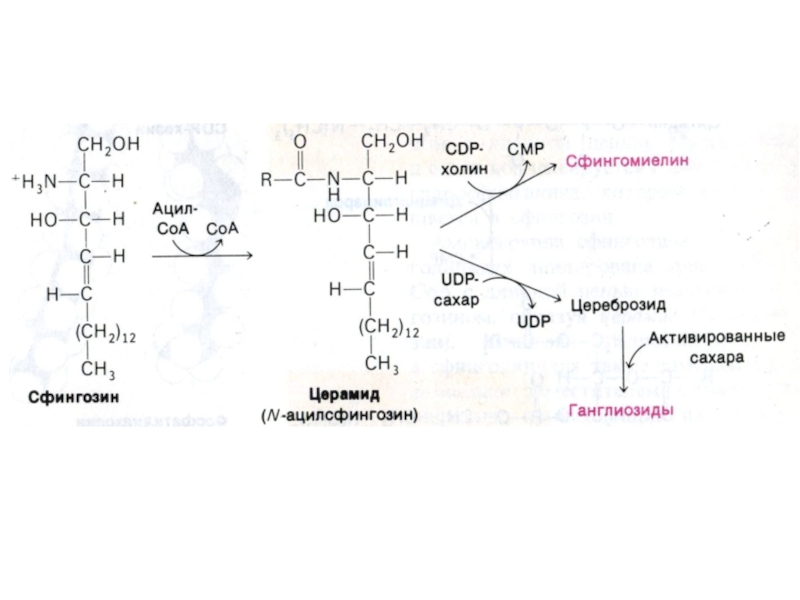
Сложные: фосфолипиды (глицеро- и
сфинголипиды); гликолипиды (цереброзиды, ганглиозиды, сульфатиды); липопротеины (ХМ, ЛПОНП, ЛПНП, ЛПВП)
Неомыляемые : стероиды и терпены
Слайд 4ФУНКЦИИ ЛИПИДОВ
1. Энергетическая (1 г липидов при окислении дает 9,3
ккал; 1 моль пальмитиновой кислоты – 130 АТФ). Резервный видоспецифический
нейтральный жир, депонированный в адипоцитах.
Но! Жирные кислоты окисляются только в митохондриях, в аэробных условиях; не проникают через гематоэнцефалический барьер.
Т.о. жирные кислоты не всегда и не во всех клетках могут служить источником энергии.
Слайд 5Функции липидов
Структурная: холестерол и фосфолипиды – структурные компоненты мембран.
Метаболическая:
холестерол образует большое число биоактивных стероидов, витамин Д, желчные кислоты;
Защитная,
антибактериальная, термоизоляционная: подкожная жировая клетчатка, сальник, миелиновая оболочка периферических нервов, альвеолярный сурфактант, кожное сало.
Слайд 6Функции липидов
Регуляторная: стероидные гормоны, фосфатидилинозитол и его производные: диацилглицерол и
инозитолфосфат (вторичные мессенджеры гормонов); производные полиненасыщенных жирных кислот: простагландины, лейкотриены,
тромбоксаны и др.
Слайд 7Патология липидного обмена
Первичные нарушения:
Гиперлипопротеинемия, дислипопротеинемия (гиперхолестеринемия: атеросклероз)
Ожирение
Желчнокаменная болезнь
Метаболический ацидоз (кетонемия)
Вторичные
гиперлипопротеинемии сопровождают сахарный диабет, нефроз, гепатит, хронический алкоголизм.
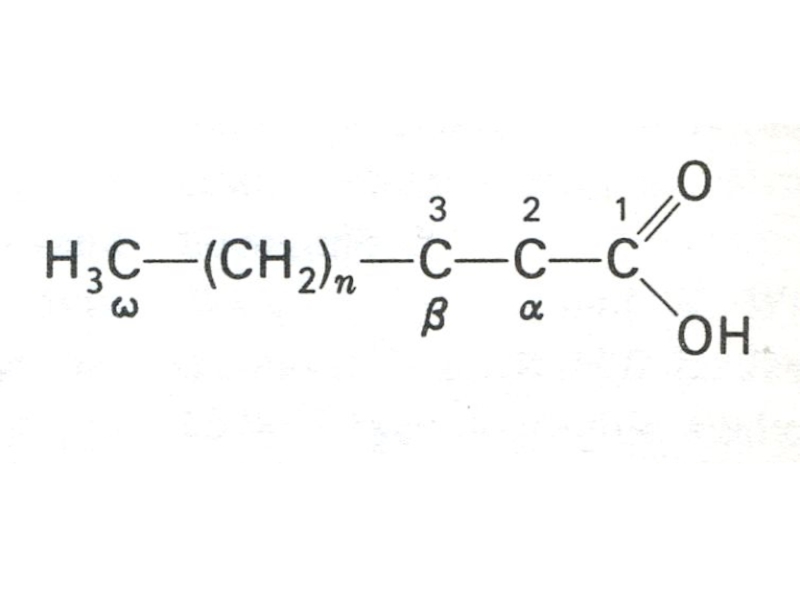
Слайд 8Жирные кислоты
> 70 жирных кислот идентифицированы в организме.
Свободные жирные кислоты
находятся в основном в плазме крови (транспортируются альбумином), в клетках
жирные кислоты - в виде эфиров со спиртами.
В клетках синтезируются в основном жирные кислоты насыщенные, с четным числом атомов С, имеющие компактную укладку (цис-конформация).
Две классификации: Сn:m,Δ или ω:3,6 , где n – число атомов С, m – количество двойных связей; Δ - место двойной связи (считая от СООН группы); ω – место двойной связи, считая от СН3 – группы.
Например: линолевая кислота С18:2 Δ 9,12 или ω− 6.
Слайд 9ЖИРНЫЕ КИСЛОТЫ
Галогеновое число определяет число двойных связей в жирной кислоте.
У человека возможен синтез только пальмитоолеиновой и олеиновой кислот (мононенасыщенные).
Полиненасыщенные (линолевая, линоленовая, арахидоновая) – незаменимые (эссенциальные).
Количество двойных связей определяет температуру плавления: для пальмитиновой к-ты 630С, олеиновой 13,50С, линолевой -110С.
Соли жирных кислот – мыла (образуют мицеллы).
Липиды экстрагируются из тканей органическими растворителями, разделяются и идентифицируются хроматографически (по растворимости).
Спектрофотометрически жирные кислоты не определяются (нет сопряженных двойных связей)
Слайд 10Производные ненасыщенных жирных кислот - ЭЙКОЗАНОИДЫ
Семейства простагландинов, тромбоксанов, лейкотриенов др.
- биологически активные вещества, действуют в концентрации 10 -9М, как
гормоны местного действия, через рецепторы и систему циклических нуклеотидов или других посредников.
Образуются в мембранах клеток из С20 полиненасыщенных кислот , продуктов гидролиза фосфолипидов мембран под действием фосфолипазы А2 (ингибируется стероидными гормонами).
Слайд 11ПРОСТАГЛАНДИНЫ
Образуются при участии циклооксигеназы из арахидоновой кислоты (С20:4).
Ингибируется аспирином по
механизму ковалентной модификации фермента – ацетилирование).
Слайд 12Внешний обмен липидов
Потребность в жирах – 80 -100 г/сут (возрастает
при необходимости перехода энергетического обмена с преимущественно углеводно-липидного на липидно-углеводный).
Важно
поступление полиненасыщенных жирных незаменимых (полиненасыщенных) кислот.
Условие гидролиза жиров в ЖКТ – эмульгирование, что делает их доступными для действия липаз, растворенных в водной среде. Колипазы (активируются трипсином).
Естественной эмульсией является только молоко.
Особенность пищеварения у детей – наличие липазной активности в желудке.
Слайд 13ВНЕШНИЙ ОБМЕН ЛИПИДОВ
Основные эмульгаторы жиров в ЖКТ – желчные кислоты
– производные холестерола, но и фосфолипиды и жирные кислоты служат
поверхностно активными веществами и являются эмульгаторами.
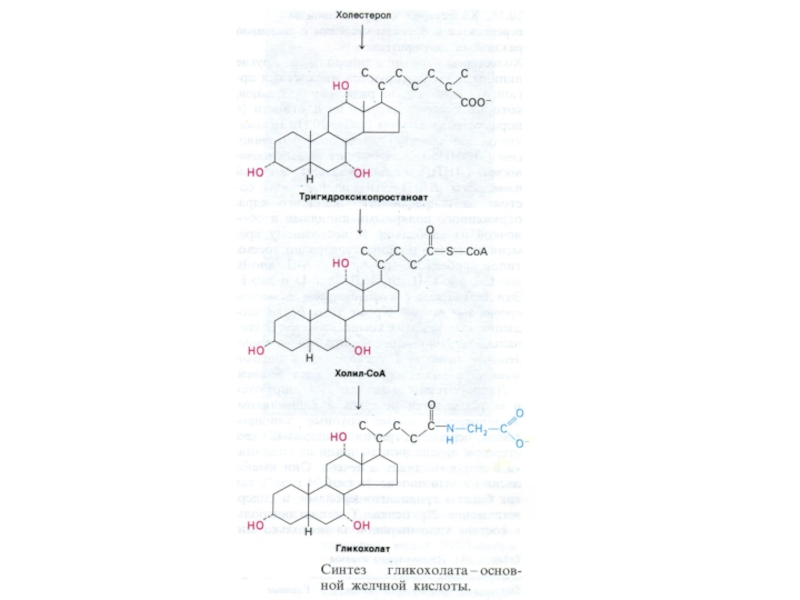
Желчные кислоты образуются в гепатоцитах после окисления боковой цепи и действии холестерол-гидроксилазы. Далее холановые кислоты коньюгируют с остатками глицина или таурина и образуют соли калия или натрия.
До 80% холестерола превращается в холевые кислоты и «сбрасывается» в желчные капилляры.
Желчные кислоты и фосфолипиды поддерживают холестерин желчи в растворимом состоянии, предотвращая образование «камней» в желчном пузыре
Являясь амфипатичными молекулами холевые кислоты способствуют эмульгированию липидов и участвуют в формировании мицелл, в составе которых всасываются гидрофобные вещества в кишечнике ( в том числе жирорастворимые витамины).
Слайд 17ВНЕШНИЙ ОБМЕН ЛИПИДОВ
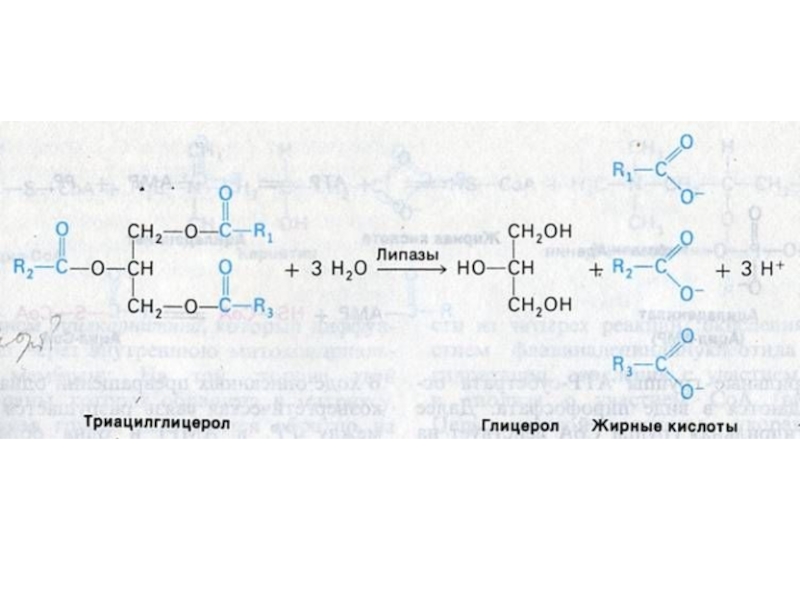
Гидролиз нейтральных жиров в 12 –п кишечнике: моно-
, ди- и триглицеридлипазы: продукты – глицерин, моно- и ди-ацилглицеролы
(чаще 2- МАГ).
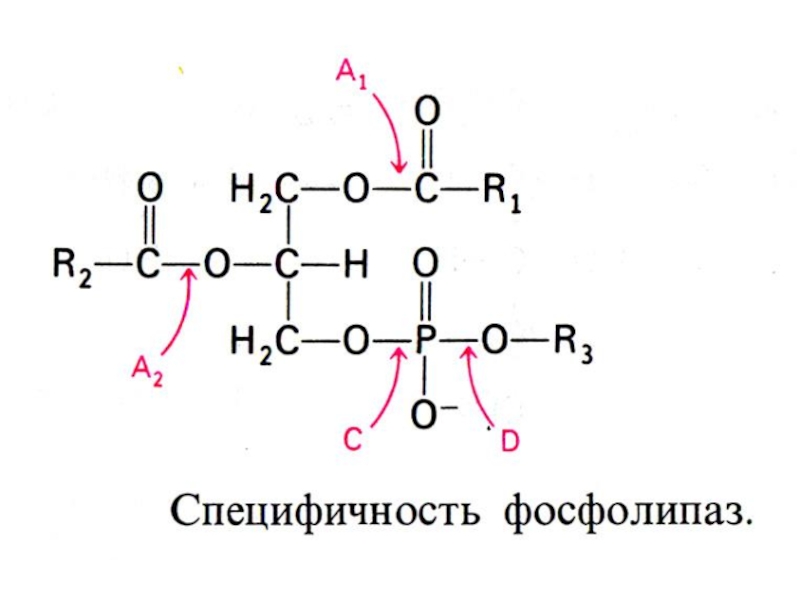
Гидролиз фосфолипидов (фосфотидилхолина,например): фосфолипаза А1, А2, С и Д. Продукты: 1,2 ацилглицеролы; 2-ацилглицеролфосфорилхолин, лизофосфатидилхолин (амфипатичное соединение!), фосфатидная кислота, холин.
Гидролиз эфиров холестерола: холестерол-эстераза. Продукты: холестерол и жирная кислота.
Липазы тонкого кишечника активируются трипсином.
Слайд 18ВСАСЫВАНИЕ ПРОДУКТОВ ГИДРОЛИЗА В ЖКТ
Мелкие эмульгированные капли жира (до 0,5
мкм) проникают через кишечную стенку без предварительного гидролиза.
Глицерин и короткие
жирные кислоты (до 10 С- атомов) диффундируют самостоятельно.
Длинноцепочечные жирные кислоты, 2 - МАГ,ХЛ и ЭХЛ всасываются в составе мицелл (окруженные фосфолипидами и желчными кислотами) (мицеллярная диффузия или пиноцитоз).
Желчные кислоты совершают многократную энтерогепатическую циркуляцию (синтез 3 -7 г при потребности 100-200 г).
До 0,6 г/сут теряется с калом.
Слайд 19Ресинтез жиров в энтероцитах
На основе продуктов гидролиза
экзо- генных жиров в энтероцитах синтезиру- ются видоспецифичные липиды. Чаще
всего 2’МАГ этерифицируется остатками олеиновой кислоты (C18:1).
Слайд 20Фосфолипиды образуются на основе фосфатидной кислоты и активных форм холина,
серина, этаноламина или инозитола.
O
II
СН2-О-С-R1
I
R2-C-O-CH OH
II I I
O CH2-O-P-OH
II
O Фосфатидная кислота
1
2
3
Слайд 21Транспортные формы экзогенных липидов
* Глицерол и СЖК (С
из энтероцитов через портальную вену и поступают в печень.
*
СЖК (С>10) покидают энтероциты через кишечную лимфатическую систему в форме ресинтезированных ТАГ в составе хиломикронов (ХМ).
от «сhylos» (греч.) – лимфа (млечный сок).
Слайд 22ХМ – транспортная форма экзогенных липидов
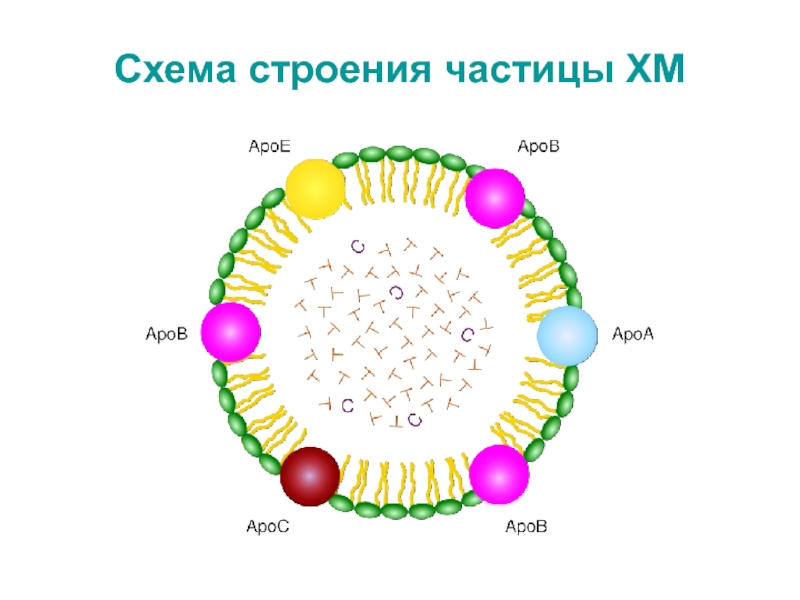
ХМ образуются в энтероцитах:
* Незрелые
ХМ (насцентные) – 85% ТАГ, немного ФЛ и ЭХС, белок
– апопротеин В-48 (апо-В-48). Покидают энтероциты путем экзоцитоза и поступают в лимфатические сосуды ? грудной лимфатический проток ? ? подключичная вена (т.е.попадают в кровоток, минуя печень) .
Слайд 24* В кровяном русле незрелые ХМ получа-ют от ЛПВП апо-Е,
апо-С-II (кофактор ЛПЛ) и апо-А-IV. Этим завершается превращение незрелых ХМ
в зрелые ХМ-частицы.
* Состав зрелых ХМ (диаметр 100-1000 нм):
ТАГ – 84%
ФЛ – 7%
ХС – 8%
Белок – менее 2% (апо-В-48, апо-С-II,
апо-Е и апо-А-IV)
Плотность (удельный вес) ХМ <0,95 г/мл
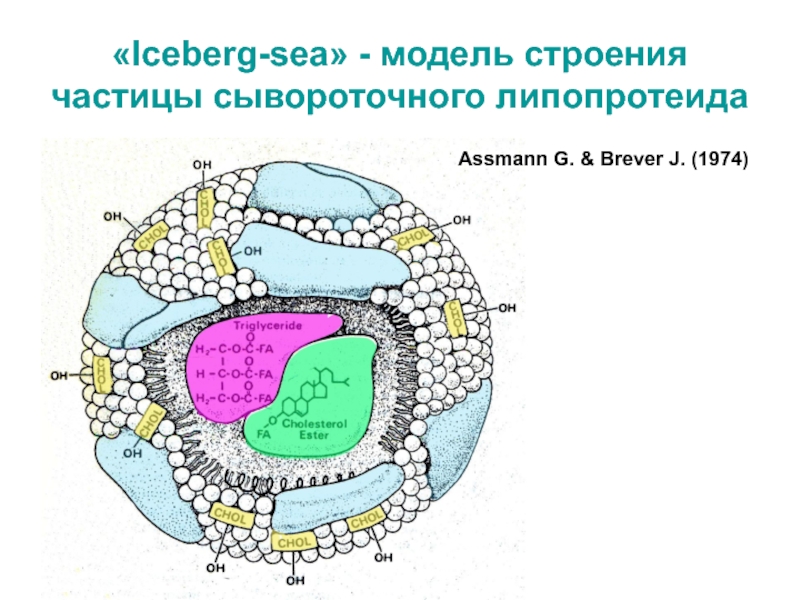
Слайд 25«Iceberg-sea» - модель строения частицы сывороточного липопротеида
Assmann G. & Brever
J. (1974)
Слайд 26Функции ХМ
* ХМ доставляют экзогенные липиды в печень, жировую ткань,
миокард и скелетные мышцы. ТАГ в составе ХМ гидролизуются с
участием липопротеинлипазы (ЛПЛ), которая находится на поверхности эндотелиоцитов капилляров.
* ЛПЛ синтезируется в печени. Активаторы: инсулин, СТГ и гепарин.
* СЖК, освобожденные в результате гидролиза ТАГ, поступают внутрь клеток.
В плазматических мембранах многих типов клеток имеются специфи-ческие белки-переносчики для СЖК (40 кДа). В скелетных мышцах имеется еще транслоказа жирных кислот (84 кДа, CD36). В ответ на повышение концентрации инсулина в крови, эта транслоказа выходит из цитоплазмы и встраивается в мембрану, обеспечивая быстрое поглощение СЖК мышечными клетками. (Подобно ГЛЮТ-4).
Слайд 27 ХМ, отдав часть ТАГ в результате их гидро-лиза
ЛПЛ, превращаются в ремнантные ХМ (р-ХМ), которые поглощаются гепатоцитами с
помощью рецепторов к р-ХМ (эти рецепторы «узнают» р-ХМ по апо-Е).
ХС из р-ХМ, оказавшись в печени, по меха-низму отрицательной обратной связи ингибирует синтез ХС de novo.
Излишки ХС выводятся печенью с желчью (в большей степени в виде желчных кислот)
Слайд 28Промежуточный обмен липидов
Внутриклеточный липолиз
Адипоциты или клетки жировой ткани
(подкожный жир, малый и большой сальники брюшной полости):
* Гидролиз ТАГ
катализирует гормончувствительная ТАГ-липаза.
* Процесс мобилизации жира активируется в
постабсорбтивном периоде, голодании,
при физической нагрузке.
Слайд 29Механизм активации гормончувствительной ТАГ-липазы адипоцитов
В постабсорбтивном периоде липолиз в ади-поцитах
активируется глюкагоном;
* При физической нагрузке липолиз в адипоцитах активируется адреналином.
* Оба гормона связываются со своими рецепторами на поверхности клеточной мембраны и активируют аденилатциклазу.
Адреналин в высоких концентрациях связы-вается с β-адренорецепторами адипоцитов.
Слайд 30* В результате активации аденилатцик-лазы повышается концентрация ц-АМФ, которая активирует
протеинкиназу А (ПКА).
* ПКА фосфорилирует неактивную форму ТАГ-липазы (активная форма
ТАГ-липазы фосфорилированная).
* Переход активной формы ТАГ-липазы в неактивную – через дефосфорилиро-вание: инсулин активирует протеин-фосфатазу.
Слайд 31Суммарный результат гидролиза ТАГ в адипоцитах
Гормончувствительная ТАГ-липаза сначала отщепляет
ЖК
в положении 1 = 1 СЖК + диацилглицерол (ДАГ).
Другие
липазы завершают процесс = 2 СЖК + глицерол.
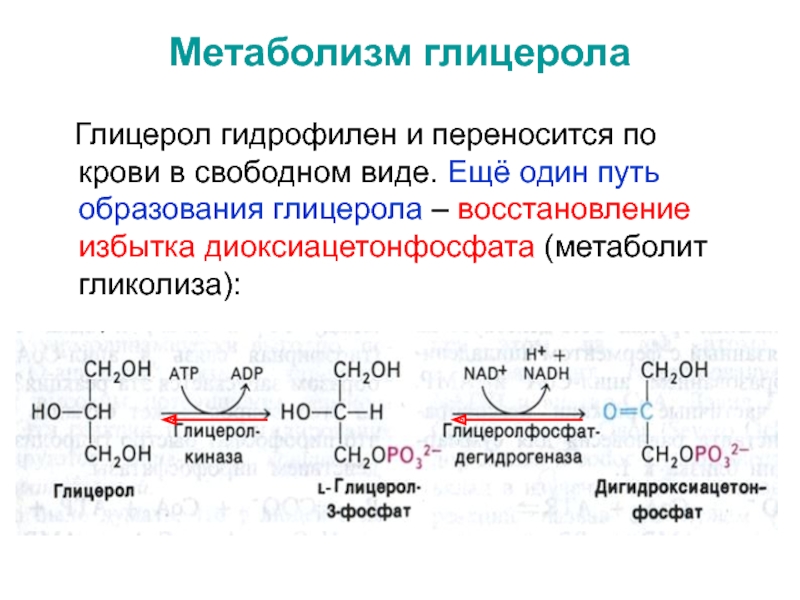
Слайд 32Метаболизм глицерола
Глицерол гидрофилен и переносится по крови в
свободном виде. Ещё один путь образования глицерола – восстановление избытка
диоксиацетонфосфата (метаболит гликолиза):
Слайд 33* Глицерол является субстратом для:
- липогенеза;
-
глюконеогенеза
- или может окисляется через диокси-ацетонфосфат по
гликолитическому пути.
ЗАДАНИЕ: Назовите ключевые ферменты этих метаболических превращений и расчитайте энерге-тическую ценность окисления глицерина.
Слайд 34 * СЖК транспортируются по крови в
комплексе
с альбумином – молекула
альбумина имеет 7 специфических
сайтов для связывания СЖК.
* СЖК из крови проникают внутрь клетки с помощью специфического белка-переносчика цитоплазматической мем-браны (40 кДа): fatty acids binding protein (FABP). В клетках СЖК включаются в процессы окисления или синтеза липидов (преобладание реакций зависит от функционального состояния клетки).
Слайд 35Окисление жирных кислот
Путь окисления СЖК, сопряженный с синте-зом АТФ, протекает
в митохондриях [Ю.Кеннеди и А.Ленинджер, 1949] и назва-ется β-окислением.
Ф. Кноп
(1904) установил, что расщепление СЖК происходит путем окисления при β-ато-ме углерода и последовательного удаления двухуглеродных фрагментов.
Слайд 36Опыты Франца Кнопа
К ω-атому углерода ЖК с неразветвленной цепью присоединена
фенильная группа. Продукты свидетельствуют о том, что окисление
ЖК идет
по β-углеродному атому.
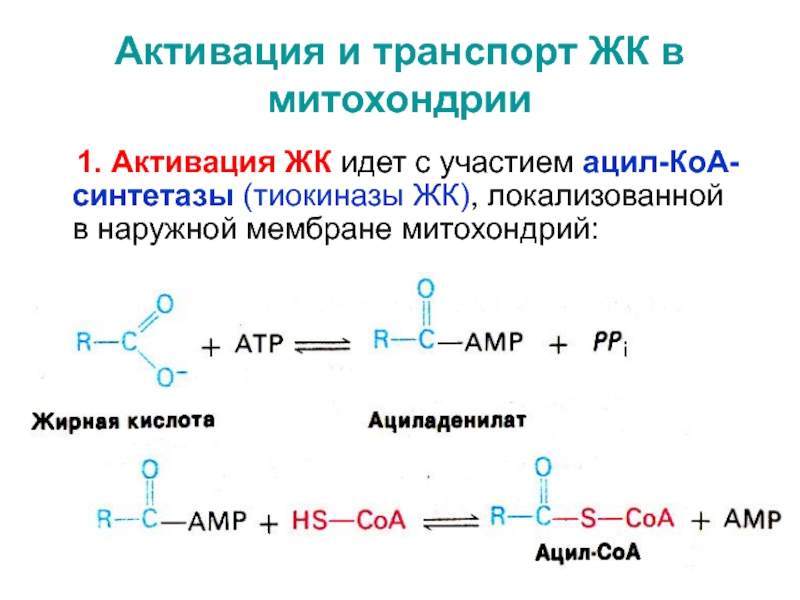
Слайд 37Активация и транспорт ЖК в митохондрии
1. Активация ЖК
идет с участием ацил-КоА-синтетазы (тиокиназы ЖК), локализованной в наружной мембране
митохондрий:
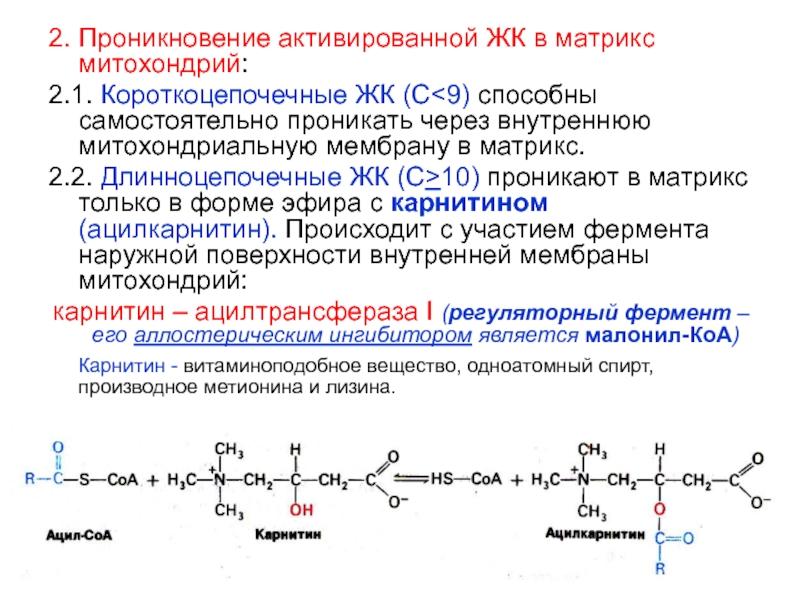
Слайд 382. Проникновение активированной ЖК в матрикс митохондрий:
2.1. Короткоцепочечные ЖК (С
способны самостоятельно проникать через внутреннюю митохондриальную мембрану в матрикс.
2.2. Длинноцепочечные
ЖК (С>10) проникают в матрикс только в форме эфира с карнитином (ацилкарнитин). Происходит с участием фермента наружной поверхности внутренней мембраны митохондрий:
карнитин – ацилтрансфераза I (регуляторный фермент – его аллостерическим ингибитором является малонил-КоА)
Карнитин - витаминоподобное вещество, одноатомный спирт, производное метионина и лизина.
Слайд 392.3. Обратное превращение:
ацилкарнитин ? ацил-КоА
Происходит с участием фермента, локализованном на внутренней поверхности внутренней мембраны митохондрий:
карнитин-ацилтрансфераза II
ацилкарнитин + КоА-SH ?? ацил-КоА + карнитин
Трехэтапный процесс: активация ЖК (ацил-КоА) и пере-
нос активированной ЖК в матрикс (ацилкарнитин ?
ацил-КоА) позволяет использовать два не обмени-
вающихся между собой пула КоА. В цитоплазме и
матриксе МХ эти пулы используются для разных целей.
Слайд 40Реакции β-окисления жирных кислот
Путь β-окисления – повторяющаяся последова-
тельность четырех реакций.
На каждом этапе окисления образуется:
1 ацетил-КоА
1 FADH2
1 NADH
исходная цепь ЖК
укорачивается на 2 С-атома.
Число этапов β – окисления: (n/2)-1,
где: n – число С-атомов в ЖК.
Слайд 41
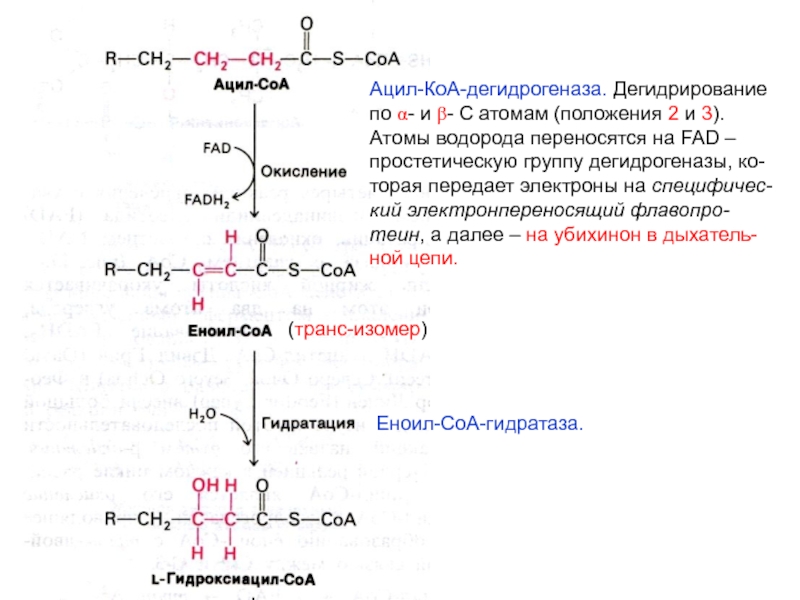
Ацил-КоА-дегидрогеназа. Дегидрирование
по α- и β- С атомам (положения 2 и
3). Атомы водорода переносятся на FAD – простетическую группу дегидрогеназы,
ко-
торая передает электроны на специфичес-кий электронпереносящий флавопро-теин, а далее – на убихинон в дыхатель-ной цепи.
Еноил-СоА-гидратаза.
(транс-изомер)
Слайд 423-гидроксиацил-СоА-дегидрогеназа. Специ-
фический акцептор электронов – NAD+
Образовавшийся NADH передает восстано-
вительные
эквиваленты на NADH-дегидроге-
назу дыхательной цепи.
Ацетил-КоА-ацетилтрансфераза, тиолаза. В ито-
ге получаются:
1.
молекула ацетил-КоА;
2. молекула ацил-КоА, укороченная на 2 С-ато-
ма.
Двухуглеродные фрагменты последовательно
удаляются с карбоксильного конца
жирной кислоты.
Слайд 43Особенности β-окисления ЖК с нечетным числом С-атомов и ненасыщенных ЖК
1. ЖК с нечетным числом С-атомов :
На
последнем этапе окисления образуется 3-х углеродный остаток -пропионил-КоА.
Пропионил-КоА карбоксилируется до сукцинил-КоА, который поступает в ЦТК.
Слайд 44 2. Ненасыщенные ЖК (содержат
двойные связи):
Требует
участия дополнительных ферментов:
1. Если ЖК имеет 1 двойную связь –
олеиновая к-та (С18:1, цис-Δ9):
Δ3,4–цис–Δ2,3–транс-изомераза
Фермент переносит двойную связь и меняет её конфигурацию.
Слайд 45Из цис-Δ3-еноил-КоА получается
транс-Δ2-еноил-КоА, который яв-
ляется нормальным субстратом
для еноил-КоА-гидратазы.
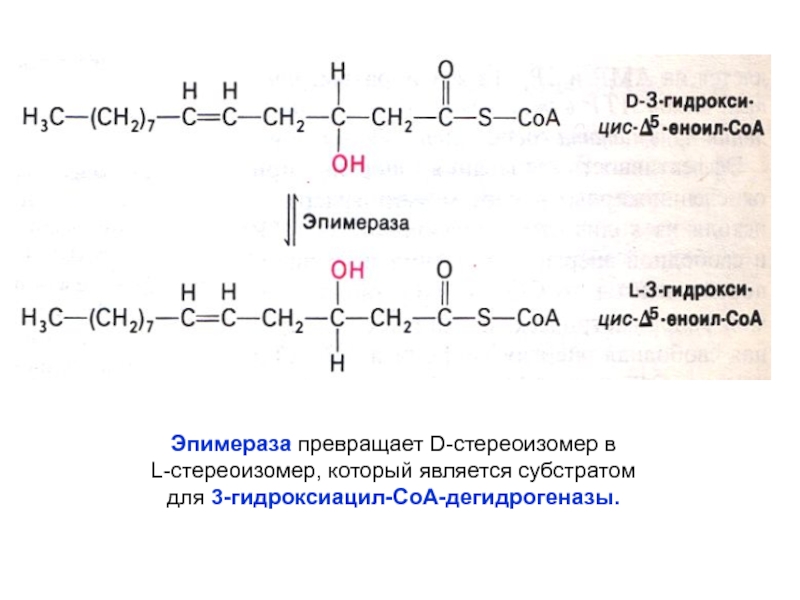
Слайд 46
Эпимераза превращает D-стереоизомер в
L-стереоизомер, который является субстратом для 3-гидроксиацил-СоА-дегидрогеназы.
Слайд 472. Если окисляется ЖК с двумя двойными
связями –
линолевая к-та (С18:2, цис-
Δ9,Δ12)
I фермент: Δ3,4–цис–Δ2,3–транс-изомераза
II фермент: эпимераза
(D-стереоизомер превра-
щает в L-стереоизомер).
Слайд 48Энергетика окисления жирных кислот
Каждый этап β –окисления сопровождается образованием ФАДН2
и НАДН (реокисление их в дыхательной цепи приводит к синтезу
2 и 3 АТФ).
Этапов β – окисления: (n/2)-1,где: n – число С- атомов в жирной кислоте.
Окисление ацетил-КоА в ЦТК в конечном итоге приводит с образованию 12 АТФ.
1 АТФ затрачивается на активацию жирной кислоты.
Слайд 49Ацетил-КоА, как продукт окисления ЖК, далее окисляется в ЦТК («Жиры
сгорают в пламени углеводов»).
В норме, оптимальность «переработки» ацетил-КоА в
ЦТК определяется доступно-стью оксалоацетата, необходимого для образования цитрата (чтобы цикл замкнулся). В норме интенсивность окисления глюкозы и жирных кислот четко сбалансированы.
Слайд 50Выход АТФ при β-окислении пальмитиновой кислоты
Каждый этап β–окисления сопровождается образованием
ФАДН2 и НАДН. Их реокисление в дыхательной цепи приводит к
синтезу 2 и 3 АТФ:
2 + 3 = 5АТФ.
Число этапов β–окисления: (n/2)-1,где: n – количество С-атомов в жирной кислоте:
7 х 5АТФ = 35 АТФ.
Окисление ацетил-КоА в ЦТК в конечном итоге приводит с образованию 12 АТФ: 8 х 12АТФ = 96АТФ
1 АТФ затрачивается на активацию жирной кислоты.
Т.о. окисление пальмитиновой кислоты имеет энергетический выход: 35 + 96 - 1 = 130 АТФ.
Слайд 51КЕТОГЕНЕЗ
Избыточное образование ацетил-КоА или снижение его утилизации в ЦТК (причины!)
приводит к активации кетогенеза в митохондриях гепатоцитов (печень пере-распределяет недоокисленные
продукты на энергетичес-кие нужды других органов.
Конденсация ацетильных фрагментов приводит к обра-зованию β−гидроксиметил-глутарил-КоА, а затем кетоновых тел: ацетона, гидроксибутирата и ацетоацетата.
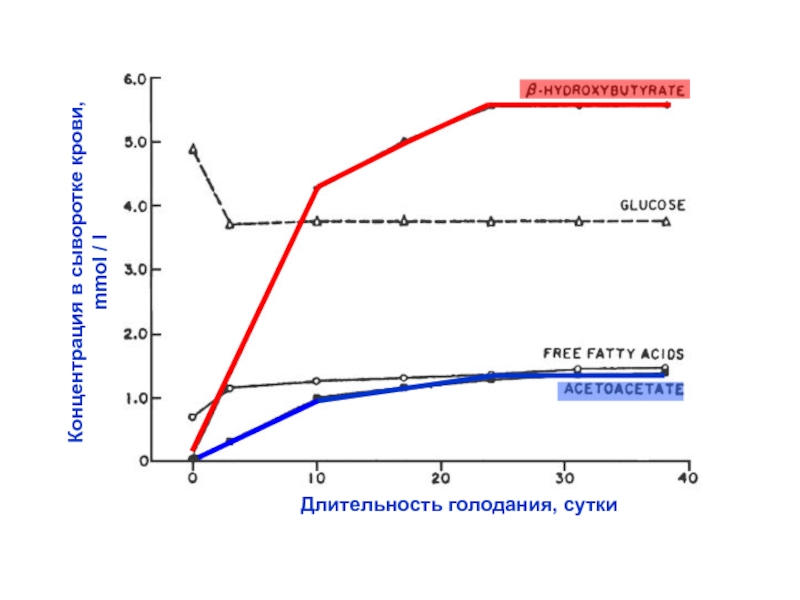
В норме концентрация кетоновых тел в крови низкая, при голодании и диабете она увеличивается до 100 раз. При дефиците глюкозы мозг активно потребляет кетоновые тела, как дополнительный источник энергии (до 75%). Почки, миокард, скелетные мышцы также используют их как источники энергии.
Слайд 52 При голодании и диабете (окисление ЖК усиливается, а
глюкозы – подавляется):
Ацетил-КоА образуется в избытке;
Концентрация оксалоацетата снижается, поскольку
он «уходит» в глюконеогенез;
В результате – избыточный поток ацетил-КоА
не может полностью расходоваться в реак-
ции конденсации с оксалоацетатом;
Избыток ацетил-КоА включается в кетогенез
с образованием кетоновых тел:
ацетоацетата, гидроксибутирата и ацетона.
Слайд 533-кетотиолаза
Гидроксиметил-
глутарил-КоА-
синтетаза
Гидроксиметил-
глутарил-КоА-
лиаза
D-3-гидрокси-
бутират-ДГ
Спонтанное
декарбокси-
лирование
(необратимо)
(«главное» КТ)
Покидает ор-
ганизм через
кожу, почки и
легкие
Слайд 54Длительность голодания, сутки
Концентрация в сыворотке крови, mmol / l
Слайд 55Ацетоацетат и гидроксибутират свободно диффундируют (по градиенту концентрации) из
гепатоцитов в
кровь и доставляются к перифе-
рическим (по отношению к печени) органам
для
окисления до СО2 и Н2О.
Кетоновые тела более эффективные источники энергии, чем пируват .
Кетоновые тела не оказывают разобщающего эффекта на митохондрии, что может быть при увеличении окисления жирных кислот.
Слайд 56Окисление кетоновых тел
Печень не способна утилизировать кетоновые тела.
В периферических
тканях гидроксибутират окисляется до ацетоацетата.
Далее ацетоацетат активируется КоА (с помощью
сукцинил-кетоацил- трансферазы).
Ацетоацетил-КоА тиолазой расщепляется до 2-х молекул ацетил-КоА и окончательно окисляется в ЦТК.
Токсичный ацетон удаляется с потом, мочой, выдыхаемым воздухом.
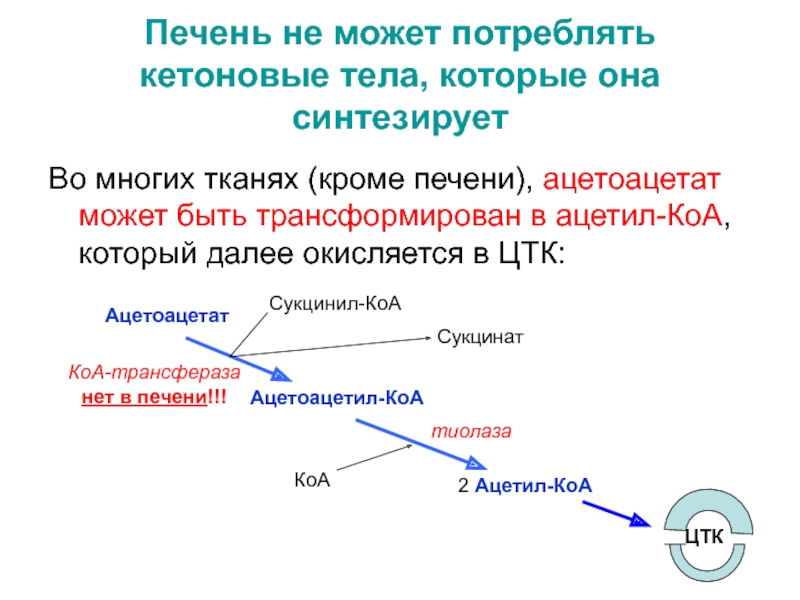
Слайд 57Печень не может потреблять кетоновые тела, которые она синтезирует
Во многих
тканях (кроме печени), ацетоацетат может быть трансформирован в ацетил-КоА, который
далее окисляется в ЦТК:
Ацетоацетат
Ацетоацетил-КоА
2 Ацетил-КоА
ЦТК
Сукцинил-КоА
Сукцинат
КоА
тиолаза
КоА-трансфераза
нет в печени!!!
Слайд 58Кетоацидоз
При длительном голодании и при диабете концентрация кетоновых тел в
крови может достигать чрезвычайно высоких значений. При этом ткани уже
не могут потребить все это количество кетоновых тел – формируется патологическое состояние - кетоз.
Слайд 59Липогенез
Абсорбтивный период. Инсулин.
Ресинтез собственных жиров на основе продуктов гидролиза экзогенного
жира в энтероцитах (этерификация 2- МАГ олеил-КоА).
Этерификация диоксиацетонфосфата активированными жирными
кислотами и восстановление с участием НАДФН в печени.
Слайд 60ЛИПОГЕНЕЗ
Субстраты:
глицерол-3-фосфат (образуется глицеролкиназой в энтероцитах и нефроцитах; диоксиацетонфосфат ДГ (фосфоглицерол
ДГ) в миоцитах и адипоцитах; В печени активны оба фермента.
активные формы жирных кислот (ацилКоА).
Слайд 61Липогенез
Избыток глюкозы обеспечивает:
1. запас гликогена (ограничен)
2. ДАФ ?глицерол-3-фосфат
3. ПВК ?
ацетил-КоА ? жирные кислоты
4. окисление глюкозы в ПФП обеспечивает биосинтез
липидов восстановленным эквивалентом НАДФН и энергией АТФ.
Слайд 62Биосинтез жирных кислот
Цитозоль. Ацилсинтетаза (пальмитоил-синтетаза). Не обращение β – окисления!
Другая ферментативная система и локализация процесса.
ацетил – КоА
АТФ, НАДФН
СО2, витамин
Н
цитрат
3 этапа:
перенос ацетил-КоА из МХ в цитоплазму;
образование основного субстрата – малонил-КоА;
наращивание жирнокислотной цепи.
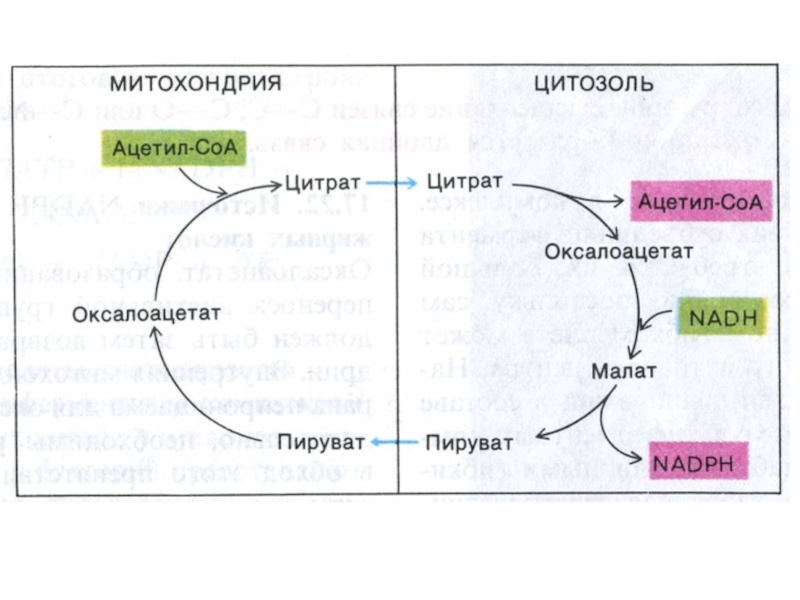
Слайд 64Транспорт ацетил-КоА в цитоплазму
В ситуации накопления АТФ и НАДН ингибируется
изоцитрат ДГ и накапливающийся цитрат выходит из МХ в цитозоль.
цитрат + НS-КоА ? Ацетил-КоА + ОА.
второй путь (неосновной) передачи ацетильных фрагментов – с участием карнитина.
Слайд 65Транспорт ацетил-КоА в цитоплазму
Возвращение ОА в МХ:
1.ОА –> малат
(НАД зависимая цитоплазматическая МДГ); Малат –транслоказа переносит малат в МХ,
где он окисляется МХ МДГ до ОА.
2. «Яблочный» фермент (МДГ декарбоксилирующая, НАДФ-зависимая):
малат? ПВК (образование НАДФН, необходимого для биосинтеза липидов).
ПВК переносится транслоказой в МХ.
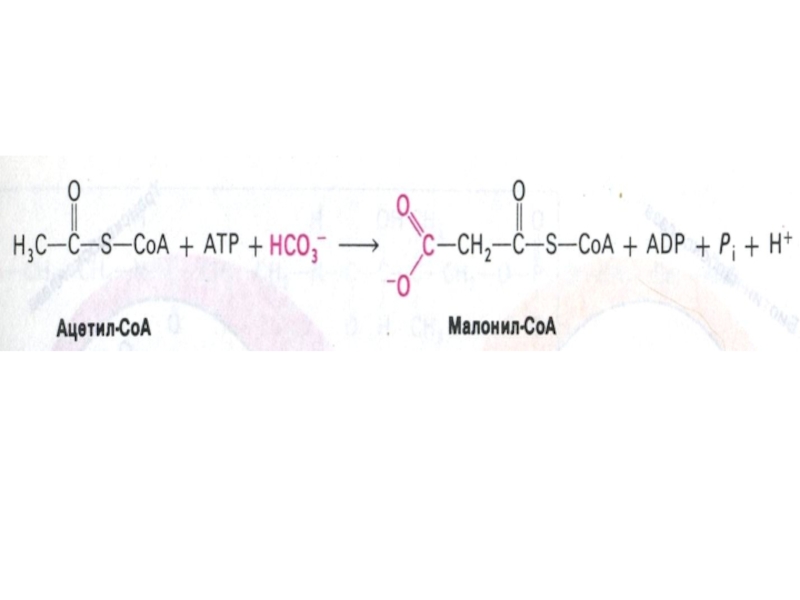
Слайд 67Образование малонил-КоА
ацетил-КоА- карбоксилаза (биотин-зависимая) – регуляторный фермент синтеза жирных кислот,
не входит в состав мультиферментного комплекса синтазы жирных кислот.
активная
форма –нефосфорилирована (в присутствии инсулина, цитрата);
неактивная форма – фосфорилирована (в присутствии глюкагона, адреналина, малонил - КоА, пальмитоил - КоА)
Слайд 68Синтетаза жирных кислот
мультиферментный комплекс (гомодимер, поэтому синтезируется две цепи одновременно).
6
ферментов и АПБ (2 SH- группы).
Ацетил-КоА – SАПБ –трансфераза
малонил-КоА
– SАПБ – трансфераза
кето-ацил-АПБ-синтетаза
кето-ацил-АПБ-редуктаза (НАДФН)
гидроксиацил-АПБ-дегидратаза
эноил-АПБ-редуктаза (НАДФН)
Тиоэстераза гидролитически отщепляет готовый продукт от синтетазного комплекса (в основном – пальмитат, в молочной железе – и короткие жирные кислоты)
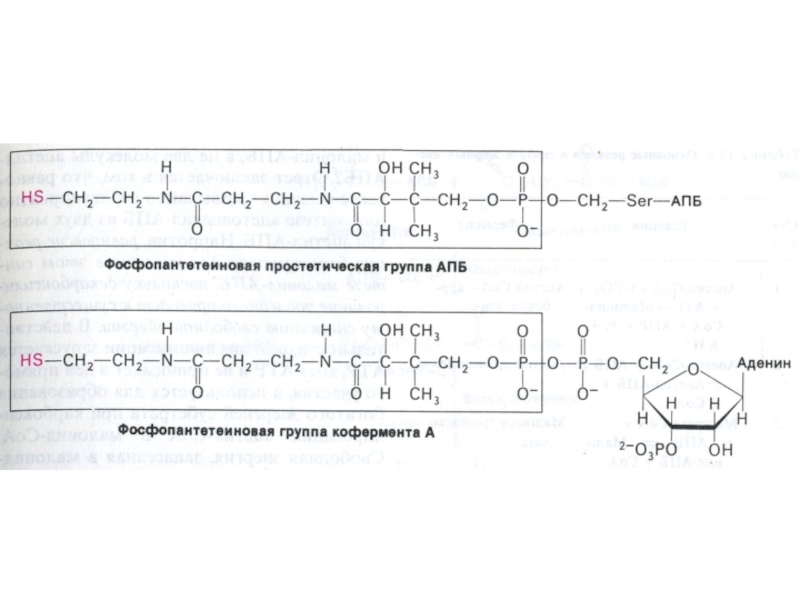
Слайд 70АПБ – структура и функция
Активный центр этого белка – фосфопантотеновая
кислота и тиоэтиламин (аналогичные структуре HS – КоА), ковалентно связанные
с апочастью.
Функция АПБ – ковалентно связывать и передавать от одного фермента к другому ацильные фрагменты.
Связь ацильных остатков с АПБ – тиоэфирная, с SH группой цистеина АПБ или SH - тиоэтиламина.
Слайд 73Пальмитоил- синтетаза
Ацетил-КоА + 7 малонил-КоА + 14 НАДФН ?C16:0 +
7 СО2 +SH-АПБ + 14 НАДФ+ + 6Н2О.
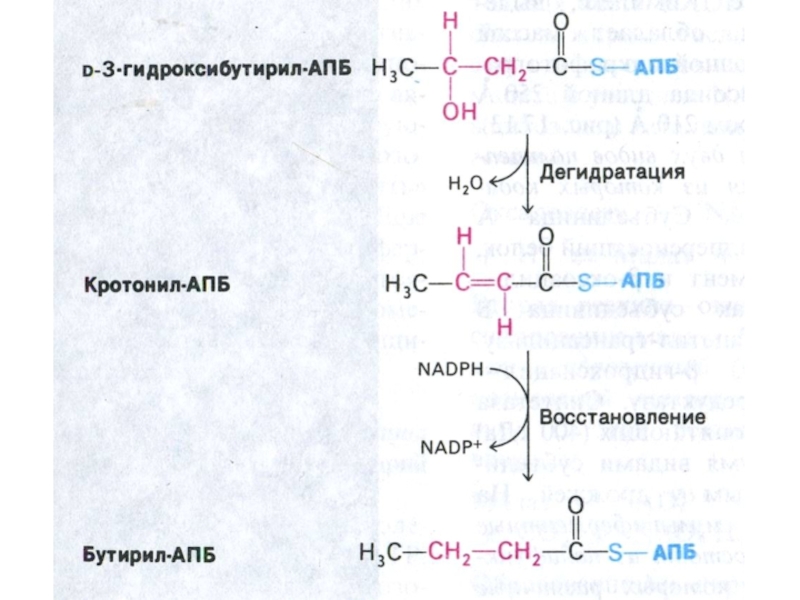
Удлинение ацильной цепи
м.б. в ЭПС (с участием малонил-КоА и НАДФН) или в МХ (как обращение β –окисления).
Синтез ацильных цепей с нечетным числом атомов начинается с пропионил-КоА (вместо ацетил-КоА).
Реакция десатурации (оксигеназа микросом) приводит к образованию мононенасыщенных пальмитоолеиновой и олеиновой кислот.
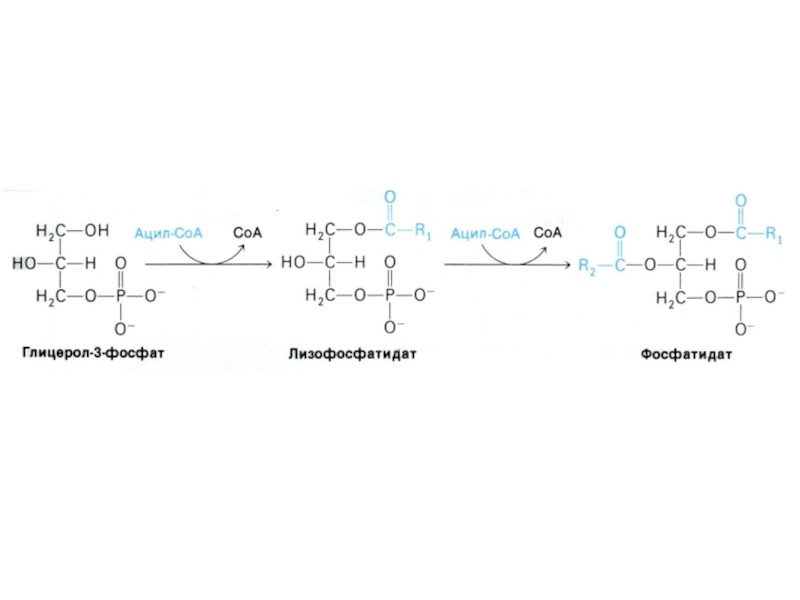
Слайд 74Синтез триацилглицеролов
Ацил-КоА- синтетаза активирует жирные кислоты с затратой АТФ через
стадию образования ациладенилатов.
Перенос ацилтрансферазой активированных жирных остатков на глицерол-3 фосфат.
1,2-
диацилглицерол-3 – фосфат (фосфатидная кислота) – общий предшественник для биосинтеза нейтральных жиров и фосфолипидов.
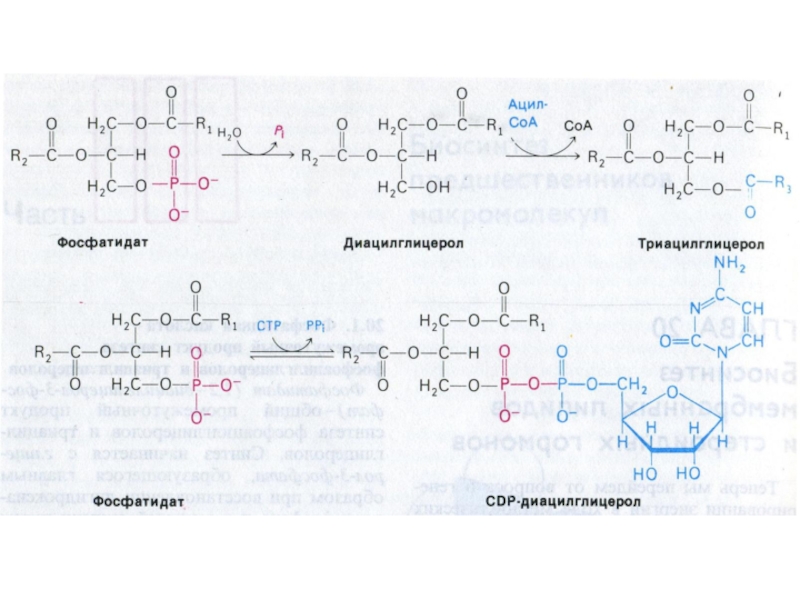
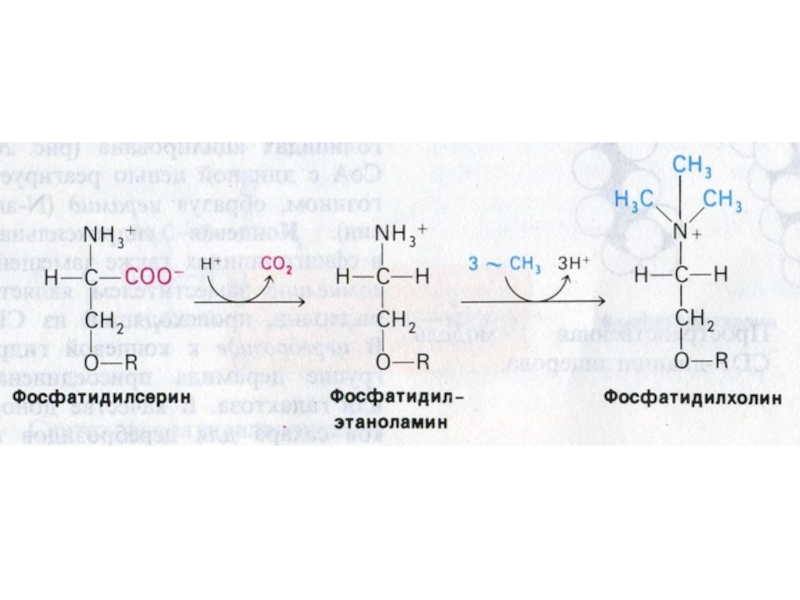
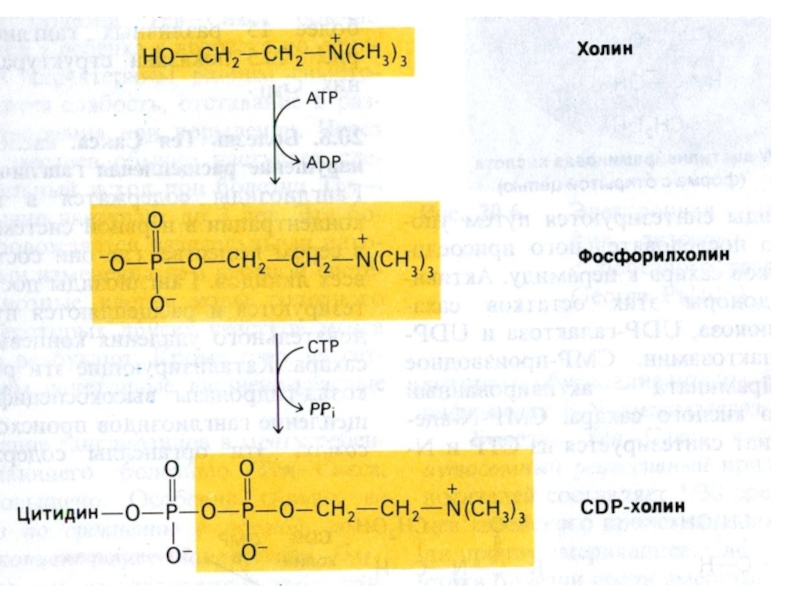
Слайд 77Синтез фосфолипидов
Синтез ТАГ и ФЛ конкурируют за общие субстраты для
собственного синтеза (фосфатидная кислота).
Синтез ФЛ требует участия ЦТФ, а также
серина, метионина (SАМ), холина.
2 пути синтеза ФЛ: активация 1,2 – диацилглицерола с участием ЦТФ или активация этаноламина, холина.
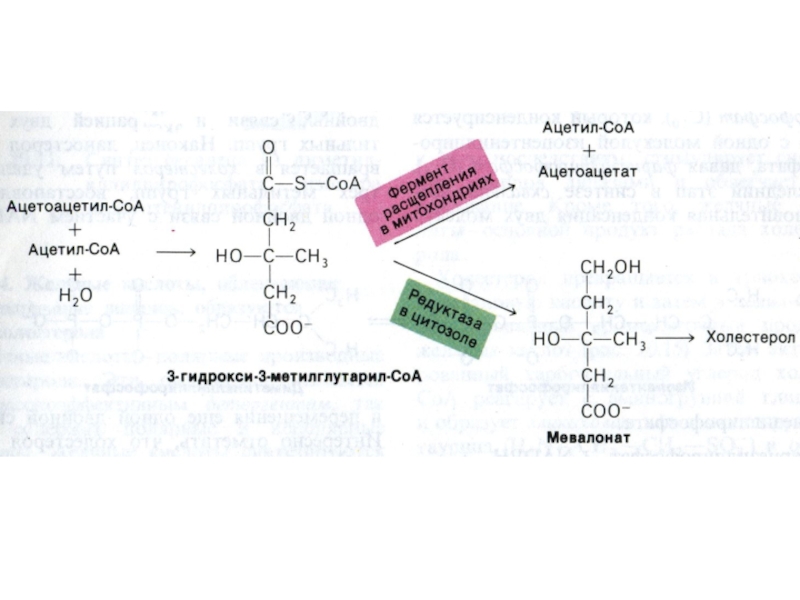
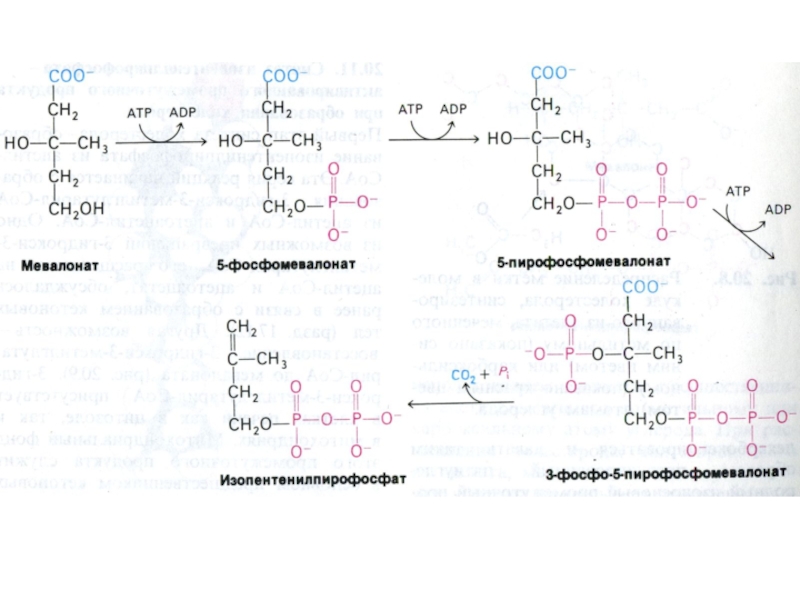
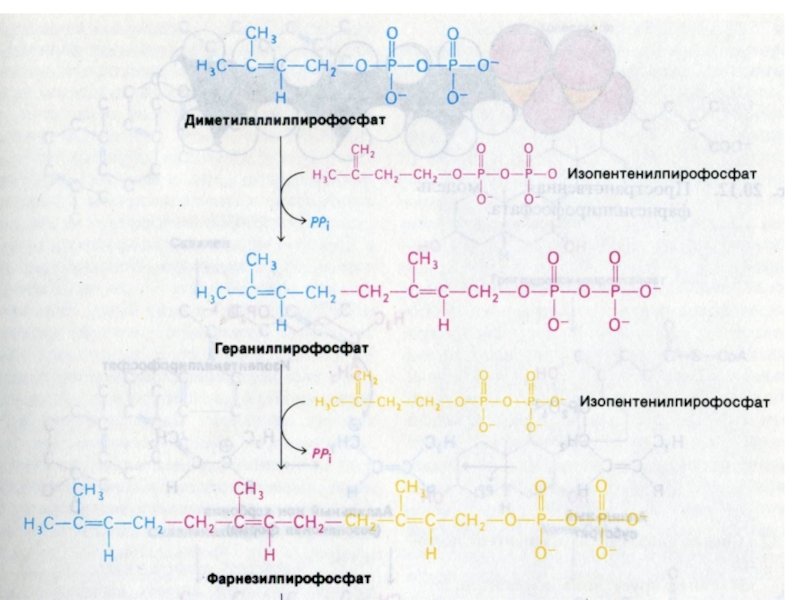
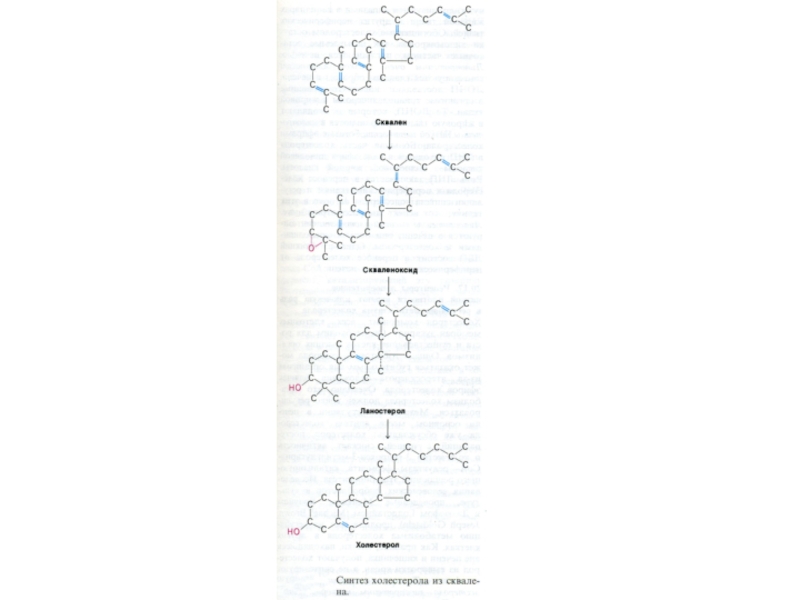
Слайд 84Синтез холестерола
1.Конденсация 3-х ацетил-КоА ?гидроксиметилглутарил –КоА
2. восстановление НАДФН-редуктазой? мевалоновая
кислота
3. фосфорилирование и декарбоксилирование? образование С5- активных изопренов
4. конденсация С5
- углеродных звеньев ? сквален (30 С линейный продукт)
5. микросомальная эпоксидация? образование циклопентанпергидрофенантрена - ланостерола (С 30)
6. Удаление 3 СН3 и восстановление двойных связей ? холестерол
Слайд 85Метаболизм холестерола
0,5 г эндогенного и 0,5 г экзогенного ХЛ
10% ХЛ
находится в виде эфиров с жирными кислотами (форма депонирования и
транспорта); в мембранах клеток – свободный ХЛ.
Этерификация происходит в гепатоцитах (АХАТ) и ЛПВП (ЛХАТ).
Экзогенный ХЛ не подвергается изменению в кишечнике, всасывается в составе мицелл.
Выводится ХЛ из организма в составе желчи (желчные кислоты и свободный ХЛ).
Слайд 91Транспортные формы ХЛ
Экзогенный ХЛ транспортируется в составе хиломикронов, ремнантные формы
которых поглощаются печенью.
Эндогенный ХЛ, образующийся в печени после этерификации,
уходит в кровь в составе ЛПОНП.
Отдавая жирные кислоты клеткам, ЛПОНП?ЛППП?ЛПНП (атерогенные формы ЛП).
Обратный транспорт ХЛ в печень осуществляют антиатерогенные ЛПВП.
Слайд 92Кругооборот эндогенных липидов
Липиды, синтезирующиеся в печени (эндогенные) транспортируются в
крови в составе ЛПОНП (Апо В-100).
ЛПОНП под действием ЛП-липазы отдают
жирные кислоты ТАГ в клетки разных органов, становясь атерогенными ЛППП и ЛПНП (обогащены ХЛ и ЭХЛ).
В печени образуются незрелые ЛПВП (Апо А – активатор ЛХАТ). Проходя через сосудистые стенки, захватывают в тканях ХЛ и транспортируют его в печень (антиатерогенное действие – дренажная система ХЛ).
Имея в своем составе фермент ЛХАТ, ЛПВП способны нагружаться большим количеством ХЛ.



























![Липиды и обмен липидов Окисление жирных кислотПуть окисления СЖК, сопряженный с синте-зом АТФ, протекает в Окисление жирных кислотПуть окисления СЖК, сопряженный с синте-зом АТФ, протекает в митохондриях [Ю.Кеннеди и А.Ленинджер, 1949] и](/img/thumbs/587814259650dafcf0eb4ac092c0a8fd-800x.jpg)