Слайд 3Теория химической связи занимает важнейшее место в современной химии.
Она
объясняет, почему атомы объединяются в химические частицы.
Позволяет сравнивать устойчивость этих
частиц.
Можно предсказать состав и строение различных соединений.
Понятие о разрыве одних химических связей и образовании других лежит в основе современных представлений о превращениях веществ в ходе химических реакций.
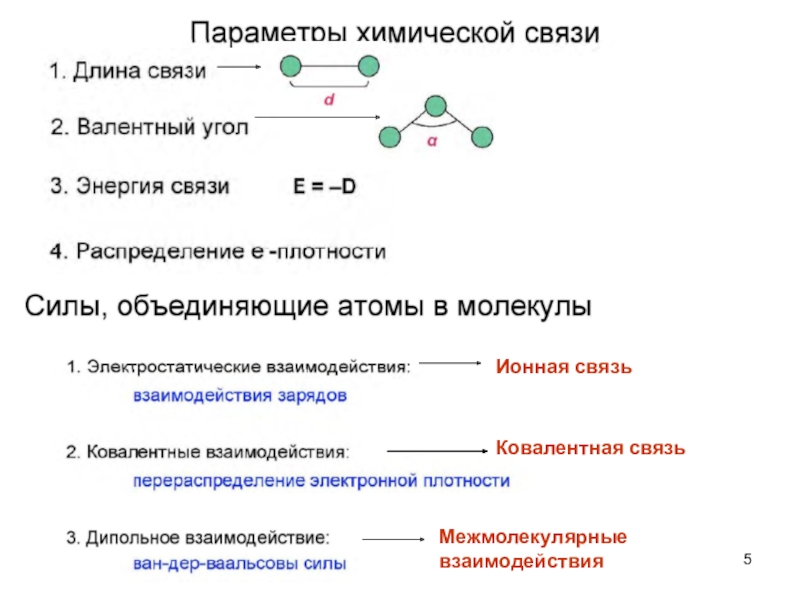
Слайд 5Ионная связь
Ковалентная связь
Межмолекулярные взаимодействия
Слайд 6Наиболее точная и детальная информация о взаимодействии атомов получена методами
квантовой механики на основе решения уравнения Шредингера (возможно только для
некоторых простейших систем - Н2 , для сложных систем необходимо вводить упрощения)
Первое решение было получено для молекулы Н2 (1927 г. немецкие физики В. Гейтлер и Ф. Лондон): оценили зависимость потенциальной энергии системы Е из двух атомов водорода от межъядерного расстояния r
Характер изменения E определяется взаимной ориентацией электронных спинов атомов.
Сближение атомов приводит к возрастанию E – отталкивание, химическая связь не образуется
Сближение атомов приводит к убыванию E до минимального значения Eсв при расстоянии r0 – образование химической связи
Дальнейшее сближение –электростатическое отталкивание одноименно заряженных ядер
r,нм
0,074
Fпр.= Fотт.
Fпр. >Fотт.
Fпр.< Fотт.
Слайд 7РЕЗУЛЬТАТЫ:
Расчетные значения энергии и длины связи оказались близки к экспериментально
определенным энергии и межъядерному расстоянию
Результаты приближенного решения уравнения Шредингенра
могут быть использованы для изучения строения молекул и определения их энергетических параметров
Расчеты показали, что перекрывание( взаимодействие) электронных облаков с антипараллельными спинами приводит к возрастанию электронной плотности в межатомном пространстве.
Силы кулоновского притяжения положительно заряженных атомных ядер в области перекрывания электронных облаков преобладают над силами межъядерного отталкивания В результате происходит сближение атомов и образование устойчивой молекулы
Слайд 8КОВАЛЕНТНАЯ СВЯЗЬ
-химическая связь, за счет образования общих электронных пар.
осуществляется валентными
электронами ( не всеми)
ВАЛЕНТНОСТЬ
-число связей, которые данный атом может образовывать
с другими атомами ( А.М. Бутлеров, 1861г.)
КОВАЛЕНТНОСТЬ ( ВАЛЕНТНОЕ ЧИСЛО) – число химических связей, образуемых атомом в конкретной молекуле, ионе или другой частице.
Определяется:
Количеством неспаренных электронов на валентном уровне
Количеством неподеленных электронных пар на валентном уровне
Количеством вакантных орбиталей на валентном уровне
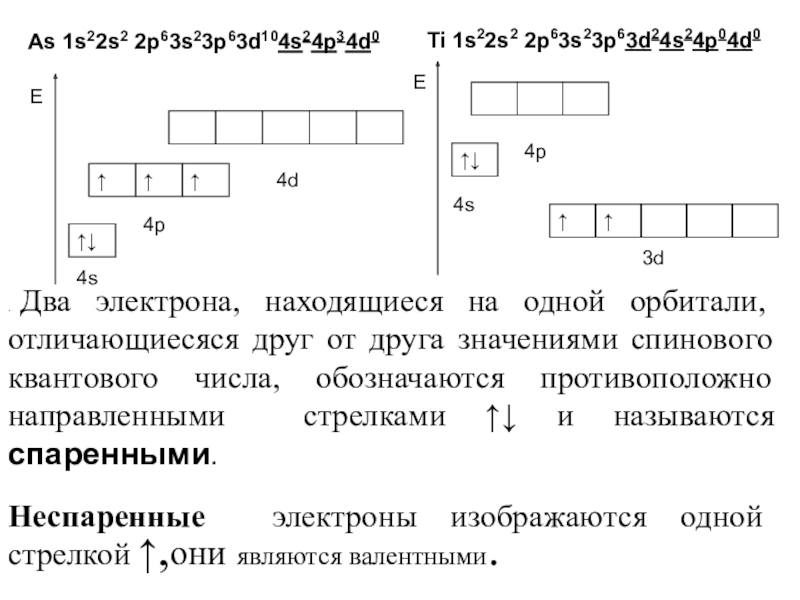
Слайд 9. Два электрона, находящиеся на одной орбитали, отличающиесяся друг от
друга значениями спинового квантового числа, обозначаются противоположно направленными стрелками ↑↓
и называются спаренными.
Неспаренные электроны изображаются одной стрелкой ↑,они являются валентными.
As 1s22s2 2p63s23p63d104s24p34d0
Ti 1s22s2 2p63s23p63d24s24p04d0
Слайд 10ОСНОВНОЕ И ВОЗБУЖДЕННОЕ СОСТОЯНИЯ АТОМА
Для атома углерода электроны разместятся по
уровням и подуровням следующим образом, что соответствуют нормальному состоянию атома,
т.е. минимальному значению энергии.
Однако при затрате сравнительно незначительной энергии возможен перевод электронов в пределах одного и того же уровня, с одного подуровня на другой, энергетически более высокий. Такое состояние атома называется возбуждённым.
В нормальном состоянии углерод двухвалентен,
в возбуждённом − четырёхвалентен.
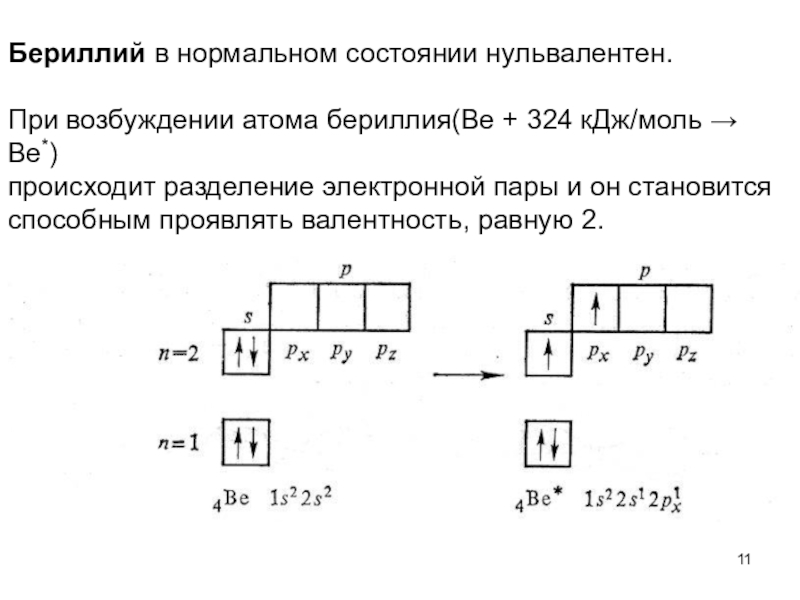
Слайд 11Бериллий в нормальном состоянии нульвалентен.
При возбуждении атома бериллия(Ве +
324 кДж/моль → Ве*)
происходит разделение электронной пары и он
становится способным проявлять валентность, равную 2.
Слайд 13ПОДХОДЫ К ОПИСАНИЮ ХИМИЧЕСКОЙ СВЯЗИ В МОЛЕКУЛАХ
( с позиций квантово-механической
теории)
Метод валентных связей (МВС) – теория локализованных электронных пар (Л.
Поллинг, Д. Слэйтер)
Ковалентную химическую связь между двумя атомами образуют два электрона с антипараллельными спинами, одновременно принадлежащие обоим атомам.
Ковалентная связь тем прочнее, чем больше степень перекрывания электронных орбиталей взаимодействующих атомов.
Пространственное расположение химической связи соответствует направлению, в котором достигается наибольшее перекрывание валентных орбиталей.
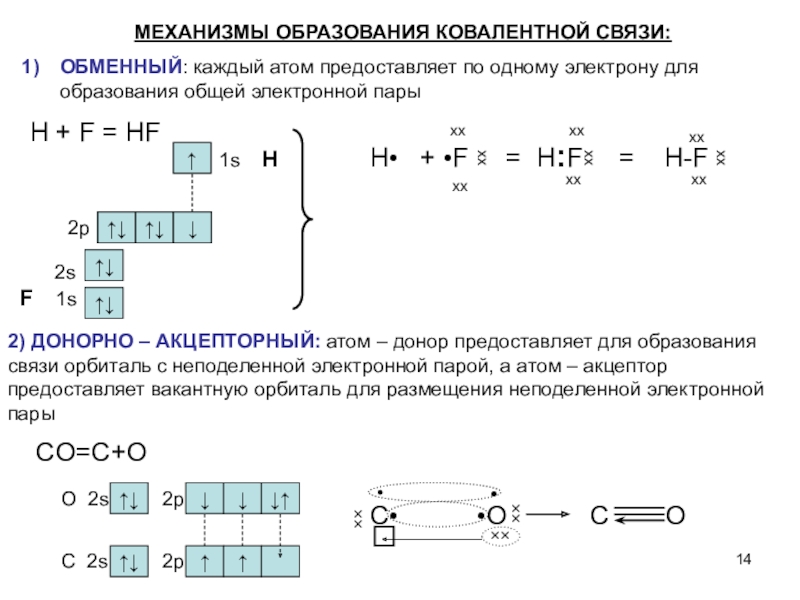
Слайд 142) ДОНОРНО – АКЦЕПТОРНЫЙ: атом – донор предоставляет для образования
связи орбиталь с неподеленной электронной парой, а атом – акцептор
предоставляет вакантную орбиталь для размещения неподеленной электронной пары
F 1s
2s
2p
1s H
CO=C+O
Слайд 16 Способы перекрывания электронных облаков
В зависимости от симметрии электронных
облаков, участвующих в перекрывании, общее электронное облако будет иметь различную
симметрию. Эта симметрия определяет три вида хим. связи:
σ-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов (s, px,, dx2-y2).
Максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов.
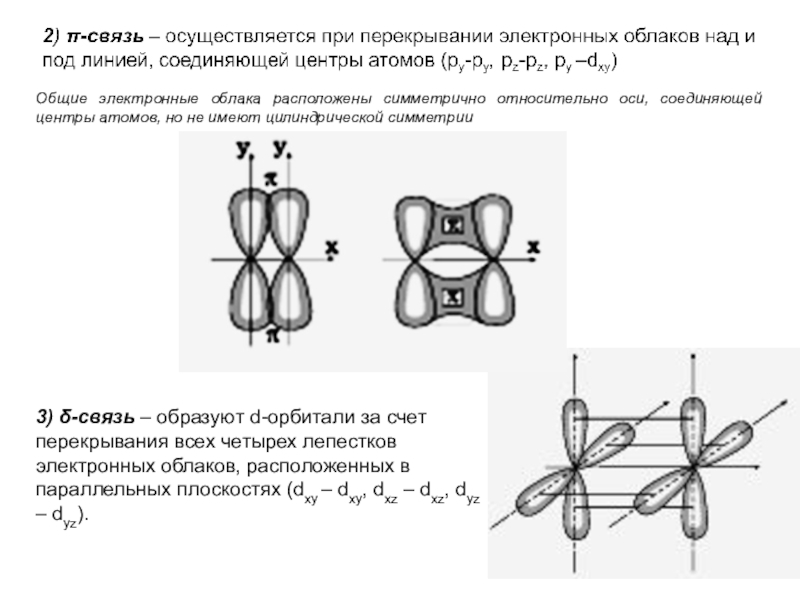
Слайд 173) δ-связь – образуют d-орбитали за счет перекрывания всех четырех
лепестков электронных облаков, расположенных в параллельных плоскостях (dxy – dxy,
dxz – dxz, dyz – dyz).
Общие электронные облака расположены симметрично относительно оси, соединяющей центры атомов, но не имеют цилиндрической симметрии
Слайд 18Задача:
Методом ВС опишите химическую связь в молекуле ВеО.
Укажите
тип химической связи и определите ее кратность
Слайд 19НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛ
Участие в образовании химической связи
атомов в возбужденном состоянии
Валентные электроны находятся на орбиталях различной симметрии
и энергии
? Почему длина связи (или энергия связи) в молекуле имеют одно определенное значение, а не набор значений.
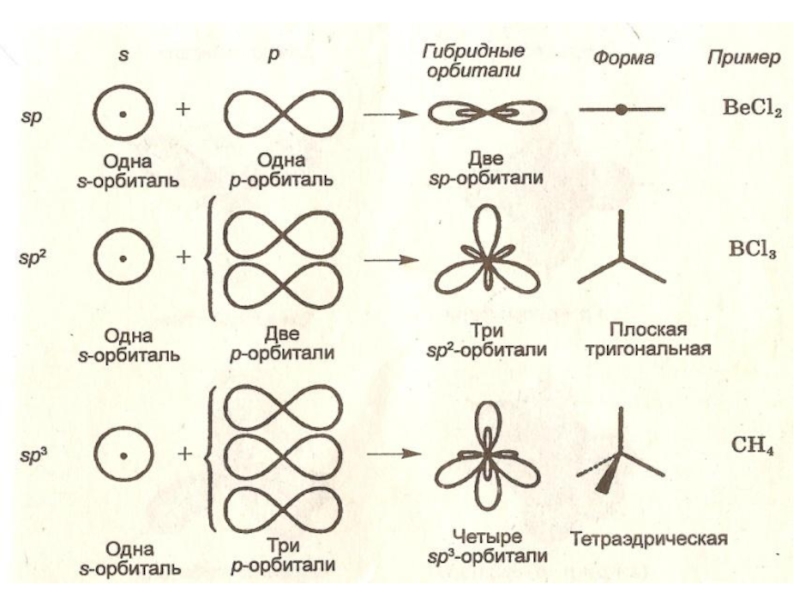
МОДЕЛЬ: ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Выравнивание пространственных конфигураций и энергий атомных орбиталей различных типов при ковалентном связывании
Результат: образование гибридных равноценных орбиталей, взаимодействие которых приводит к образованию более прочных ковалентных связей и повышению устойчивости молекул
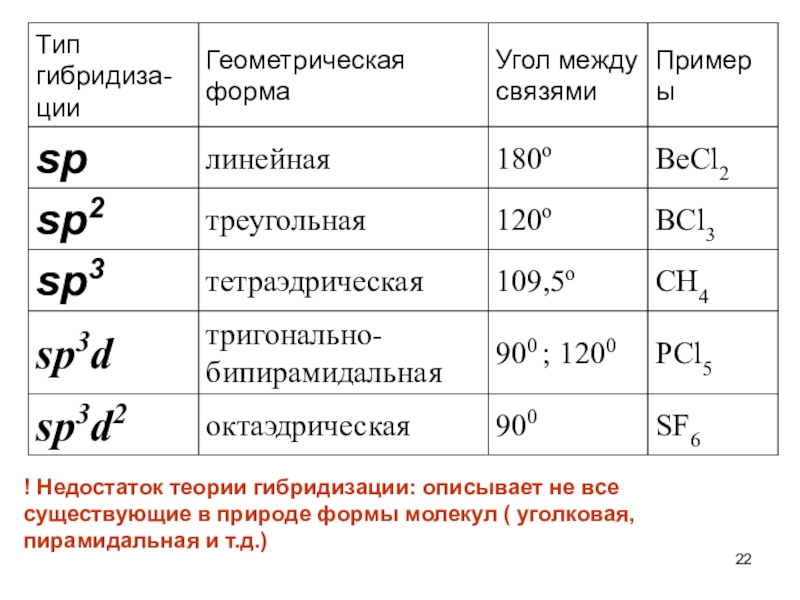
Слайд 20При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ
ОРБИТАЛЕЙ.
Слайд 22! Недостаток теории гибридизации: описывает не все существующие в природе
формы молекул ( уголковая, пирамидальная и т.д.)
Слайд 23Задача:
Методом ВС опишите химическую связь в молекуле PCl5.
Какова
гибридизация орбиталей атома фосфора и форма этой молекулы?
Слайд 243s
3p
3d
3) Тип гибридизации атома P
P* 3s13p33d1
s +
p + p + p + d = sp3d
– тип гибридизации
Форма молекулы: тригональная бипирамида
Слайд 25 связано с ↑ числа несвязывающих гибр. орбиталей
тетраэдрическая
пирамидальная
угловая
СН4
NН3
Н2O
ВЛИЯНИЕ НЕПОДЕЛЕННОЙ ПАРЫ
ЭЛЕКТРОНОВ
Слайд 281. Энергия связи
2. Длина связи
3. Кратность связи
4. Насыщаемость
5. Направленность
6. Полярность
7.
Поляризуемость
СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
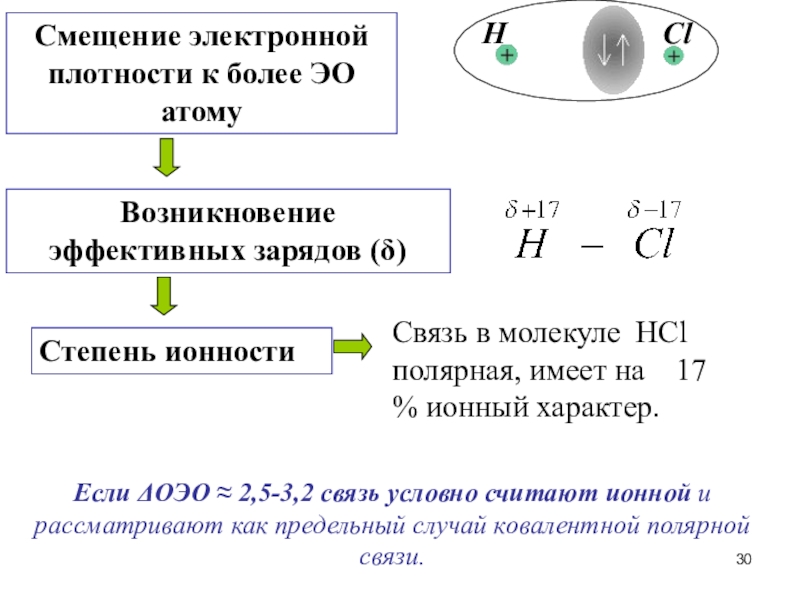
Слайд 29Чем ОЭО, тем полярность химической связи
Полярность ковалентной связи
–
определяется разностью относительных электроотрицательностей элементов
Слайд 31Дипольный момент связи ()
l - Длина связи
q- Эффективный заряд
Векторная величина
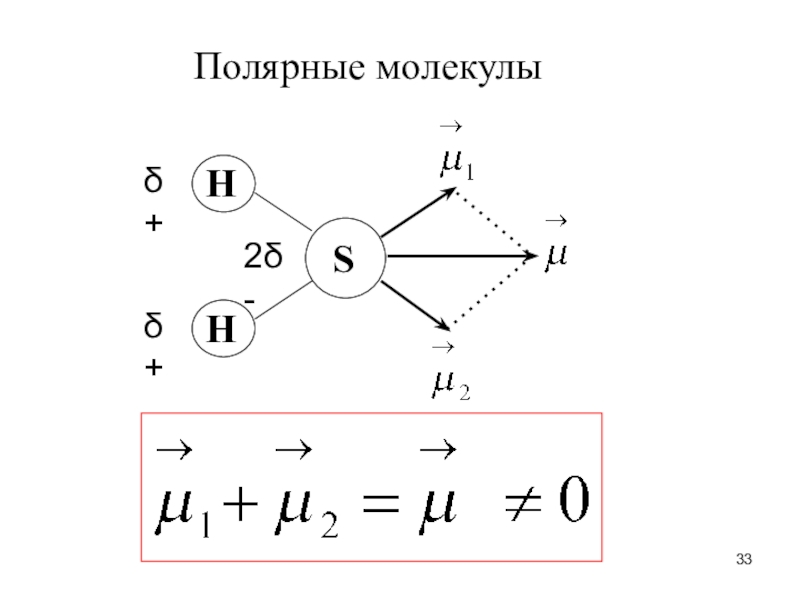
Слайд 32Неполярные молекулы
Молекула неполярна, если суммарный всех связей = 0.
Слайд 35Дипольный момент молекулы зависит:
от полярности связей;
от геометрии молекулы;
от наличия неподелённых пар электронов.
Слайд 37т.е. степень ионности равна 83%.
Полного перетягивания связующих пар электронов
от более электроположительного к более электроотрицательному атому и образования 100
% -ной ионной связи практически не наблюдается.
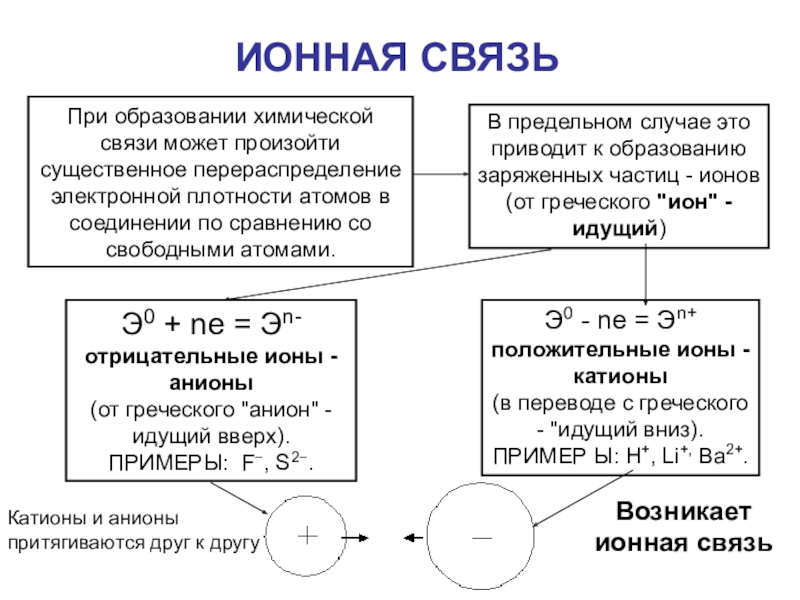
Слайд 38ИОННАЯ СВЯЗЬ
При образовании химической связи может произойти существенное перераспределение электронной
плотности атомов в соединении по сравнению со свободными атомами.
В
предельном случае это приводит к образованию заряженных частиц - ионов (от греческого "ион" - идущий)
Э0 + nе = Эn- отрицательные ионы - анионы
(от греческого "анион" - идущий вверх).
ПРИМЕРЫ: F−, S2−.
Э0 - nе = Эn+
положительные ионы - катионы
(в переводе с греческого - "идущий вниз).
ПРИМЕР Ы: Н+, Li+, Ва2+.
Возникает
ионная связь
Катионы и анионы притягиваются друг к другу
Слайд 39Для возникновения ионной связи необходимо, чтобы сумма значений энергии ионизации Ei (для
образования катиона) и сродства к электрону Ae (для образования аниона) должна быть
энергетически выгодной.
Это указывает на участие в образовании ионной связи
в качестве КАТИОНОВ
атомов активных металлов (элементы IA- и IIA-групп, некоторые элементы IIIA-группы и некоторые переходные элементы)
в качестве АНИОНОВ
атомов активных неметаллов (галогены, халькогены, азот)
+
Слайд 40Энергия ионной связи
Энергия связи для ионного соединения - это энергия,
которая выделяется при его образовании из бесконечно удаленных друг от
друга газообразных противоионов.
При возникновении ионной связи между двумя свободными ионами энергия их притяжения определяется законом Кулона:
E(прит.) = q+ ×q− / (4πr ε),
где q+ и q− - заряды взаимодействующих ионов,
r - расстояние между ними,
ε - диэлектрическая проницаемость среды.
Так как один из зарядов отрицателен, то значение энергии также будет отрицательным.
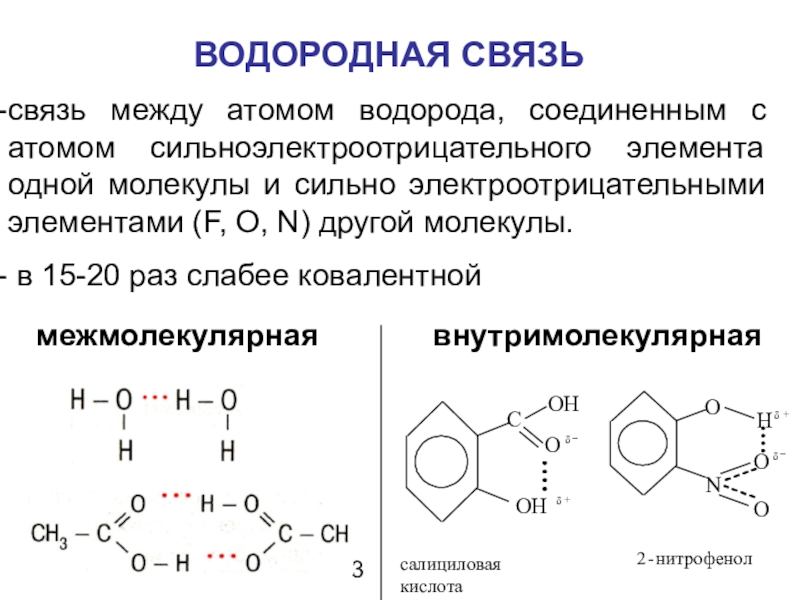
Слайд 41ВОДОРОДНАЯ СВЯЗЬ
связь между атомом водорода, соединенным с атомом сильноэлектроотрицательного элемента
одной молекулы и сильно электроотрицательными элементами (F, O, N) другой
молекулы.
в 15-20 раз слабее ковалентной
межмолекулярная
внутримолекулярная
салициловая кислота
Слайд 42Механизм образования Н-связи:
- Электростатическое взаимодействие (диполь-дипольное)
-Донорно-акцепторное взаимодействие:
-направленность
-насыщаемость
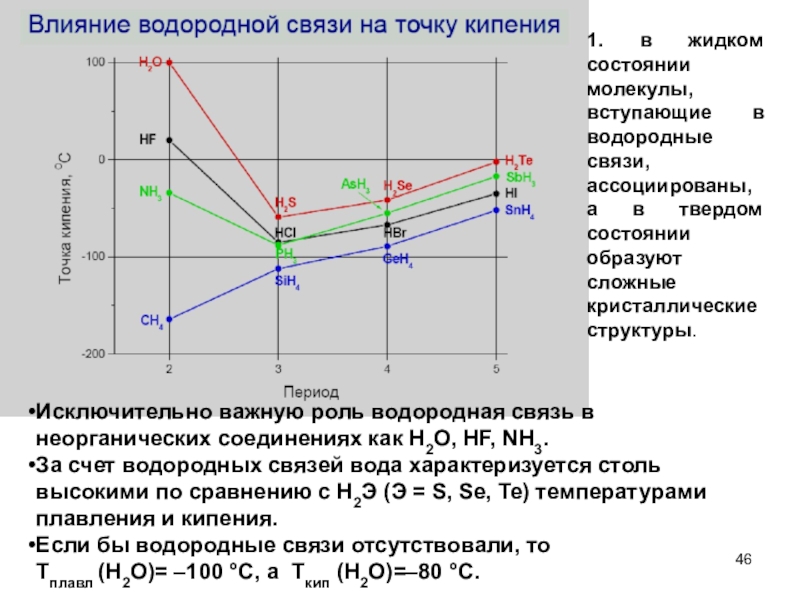
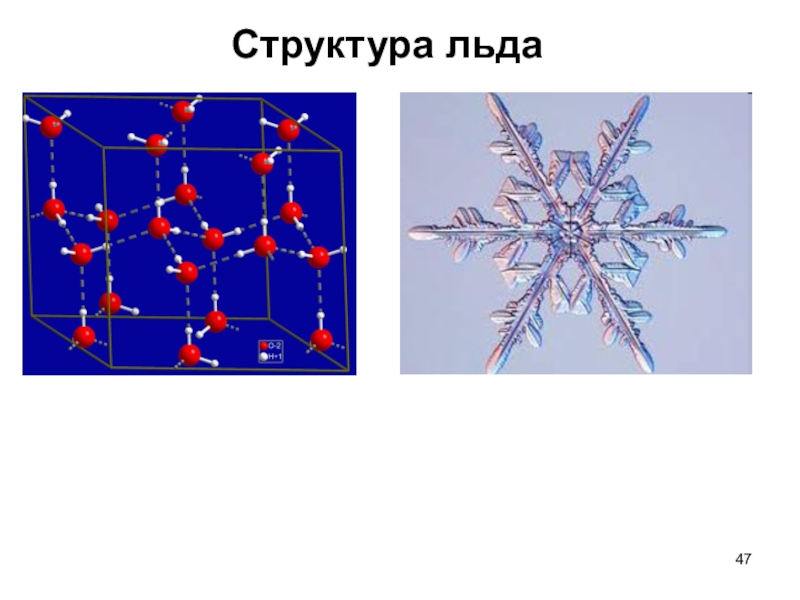
Слайд 461. в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы,
а в твердом состоянии образуют сложные кристаллические структуры.
Исключительно важную роль
водородная связь в неорганических соединениях как H2O, HF, NH3.
За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения.
Если бы водородные связи отсутствовали, то Тплавл (H2O)= –100 °С, а Ткип (H2O)=–80 °С.
Слайд 48В 1873 г. голландский ученый Я.Д. Ван-дер-Ваальс предположил, что существуют
силы, обусловливающие притяжение между молекулами. Эти силы позднее получили название
Ван-дер-ваальсовых сил. Они включают в себя три составляющие:
1) диполь-дипольное
2) индукционное
3) дисперсионное взаимодействия.
МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ
При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя
Диполь-дипольное взаимодействие (ориентационное)
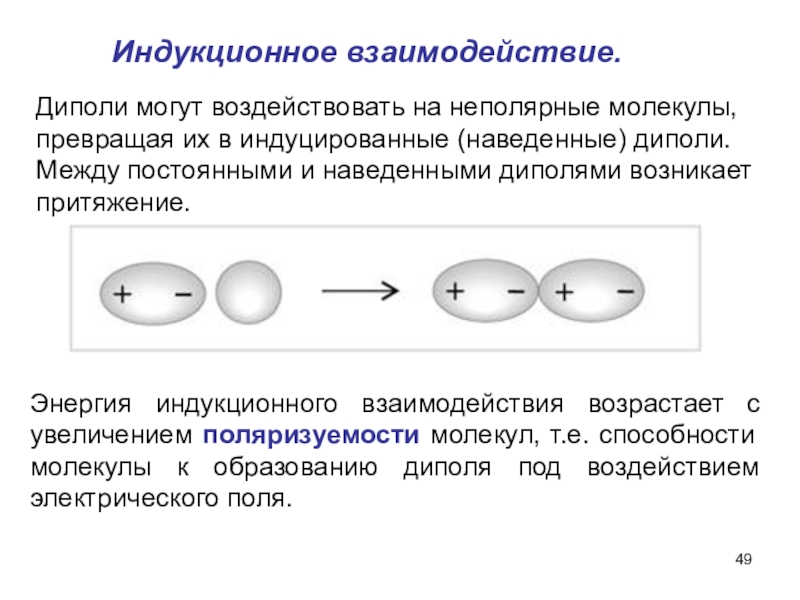
Слайд 49Индукционное взаимодействие.
Диполи могут воздействовать на неполярные молекулы, превращая их в
индуцированные (наведенные) диполи. Между постоянными и наведенными диполями возникает притяжение.
Энергия индукционного взаимодействия возрастает с увеличением поляризуемости молекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля.
Слайд 50В любой молекуле возникают флуктуации электрической плотности, в результате чего
появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи
у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно.
Дисперсионное притяжение
В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц.
Для неполярных молекул дисперсное взаимодействие является единственной составляющей ван-дер-ваальсовых сил
Межмолекулярное взаимодействие имеет электростатическую природу.
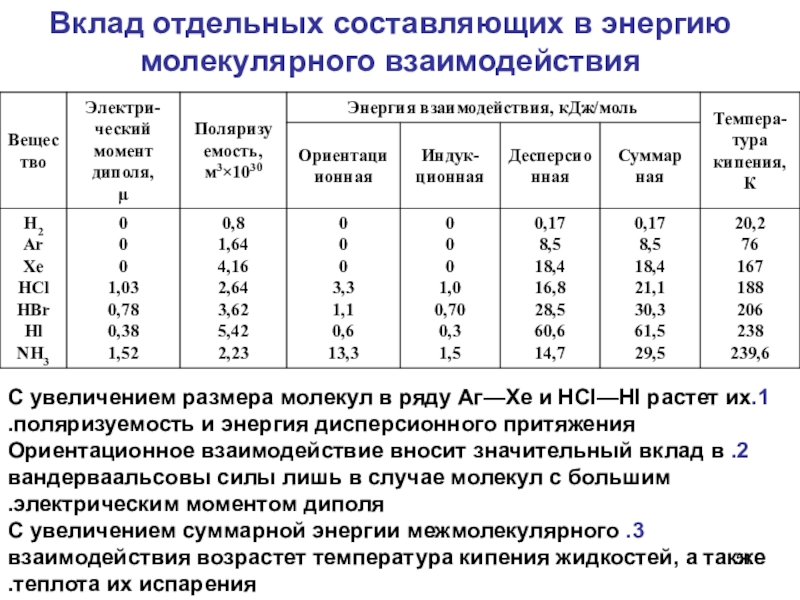
Слайд 51Вклад отдельных составляющих в энергию молекулярного взаимодействия
1.С увеличением размера
молекул в ряду Аг—Хе и НСl—HI растет их поляризуемость и
энергия дисперсионного притяжения.
2. Ориентационное взаимодействие вносит значительный вклад в вандерваальсовы силы лишь в случае молекул с большим электрическим моментом диполя.
3. С увеличением суммарной энергии межмолекулярного взаимодействия возрастет температура кипения жидкостей, а также теплота их испарения.
Слайд 52Группа ученых «Гекко»
возглавляют физиолог К.Отан из колледжа Льюиса и
Кларка в г. Портленд (США) и физик Р.Фул из знаменитого Калтеха
в г. Беркли (США).
Когда геккон взбегает вверх по стенке, он может удержаться даже на одной прилипшей к поверхности лапке. Однако при этом незаметно, чтобы геккон прилагал какие-то усилия, чтобы оторвать приклеившуюся ногу, когда собирается сделать следующий шаг. В чем тут причина?
Силы Ван-дер-ваальса и «хитрый» геккон
Физикам пришлось изрядно поломать голову над способом его передвижения по стенам и потолку. Одно время думали, что весь секрет в уникальных присосках, которыми снабжены лапы. Потом уповали на клей, которым они якобы смазаны.
Слайд 53Ученые внимательно изучили лапки геккона под микроскопом.
Выяснилось, что лапки снизу
покрыты листочками ткани, расположенными подобно страницам в книге с мягким
переплетом.
А щетинки, в свою очередь, делятся на сотни лопатообразных кончиков, диаметр каждого из которых всего 200 нм
Слайд 54Когда ученые, ИМИТИРУЯ движение лапки геккона:
сначала прижимали щетинку к сенсору
измерительного прибора
затем отрывали
ОБНАРУЖИЛОСЬ
что щетинка способна выдержать вес муравья!
ОДНАКО
ни особого разрежения, свойственного вакуумным присоскам
ни следов клея на щетинках обнаружить не удалось
Как оказалось, здесь работают силы Ван-дер-Ваальса = силы межмолекулярного взаимодействия.
Эти силы малы и часто теряются на фоне более мощных сил.
Но именно этими малыми силами умеет управлять геккон.
Когда геккон опускает лапку на поверхность, лопаточки на концах щетинок столь плотно прилегают к ней, что в работу включаются силы Ван дер Ваальса.
Лапка как бы прилипает к вертикальной стене или потолку. Но чуть геккон напряжет мышцы и потянет лапку – силы Ван дер Ваальса исчезают, и лапка легко отделяется от поверхности.
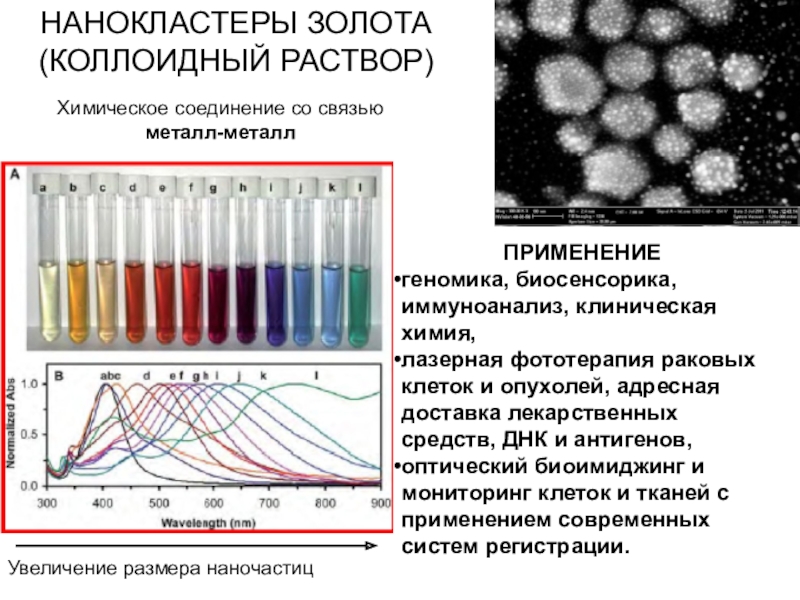
Слайд 56НАНОКЛАСТЕРЫ ЗОЛОТА (КОЛЛОИДНЫЙ РАСТВОР)
Увеличение размера наночастиц
ПРИМЕНЕНИЕ
геномика, биосенсорика, иммуноанализ, клиническая
химия,
лазерная фототерапия раковых клеток и опухолей, адресная доставка лекарственных
средств, ДНК и антигенов,
оптический биоимиджинг и мониторинг клеток и тканей с применением современных систем регистрации.
Химическое соединение со связью металл-металл
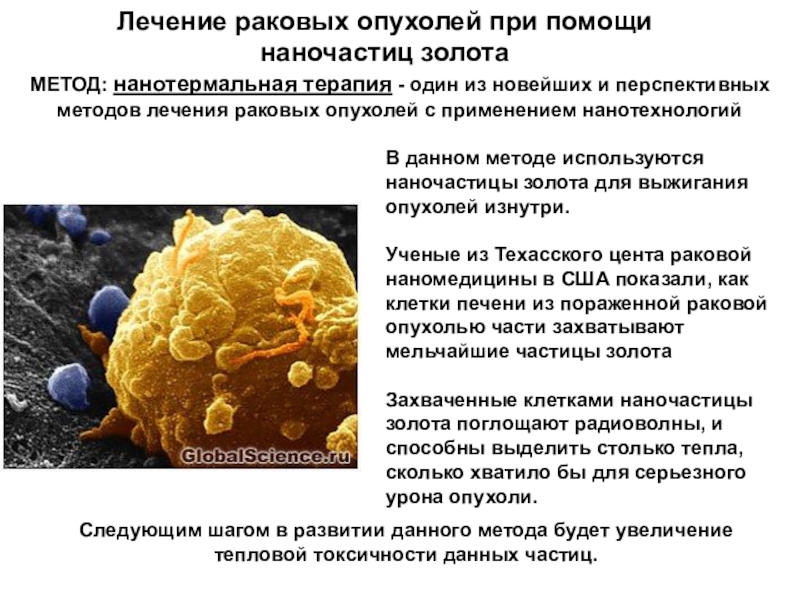
Слайд 57Лечение раковых опухолей при помощи
наночастиц золота
В данном методе
используются наночастицы золота для выжигания опухолей изнутри.
Ученые из Техасского
цента раковой наномедицины в США показали, как клетки печени из пораженной раковой опухолью части захватывают мельчайшие частицы золота
Захваченные клетками наночастицы золота поглощают радиоволны, и способны выделить столько тепла, сколько хватило бы для серьезного урона опухоли.
МЕТОД: нанотермальная терапия - один из новейших и перспективных методов лечения раковых опухолей с применением нанотехнологий
Следующим шагом в развитии данного метода будет увеличение тепловой токсичности данных частиц.
Слайд 58Один из давних сплавов золота, имеющий черно-голубой цвет называется Сякудо
(транслитерация – «shakudo» с японского словосочетания 赤銅).
Этот сплав состоит
из небольшого количества золота (не более 9 – 10 %). В Японии времен европейских Средних Веков использовался в процессе изготовления самурайского оружия – мечей и кинжалов, под общим названием «катаны».
Слайд 59Интерметалли́ды
- химическое соединение двух или более металлов ( иногда неметалла).
Обычно это
соединения металлов с малым удельным весом (Al, Ca, K, Co)
с «тяжелыми» металлами (Pb, Sn, Ag, Au, Hg, U и п. т.)/
Иногда в составе интерметаллидов присутствуют металлоиды (полуметаллы) - химические элементы, расположенные в Периодической системе на границе между металлами и неметаллами:
Si, B, Ge, As, Sb, Te, Bi, Po, At, Sn.
Слайд 61Состав
интерметаллических соединений не всегда подчиняется правилам валентности, но эти соединения
имеют ярко выраженную индивидуальность свойств.
Два металла могут образовывать между
собой не одно, а несколько соединений, например, NaSn3, NaSn2, NaSn, Na4Sn3, Na2Sn, Na4Sn и др., существующие лишь в определенных пределах состава и температуры.
Устойчивость
интерметаллидов определяется природой взаимодействующих металлов.
Чем сильнее отличаются металлы по своей природе и электроотрицательности (ОЭО), тем более прочные соединения они образуют, а их образование сопровождается значительным экзотермическим эффектом.
Эту закономерность можно наблюдать на примере соединений Mg с металлами II–V групп, в которых резко повышается при переходе от MgZn к
Слайд 62ПРИМЕНЕНИЕ
Нитинол от англ. Nitinol = nickel (никель) + titanium (титан) - TiNi
Разработано в Лабораторииморской
артиллерии США,
Обладает высокой коррозионной стойкостью.
Процентное содержание титана — 45 %, никеля — 55 %, в
формуле количества атомов равны.
Необычно то, что данный сплав обладает свойством ПАМЯТЬ ФОРМЫ ( открыто советским металлургом Курдюмовым Г.В. 1980 г)
Если деталь сложной формы подвергнуть нагреву до
красного каления, то она запомнит эту форму.
После остывания до комнатной температуры деталь можно деформировать, но при нагреве выше 40 °C она
восстановит первоначальную форму.
Такое поведение связано с тем, что, фактически, этот материал является не типичным сплавом, а интеометаллидом, и при закалке взаимное расположение атомов упорядочивается, что приводит к запоминанию формы.
Применение в медицине
- для лечения пациентов с заболеваниями и травмами опорно-двигательного аппарата: воронкообразная деформация грудной клетки («грудь сапожника»), переломы позвонков,
- в стоматологии для ортодонтического лечения: металлические дуги брекет-систем сделаны из данного материала.
Слайд 66Химическая связь в твердых телах
Свойства твердых веществ определяются природой
частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними
Твердые
аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах.
Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Слайд 67Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку
электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы.
Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов).
Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl
tпл = 801 °C, а для NaNO3 tпл = 306,5 °C.
кварц – кристаллическая форма
оксида кремния
Слайд 68В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью,
поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими
тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованной s-электронами.