Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 МОСКОВСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА АКУШЕРСТВА И ГИНЕКОЛОГИИ № 1
Содержание
- 1. 1 МОСКОВСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА АКУШЕРСТВА И ГИНЕКОЛОГИИ № 1
- 2. Самая распространенная опухоль у женщин репродуктивного возраста
- 3. Может долго сохранять стабильные размеры или увеличиваться
- 4. Чаще множественная, но может быть одиночнойВ развитии
- 5. соматические, воспалительные, нейроэндокринные заболевания;опухоли яичников;эндометриоз
- 6. МИОМА МАТКИ - истинная доброкачественная опухольмиометрия, моноклонального характера, развивающаяся из миоцитов сосудистой стенки
- 7. Имеет моноклональный характер.В зависимости от клетки-родоначальницы
- 8. Для своего роста и развития выделяет
- 9. Наблюдается большое морфологическое и клиническое разнообразие миомы
- 10. По соотношению паренхимы и стромы (миомы, фибромы,
- 11. Слайд 11
- 12. Слайд 12
- 13. Что нового в этой проблеме?Доказана опухолевая природа
- 14. 4. Подтверждены стадии развития ММ:
- 15. Образование зачатка роста из незрелой ГМ клетки,
- 16. Запускается процесс неоангиогенеза, подавление иммунологической защиты.Факторы роста:ИПФР
- 17. Классификация миом матки в основном анатомическая и
- 18. Классификации миом матки Клинико-гистохимическая
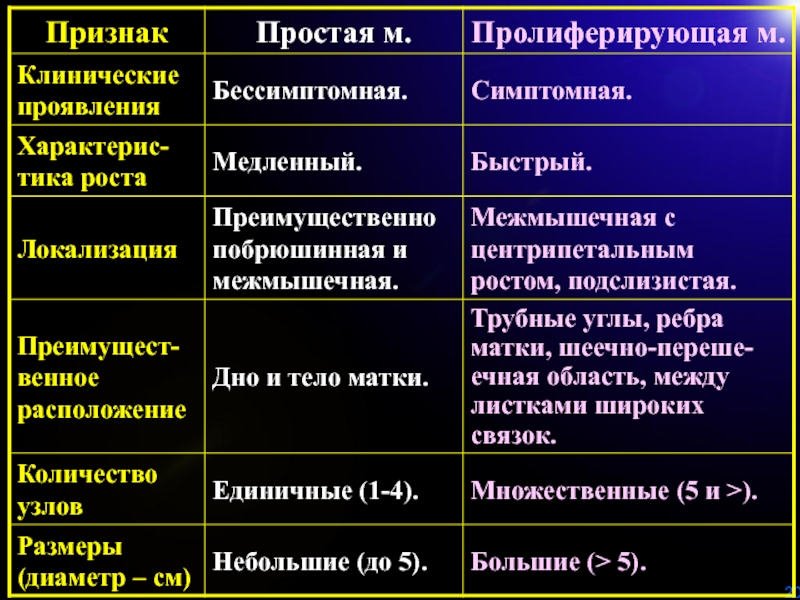
- 19. Клинико-морфологическая характеристика простой и пролиферирующей миомы матки (крайние варианты развития). И.С. Сидорова.
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Не активная, растет медленно. Преобладают элементывнеклеточногоматрикса. Кровоснабжение
- 26. Гиперэхогенное изображение новообразования с эффектом дистального
- 27. Неоднородная, “пятнистая” структура миоматозных узлов. Неоваскуляризация.
- 28. Артериальная реконструктивная фаза исследования.МСКТ - простая миомана
- 29. Артериальная реконструктивная фаза исследования.МСКТ - пролиферирующая ММвизуализируется,
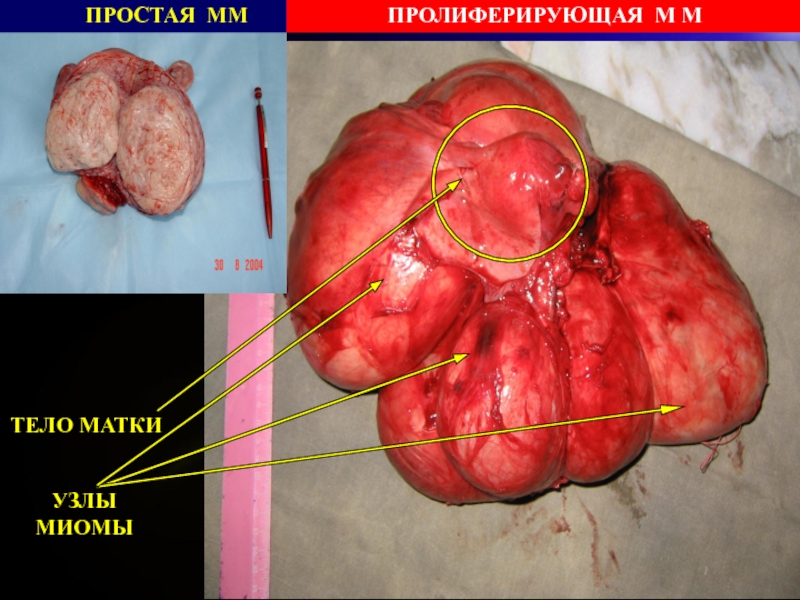
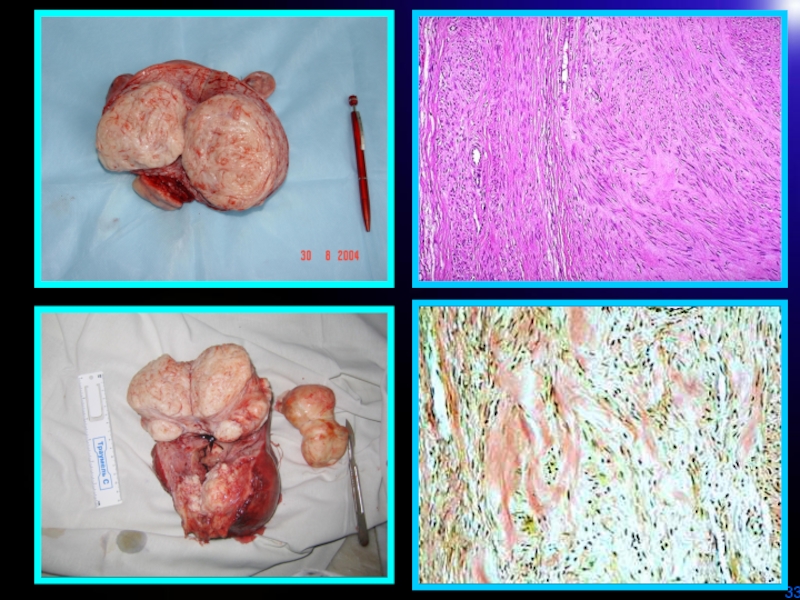
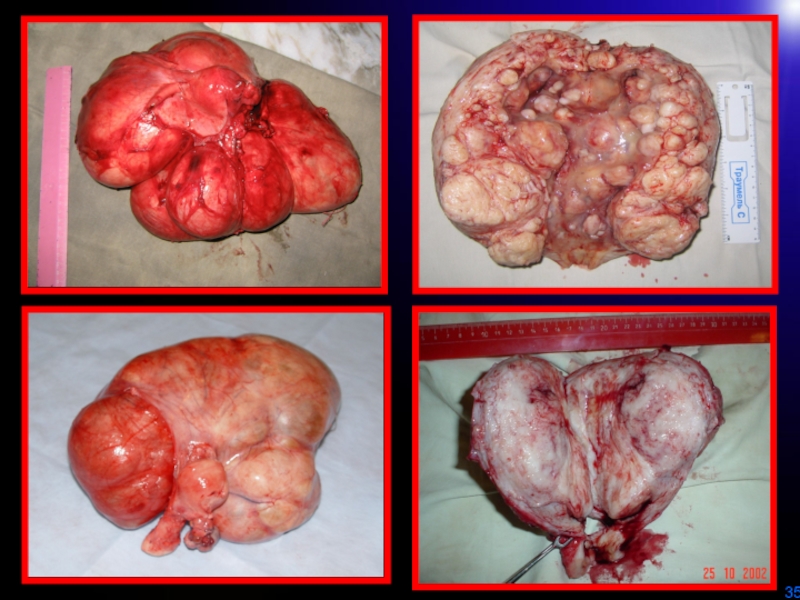
- 30. Простая миомаПролиферирующая миомаМакроскопическая характеристика
- 31. ТЕЛО МАТКИУЗЛЫ МИОМЫПРОСТАЯ ММПРОЛИФЕРИРУЮЩАЯ М М
- 32. Выраженные дистрофические изменения, очаги некроза, отека, склерозаПреобладание
- 33. Слайд 33
- 34. Во всех пролиферирующих узлах
- 35. Слайд 35
- 36. ?В чем заключаются морфологические особенностистромального компонентав зависимости от гистологического вида миомы матки ?
- 37. Э Ц М
- 38. осуществляют диффузию питательных веществ, метаболитов и гормонов;
- 39. Особенности стромального компонента ММ
- 40. ВАХ BCL-2
- 41. АпоптозРис. 6 Вcl-2 в клеточной миоме матки. Х400Bcl-2 х400 Простая ММКлеточная МММитотически акт. ММ - ингибитор
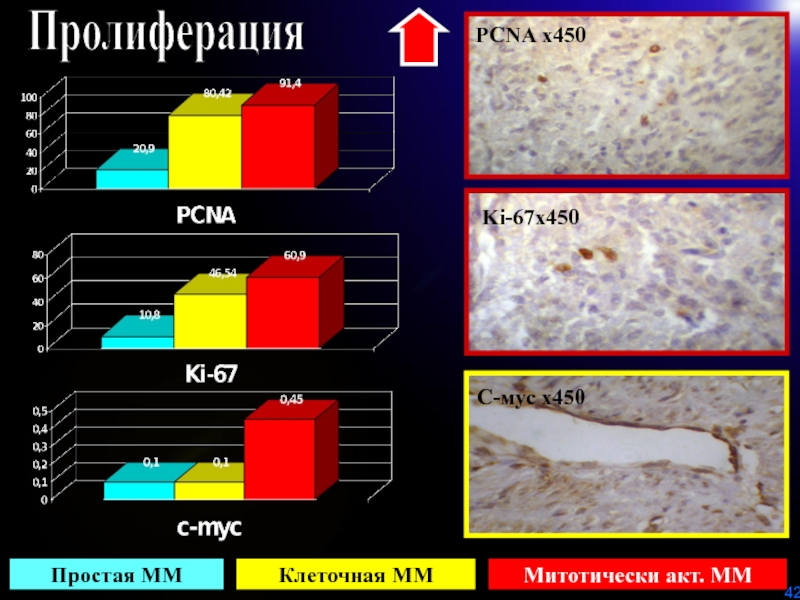
- 42. ПролиферацияPCNA х450 Ki-67х450 С-мус х450 Простая ММКлеточная МММитотически акт. ММ
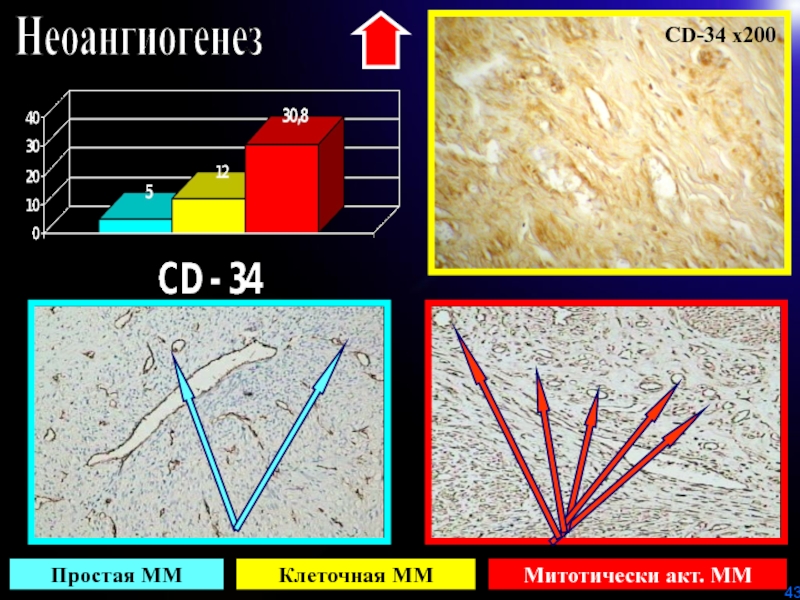
- 43. НеоангиогенезПростая ММКлеточная МММитотически акт. ММCD-34 х200
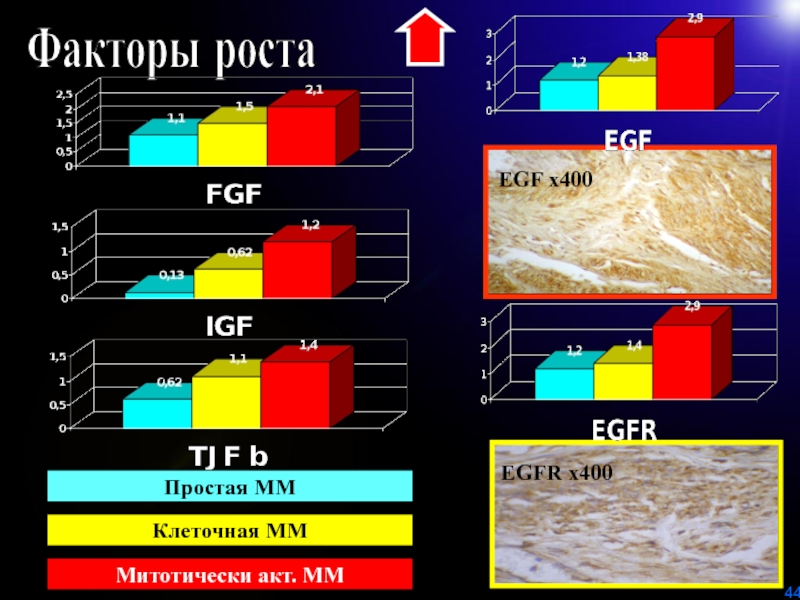
- 44. EGF х400 EGFR х400 Факторы ростаПростая ММКлеточная МММитотически акт. ММ
- 45. Факторы
- 46. МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ миомы маткиПРОСТАЯПролиферация низкаяМитотическая активность низкаяУвеличение
- 47. НЕОАНГИОГЕНЕЗCD-34ПРОЛИФЕРАЦИЯKI-67ФАКТОРЫ РОСТАEGF, FGFМИОМА АДЕНОМИОЗ
- 48. ЛЕЧЕНИЕ И ПРОФИЛАКТИКАопределяется двумя основными факторами:ВОЗРАСТОМ ЖЕНЩИНЫКЛИНИКО-МОРФОЛГИЧЕСКИМВАРИАНТОМ РАЗВИТИЯ ОПУХОЛИ
- 49. Пременопаузальный 45 - 50 лет
- 50. Все изменения в организме женщины направлены на
- 51. СОХРАНЯТЬ БЕРЕМЕННОСТЬКОРРИГИРОВАТЬГОРМОНАЛЬНЫЕ НАРУШЕНИЯ
- 52. О С О
- 53. Нарушаются клеточно-межклеточные отношения в органах репродуктивной системы
- 54. Пременопаузальный возраст (46-50 лет)Постепенное прекращение репродуктивной функции
- 55. Повышенная лабильность ССС, показателей гемо- и гомеостаза.Возрастание
- 56. У большинства пациенток в
- 57. Постменопаузальный возраст.Практическое прекращение секреторной функции яичников, их
- 58. Эстрон (Э1) – на молекулярном уровне может
- 59. Клинические проявления нерегрессирующей ММ в постменопаузе:Отсутствие уменьшения
- 60. Нерегрессирующая миома матки в постменопаузальном возрасте является
- 61. Основным методом лечения больных с ММ в
- 62. КОНСЕРВАТИВНЫЕХИРУРГИЧЕСКИЕМиомэктомия при простой миоме.Эмболизация сосудов матки (эффективнее при пролиферирующей). Миомэктомия с гормональной терапией.МЕТОДЫ ЛЕЧЕНИЯ
- 63. Под «истинным ростом» понимают количественное увеличение мышечной
- 64. Консервативное лечение Позволяет в
- 65. Гормональная терапия Производные прогестерона, тестостерона, нороксипрогестерона:Норколут;Прималют-нор;Норэтистерон
- 66. Гормональная терапияПротивопоказания: надпочечниковая и печеночная недостаточность, длительное
- 67. Под действием препаратов этой
- 68. Пульсирующий выброс гонадолиберина поддерживает секрецию
- 69. Перифокальный склероз активной периваскулярной зоны
- 70. Лечение в зависимости от клинико-морфологического варианта развития
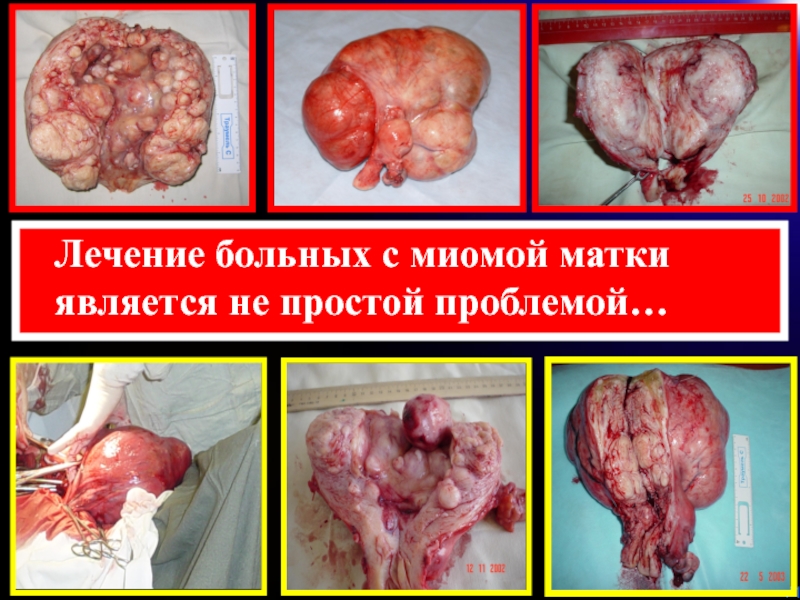
- 71. Лечение больных с миомой матки является не простой проблемой…
- 72. Гормональная терапия в лечении
- 73. Операции миомэктомии небольших миоматозных узлов
- 74. Необходим поиск
- 75. НЕО- АНГИОГЕНЕЗПРОЛИ-ФЕРАЦИЯФАКТОРЫ РОСТАПРЕПАРАТПУТИ ФАРМАКОЛОГИЧЕСКОЙ КОРРЕКЦИИ ПРИ МИОМЕ МАТКИИНВАЗИЯАПОПТОЗАПОПТОЗ
- 76. Indole-3-carbinolСпособ применения и дозы: 200-400 мг (2-4
- 77. Миома матки небольших размеров.Моло-дой возраст.Отказ от лечения
- 78. КЛИНИЧЕСКИЕ СИМПТОМЫ ПРИ МИОМЕ МАТКИ (ДО И
- 79. Динамика размеров матки, узлов миом и участков
- 80. Степень уменьшения размеров (%) миоматозных узлов (диаметр
- 81. 12%18%7%9%6 месяцев1 годПростая миома маткиПролиферирующая миома маткиИНДИНОЛЭПИГАЛЛАТ
- 82. Сниженный кровоток узла с немногочисленными цветовыми сигналами
- 83. АпоптозКонтрольПосле леченияМолекулярная эффективность применения при ММИНДИНОЛRЭПИГАЛЛАТRR
- 84. КонтрольПосле леченияМолекулярная эффективность применения при ММИНДИНОЛRЭПИГАЛЛАТRRПролиферация?
- 85. КонтрольПосле леченияМолекулярная эффективность применения при ММИНДИНОЛRЭПИГАЛЛАТRRНеоангиогенез
- 86. КонтрольПосле леченияМолекулярная эффективность применения при ММИНДИНОЛRЭПИГАЛЛАТRRФакторы роста
- 87. Во всех
- 88. В чем заключается концепция будущей стратегии в терапии миомы матки?
- 89. Таргетная терапияTargeted theraphy(от англ. target — цель, мишень)
- 90. - принципиально новый метод терапии молекулярно-нацеленного действия,
- 91. Таргетные препараты- выгодно отличаются от классических лекарственных
- 92. Результаты внедрения
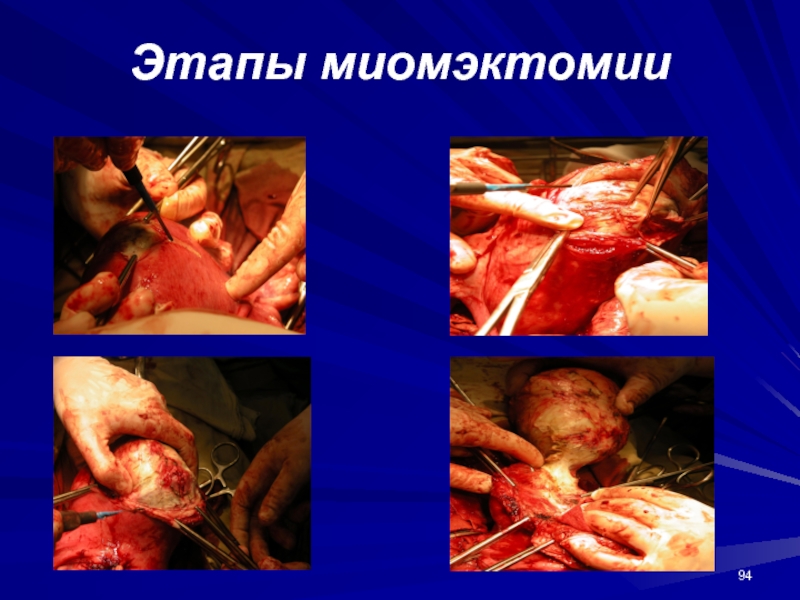
- 93. Этапы консервативной миомэктомии
- 94. Этапы миомэктомии
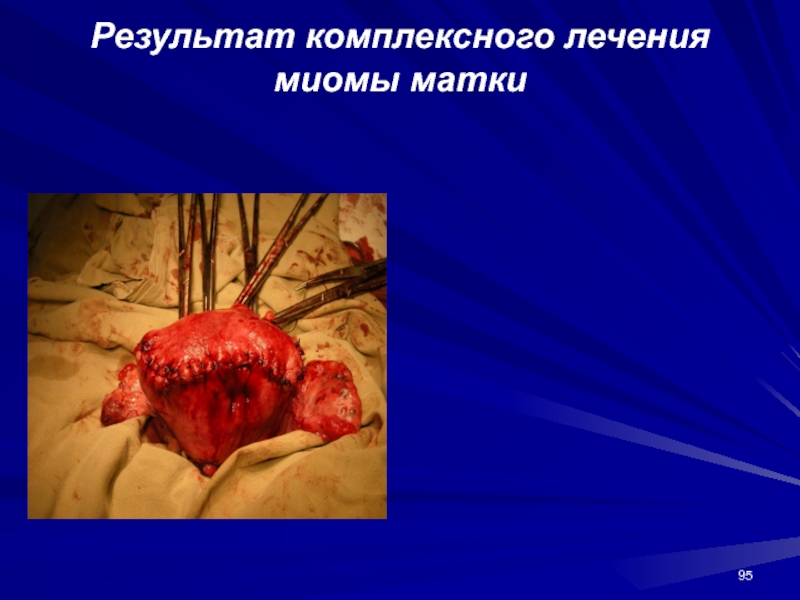
- 95. Результат комплексного лечения миомы матки
- 96. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1МОСКОВСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА АКУШЕРСТВА И ГИНЕКОЛОГИИ № 1 лечебного факультета
имени
И. М. СЕЧЕНОВА
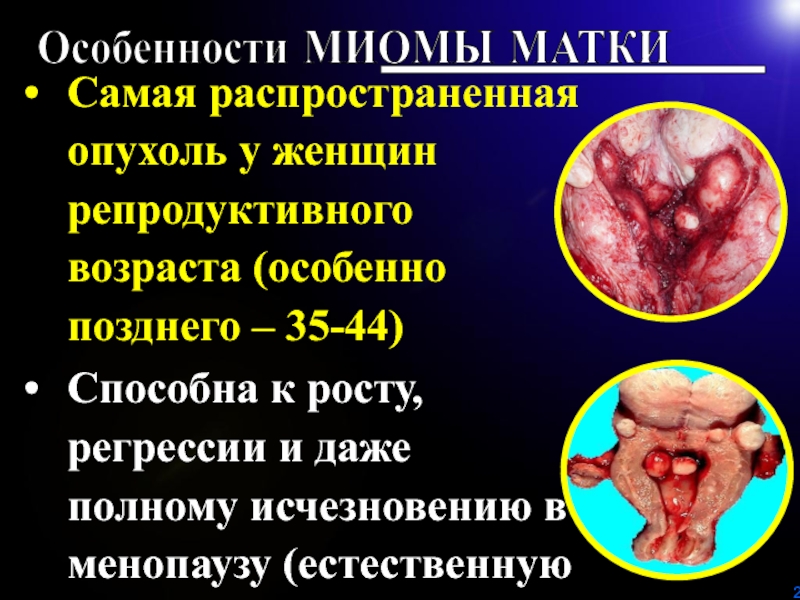
Слайд 2Самая распространенная опухоль у женщин репродуктивного возраста (особенно позднего –
35-44)
Способна к росту, регрессии и даже полному исчезновению в
менопаузу (естественную или искусственную).Особенности МИОМЫ МАТКИ
Слайд 3
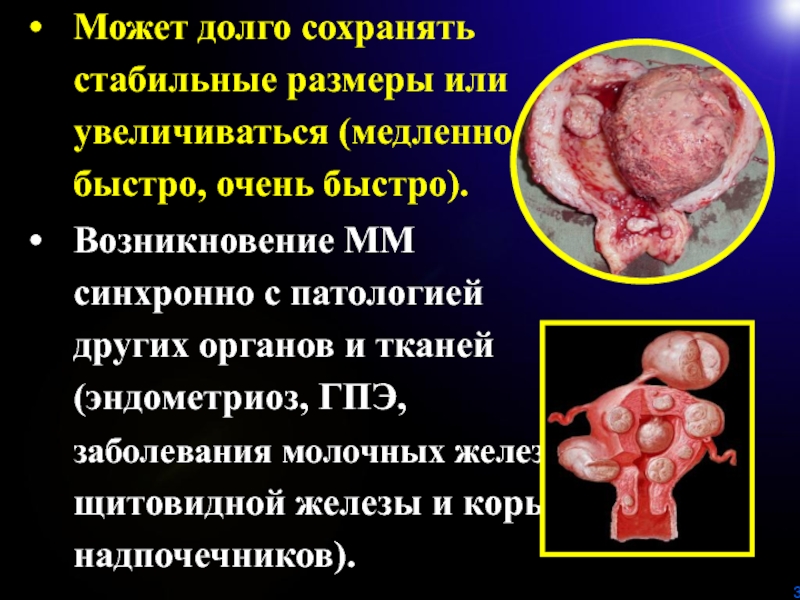
Может долго сохранять стабильные размеры или увеличиваться (медленно, быстро, очень
быстро).
Возникновение ММ синхронно с патологией других органов и тканей (эндометриоз,
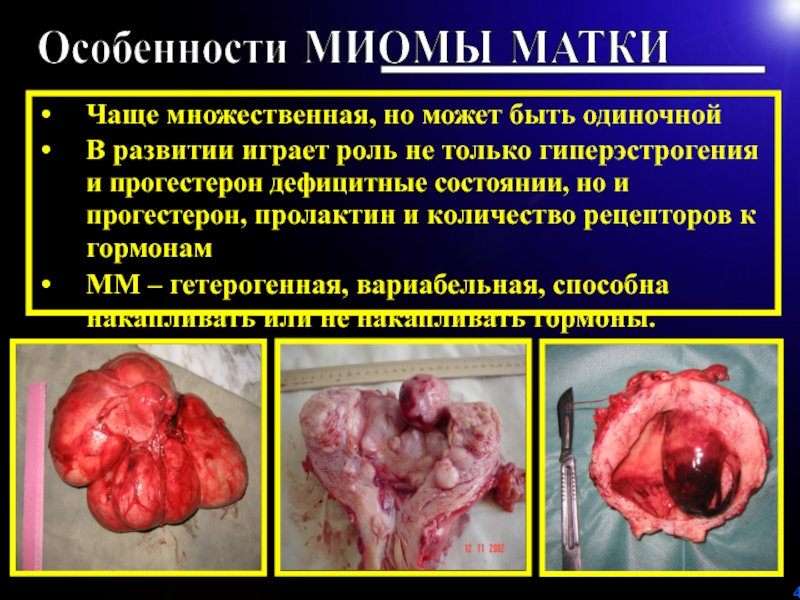
ГПЭ, заболевания молочных желез, щитовидной железы и коры надпочечников).Слайд 4Чаще множественная, но может быть одиночной
В развитии играет роль не
только гиперэстрогения и прогестерон дефицитные состоянии, но и прогестерон, пролактин
и количество рецепторов к гормонамММ – гетерогенная, вариабельная, способна накапливать или не накапливать гормоны.
Особенности МИОМЫ МАТКИ
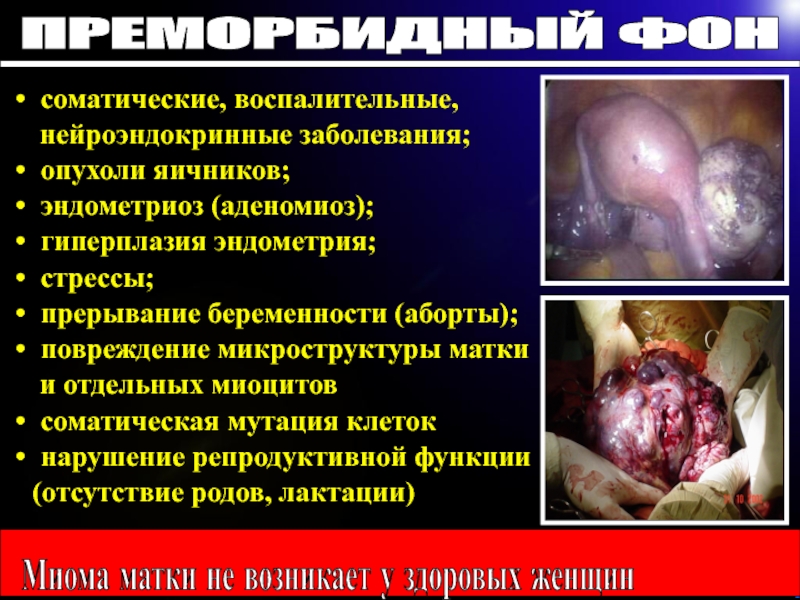
Слайд 5соматические, воспалительные,
нейроэндокринные заболевания;
опухоли яичников;
эндометриоз (аденомиоз);
гиперплазия эндометрия;
стрессы;
прерывание беременности
(аборты);
повреждение микроструктуры матки
и отдельных миоцитов
соматическая мутация клеток
нарушение репродуктивной
функции (отсутствие родов, лактации)
ПРЕМОРБИДНЫЙ ФОН
Миома матки не возникает у здоровых женщин
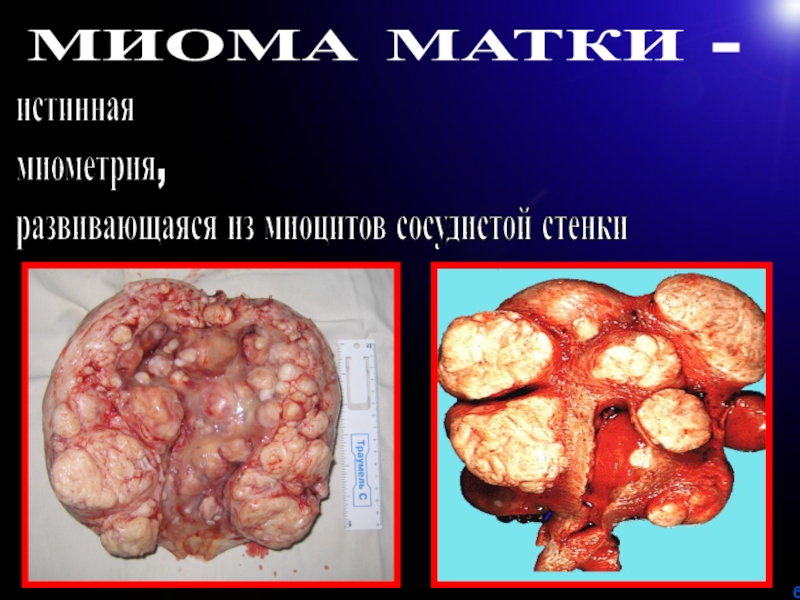
Слайд 6МИОМА МАТКИ -
истинная доброкачественная опухоль
миометрия, моноклонального характера,
развивающаяся из
миоцитов сосудистой стенки
Слайд 7 Имеет моноклональный характер.
В зависимости от клетки-родоначальницы миома матки может
быть:
лейомиомой,
фибромиомой,
фибромой,
эпителиоидной,
аденоматозной,
интравенозной.
Почти всегда множественная (сразу закладываются несколько очагов роста, но развитие
и увеличение миом происходит с разной скоростью и в разное время).Имеет автономный рост (аутокринный и паракринный).
Слайд 8Для своего роста и развития выделяет
ФРФ, ЭРФ, СФР и образует новые
сосуды (процесс неоангиогенеза).Строение сосудов – синусоидное с низко резистентным кровотоком.
Митотическая активность низкая, но имеет место экспрессия пролиферирующих генов.
В патогенезе развития играет роль сниженный АПОПТОЗ и генетические нарушения.
Как всякая опухоль, миомы могут достигать больших размеров.
Слайд 9Наблюдается большое морфологическое и клиническое разнообразие миомы матки.
В развитии ММ
ведущую роль играют не только гиперэстрогения, но
и прогестерон, пролактин, наличие рецепторов к гормонам (результаты неоднозначны).ММ – гетерогенная, вариабельная, способна накапливать или не накапливать гормоны.
Слайд 10По соотношению паренхимы и стромы (миомы, фибромы, фибромиомы, лейомиомы).
По клинике
(симптомная – бессимптомная).
По характеру гистогенеза (простая – пролиферирующая).
По сочетанию с
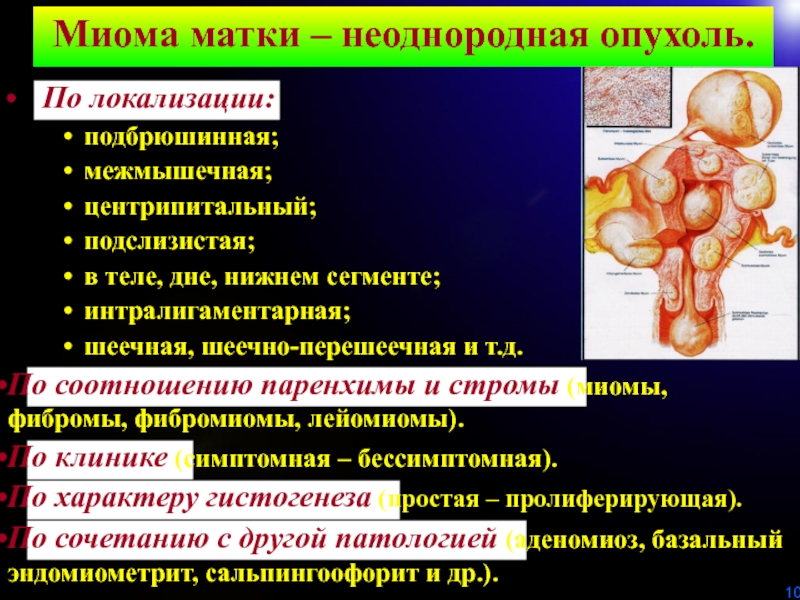
другой патологией (аденомиоз, базальный эндомиометрит, сальпингоофорит и др.).Миома матки – неоднородная опухоль.
По локализации:
подбрюшинная;
межмышечная;
центрипитальный;
подслизистая;
в теле, дне, нижнем сегменте;
интралигаментарная;
шеечная, шеечно-перешеечная и т.д.
Слайд 13Что нового в этой проблеме?
Доказана опухолевая природа ММ- моноклональность.
Пересмотрены позиции
о ведущей роли гиперэстрогении и прогестерон дефицитных состояний в возникновении
опухоли.Выявлена определяющая роль прогестерона в развитии ММ.
Слайд 14 4. Подтверждены стадии развития ММ:
образование «активной» зоны
роста
рост опухоли без признаков ее дифференцировки
рост опухоли с дифференцировкой и
созреваниемклинически незначимый
клинически значимый
автономный рост (регуляция роста на ауто- и паракринном уровне)
5. Самым распространенным направлением в лечении ММ являются органосохраняющие методы.
Слайд 15Образование зачатка роста из незрелой ГМ клетки, из перицита.
Активная зона
роста без признаков дифференцировки.
Рост опухоли с дифференцировкой и созреванием миоцитов.
Изменение
функциональной активности миоцита (из сократительного → синтетический и продуци-рует коллаген, гликопротеиды, протеингликаны).Разобщенность клеточного сообщества вызывает активный синтез ЭЦМ, гипертрофию и экспрессию ФР – переносчиков митогенных сигналов, которые усиливают деление и дифференцировку клеток. Через ФР опосредуется действие Э, П, ГтГ и стрессовых гормонов (кортикостероиды).
П А Т О Г Е Н Е З
Слайд 16Запускается процесс неоангиогенеза, подавление иммунологической защиты.
Факторы роста:
ИПФР – инсулиноподобный;
ЭФР –
эпидермальный;
СЭФР – сосудисто-эндотелиальный;
ТФР – тромбоцитарный;
ФРФ – фактор роста фибробластов.
ФР, гормоны – составляют молекулярную основу многих процессов: воспаление, опухоль, неоангиогенез.Нарушение соотношения пролиферации (↑) и апоптоза (↓). ↑ BCL-2, Bax, C-myc, P-53.
Слайд 17Классификация миом матки в основном анатомическая и морфологическая.
Классификация по локализации:
субсерозная;
межмышечная;
подслизистая.
Классификация
ВОЗ (1994 г.):
обычная (зрелая доброкачественная опухоль);
причудливая;
внутрисосудистый лейомиоматоз;
растущая (пролиферирующая);
малигнизирующая (предсаркоматозная);
эпителиоидная.
Слайд 18Классификации миом матки
Клинико-гистохимическая
Простая,
Пролиферирующая
(клеточная, митотически активная).
(Сидорова И.С., Коган Е.А., Зайратьянц О.В., 2001 г.)
ГистологическаяПростая,
Клеточная,
Митотически активная.
(по классификации ВОЗ, 2003 г., World Health
Organization Classification of Tumors).
Слайд 19Клинико-морфологическая характеристика простой и пролиферирующей миомы матки (крайние варианты развития).
И.С. Сидорова.
Слайд 25
Не активная, растет
медленно.
Преобладают элементы
внеклеточного
матрикса.
Кровоснабжение снижено.
Опухоль белесоватого
цвета, плотная,
с четкими контурами.
Активная, множественная,
быстрорастущая, клеточная.
Повышен пролиферативный
потенциал.
Часто сочетается
с аденомиозом и
гиперпластическими
процессами эндометрия.
ПРОСТАЯ МИОМА МАТКИ
ПРОЛИФЕРИРУЮЩАЯ МИОМА МАТКИ
Общая характеристика крайних вариантов развития ММ
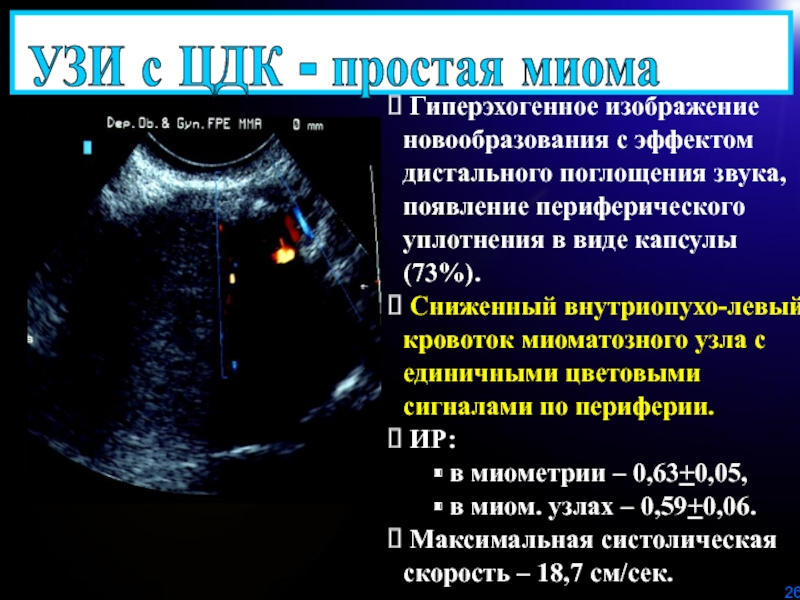
Слайд 26 Гиперэхогенное изображение новообразования с эффектом дистального поглощения звука, появление
периферического уплотнения в виде капсулы (73%).
Сниженный внутриопухо-левый кровоток
миоматозного узла с единичными цветовыми сигналами по периферии.ИР:
в миометрии – 0,63+0,05,
в миом. узлах – 0,59+0,06.
Максимальная систолическая скорость – 18,7 см/сек.
УЗИ с ЦДК - простая миома
Слайд 27 Неоднородная, “пятнистая” структура миоматозных узлов.
Неоваскуляризация.
Кровоток с низким
сосудистым сопротивлением, синусоидальные сосуды с высокой скоростью и разнообразным направлением.
Кровоток с выраж. яркостью цветового сигнала и «мозаичной» формой картирования, высокой плотностью цветовых сигналов. ИР в миометрии – 0,53+0,09, в миоматозных узлах – 0,34+0,06.
Vmax – 28,9 см/сек.
Много вен в различных отделах миом. узла с Vmax – 12,8 см/сек.
УЗИ с ЦДК - пролиферирующая ММ
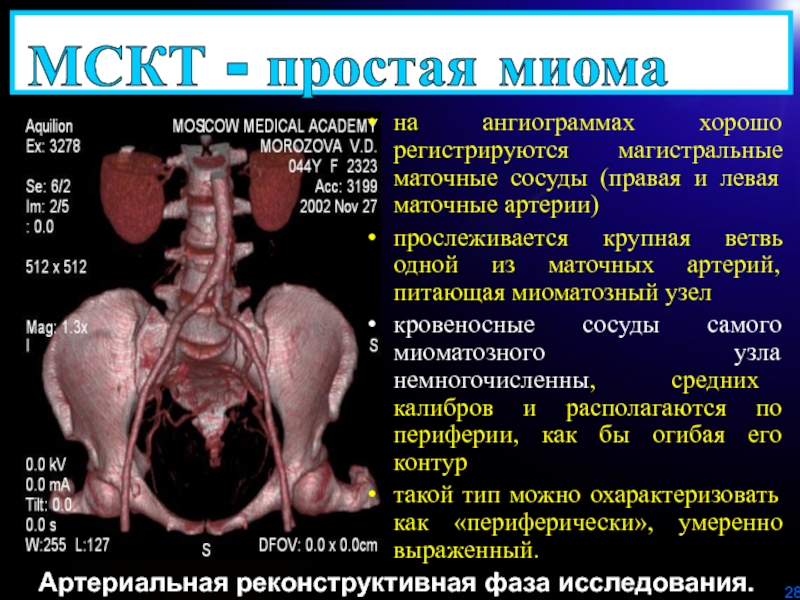
Слайд 28Артериальная реконструктивная фаза исследования.
МСКТ - простая миома
на ангиограммах хорошо регистрируются
магистральные маточные сосуды (правая и левая маточные артерии)
прослеживается крупная ветвь
одной из маточных артерий, питающая миоматозный узел кровеносные сосуды самого миоматозного узла немногочисленны, средних калибров и располагаются по периферии, как бы огибая его контур
такой тип можно охарактеризовать как «периферически», умеренно выраженный.
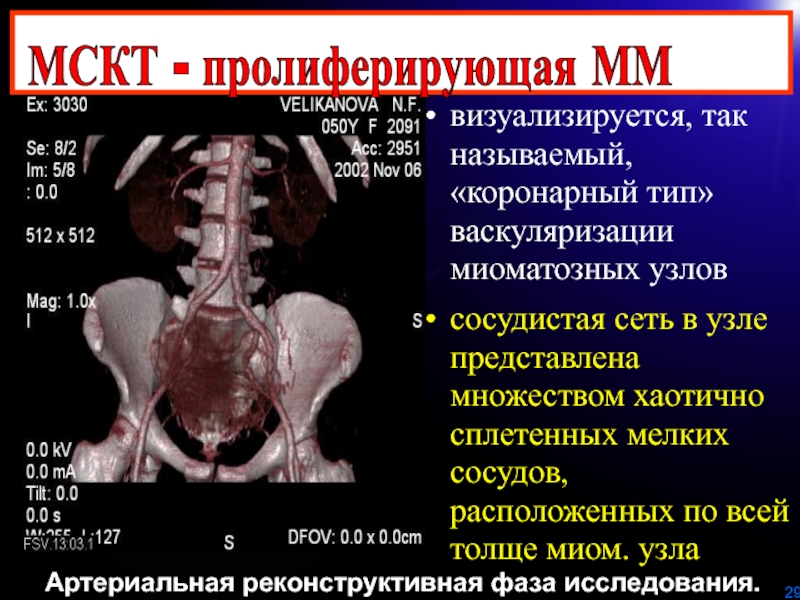
Слайд 29Артериальная реконструктивная фаза исследования.
МСКТ - пролиферирующая ММ
визуализируется, так называемый, «коронарный
тип» васкуляризации миоматозных узлов
сосудистая сеть в узле представлена множеством
хаотично сплетенных мелких сосудов, расположенных по всей толще миом. узлаСлайд 32Выраженные дистрофические изменения, очаги некроза, отека, склероза
Преобладание соединительнотканной стромы с
выраженным склерозом, гиалинозом на фоне отека и множественных участков некроза.
Признаки нарушения кровообращения в миомах.В участках некроза – скопление нейтрофильных лейкоцитов, лимфоцитов, формирование кистозных полостей в месте разрушения ткани миомы.
Микроскопическая характеристика простой ММ
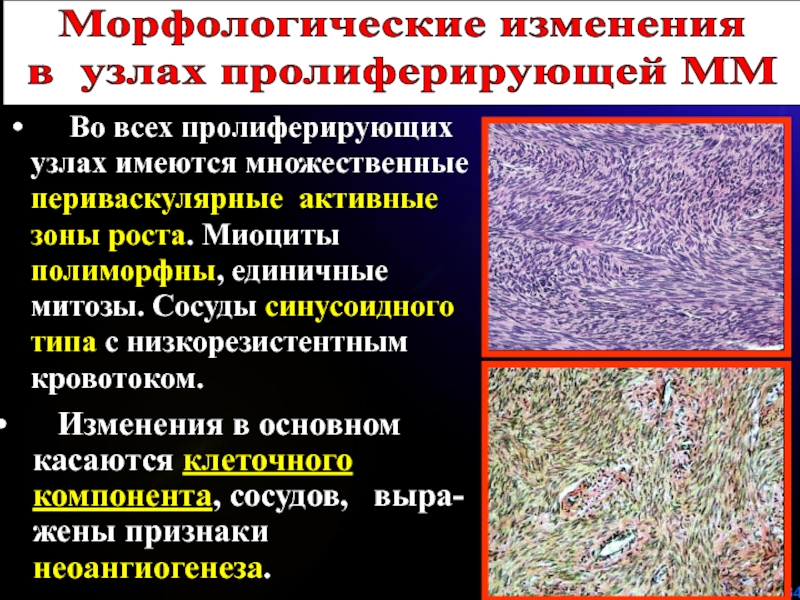
Слайд 34 Во всех пролиферирующих узлах имеются множественные периваскулярные
активные зоны роста. Миоциты полиморфны, единичные митозы. Сосуды синусоидного типа
с низкорезистентным кровотоком.Морфологические изменения
в узлах пролиферирующей ММ
Изменения в основном
касаются клеточного
компонента, сосудов, выра-
жены признаки
неоангиогенеза.
Слайд 36?
В чем заключаются
морфологические особенности
стромального компонента
в зависимости от гистологического вида
миомы матки ?
Слайд 37 Э Ц М – ламинин,
фибронектин, коллаген
определяет сохранение формы и функции окружающих клеток;
противостояние физическим
воздействиям, которым подвергается матка (выскабливания, воспаления, метаболические нарушения); сохраняют прочность органа препятствуя чрезмерному растяжению и сокращению матки;
Слайд 38осуществляют диффузию питательных веществ, метаболитов и гормонов;
являются источником белка
и ФР;
определяют энергию роста (сборка полисахаридных цепей);
выявлено до 400
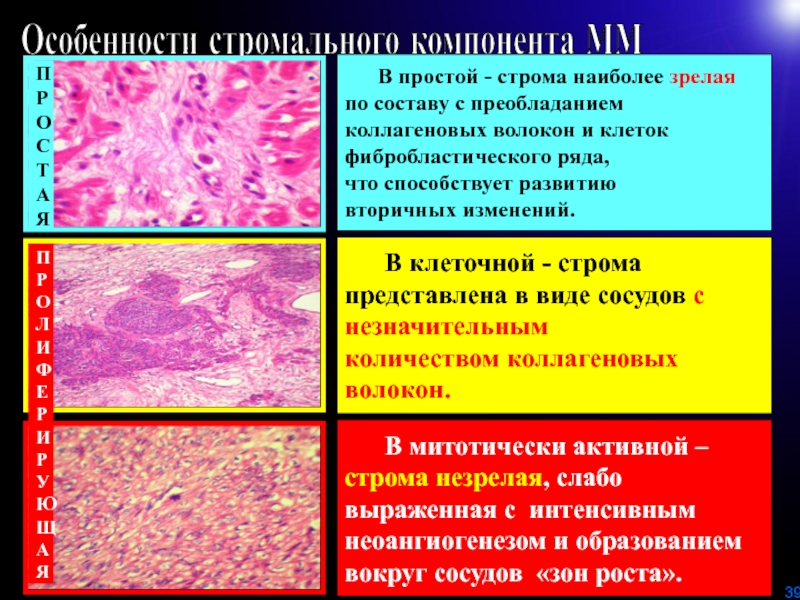
вариантов мутаций генов ламинина, фибронектина и коллагенов, что нарушает образование сосудов (возникновение активного «зачатка» роста миоматозного узелка?)Слайд 39Особенности стромального компонента ММ
В простой - строма наиболее зрелая
по составу с преобладанием
коллагеновых волокон и клеток
фибробластического ряда,
что способствует развитию
вторичных изменений.
В клеточной - строма
представлена в виде сосудов с
незначительным
количеством коллагеновых
волокон.
В митотически активной –
строма незрелая, слабо
выраженная с интенсивным
неоангиогенезом и образованием
вокруг сосудов «зон роста».
П
Р
О
С
Т
А
Я
П
Р
О
Л
И
Ф
Е
Р
И
Р
У
Ю
Щ
А
Я
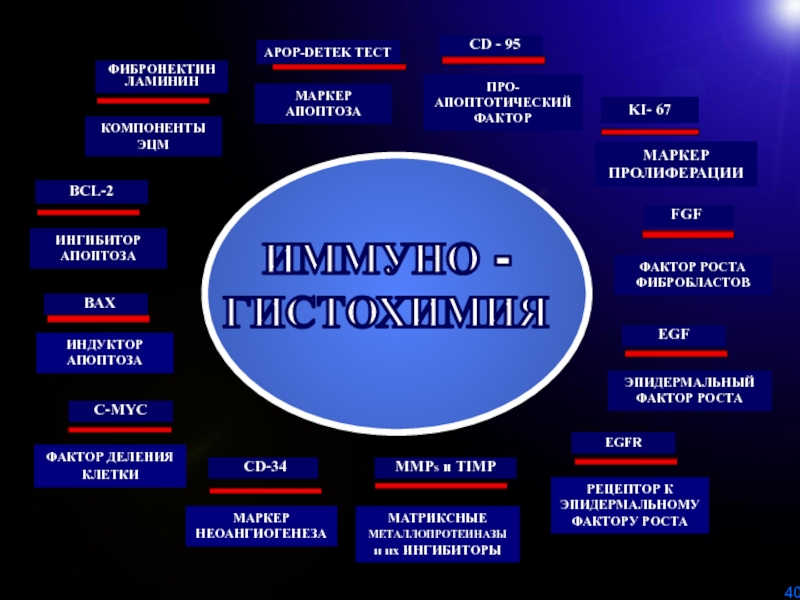
Слайд 40 ВАХ
BCL-2
FGF
CD-34
C-MYC
ИНГИБИТОР
АПОПТОЗА
ИНДУКТОР
АПОПТОЗА
ФАКТОР ДЕЛЕНИЯ КЛЕТКИ
МАРКЕР
НЕОАНГИОГЕНЕЗА
ФАКТОР РОСТА
ФИБРОБЛАСТОВ
KI- 67
МАРКЕР ПРОЛИФЕРАЦИИ
EGF
ЭПИДЕРМАЛЬНЫЙ
ФАКТОР РОСТА
ФИБРОНЕКТИН
ЛАМИНИН
КОМПОНЕНТЫ ЭЦМ
APOP-DETEK ТЕСТ
МАРКЕР АПОПТОЗА
EGFR
РЕЦЕПТОР К
ЭПИДЕРМАЛЬНОМУ ФАКТОРУ РОСТА
ИММУНО -
ГИСТОХИМИЯ
CD - 95
ПРО-
АПОПТОТИЧЕСКИЙ ФАКТОР
ММРS и TIMP
МАТРИКСНЫЕ МЕТАЛЛОПРОТЕИНАЗЫ и их ИНГИБИТОРЫ
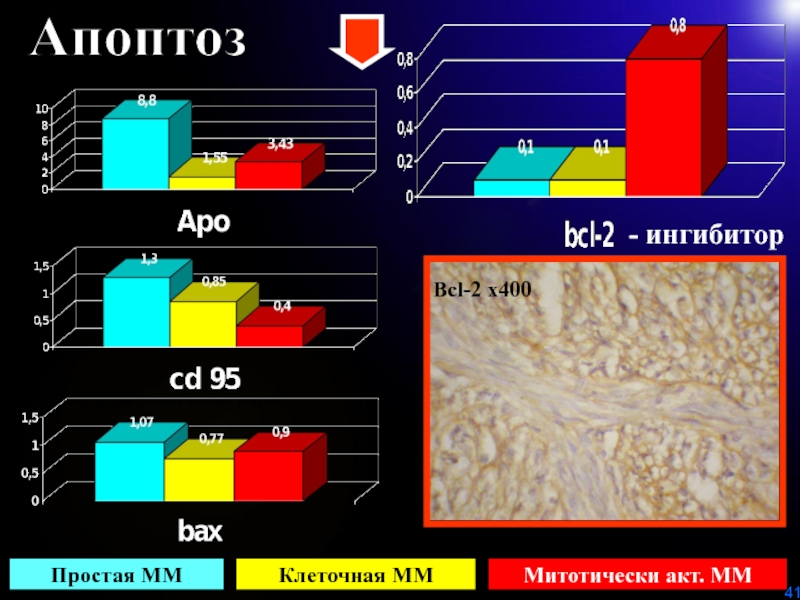
Слайд 41Апоптоз
Рис. 6 Вcl-2 в клеточной миоме матки. Х400
Bcl-2 х400
Простая
ММ
Клеточная ММ
Митотически акт. ММ
- ингибитор
Слайд 45 Факторы роста способствуют
:
росту миомы за счет гипертрофии и пролиферации миоцитов.
гипертрофии миометрия, что
сопровождается увеличением толщины миометрия у больных с миомой матки. возникновению гиперпластических процессов эндометрия
усилению неоангиогенеза, с формированием сосудов синусоидного типа с низкорезистентным кровотоком
Слайд 46МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
миомы матки
ПРОСТАЯ
Пролиферация
низкая
Митотическая
активность низкая
Увеличение
компонентов ЭЦМ
Мало сосудов
Апоптоз
высокий
Пролиферация
повышена
Митозов мало
Компонентов ЭЦМ
мало
Сосудов много
Апоптоз снижен
Пролиферация
выраженная
Много митозовСтромообразование
снижено
Выраженный
Ангиогенез
Множество зон
роста
Низкий апоптоз
ПРОЛИФЕРИРУЮЩАЯ
КЛЕТОЧНАЯ
МИТОТИЧЕСКИ
АКТИВНАЯ
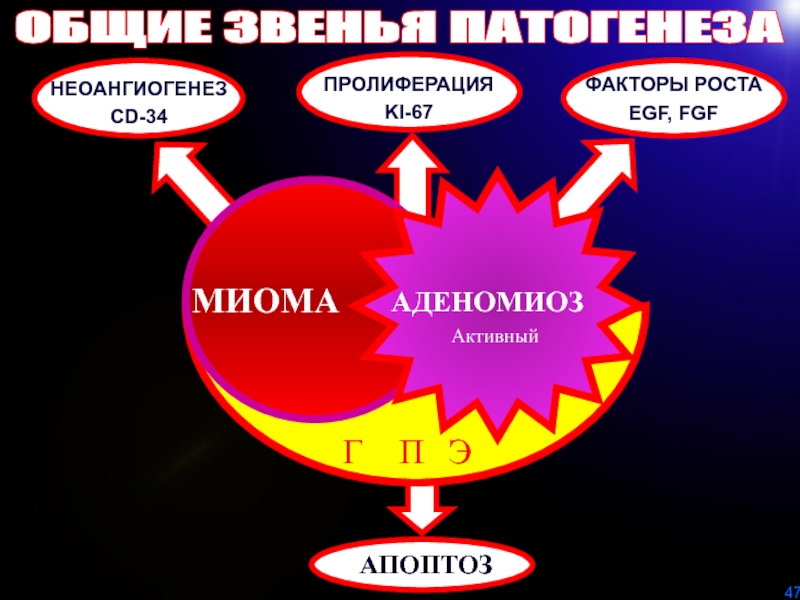
Слайд 47НЕОАНГИОГЕНЕЗ
CD-34
ПРОЛИФЕРАЦИЯ
KI-67
ФАКТОРЫ РОСТА
EGF, FGF
МИОМА
АДЕНОМИОЗ
Активный
АПОПТОЗ
ОБЩИЕ ЗВЕНЬЯ ПАТОГЕНЕЗА
Г П Э
Слайд 48ЛЕЧЕНИЕ И ПРОФИЛАКТИКА
определяется двумя основными факторами:
ВОЗРАСТОМ ЖЕНЩИНЫ
КЛИНИКО-МОРФОЛГИЧЕСКИМ
ВАРИАНТОМ РАЗВИТИЯ ОПУХОЛИ
Слайд 49 Пременопаузальный 45 - 50 лет
Менопауза –
50,8 лет
МИОМА МАТКИ И ВОЗРАСТ
Постменопаузальный
Репродуктивный
15 - 44 летСлайд 50Все изменения в организме женщины направлены на осуществление и реализацию
репродуктивной функции.
Оптимальный возраст для:
I РОДОВ - 20 – 22 лет
II
РОДОВ - 25 летIII РОДОВ - 28 – 30 лет
Наличие ММ у молодой женщины (20-29 лет) свидетельствует о:
наследственном заболевании;
пролиферирующем варианте развития ММ.
Молодой репродуктивный возраст до 34 лет
Слайд 51 СОХРАНЯТЬ БЕРЕМЕННОСТЬ
КОРРИГИРОВАТЬ
ГОРМОНАЛЬНЫЕ НАРУШЕНИЯ (НЛФ цикла, ановуляцию)
ЛЕЧЕНИЕ В МОЛОДОМ ВОЗРАСТЕ
ЛЕЧИТЬ БЕСПЛОДИЕСлайд 52О С О Б
Е Н Н
О С Т И :Постепенно снижается гормональная функция яичников и соответственно для её поддержания повышается синтез гонадотропных гормонов.
Накапливаются последствия перенесенных и сопутствующих экстрагенитальных и гинекологических заболеваний.
Суммируются гормональные нарушения.
Поздний репродуктивный возраст
Слайд 53Нарушаются клеточно-межклеточные отношения в органах репродуктивной системы – ↑ процессы
пролиферации, ↓ апоптоз;
Возникают мутации белка р-53 – гена-супрессора опухолевого
роста. На поздний репродуктивный возраст приходится «пик» гинекологической заболеваемости (в том числе и ММ).
Через 10-15 лет у большинства пациенток с ММ возникнут показания к удалению органа.
О С О Б Е Н Н О С Т И :
Поздний репродуктивный возраст
Слайд 54Пременопаузальный возраст (46-50 лет)
Постепенное прекращение репродуктивной функции и циклической деятельности
Г–Г–Я–М системы.
Снижение чувствительности яичников к гонадотропной стимуляции (к концу этого
периода секреция ФСГ возрастает в 10-14 раз, ЛГ – в 3-4 раза).Увеличение продукции стрессовых гормонов (реакция «льва и кролика»).
Уменьшение синтеза антистрессовых нейрогормонов (эндорфинов).
О С О Б Е Н Н О С Т И :
Слайд 55Повышенная лабильность ССС, показателей гемо- и гомеостаза.
Возрастание размеров яичников и
матки, снижение их кровоснабжения.
Активизация пролиферативных процессов в органах репродуктивной системы
(гиперплазия эндометрия, аденомиоз, эндометриоз, кисты и опухоли яичников).Слайд 56 У большинства пациенток в этом возрасте наблюдается
быстрый рост миоматозных узлов, которые в совокупности с гиперплазией эндометрия,
эндометриозом являются основным показанием к удалению матки.Маточные кровотечения (32-48%).
Анемия (37-54%).
Кисты и кистомы яичников (18-27%).
Гиперплазия и рак эндометрия (42%).
ЛЕЧЕНИЕ
ГОРМОНАЛЬНАЯ ТЕРАПИЯ
АБЛАЦИЯ ЭНДОМЕТРИЯ
УДАЛЕНИЕ МАТКИ
Слайд 57Постменопаузальный возраст.
Практическое прекращение секреторной функции яичников, их атрофия.
Атрофия эндометрия и
других гормонально зависимых тканей.
Менопауза у здоровых – 50,8 ± 0,9
летПри миоме матки – 53,6 ± 1,1 лет
О С О Б Е Н Н О С Т И :
Слайд 58Эстрон (Э1) – на молекулярном уровне может усиливать экспрессию онкогенов,
ФР и опухолевую трансформацию клеток (ожирение, гипотиреоз, гиперплазия коры надпочечников).
Инволюция
и апоптоз органов и тканей.Уменьшение размеров матки (30 лет – 120 г, 65 лет – 30 г) и одновременно – миоматозных узлов.
Слайд 59Клинические проявления нерегрессирующей ММ в постменопаузе:
Отсутствие уменьшения размеров матки
Кровянистые выделения.
Патология
эндометрия (гиперплазия, отсутствие атрофии – М-эхо до 8 мм и
более).Сочетание ММ с эндометриозом и ГПЭ.
Хроническая анемия.
Отсутствие физиологической атрофии яичников (в норме 3,6±1,4 см). В первые 5 лет постменопаузы их размеры уменьшаются на 20%, после 10 лет – на 30-35%, в 70 лет – на 50% (маленькие сморщенные яичники).
Слайд 60Нерегрессирующая миома матки в постменопаузальном возрасте является маркером онкопатологии органов
репродуктивной системы (опухоль яичников, гиперплазия или рак эндометрия).
Продукция Э
столь низкая, что удаление яичников не сопровождается снижением его содержания в крови и моче. В организме повышается содержание тестостерона и андростендиона (андрогенное воздействие).
Стабильно высокая продукция гонадотропинов (в десятки раз!) – «пиковая флюктуация».
Гонадотропины – ингибиторы апоптоза и индукторы-посредники пролиферации.
Слайд 61Основным методом лечения больных с ММ в постменопаузе является оперативное
- удаление матки.
В пери- и постменопаузальном возрасте – соблюдать разумную
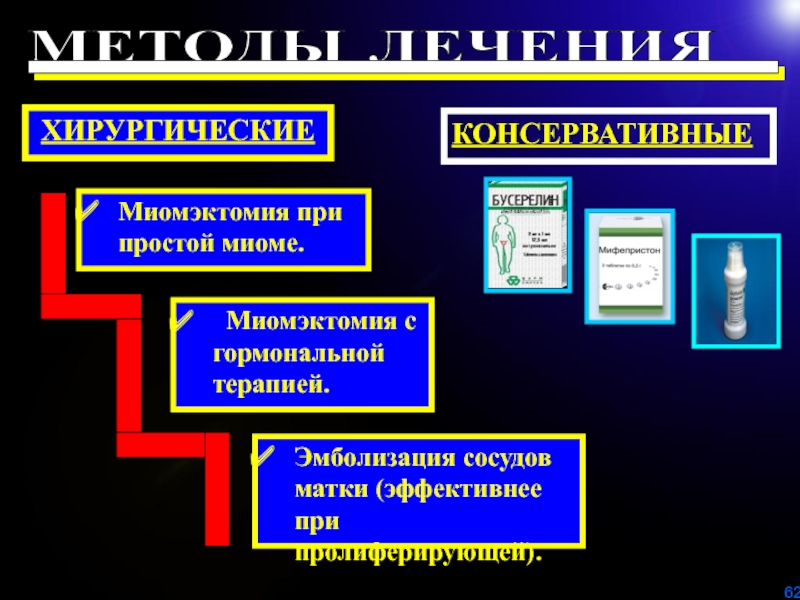
онкологическую настороженность (саркома в узле, рак эндометрия, опухоль яичника).Слайд 62КОНСЕРВАТИВНЫЕ
ХИРУРГИЧЕСКИЕ
Миомэктомия при простой миоме.
Эмболизация сосудов матки (эффективнее при пролиферирующей).
Миомэктомия
с гормональной терапией.
МЕТОДЫ ЛЕЧЕНИЯ
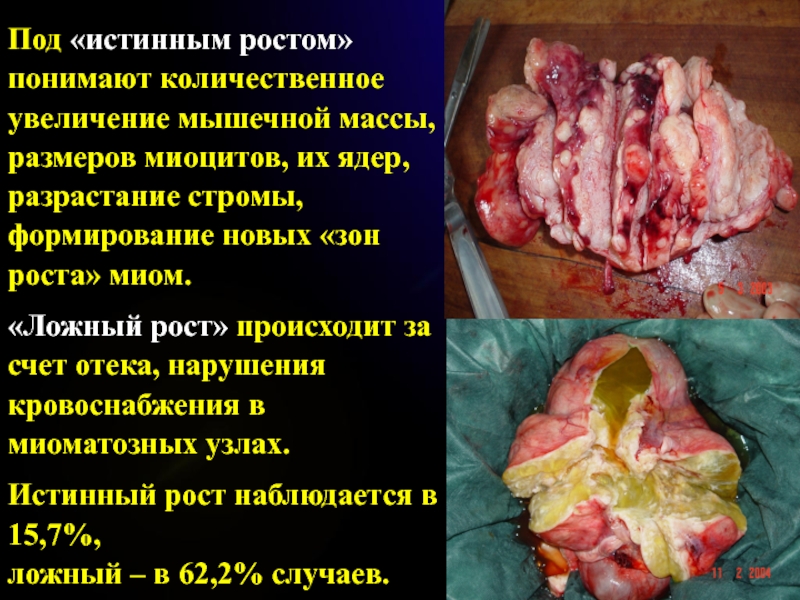
Слайд 63Под «истинным ростом» понимают количественное увеличение мышечной массы, размеров миоцитов,
их ядер, разрастание стромы, формирование новых «зон роста» миом. «Ложный
рост» происходит за счет отека, нарушения кровоснабжения в миоматозных узлах. Истинный рост наблюдается в 15,7%, ложный – в 62,2% случаев.Слайд 64Консервативное лечение
Позволяет в ряде случаев избежать
удаления матки, так как в первые 2 года постменопаузы миома
матки регрессирует или даже полностью исчезает.Консервативная терапия нередко позволяет затормозить дальнейший рост опухоли, нормализовать гормональные нарушения.
Слайд 65Гормональная терапия
Производные прогестерона, тестостерона, нороксипрогестерона:
Норколут;
Прималют-нор;
Норэтистерон ацетат.
ПРОГЕСТАГЕНЫ
В патогенезе ММ прогестерон играет ключевую роль.
Прогестероны
блокируют рецепторы к прогестеронуЭффект сомнительный нередко противоположный, побочные явления (неврологические, нейро-эндокринные).
Слайд 66Гормональная терапия
Противопоказания: надпочечниковая и печеночная недостаточность, длительное применение глюкокортикоидов, воспалительные
заболевания, гиперплазия эндометрия, заболевания почек, беременность.
Мифепристон (блокирует действие П на
уровне рецепторов, уменьшает кровоснабжение узлов опухоли) – по 50 мг – 30 дней. АНТИПРОГЕСТАГЕНЫ
Слайд 67 Под действием препаратов этой группы происходит значительное
уменьшение внутриопухолевого кровотока, количества микрососудов, повышается индекс резистентности.
Гормональная терапия
оказывает обратимое
угнетающее воздействие на гипофизарно-яичниковую систему;снижает уровень гонадотропных гормонов;
действует на уровне гипоталамуса;
подавляет клеточную пролиферацию;
оказывает антиэстрогенный и антипрогестероновый эффект.
Назначают по 200-400 мг/сут. однократно 4-6 мес.
– назначают по 2,5 мг* 2 раза в сут – 6 мес
Антагонисты гонадолиберина
Д А Н А З О Л
НЕМЕСТРАН
Слайд 68 Пульсирующий выброс гонадолиберина поддерживает секрецию гонадотропинов.
Длительное
– приводит к десентизации и псевдоменопаузе (гипоэстрогения), снижению кровоснабжения матки,
подавлению неоангиогенеза.ГнРГ – уменьшают размеры миом, снижают васкуляризацию, подавляют активность неоангиогенеза путем склеротических изменений в активных зонах роста.
Гормональная терапия
Гозерелин;
Нафарелин;
Бусерелин – 0,2% р-р в носовые ходы * 3 раза в день 4-6 мес.
Золадекс – 3,6 мг/28 дн.*3-6 мес.+премарин 0,3 мг/сут. с 1-25 д.ц.
Агонисты гонадолиберина - ГнРГ
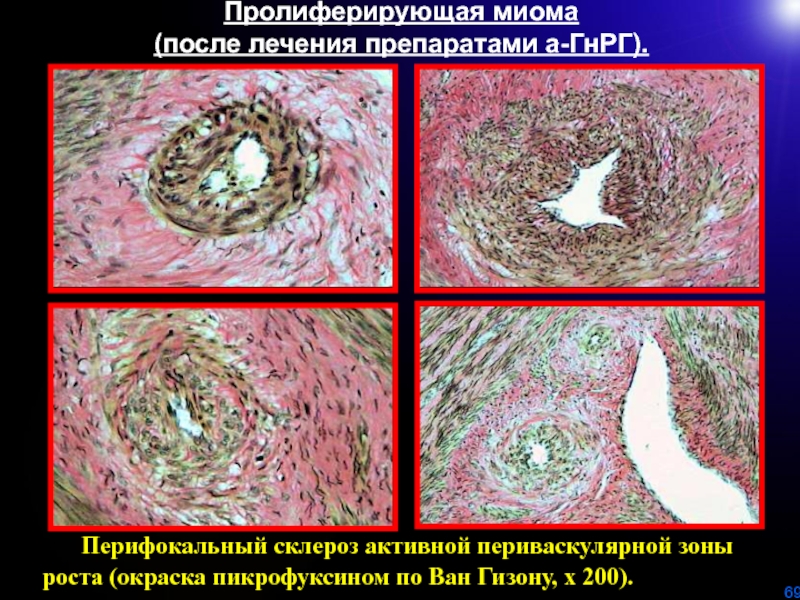
Слайд 69Перифокальный склероз активной периваскулярной зоны роста (окраска пикрофуксином
по Ван Гизону, х 200).
Пролиферирующая миома
(после лечения препаратами
а-ГнРГ).Слайд 70Лечение в зависимости от клинико-морфологического варианта развития миомы матки.
Консервативная миомэктомия эффективна при простой миоме.
При пролиферирующей миоме матки – возможны рецидивы.1. МИОМЭКТОМИЯ
2. ПРОФИЛАКТИКА
НАРУШЕНИЯ
ПИТАНИЯ В УЗЛАХ
(СПАЗМОЛИТИКИ,
АНТИАГЕГАНТЫ)
1. МИОМЭКТОМИЯ
ДОМИНИРУЮЩЕГО УЗЛА
2. ГОРМОНАЛЬНАЯ ТЕРАПИЯ
3. ЭМБОЛИЗАЦИЯ СОСУДОВ МАТКИ
4 ФУЗ
ПРОСТАЯ МИОМА МАТКИ
ПРОЛИФЕРИРУЮЩАЯ МИОМА МАТКИ
Слайд 72 Гормональная терапия в лечении миомы матки недостаточно
эффективна и сопровождается существенными отрицательными эффектами, ограничивающими их применение.
Подавляет овуляцию, выключает механизм образования желтого телаЭндометрий длительно существует без влияния прогестерона
Атрофия эндометрия
Отрицательное влияние на систему гемостаза (гиперкоагуляция, венозные тромбозы)
Отр. влияние на структуру молочных желез
Склероз стенок сосудов матки и др.
Слайд 73 Операции миомэктомии небольших миоматозных узлов сопровождаются травмой миометрия,
спаечным процессом, дефектами стенки матки, наличием рубца, коагуляционным ожогом и
т.д.Главное в лечении остановить дальнейший рост и развитие миоматозных узлов на стадии клинически незначимых, но это не гормональная терапия и не эмболизация узлов небольших размеров.
Слайд 74 Необходим поиск и оценка эффективности
новых ЛС, влияющих на основные молекулярно-биологические процессы, которые сопровождают развитие
ММ:индукция апоптоза
ингибирование пролиферации и ангиогенеза
подавление экспрессии ФР
угнетение активности ММРs
Слайд 75НЕО-
АНГИОГЕНЕЗ
ПРОЛИ-
ФЕРАЦИЯ
ФАКТОРЫ
РОСТА
ПРЕПАРАТ
ПУТИ ФАРМАКОЛОГИЧЕСКОЙ КОРРЕКЦИИ ПРИ МИОМЕ МАТКИ
ИНВАЗИЯ
АПОПТОЗ
АПОПТОЗ
Слайд 76Indole-3-carbinol
Способ применения и дозы: 200-400 мг (2-4 капсулы) ежедневно, в
течение 6 месяцев
ИНДИНОЛ
R
R
Способ применения и дозы: 1,2 г (4 капсулы)
ежедневно, в течение 6 месяцевEpigallocatechin-3-Gallate
ЭПИГАЛЛАТ
R
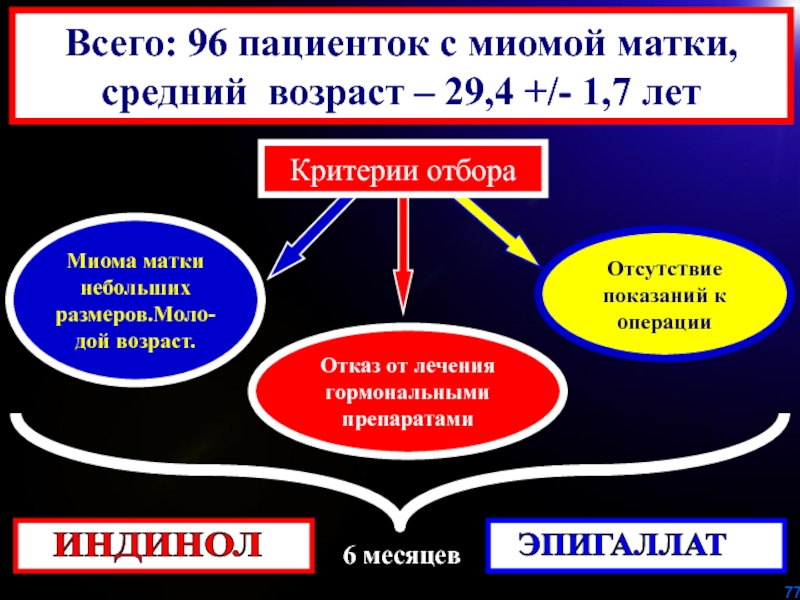
Слайд 77Миома матки небольших размеров.Моло-дой возраст.
Отказ от лечения гормональными препаратами
Отсутствие показаний
к операции
Всего: 96 пациенток с миомой матки,
средний возраст –
29,4 +/- 1,7 летКритерии отбора
ЭПИГАЛЛАТ
ИНДИНОЛ
6 месяцев
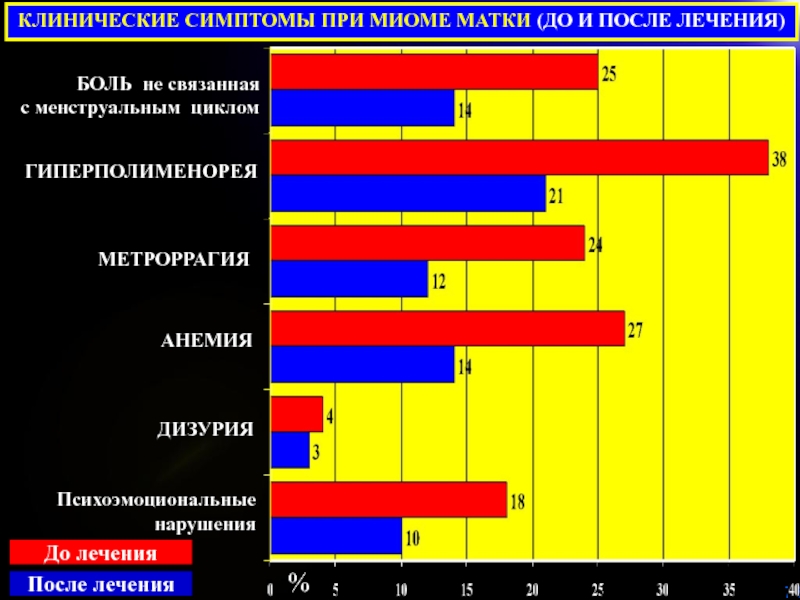
Слайд 78КЛИНИЧЕСКИЕ СИМПТОМЫ ПРИ МИОМЕ МАТКИ (ДО И ПОСЛЕ ЛЕЧЕНИЯ)
%
БОЛЬ не
связанная
с менструальным циклом
ГИПЕРПОЛИМЕНОРЕЯ
МЕТРОРРАГИЯ
ДИЗУРИЯ
АНЕМИЯ
Психоэмоциональные
нарушения
До лечения
После лечения
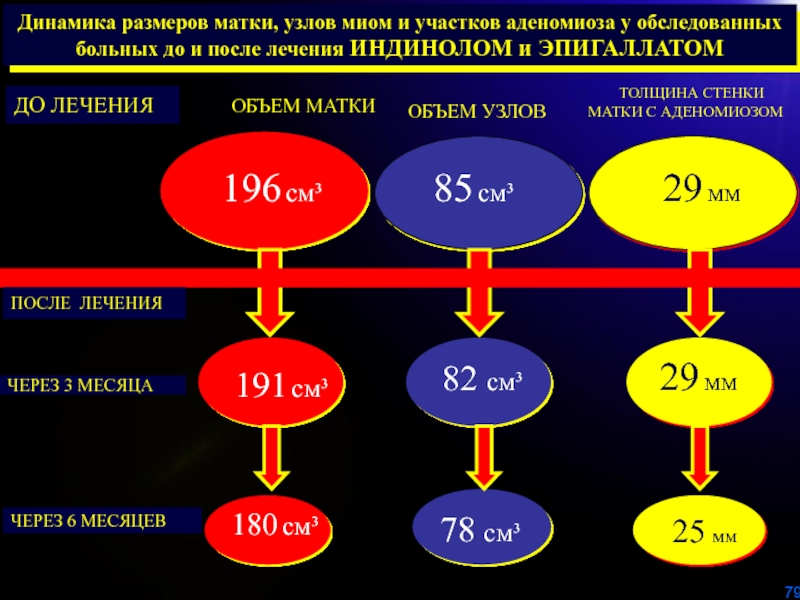
Слайд 79Динамика размеров матки, узлов миом и участков аденомиоза у обследованных
больных до и после лечения ИНДИНОЛОМ и ЭПИГАЛЛАТОМ
ДО ЛЕЧЕНИЯ
ОБЪЕМ МАТКИ
ОБЪЕМ
УЗЛОВ ТОЛЩИНА СТЕНКИ
МАТКИ С АДЕНОМИОЗОМ
ПОСЛЕ ЛЕЧЕНИЯ
ЧЕРЕЗ 3 МЕСЯЦА
ЧЕРЕЗ 6 МЕСЯЦЕВ
196 см³
191 см³
180 см³
85 см³
29 мм
82 см³
78 см³
29 мм
25 мм
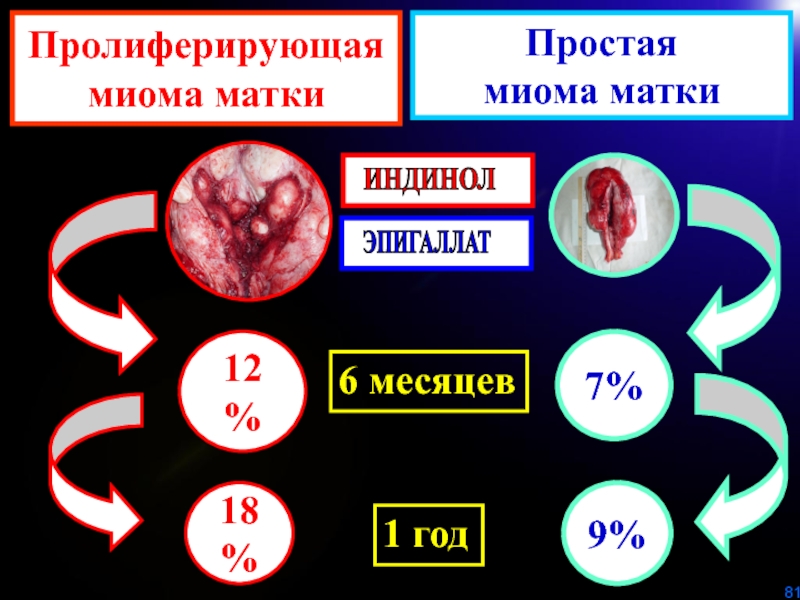
Слайд 80Степень уменьшения размеров (%) миоматозных узлов (диаметр до 4 см)
в зависимости от морфотипа после лечения Индинолом и Эпигаллатом.
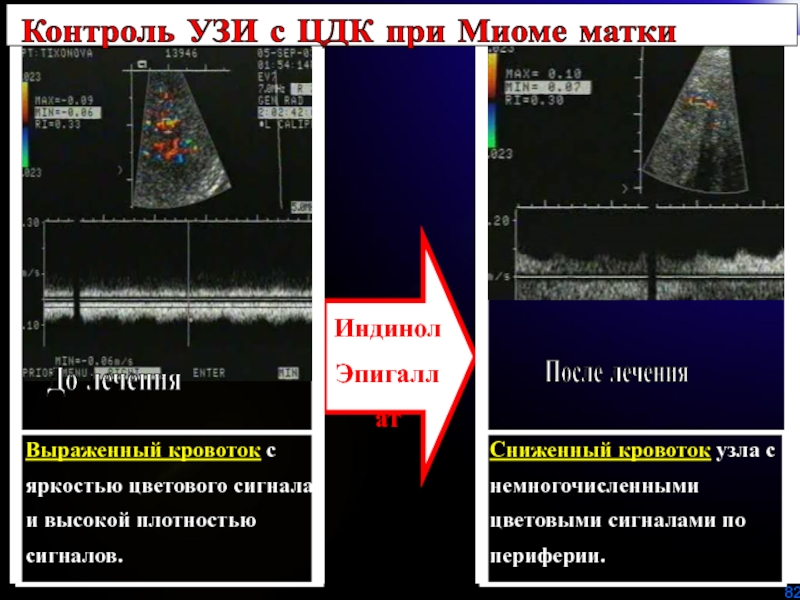
Слайд 82Сниженный кровоток узла с немногочисленными цветовыми сигналами по периферии.
Выраженный кровоток
с яркостью цветового сигнала и высокой плотностью сигналов.
Индинол
Эпигаллат
После
леченияКонтроль УЗИ с ЦДК при Миоме матки
До лечения
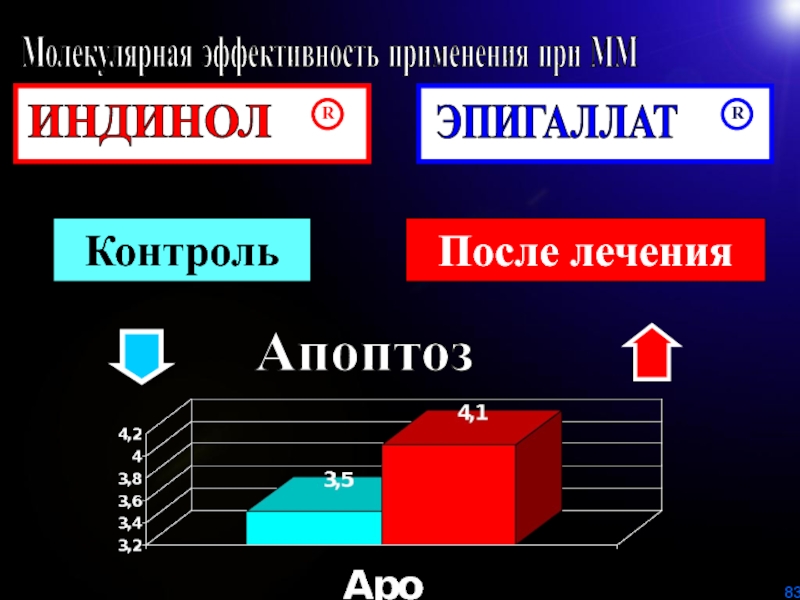
Слайд 84Контроль
После лечения
Молекулярная эффективность применения при ММ
ИНДИНОЛ
R
ЭПИГАЛЛАТ
R
R
Пролиферация
?
Слайд 85Контроль
После лечения
Молекулярная эффективность применения при ММ
ИНДИНОЛ
R
ЭПИГАЛЛАТ
R
R
Неоангиогенез
Слайд 86Контроль
После лечения
Молекулярная эффективность применения при ММ
ИНДИНОЛ
R
ЭПИГАЛЛАТ
R
R
Факторы роста
Слайд 87 Во всех случаях миомы матки,
при отсутствии показаний к оперативному лечению.
При профилактике рецидивирования и роста узлов после миомэктомии.Применение Индинола и Эпигаллата целесообразно: