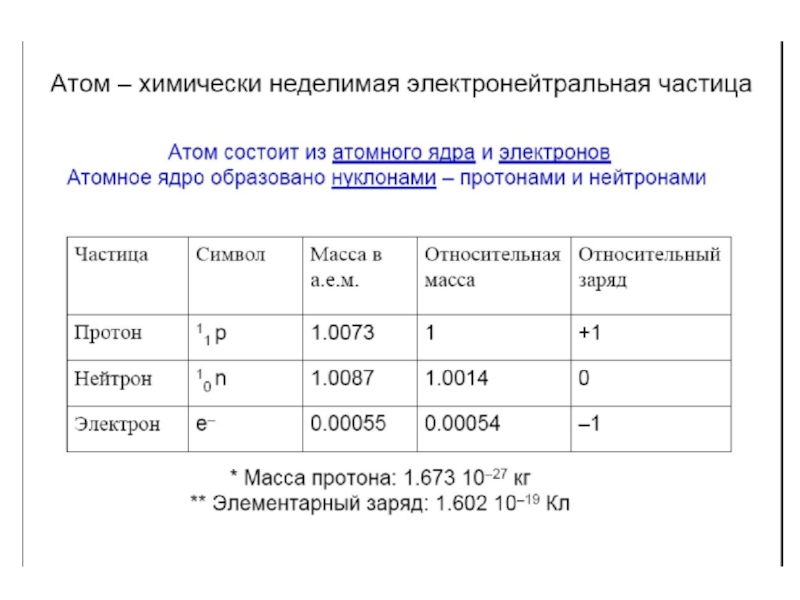
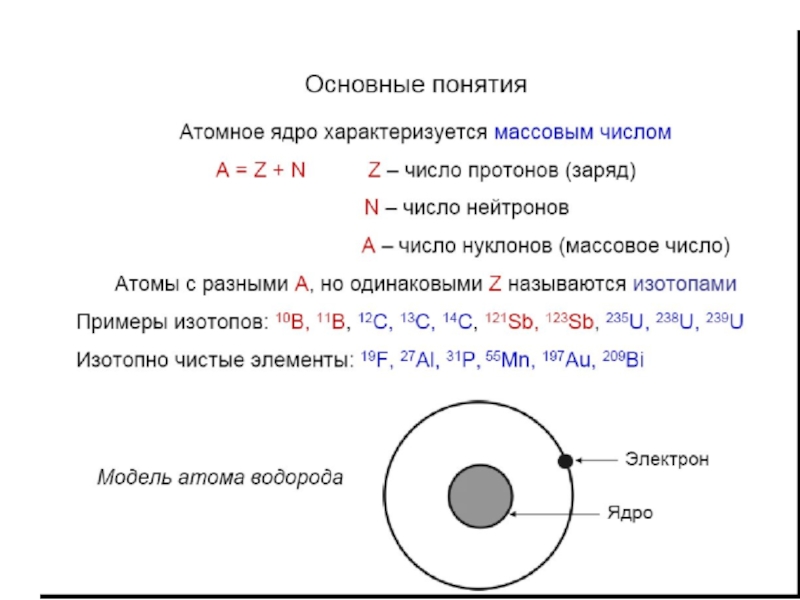
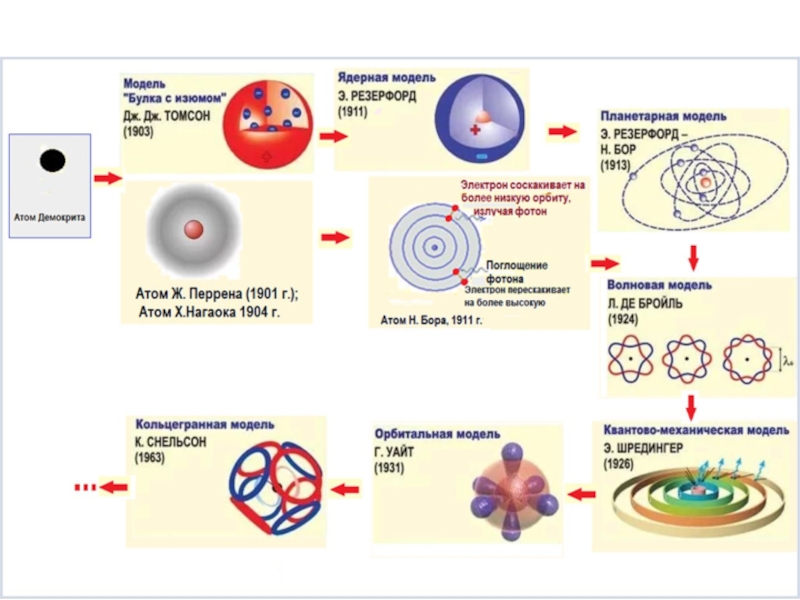
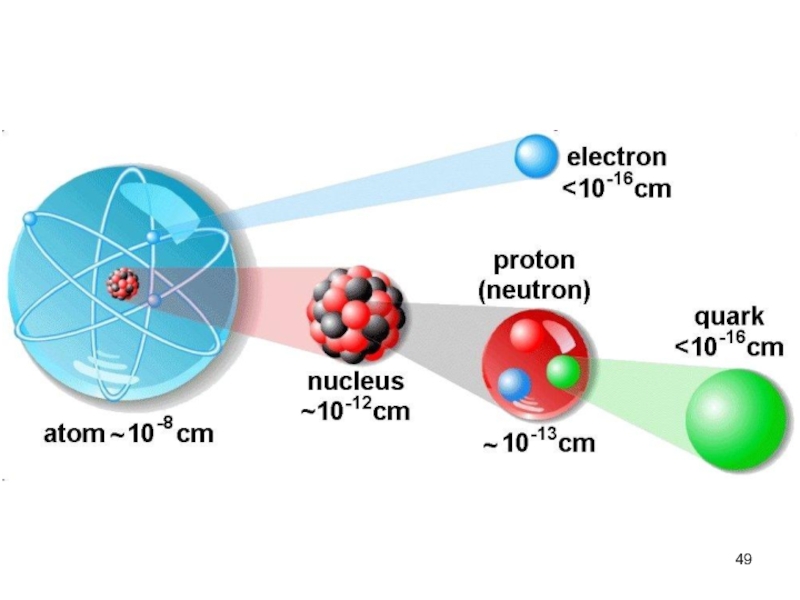
Слайд 4Одним из основных понятий химии и других естественных наук является
атом (греч.ατομοζ – неделимый). Этот термин имеет давнее происхождение; он
насчитывает уже около 2500 лет. Впервые понятие атома зародилось в Древней Греции, примерно в V в. до н. э. Основоположниками атомистического учения были древнегреческие философы Левкипп и его ученик Демокрит. Именно они выдвинули идею о дискретном строении материи и ввели термин «АТОМ». Демокрит определял атом как наименьшую, далее неделимую, частицу материи.
Левкипп
Демокрит
История развития атомно-молекулярного учения
Слайд 5Французский ученый Пьер Гассенди ввел понятие о молекуле, под которой
он понимал качественно новое образование, составленное путем соединения нескольких атомов.
По
мысли английского ученого Р. Бойля, мир корпускул (частиц, молекул), их движение и «сплетение» очень сложны. Мир в целом и его мельчайшие части – это целесообразно устроенные механизмы.
Великий русский ученый М. В. Ломоносов развил и обосновал учение о материальных атомах и корпускулах. Он приписывал атомам не только неделимость, но и активное начало – способность к движению и взаимодействию.
Английский ученый Дж. Дальтон (1808 г.) рассматривал атом как мельчайшую неделимую частицу химического элемента, отличающуюся от атомов других элементов прежде всего массой.
Большой вклад в атомно-молекулярное учение внесли французский ученый Ж. Гей-Люссак, итальянский ученый А. Авогадро, русский ученый Д. И. Менделеев..
XIX век
Слайд 6В1860 году в г. Карлсруэ состоялся международный конгресс химиков. Благодаря
усилиям итальянского ученого С. Канниццаро были приняты следующие определения атома
и молекулы:
молекула – «количество тела, вступающее в реакции и определяющее химические свойства»;
атом – «наименьшее количество элемента, входящее в частицы (молекулы) соединений. Установленные С. Канниццаро атомные массы элементов послужили Д. И.Менделееву основной при открытии периодического закона.
Слайд 7Долгое время атом считался неделимым. Открытие электрона Дж.Дж.Томсоном (1897 г.),
открытие и исследование радиоактивности (А.Беккерель, М.Склодовская-Кюри, П.Кюри 1896-1899 г.), показали,
что атом имеет сложное строение и неделим лишь в химическом отношении.
Первая гипотеза строения атома предложена английским учёным Томсоном (1903 г.) так называемая статическая или электронно-ионная теория, согласно которой атом состоит из положительно заряженной сферы, в которую вкраплены отрицательные электроны (можно для простоты представить булка с изюмом, где вся масса заряжена положительно, а изюминки − это электроны).
Слайд 8В 1904 г. японский физик Хантаро Нагаока предложил модель
“сатурноподобного” атома:
атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из
большого числа электронов,
колебания частиц в плоскости колец должны сопровождаться изменением их устойчивых состояний и испусканием атомных спектров, по аналогии с теорией устойчивости колец Сатурна, разработанной Максвеллом (1856).
Слайд 9
Факт выделения электронов самыми разнообразными веществами приводил к выводу, что
электроны входят в состав всех атомов. Но атом, как известно,
электрически нейтрален, из этого следовало, что в его состав должна была входить ещё одна составная часть, уравновешивавшая сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Резерфордом при исследовании движения α-частиц в газах и других веществах
Резерфорд Эрнест
(1871-1937)
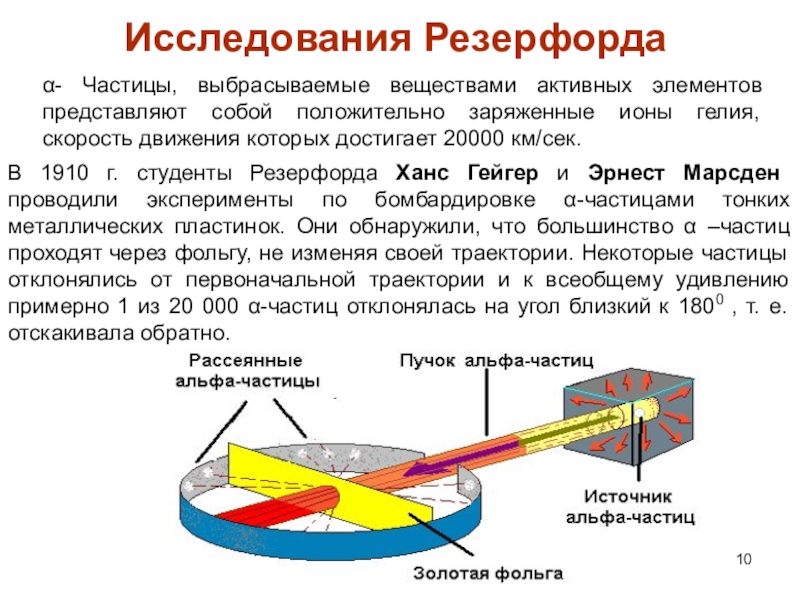
Слайд 10α- Частицы, выбрасываемые веществами активных элементов представляют собой положительно заряженные
ионы гелия, скорость движения которых достигает 20000 км/сек.
Исследования Резерфорда
В
1910 г. студенты Резерфорда Ханс Гейгер и Эрнест Марсден проводили эксперименты по бомбардировке α-частицами тонких металлических пластинок. Они обнаружили, что большинство α –частиц проходят через фольгу, не изменяя своей траектории. Некоторые частицы отклонялись от первоначальной траектории и к всеобщему удивлению примерно 1 из 20 000 α-частиц отклонялась на угол близкий к 1800 , т. е. отскакивала обратно.
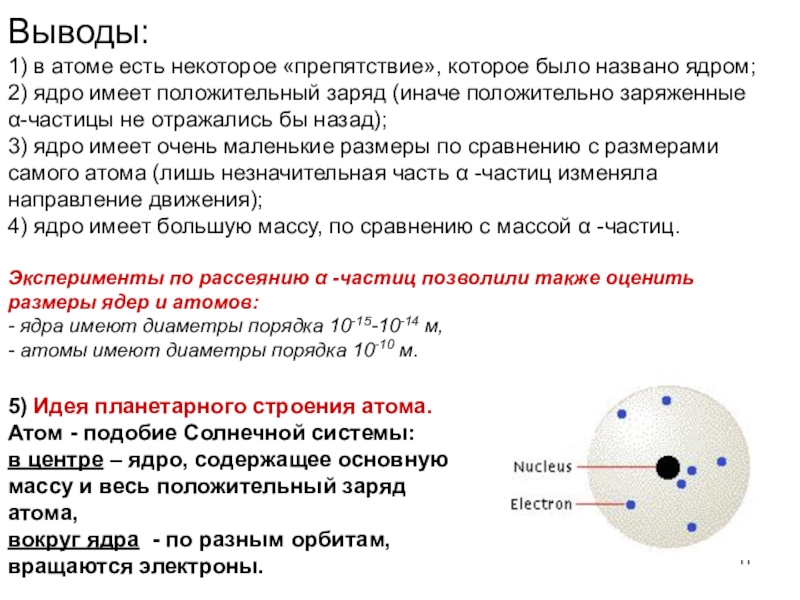
Слайд 11Выводы:
1) в атоме есть некоторое «препятствие», которое было названо ядром;
2)
ядро имеет положительный заряд (иначе положительно заряженные
α-частицы не отражались бы
назад);
3) ядро имеет очень маленькие размеры по сравнению с размерами самого атома (лишь незначительная часть α -частиц изменяла направление движения);
4) ядро имеет большую массу, по сравнению с массой α -частиц.
Эксперименты по рассеянию α -частиц позволили также оценить
размеры ядер и атомов:
- ядра имеют диаметры порядка 10-15-10-14 м,
- атомы имеют диаметры порядка 10-10 м.
5) Идея планетарного строения атома.
Атом - подобие Солнечной системы:
в центре – ядро, содержащее основную массу и весь положительный заряд атома,
вокруг ядра - по разным орбитам, вращаются электроны.
Слайд 12ВСЕГО ЭТОГО МОГЛО БЫ И НЕ БЫТЬ
Предположим, что в начале
XX века Э.Резерфорд (1871-1937) и его молодые сотрудники Ганс Вильгельм
Гейгер (1882-1945) и Эрнест Марсден (1889-1970) использовали для своих экспериментов с рассеянием α-частиц компьютеризированную установку.
+ Она легко воспроизвела бы основной результат, что наиболее вероятный угол рассеяния α-частиц на золотой фольге толщиной 4*10–5 см составляет 0,870.
- Для тех же чрезвычайно редких (1 из 20000 измерений) случаев рассеяния на угол более 900 согласно центральной предельной теореме теории вероятностей достоверность эксперимента составляет 3*10–2174
(это не опечатка!)
СОВРЕМЕННЫЙ компьютер со стандартной программой без малейшего
сомнения отбросил бы такие “случайные ошибки”.
И осталась бы наука без планетарной модели атома, по крайней мере на несколько десятков лет.
!!!! Только великолепная интуиция Резерфорда позволила ему сделать вывод, что чрезвычайно редкие “случайные” результаты истинны, и на их основе изменить физическую модель атома (вместо “пудинга с изюмом”
Дж.Томсона (1856-1940) подобие солнечной системы).

Слайд 13Но характер движения электрона по орбите вокруг ядра атома противоречит
законам электродинамики:
1) Заряженная частица, движущаяся с ускорением (а электрон в
атоме движется с центростремительным ускорением), должна излучать энергию. При этом потеря энергии должна приводить к уменьшению радиуса орбиты и падению электрона на ядро.
2) Непрерывное изменение траектории электрона должно способствовать и непрерывному изменению частоты излучения и, следовательно, непрерывному спектру испускания. Но эксперименты показывали, что спектр испускания водорода, а также других атомов, находящихся в газообразном состоянии, состоит из нескольких полос, т. е. имеет дискретный характер.
Модель Резерфорда
"электронный рой" в пространстве вокруг ядра
Электрон движется по различным траекториям, в том числе и спиралевидным орбитам
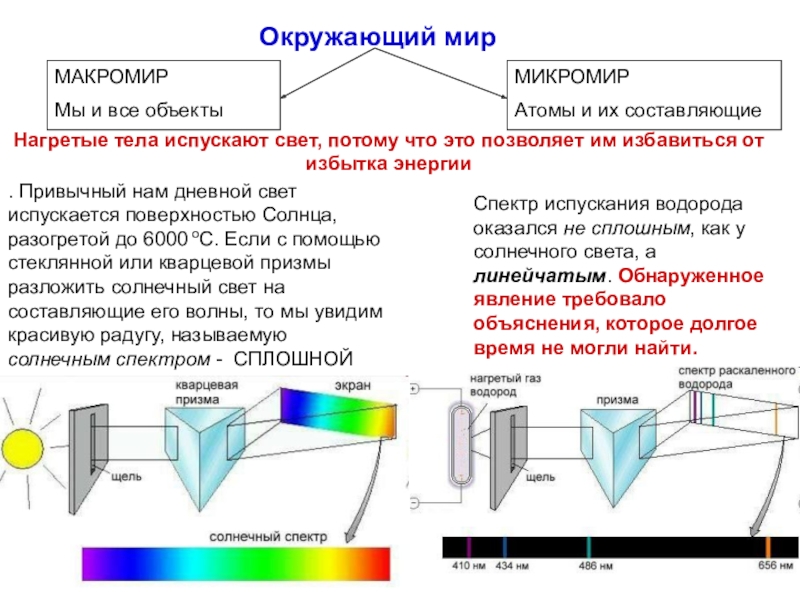
Слайд 14. Привычный нам дневной свет испускается поверхностью Солнца, разогретой до
6000 оС. Если с помощью стеклянной или кварцевой призмы разложить
солнечный свет на составляющие его волны, то мы увидим красивую радугу, называемую солнечным спектром - СПЛОШНОЙ
Спектр испускания водорода оказался не сплошным, как у солнечного света, а линейчатым. Обнаруженное явление требовало объяснения, которое долгое время не могли найти.
Нагретые тела испускают свет, потому что это позволяет им избавиться от избытка энергии
Слайд 151. Теория квантования энергии
М. Планк (1900 г.)
Берлинский профессор Макс Планк
в течение многих лет занимался этой проблемой. В конце концов
он пришел к выводу, что единственный выход – это предположить, что излучение света веществом происходит не непрерывно, а отдельными "элементарными" порциями энергии, которые рождаются колеблющимися атомами. Такие “порции” световой энергии называются квантами энергии.
Е = h
Е-энергия
ν – частота колебаний
h- постоянная Планка 6,626•10-34(Дж•c)
ТЕОРИИ И ЗАКОНЫ МИКРОМИРА
Слайд 162. Теория СТРОЕНИЯ АТОМА по Н. Бору
На основе квантовой теории
излучения и поглощения света, созданной Максом Планком и Альбертом Эйнштейном
ученик Резерфорда Нильс Бор в 1913 г., разработал квантовую модель атома.
При этом удалось объяснить и рассчитать теоретически линейчатые спектры испускания атомов водорода, а также серии линий в рентгеновских спектрах элементов.
Основа расчетов : простая формула для расчета частот линий испускания водорода в видимой области:
n = R(1/k2 – 1/n2 )
где n – частота, R – постоянная [3,29*1015 гц ],
k = 2; n = 1,2,3,...
предложена швейцарским школьным учителем и одновременно доктором Базельского университета Иоганом Бальмером
Слайд 17Бор выдвинул предположение, что:
атом водорода (система протон-электрон) может находиться
только в определенных стационарных энергетических состояниях (электрон – на определенных
орбитах), причем одно из них соответствует минимуму энергии и является основным (невозбужденным).
Испускание или поглощение атомом энергии может происходить, согласно теории Бора, только при переходах электрона из одного энергетического состояния в другое (с одной орбиты на другую).
При этом Бор предсказал существование серии линий испускания в ультрафиолетовой области (k = 1), которые затем были обнаружены в 1915 г. Теодором Лайманом.
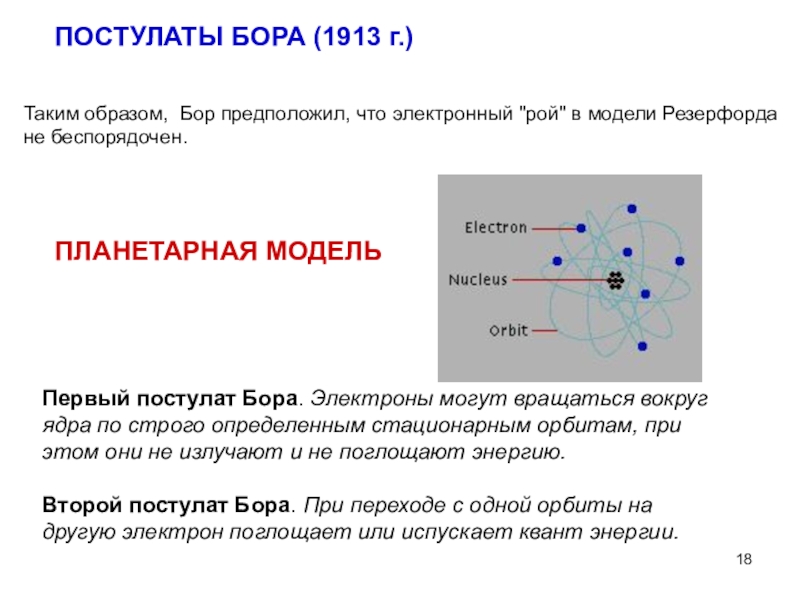
Слайд 18Таким образом, Бор предположил, что электронный "рой" в модели Резерфорда
не беспорядочен.
ПОСТУЛАТЫ БОРА (1913 г.)
Первый постулат Бора. Электроны могут
вращаться вокруг ядра по строго определенным стационарным орбитам, при этом они не излучают и не поглощают энергию.
Второй постулат Бора. При переходе с одной орбиты на другую электрон поглощает или испускает квант энергии.
ПЛАНЕТАРНАЯ МОДЕЛЬ
Слайд 19В теории Бора впервые искусственно было введено главное квантовое число
n, значение которого определяет энергию электрона в атоме
С ее позиций
нельзя было описать поведение атома водорода в магнитном поле.
Не удается также объяснить образование молекулы водорода
Невозможно описать многоэлектронные атомы.
Для систем, содержащих более одного электрона, например атома гелия, теория Бора уже не давала точных значений спектральных линий
!
НЕДОСТАТКИ ТЕОРИИ БОРА:
Слайд 20Законы, которые описывают явления, происходящие в микромире, существенно отличаются от
законов, описывающих поведение макротел.
Корпускулярно-волновые свойства микромира
В 1924 г.
французский физик де Бройль исходя из представления о двойственной природе микромира, предположил, что электрон, как и другие частицы микромира обладает корпускулярно-волновой (от лат. corpusculum – частица) двойственностью, т.е. частице с массой m, движущейся со скоростью v, соответствует движение волны длиной
λ = h/mv.
Электрон как частица обладает массой (9,1∙10-31 кг) и зарядом.
Электрону как волне присущи волновые явления дифракции (способность электронной волны огибать препятствие).
1.Принцип корпускулярно-волнового дуализма
Слайд 22
2. Принцип неопределенности Гейзенберга
Принцип неопределённости означает, что движение микрочастиц
нельзя характеризовать траекторией как точной линией, а движение электрона нельзя
рассматривать как движение точечного заряда (пули) по определённой замкнутой траектории-орбите.
Принцип неопределённости Гейзенберга (1927):
невозможно одновременно точно измерить скорость и положение (координаты) электрона.
Слайд 23Для тел атомного масштаба нельзя указать одновременно их точное положение
в пространстве и направление движения.
Можно указать только вероятность нахождения
электрона в определенном положении в любой момент времени.
Электронное облако −
это квантовомеханическая модель электрона в атоме.
Схема строения атома водорода
Орбиталь − это та часть пространства атома, где наиболее вероятно нахождение электрона в атоме.
Максимальная электронная плотность находится на расстоянии 0,53А (0,053нм), здесь наиболее вероятно нахождение движущегося электрона. По современным представлениям, ядро атома водорода окружено электронным облаком, т.е. электрон находится на атомной орбитали (АО).
Слайд 24В 1926 г. Шредингер предложил уравнение, в которое для описания
поведения электрона в атоме была введена волновая функция ψ. Для
одноэлектронного атома водорода уравнение Шредингера может быть выражено так:
где E – полная энергия электрона,
U – потенциальная энергия электрона,
m – волновая функция,
h – постоянная Планка,
ψ 2 – оператор Гамильтона.
Уравнение Шредингера точно решается для водорода и водородоподобных атомов (т. е. для систем, состоящих из ядра и одного электрона).
3. Уравнение Шредингера
Слайд 25Физический смысл волновой функции определить трудно, а вот квадрат модуля
ее |ψ| 2 определяет вероятность нахождения электрона в данной области
пространства.
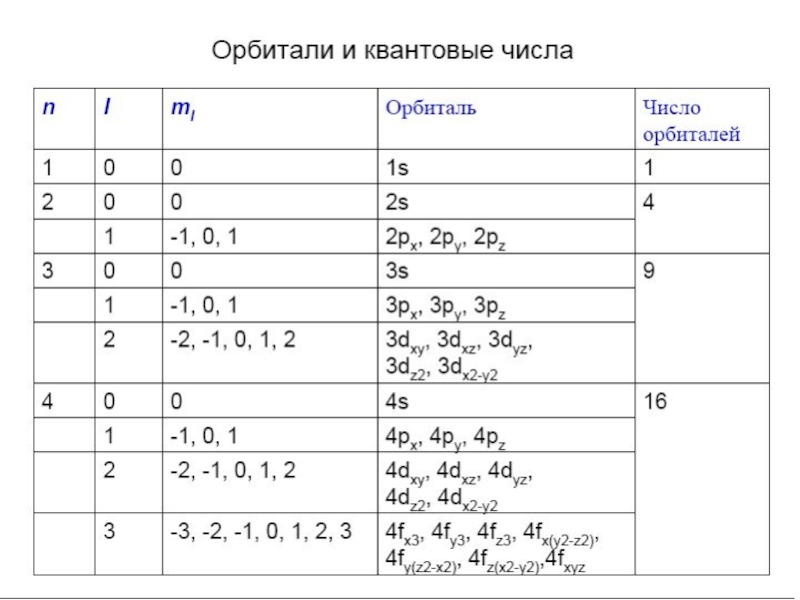
Слайд 26Уравнение Шредингера - трехмерно. Соответственно - три набора квантовых чисел.
Каждой координате свое квантовое число.
Размер, энергия, форма и ориентация электронного
облака изменяются в атоме скачками (квантами)
Слайд 27l
l
Состояние электрона, соответствующее определенному значению l, называется энергетическим подуровнем.
КВАНТОВЫЕ ЧИСЛА
Слайд 28Например,
n = 1 l = 0s
n = 2
l = 0s, 1p
n = 3
l = 0s, 1p, 2d
n = 4 l = 0s, 1p, 2d, 3 f
Орбитальное квантовое число определяет энергию электрона на подуровне и форму электронного облака.
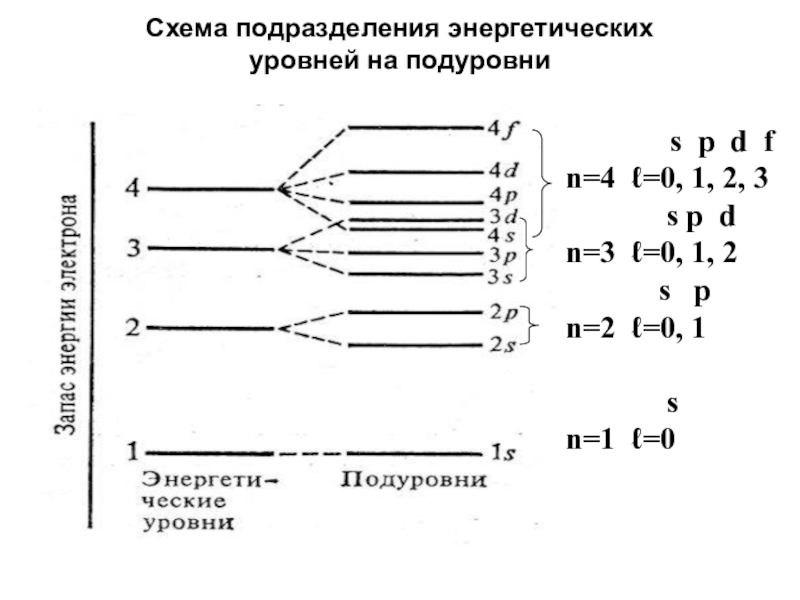
Энергетические уровни подразделяются на подуровни.
Число подуровней равно номеру уровня.
Принято:
l = 0 1 2 3 4
s p d f g
Слайд 29Схема подразделения энергетических уровней на подуровни
s p d f
n=4
ℓ=0, 1, 2, 3
s p d
n=3 ℓ=0, 1, 2
s p
n=2 ℓ=0, 1
s
n=1 ℓ=0
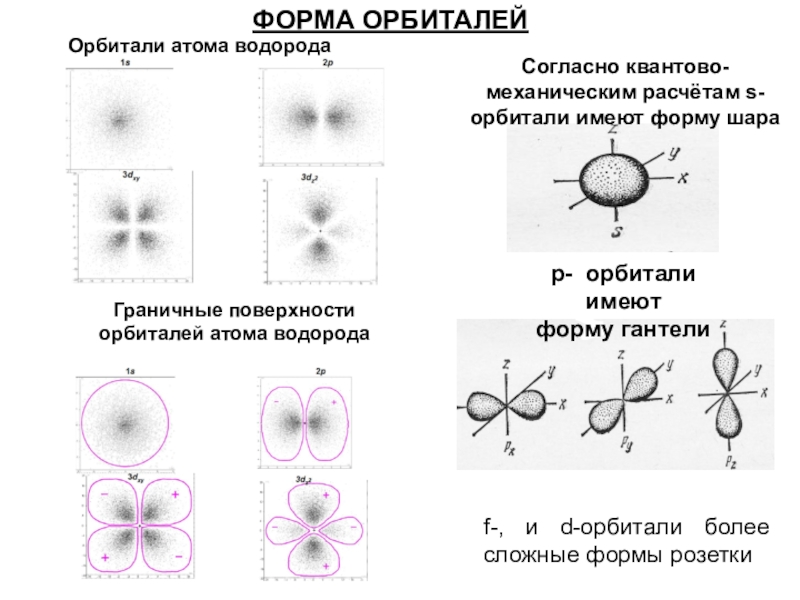
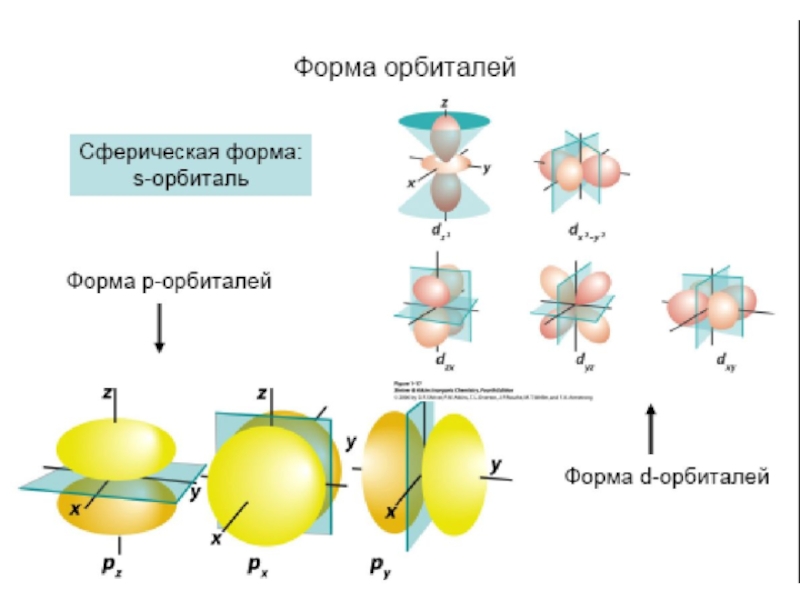
Слайд 31Согласно квантово-механическим расчётам s- орбитали имеют форму шара
p- орбитали имеют
форму гантели
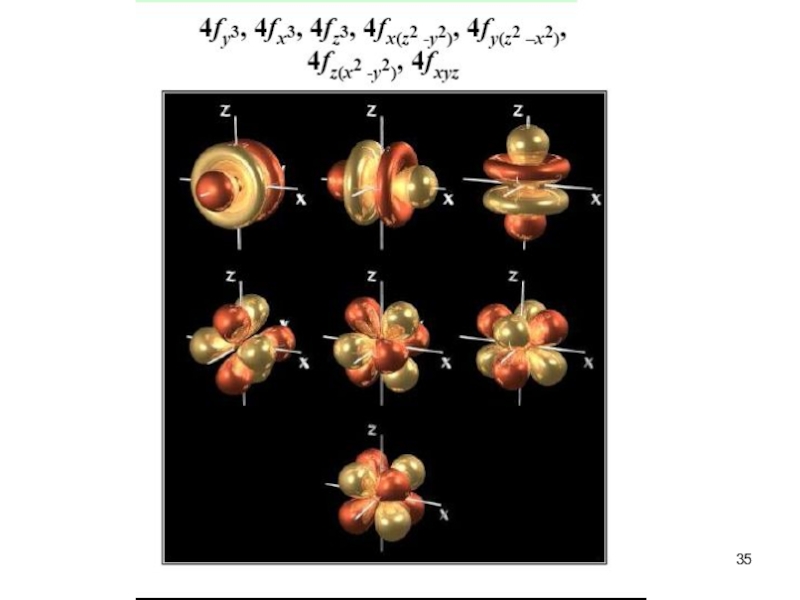
f-, и d-орбитали более сложные формы
розетки
ФОРМА ОРБИТАЛЕЙ
Орбитали атома водорода
Граничные поверхности
орбиталей атома водорода
Слайд 323. ml – магнитное квантовое число. При данном l ,
ml принимает значения всех целых чисел от –l через нуль
до +l.
Магнитное квантовое число определяет ориентацию электронного облака в пространстве.
Данному значению l соответствует (2l+1) способов расположения электронного облака в пространстве.
s (l=0) ml=0 одна орбиталь
p (l=1) ml=-1,0,1 три орбитали
d (l=2) ml=-2,-1,0,1,2 пять орбиталей
f (l=3) ml=-3,-2,-1,0,1,2,3 семь орбиталей
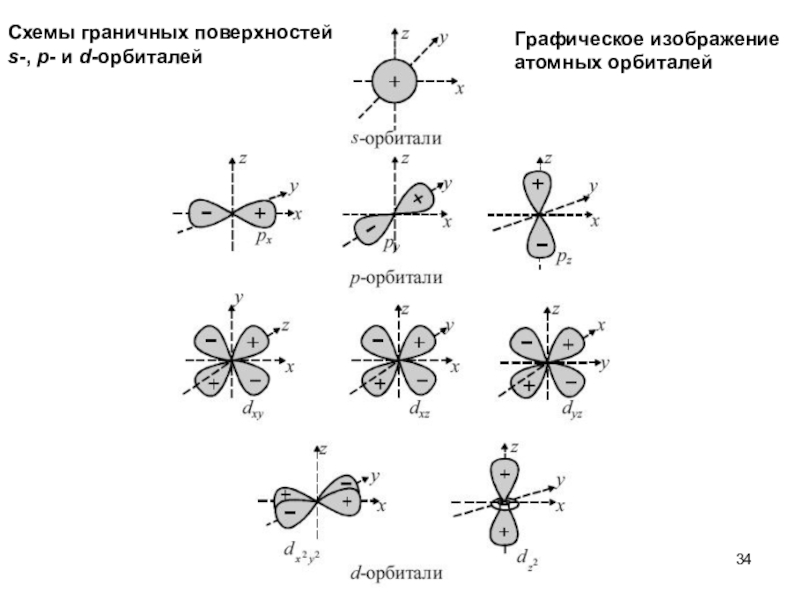
Слайд 34Схемы граничных поверхностей
s-, p- и d-орбиталей
Графическое изображение
атомных орбиталей
Слайд 374. ms – спиновое квантовое число.
спиновое квантовое число может иметь
только два значения:
+½ (↑) и -½(↓).
Изучение тонкой структуры атомных
спектров показало, что электроны в атомах отличаются еще одной характеристикой – собственным моментом количества движения, называемым спином
Уленбек и Гаудсмит показали, что особым движением электрона, которое только очень условно можно описать как движение вокруг собственной оси. Спин, как и другие характеристики движения микрочастиц, не имеет подлинных механических аналогий и принципиально не может быть связан с какой-либо наглядной моделью.
Вращение электрона вокруг своей оси следует понимать лишь в том смысле, что электрон имеет собственный момент.
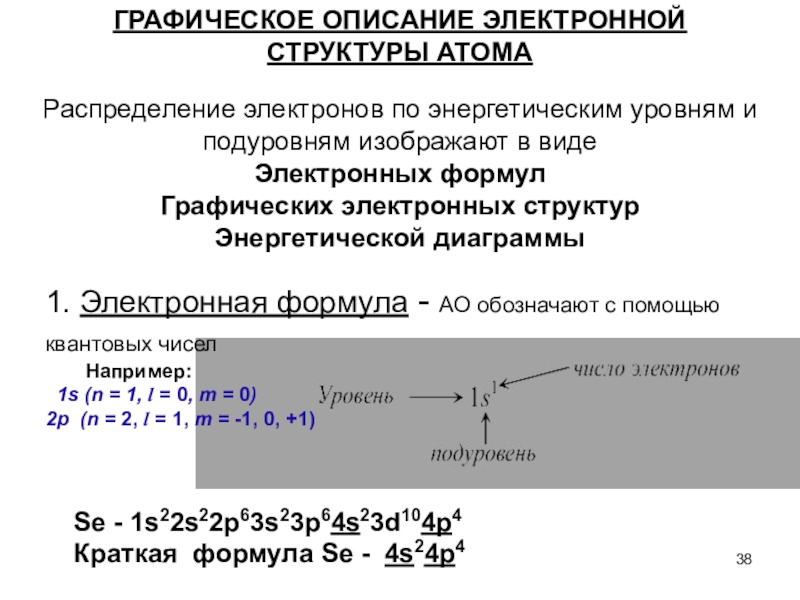
Слайд 38Распределение электронов по энергетическим уровням и подуровням изображают в виде
Электронных формул
Графических электронных структур
Энергетической диаграммы
ГРАФИЧЕСКОЕ ОПИСАНИЕ ЭЛЕКТРОННОЙ СТРУКТУРЫ АТОМА
1. Электронная
формула - АО обозначают с помощью квантовых чисел
Например:
1s (n = 1, l = 0, m = 0)
2p (n = 2, l = 1, m = -1, 0, +1)
Se - 1s22s22p63s23p64s23d104p4
Краткая формула Se - 4s24p4
Слайд 39Принцип наименьшей энергии
каждый электрон в атоме
занимает свободную орбиталь с наиболее низкой энергией. С ростом порядкового
номера элемента электроны заполняют орбитали и уровни в порядке возрастания их энергии
2. Принцип Паули
В атоме не существует двух электронов с одинаковым набором квантовых чисел
ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ
Максимальная емкость подуровня:
2(2l+1)
s-орбиталь (1 шт) 2(2×0+1) =2 электрона максимально
р-орбитали (3 шт) 2(2×1+1) = 6 электронов максимально
d-орбитали (5 шт) 2(2×2+1) =10 электронов максимально
f-орбитали (7 шт) 2(2×3+1) =14 электронов максимально
Максимальная емкость уровня:
2n2
1 уровень (s) =2×12= 2 электрона, 2 уровень( s+3p)= 2×22= 8 электронов…….
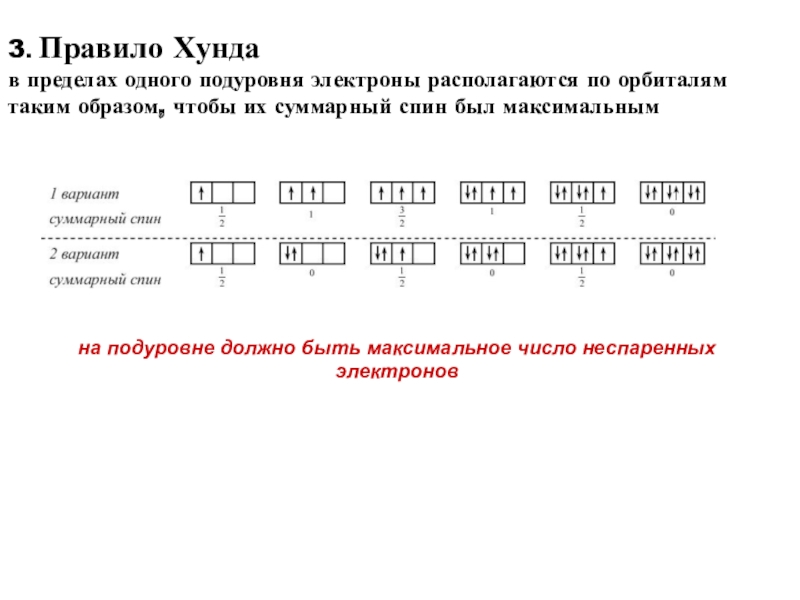
Слайд 403. Правило Хунда
в пределах одного подуровня электроны располагаются по
орбиталям таким образом, чтобы их суммарный спин был максимальным
на подуровне
должно быть максимальное число неспаренных электронов
Слайд 414. Правила Клечковского
Первое правило: при увеличении заряда ядра атома последовательное
заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы
главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы
Второе правило: при одинаковых значениях суммы (n+l) заполнение орбиталей происходит в порядке возрастания значений главного квантового числа n.
Графическое правило Клечковского
Слайд 42НЕ ПОДЧИНЯЮТСЯ ПРАВИЛАМ КЛЕЧКОВСКОГО
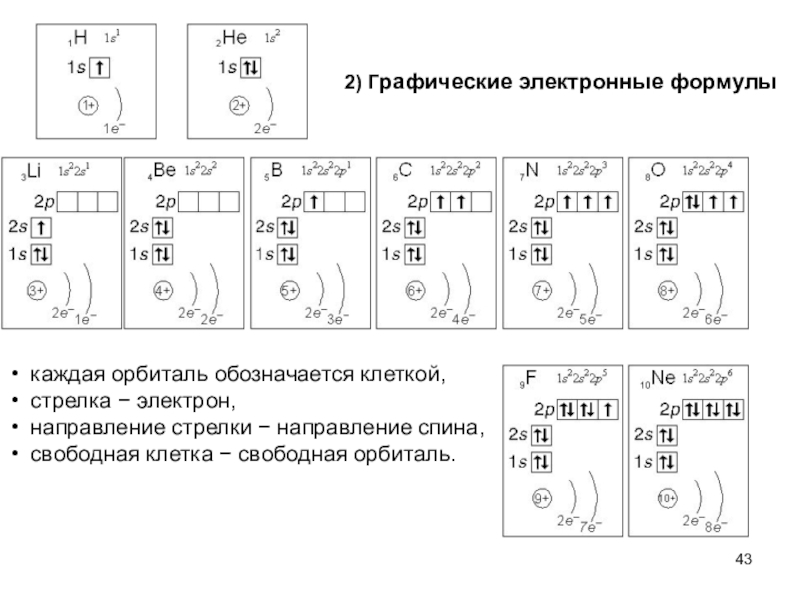
Слайд 432) Графические электронные формулы
каждая орбиталь обозначается клеткой,
стрелка − электрон,
направление
стрелки − направление спина,
свободная клетка − свободная орбиталь.
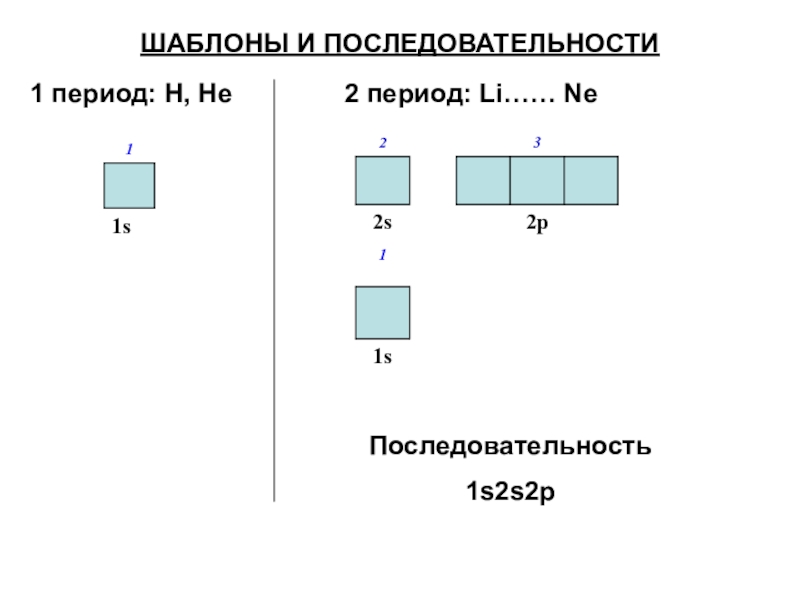
Слайд 44ШАБЛОНЫ И ПОСЛЕДОВАТЕЛЬНОСТИ
1 период: H, He
2 период: Li…… Ne
Последовательность
1s2s2p
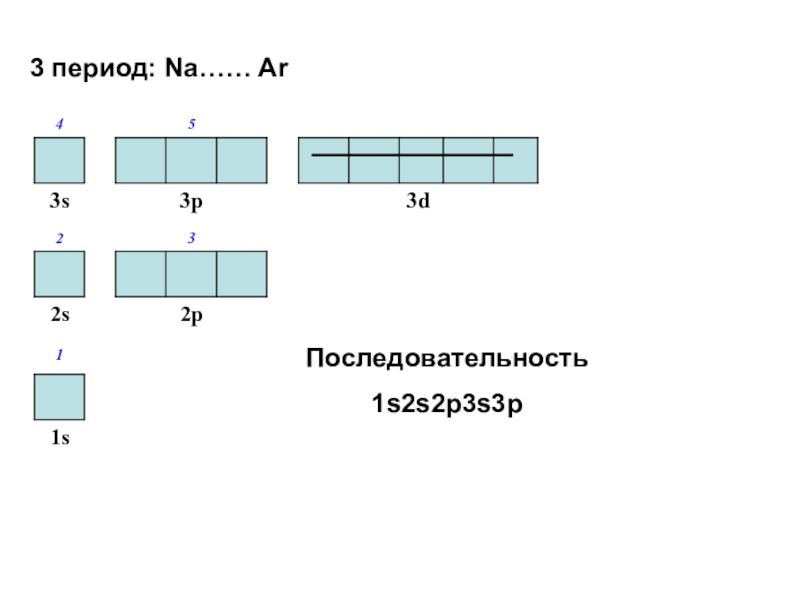
Слайд 453 период: Na…… Ar
Последовательность
1s2s2p3s3p
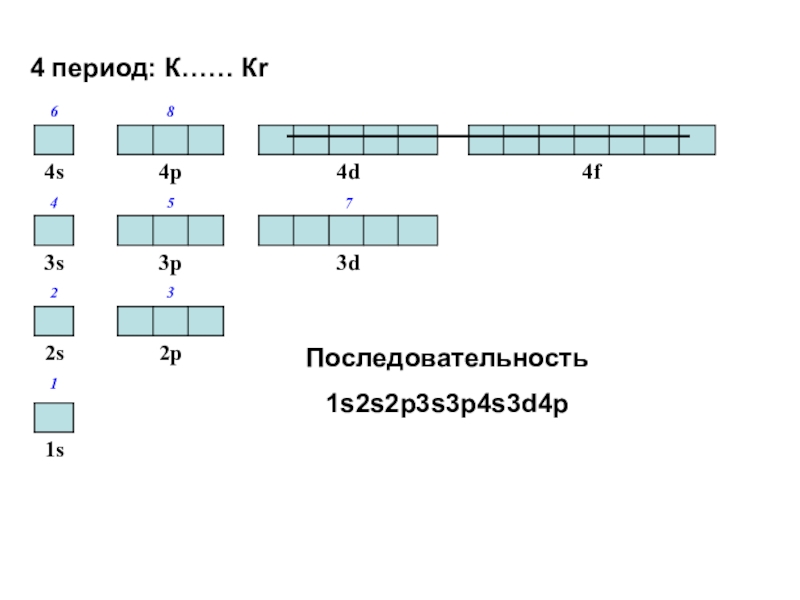
Слайд 464 период: К…… Кr
Последовательность
1s2s2p3s3p4s3d4p
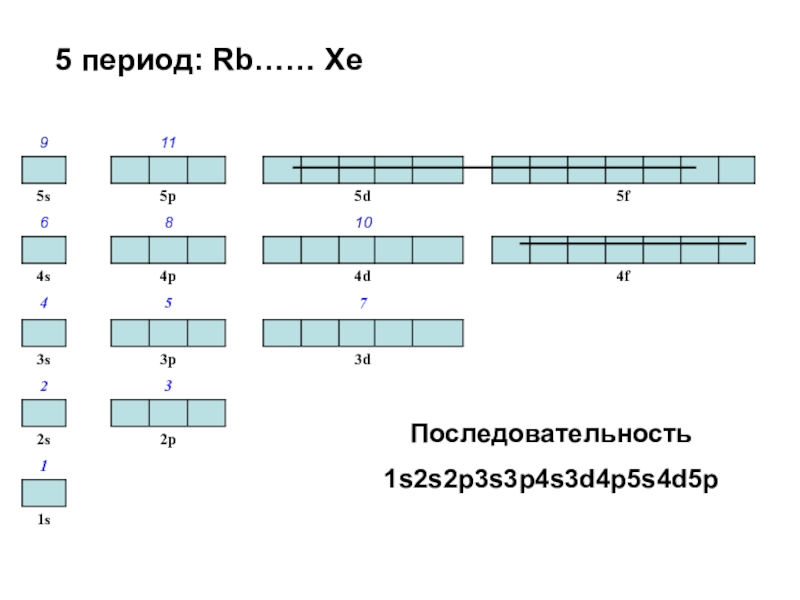
Слайд 475 период: Rb…… Xe
Последовательность
1s2s2p3s3p4s3d4p5s4d5p