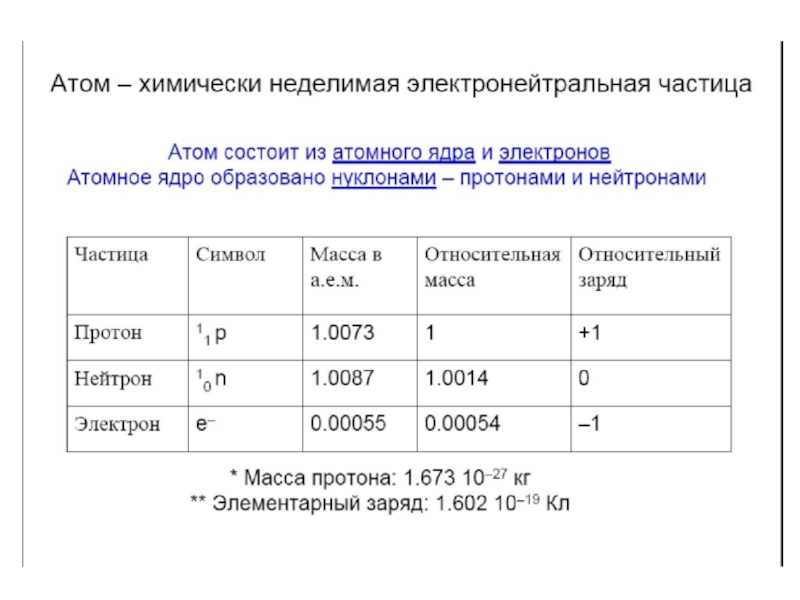
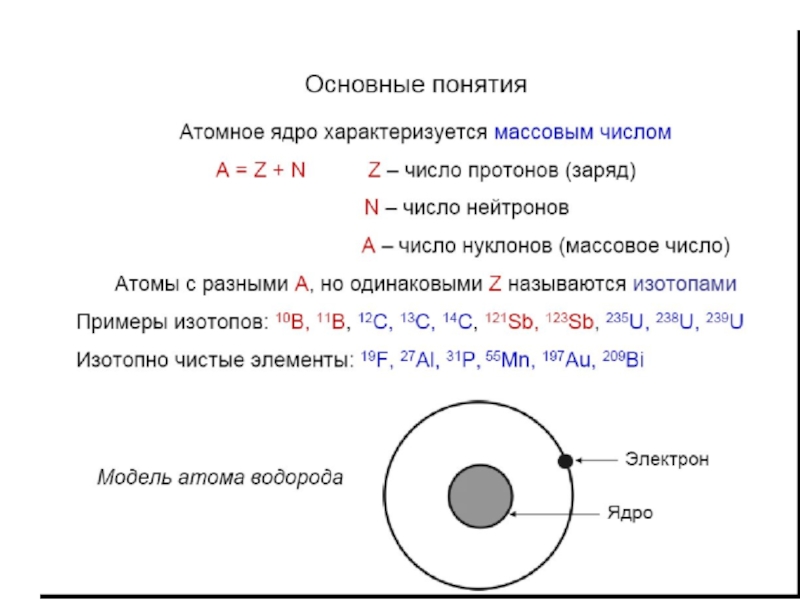
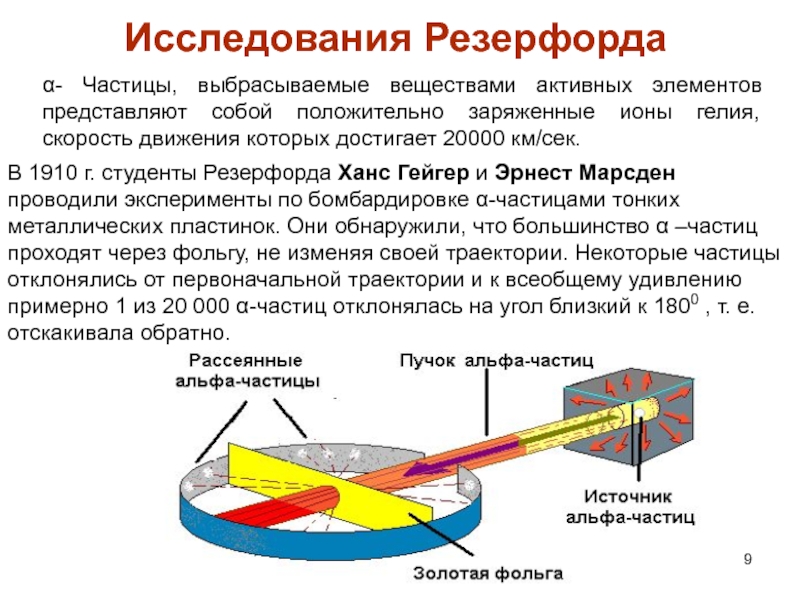
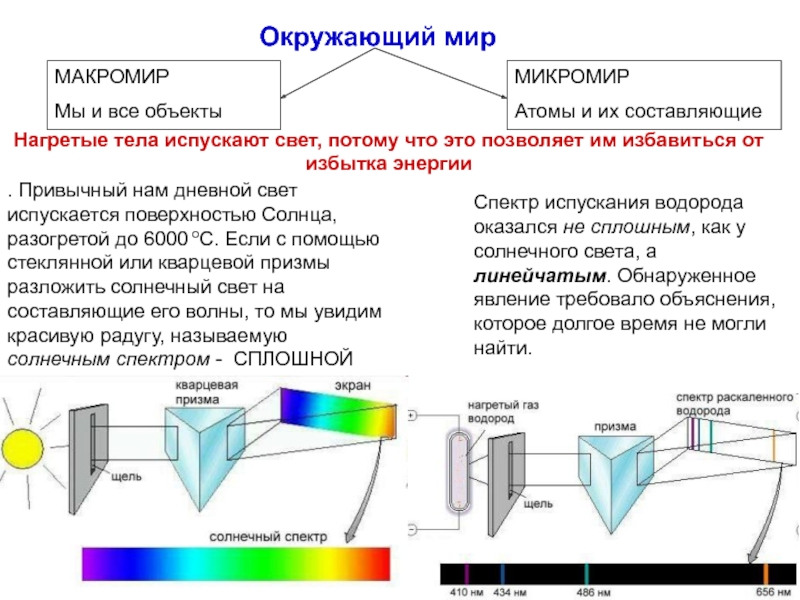
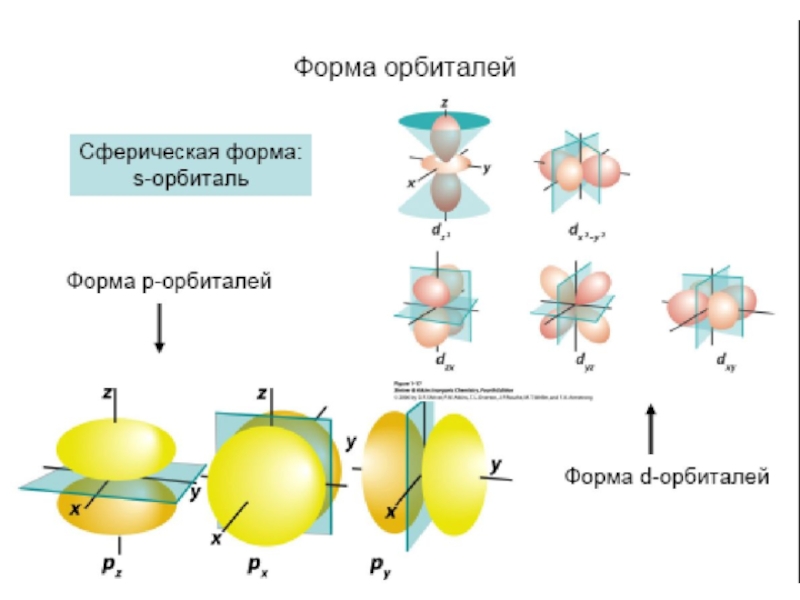
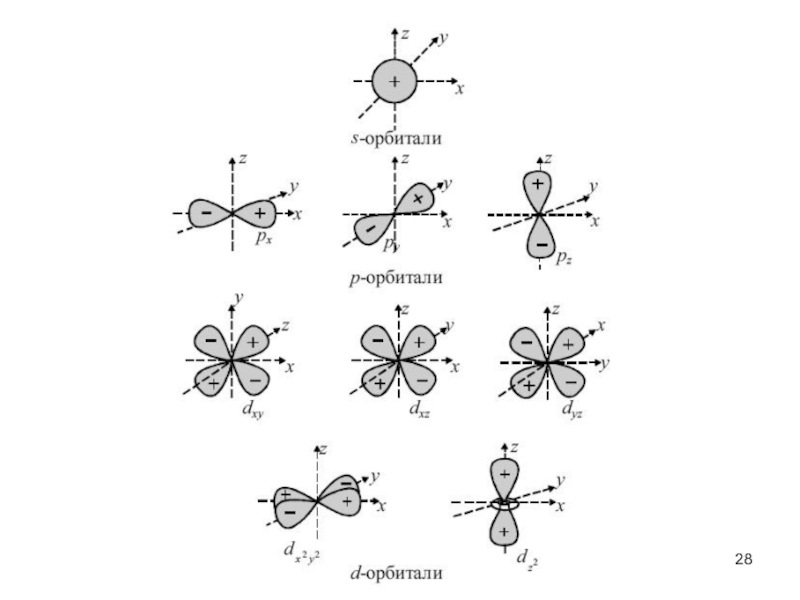
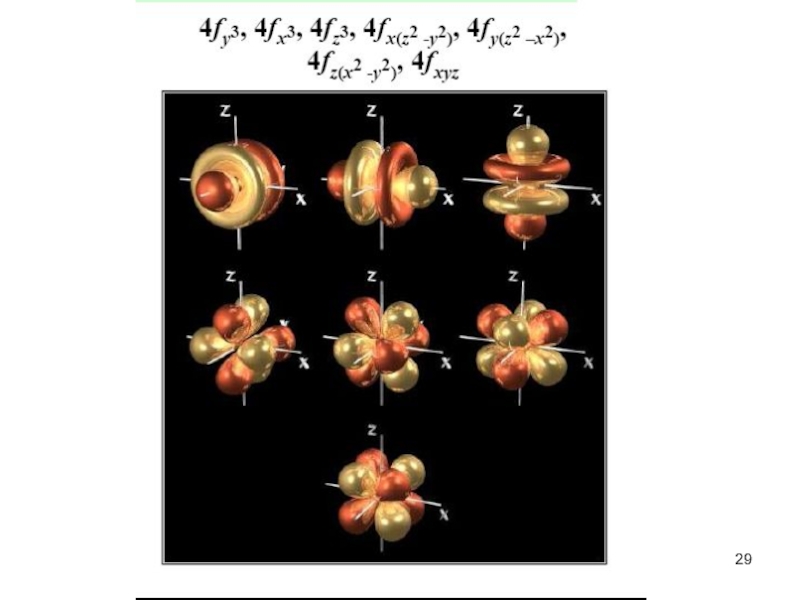
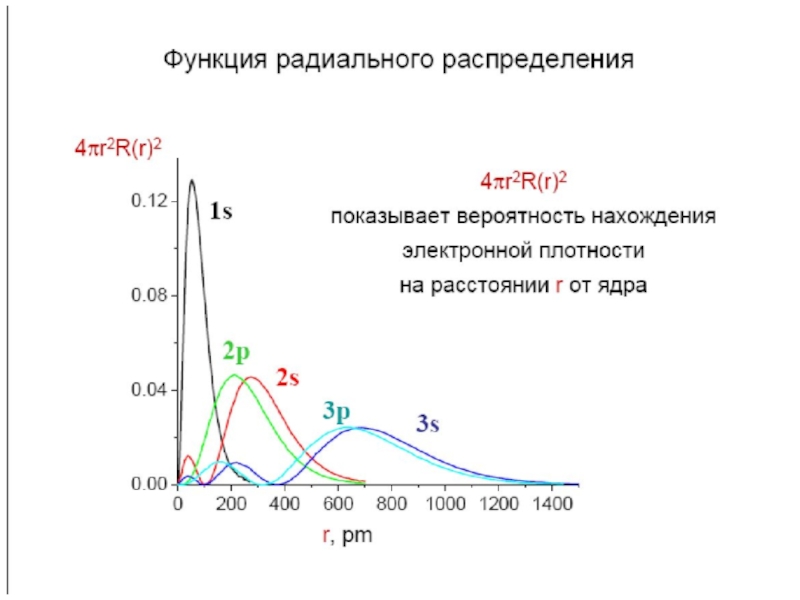
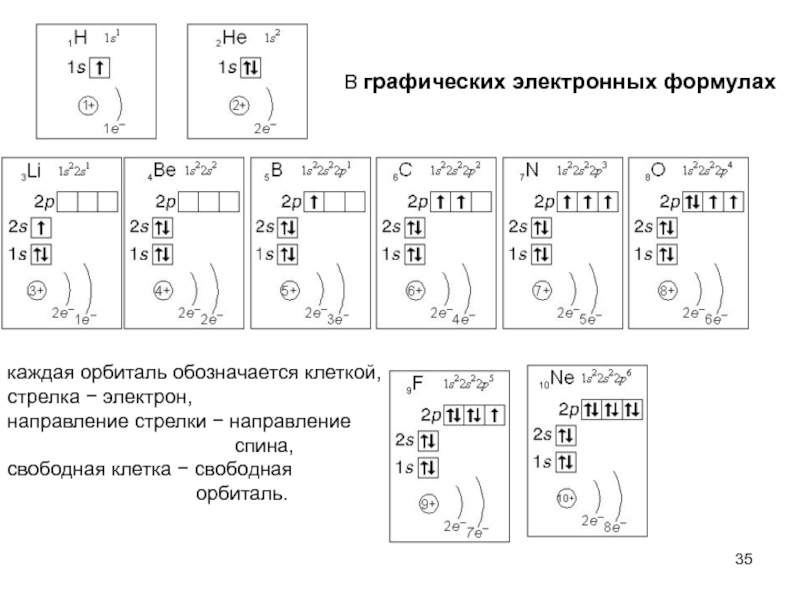
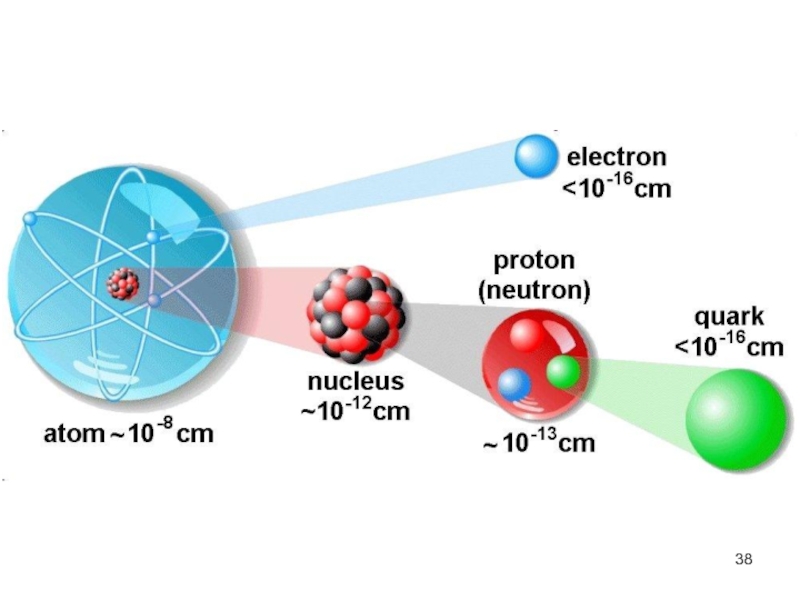
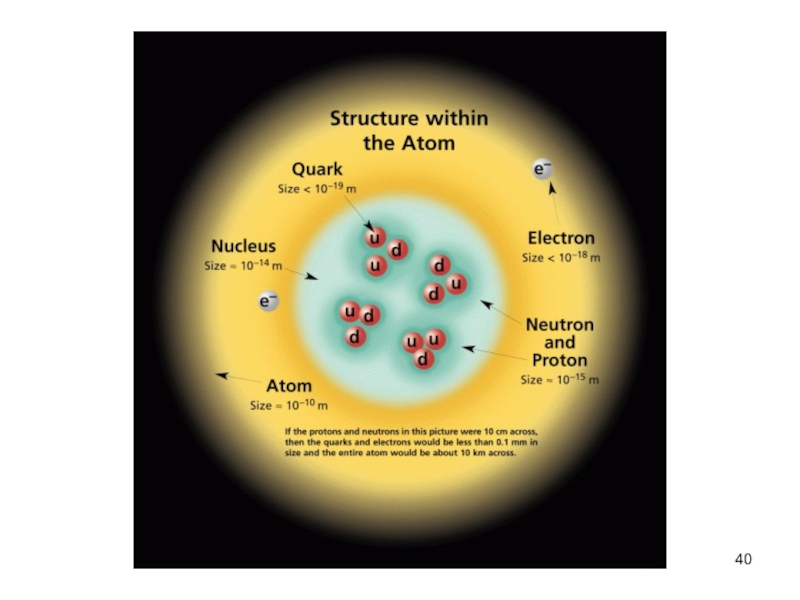
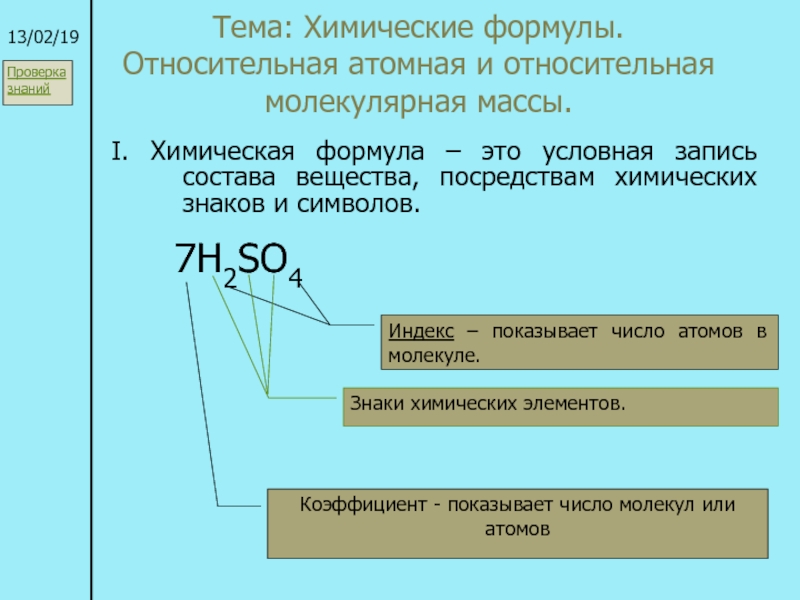
атом (греч.ατομοζ – неделимый). Этот термин имеет давнее происхождение; он
насчитывает уже около 2500 лет. Впервые понятие атома зародилось в Древней Греции, примерно в V в. до н. э. Основоположниками атомистического учения были древнегреческие философы Левкипп и его ученик Демокрит. Именно они выдвинули идею о дискретном строении материи и ввели термин «АТОМ». Демокрит определял атом как наименьшую, далее неделимую, частицу материи.Левкипп
Демокрит
История развития атомно-молекулярного учения