§29. Углерод
«Химическая история»
Основные характеристики
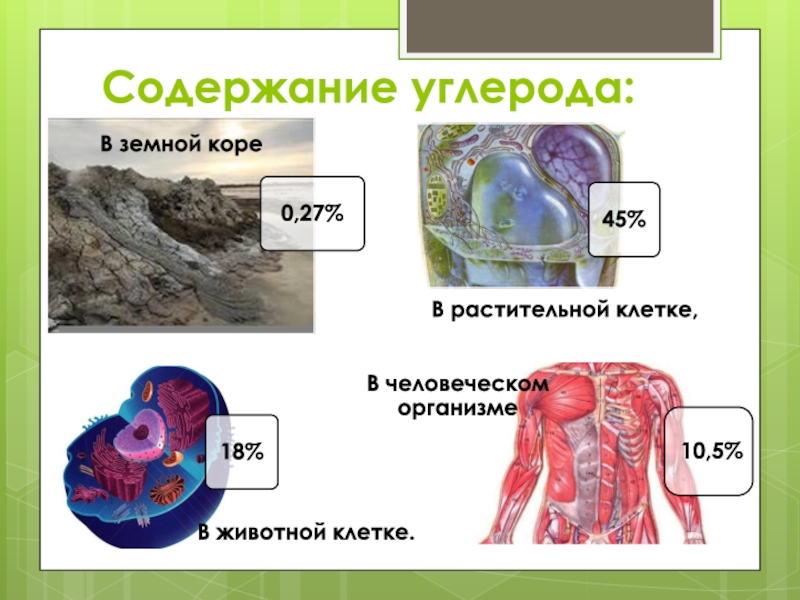
Содержание углерода
Физические свойства
Химические
свойства
Применение углерода С
Круговорот углерода в природе
Тест «Углерод»
Слайд 2«Химическая история»
Углерод является одним из первых химических элементов, который известен
человеку. 3750 г. до н.э.
Углерод является одним из элементов, имя
первооткрывателя которого неизвестно, неизвестно и то, какая из форм элементарного углерода – алмаз или графит – была открыта раньше. И то и другое случилось слишком давно, ещё до возникновения письма.
В 1791 г. английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокаленным мелом, в результате чего образовывался фосфат кальция и углерод.
Слайд 3«Химическая история»
Впервые название углерод (carbone) в книге Гитона де Морво,
Лавуазье, Бертолле и Фуркруа "Метод химической номенклатуры" (1787) .
Международное название
Carboneum происходит от лат. carbo (уголь).
Соединения углерода имеют в названии часть карб(он)- от лат. carbō (род. п. carbōnis) «уголь».
Слайд 4
Углеро́д — химический элемент 4-ой группы главной подгруппы 2-го
периода периодической системы Д. И. Менделеева
Слайд 5Основные характеристики
Имя, : Углерод / Carboneum
Символ, номер:(С) , 6
Электронная конфигурация:
[He] 2s2 2p2
Температура кипения: 4 827°C
Атомная масса: 12,0107 ± 0,0008 а.
е. м.
Степень окисления -4 , +2, +4
Слайд 7Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными
физическими свойствами.
Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Известны
четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит.
Слайд 8Графит
Графит - серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая
масса с металлическим блеском, обладает электропроводимостью
Атомы расположены параллельными слоями, образуя
гексагональную решетку.
Внутри слоя атомы связаны сильнее, чем один слой с другим, поэтому графит может расслаиваться.
Слайд 9Графит
Сгорает при 700оС в присутствии кислорода.
Встречается в природе;
получается искусственно.
При высокой температуре, давлении и присутствии катализатора
(марганец Mn, хром Cr, платиновые металлы) графит превращается в алмаз.
Слайд 10Алмаз
Алмаз - минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой
и черный цвет.
Не проводит электрический ток, но имеет высокую теплопроводность.
В кристалле атомы углерода образуют непрерывный трехмерный каркас, состоящий из сочлененных тетраэдров, что обеспечивает высокую прочность связей.
Слайд 11Алмаз
Алмаз - это самое твердое вещество из всех известных.
Температура
плавления выше 3500оС. Химически стоек. Сгорает при 870оС в присутствии
кислорода. При 1800оС в отсутствие кислорода превращается в графит.
Прозрачные кристаллы; после обработки - бриллианты.
Добывают из россыпей и коренных месторождений. Синтетический алмаз получают из графита при высоком давлении и температуре.
Слайд 12Карбин
Карбин получен искусственно.
Он представляет собой мелкокристаллический порошок чёрного цвета.
Построен из длинных цепочек атомов С, уложенных параллельно друг другу.
Слайд 13Лонсдейлит
Лонсдейлит найден в метеоритах и получен искусственно;
Его структура и
свойства окончательно не установлены.
Слайд 14Аллотропные модификации углерода
Кристаллический углерод
Алмаз
Графен
Графит
Карбин
Лонсдейлит
Наноалмаз
Фуллерены
Фуллерит
Углеродное волокно
Углеродные нановолокна
Углеродные нанотрубки
Аморфный углерод
Активированный уголь
Древесный уголь
Ископаемый
уголь: антрацит и др.
Кокс каменноугольный, нефтяной и др.
Стеклоуглерод
Техуглерод
Сажа
Углеродная нанопена
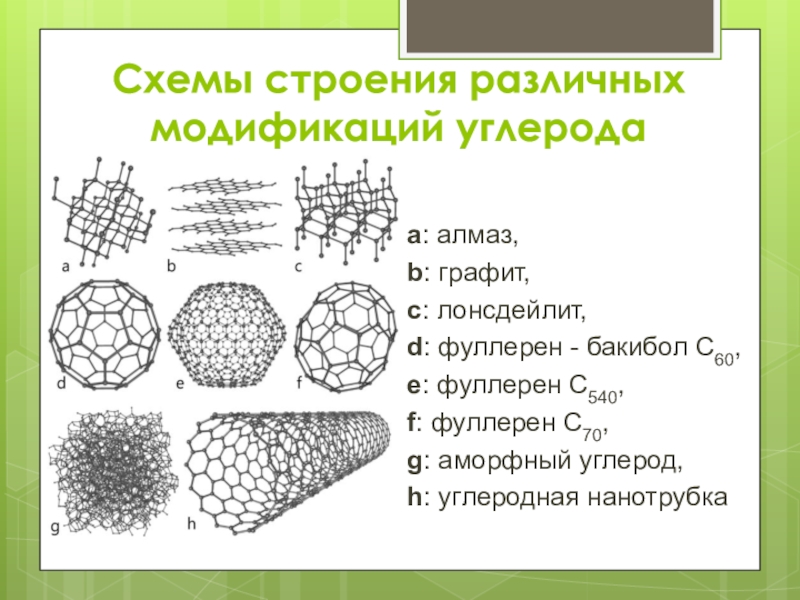
Слайд 15Схемы строения различных модификаций углерода
a: алмаз,
b: графит,
c: лонсдейлит,
d: фуллерен - бакибол C60,
e: фуллерен C540,
f: фуллерен
C70,
g: аморфный углерод,
h: углеродная нанотрубка
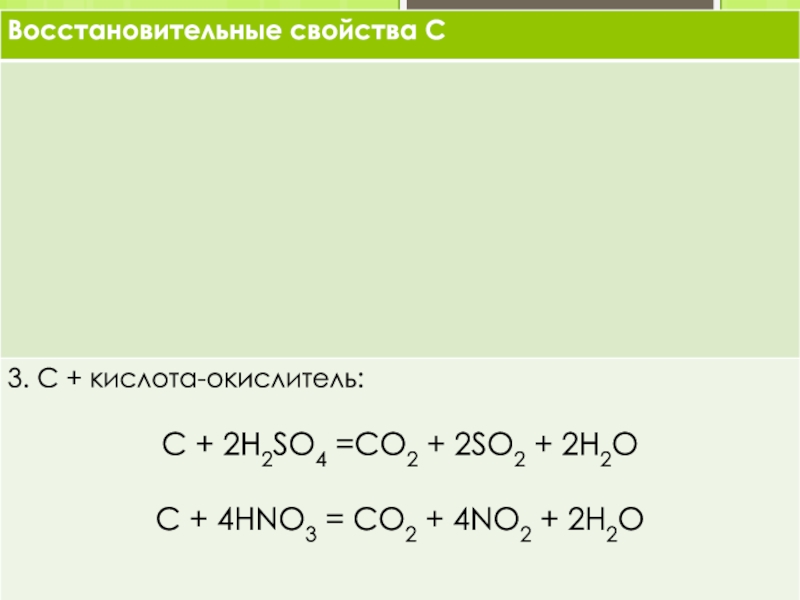
Слайд 16Химические свойства
При обычных условиях углерод химически инертен, при высоких температурах
он соединяется со многими элементами, проявляя сильные восстановительные свойства.
Все
формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3 и KCIO3 и др.).
“Аморфный” углерод реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании.
С бромом и йодом углерод не реагирует
Слайд 20Получение углерода
Сухая перегонка древесины, каменного угля, древесный уголь, кокс, активированный
уголь.
Самый чистый углерод – сажа:
CH4 → C +
2H2 при 1000о С
Неполное сжигание метана и др. углеводородов:
СН4+О2=С+2Н2О
Слайд 21Применение углерода С
Углерод играет огромную роль в жизни человека. Его
применения столь же разнообразны, как сам этот многоликий элемент.
В
частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Слайд 22Применение углерода С
Графит используется в карандашной промышленности, но в смеси с
глиной, для уменьшения его мягкости.
Также его используют в качестве
смазки при особо высоких или низких температурах.
Его невероятно высокая температура плавления, позволяет делать из него тигли для заливки металлов.
Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.
Слайд 23Применение углерода С
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают
шлифовальные насадки бормашин.
Кроме этого, ограненные алмазы - бриллианты используются в качестве драгоценных
камней в ювелирных украшениях.
Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров.
Слайд 24Применение углерода С
В фармакологии и медицине широко используются различные соединения
углерода.
Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных
токсинов; графит (в виде мазей) — для лечения кожных заболеваний
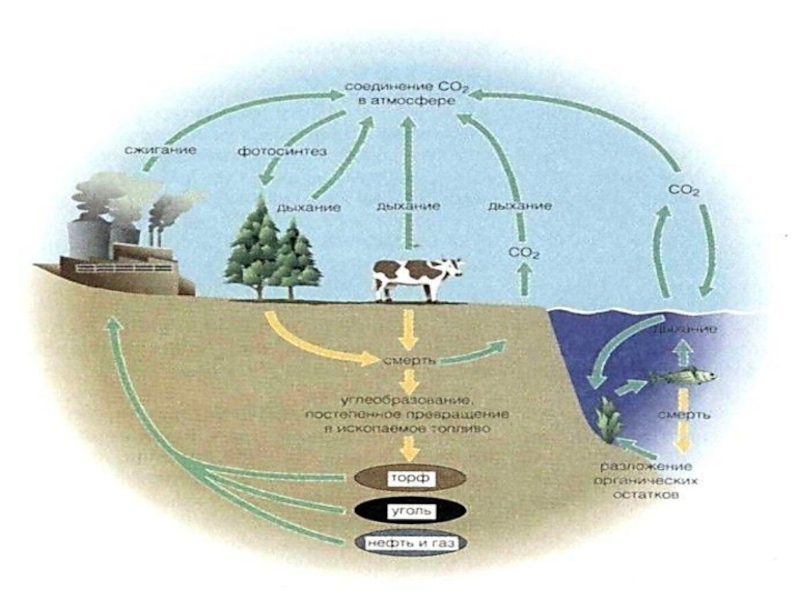
Слайд 26Круговорот углерода в природе
Углерод является основой всех органических веществ.
Любой
живой организм состоит в значительной степени из углерода. Углерод — основа
жизни.
Источником углерода для живых организмов обычно является СО2 из атмосферы или воды.
В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела.
Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Слайд 28Круговорот углерода в природе
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) —
один из важнейших источников энергии для человечества.
Слайд 29Выполните тест
Тест «Углерод»
Атом углерода расположен в:
а) VI группе главной
подгруппе;
б) V группе побочной подгруппе;
в) IV группе побочной подгруппе;
г) IV
группе главной подгруппе.
Слайд 30Тест «Углерод»
2. Углерод не проявляет степень окисления:
а)+4; б)+5;
в)-4; г)+2.
3. Степень окисления углерода
- 4 в соединении:
а) СН4;
б) СО;
в) ССl4;
г)Н2С03.
Слайд 31Тест «Углерод»
4.Углерод проявляет свойства:
а) только окислительные;
б) только восстановительные;
в) окислительные и
восстановительные.
5.Кристаллическая решётка в простых веществах углерода:
а) ионная;
б) молекулярная,
в) атомная;
г) металлическая.
Слайд 32Тест «Углерод»
6.Самое твёрдое вещество:
а) графит;
б) карбин;
в) фуллерен;
г) алмаз.
7. Не имеет
кристаллического строения:
а) кокс;
б)
алмаз;
в) графит;
г) карбин.




![29. Углерод Основные характеристикиИмя, : Углерод / CarboneumСимвол, номер:(С) , 6Электронная конфигурация: [He] Основные характеристикиИмя, : Углерод / CarboneumСимвол, номер:(С) , 6Электронная конфигурация: [He] 2s2 2p2Температура кипения: 4 827°CАтомная масса: 12,0107](/img/tmb/6/576358/b31b7f09aa8ce1996b9e0a03c03a6178-800x.jpg)