Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Адаптивный иммунитет
Содержание
- 1. Адаптивный иммунитет
- 2. Центральные лимфоидные органы: пролиферация, дифференцировка (так называемая,
- 3. Т-ЛИМФОЦИТЫОсновная задача T-лимфоцитов - распознавание чужеродных или
- 4. Чтобы T-лимфоцит «обратил на антиген своё внимание»,
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. АНТИГЕНРАСПОЗНАЮЩИЙ РЕЦЕПТОР T-ЛИМФОЦИТОВАнтигенраспознающие рецепторы T-клеток - TCR состоят из цепей, принадлежащих к суперсемейству иммуноглобулинов
- 9. Антигенраспознающий участок TCR - гетеродимер, т.е. состоит
- 10. Короткий цитоплазматический участок α- и β-цепи не может
- 11. Корецепторные молекулы CD4 и CD8• CD4 связывается с инвариантной
- 12. • CD8 принадлежит к суперсемейству иммуноглобулинов, связывается с инвариантной
- 13. Гены T-клеточного рецептораГены α-, β-, γ- и δ-цепей гомологичны
- 14. Слайд 14
- 15. После перестройки VJ в генах α-цепи и
- 16. Развитие Т-лимфоцитов• Клетки-предшественники Т-лц мигрируют из костного мозга
- 17. Селекция тимоцитов- Позитивная селекция: погибают тимоциты, не связавшие
- 18. Слайд 18
- 19. CD8+ T-клетки играют роль цитотоксических T-лимфоцитов (ЦТЛ) - они
- 20. Как CD8+ T-клетки убивают
- 21. Субпопуляции T-хелперовС конца 80-х годов XX века
- 22. • Th0 - CD4+ Т-лимфоциты на ранних стадиях развития
- 23. • Th2 - дифференцированная субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на выработке
- 24. Слайд 24
- 25. Th17 - субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на образовании ИЛ-17.
- 26. Tfh ( follicular helper - фолликулярный хелпер) находятся в
- 27. Т-регуляторы - CD4+ Т-лимфоциты, подавляющие активность других клеток иммунной
- 28. Адаптивные субпопуляции Т-клеток (клетки-партнеры, физиологические и патологические эффекты)
- 29. γδT-лимфоцитыПодавляющее большинство (99%) T-лимфоцитов, проходящих лимфопоэз в
- 30. γδT-клетки • не экспрессируют CD4.• связывают нативные
- 31. Слайд 31
- 32. Толерантность на уровне периферических органов иммуногенеза (миндалины,
- 33. б) Супрессорный эффект Т-хелперов. Классическая модель баланса
- 34. Скачать презентанцию
Центральные лимфоидные органы: пролиферация, дифференцировка (так называемая, антиген-независимая), селекция лимфоцитов.Костный мозг – продукция В-лимфоцитов.Тимус – развитие Т-лимфоцитов.Далее лимфоциты выселяются в периферические лимфоидные органы, постоянно рециркулируя: ткани – лимфа – лимфоидные ткани
Слайды и текст этой презентации
Слайд 2Центральные лимфоидные органы: пролиферация, дифференцировка (так называемая, антиген-независимая), селекция лимфоцитов.
Костный
мозг – продукция В-лимфоцитов.
периферические лимфоидные органы, постоянно рециркулируя: ткани – лимфа – лимфоидные ткани – кровь. При активации антигеном – клональная антигензависимая пролиферация и дифференцировка.Слайд 3Т-ЛИМФОЦИТЫ
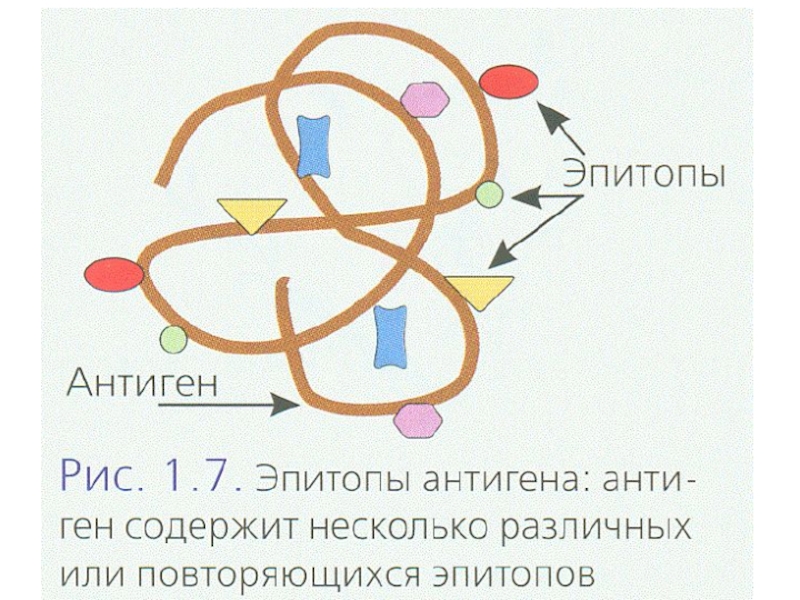
Основная задача T-лимфоцитов - распознавание чужеродных или изменённых собственных антигенов
в составе комплекса с молекулами MHC. Если на поверхности своих
клеток представлены чужеродные или изменённые свои молекулы, T-лимфоцит запускает их уничтожение.В отличие от B-лимфоцитов, T-лимфоциты не продуцируют растворимых форм антигенраспознающих молекул (антител). Более того, большинство T-лимфоцитов не способны распознавать растворимые антигены.
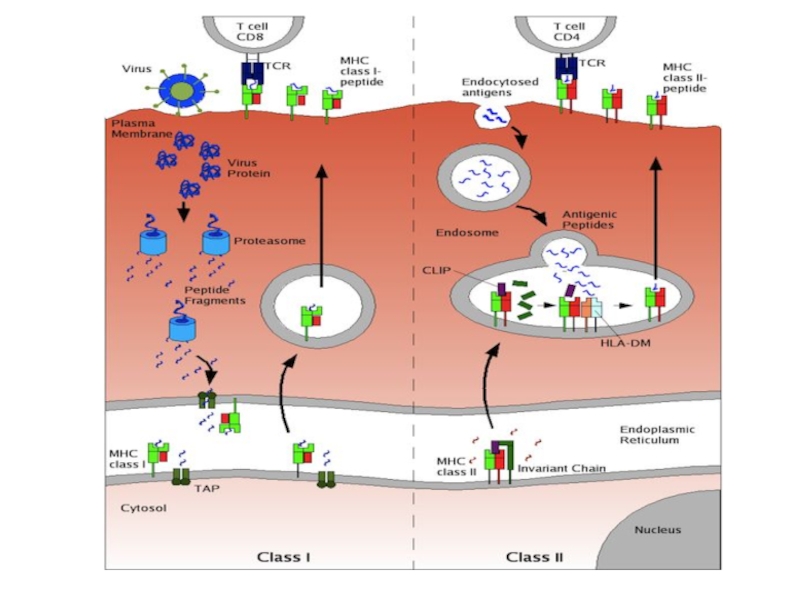
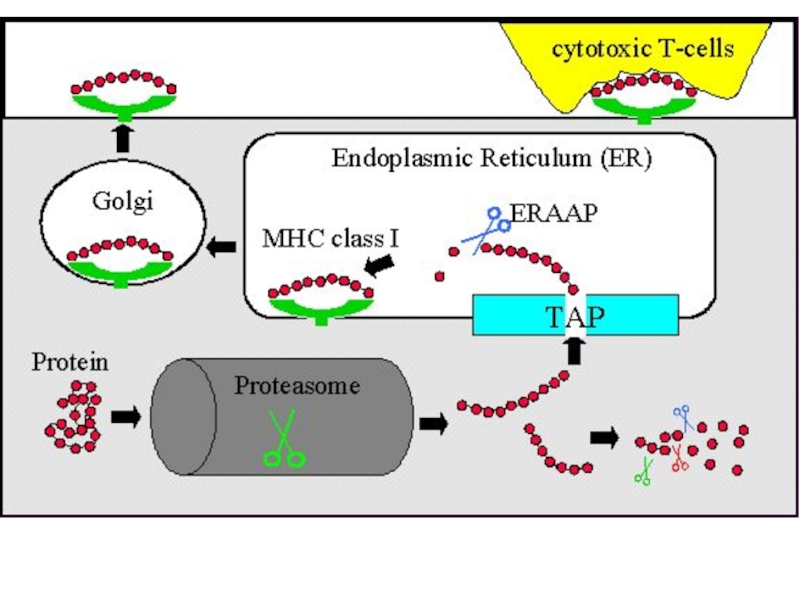
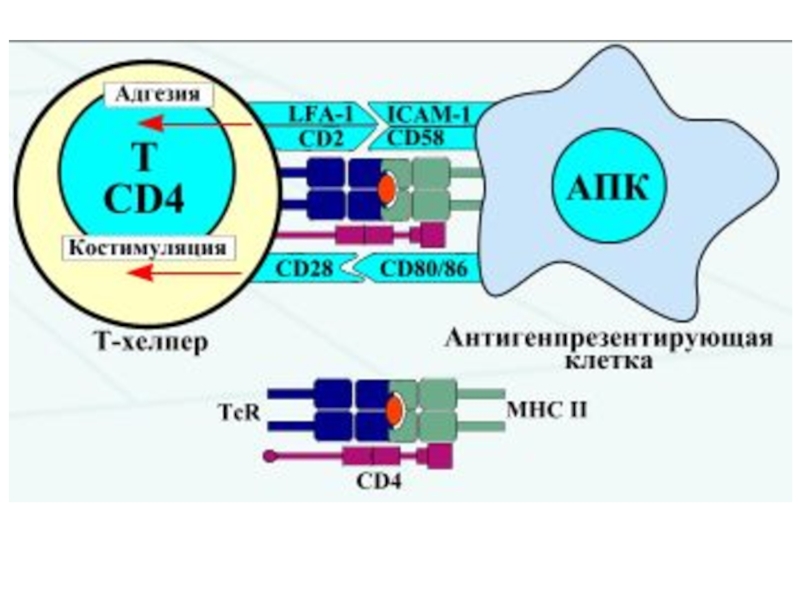
Слайд 4Чтобы T-лимфоцит «обратил на антиген своё внимание», другие клетки должны
«пропустить» антиген через себя и выставить его на своей мембране
в комплексе с MHC-I или MHC-II. Это и есть процессинг и презентация антигена T-лимфоциту. Распознавание такого комплекса T-лимфоцитом - двойное распознавание, «своего» - молекул МНС (MHC-рестрикция T-лимфоцитов) и«чужого» – процессированного антигена (короткого пептидного фрагмента).
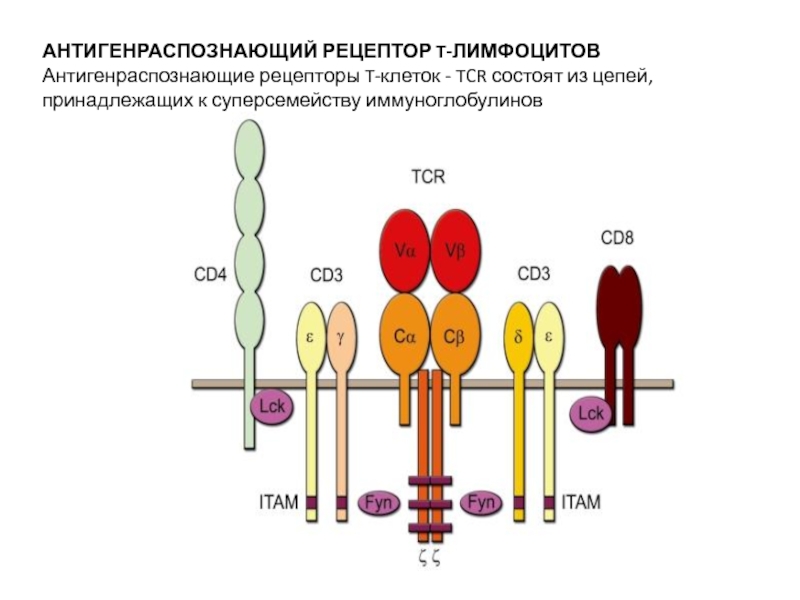
Слайд 8АНТИГЕНРАСПОЗНАЮЩИЙ РЕЦЕПТОР T-ЛИМФОЦИТОВ
Антигенраспознающие рецепторы T-клеток - TCR состоят из цепей,
принадлежащих к суперсемейству иммуноглобулинов
Слайд 9Антигенраспознающий участок TCR - гетеродимер, т.е. состоит из двух разных
полипептидных цепей.
Известны два варианта TCR, обозначаемые как αβTCR и
γδTCR, они различаются составом полипептидных цепей антигенраспознающего участка. αβT-клетки были открыты раньше и изучены подробнее, чем γδT-лимфоциты. В связи с этим строение антигенраспознающего рецептора T-лимфоцитов удобнее описывать на примере αβTCR. Трансмембранно расположенный комплекс TCR состоит из 8 полипептидных цепей (α- и β-цепей собственно TCR, двух вспомогательных цепей ζ, а также по одному гетеродимеру ε/δ- и ε/γ-цепей молекулы СD3)
Слайд 10Короткий цитоплазматический участок α- и β-цепи не может проводить сигнал внутрь
клетки. Для этого служат 6 дополнительных полипептидных цепей: γ, δ, 2ε и 2ζ.
• Комплекс
CD3. Цепи γ, δ, ε между собой образуют гетеродимеры γε и δε (вместе их называют комплекс CD3). Этот комплекс необходим для экспрессии α- и β-цепей, их стабилизации и проведения сигнала внутрь клетки. • ζ-Цепи расположены в цитоплазме и осуществляют проведение сигнала внутрь клетки.
Слайд 11
Корецепторные молекулы CD4 и CD8
• CD4 связывается с инвариантной частью (β2-доменом) молекулы MHC-II
(принадлежит к суперсемейству иммуноглобулинов).
При активации T-лимфоцита одну молекулу TCR
«обслуживают» 2 молекулы CD4: вероятно, происходит димеризация молекул CD4.Слайд 12• CD8 принадлежит к суперсемейству иммуноглобулинов, связывается с инвариантной частью молекулы MHC-I.
CD8 - гетеродимер цепей α и β, соединённых дисульфидной связью.
Во внеклеточной части
каждая из цепей имеет по одному иммуноглобулиноподобному домену.Слайд 13Гены T-клеточного рецептора
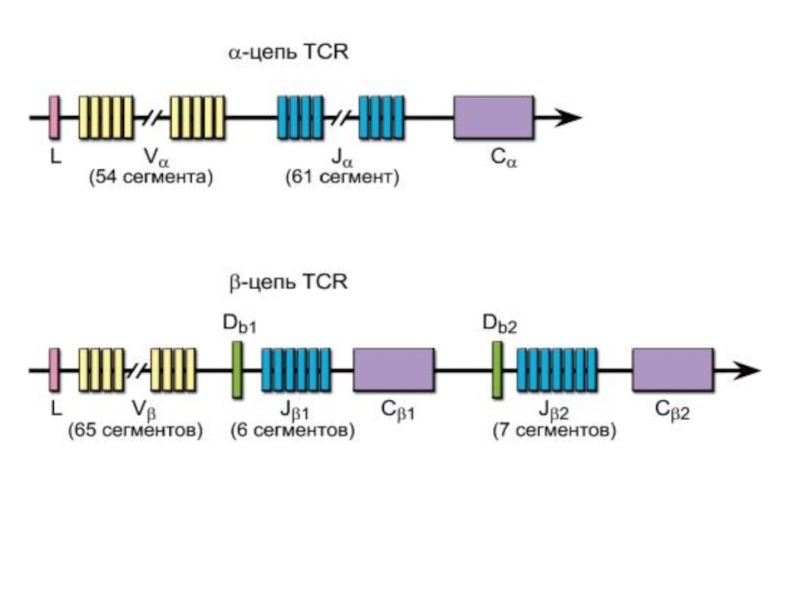
Гены α-, β-, γ- и δ-цепей гомологичны генам иммуноглобулинов и
претерпевают при дифференцировке T-лимфоцитов рекомбинацию ДНК, что теоретически обеспечивает генерацию
порядка 1016-1018 вариантов антигенсвязывающих рецепторов (реально это разнообразие ограничено числом лимфоцитов в организме до 109).Рекомбинация ДНК происходит при объединении V-, D- и J-сегментов и катализируется тем же комплексом рекомбиназ, что и при дифференцировке B-лимфоцитов.
Слайд 15После перестройки VJ в генах α-цепи и VDJ в генах
β-цепи, а также после присоединения некодируемых N- и P-нуклеотидов с
ДНК транскрибируется РНК.Гены α-цепи могут перестраиваться неоднократно при уже правильно перестроенных и экспрессированных генах β-цепи. Именно поэтому есть вероятность того, что одна клетка может нести более одного варианта TCR.
• Соматическому гипермутагенезу гены TCR в отличие от генов иммуноглобулинов не подвергаются.
Слайд 16Развитие Т-лимфоцитов
• Клетки-предшественники Т-лц мигрируют из костного мозга в субкапсулярную зону
коры тимуса, где пролиферируют.
• Затем клетки перемещаются вглубь коры тимуса. Начинается
перестройка генов β-, γ- и δ-цепей TCR. Если гены γ- и δ-цепей успевают перестроиться раньше, чем гены β-цепи, то лимфоцит дифференцируется далее как γδT. В противном случае развивается αβТ.Клетки начинают пролиферировать. Накапливается масса клеток с уже готовой β-цепью, но с ещё не перестроенными генами α-цепи, что вносит свой вклад в разнообразие αβ-гетеродимеров.
• Далее - рекомбинация вариабельных сегментов генов α-цепи.
Слайд 17Селекция тимоцитов
- Позитивная селекция: погибают тимоциты, не связавшие ни одного из
доступных комплексов MHC-пептид (не имеют CD4 или CD8).
В результате
позитивной селекции в тимусе погибает около 90% тимоцитов.- Негативная селекция уничтожает клоны тимоцитов, связывающих комплексы MHC-пептид со слишком высокой аффинностью (распознан «свой» пептид).
- Тимоциты, связавшие какой-либо из комплексов MHC-пептид с правильной, т.е. средней по силе, аффинностью, получают сигнал к выживанию и продолжают дифференцировку.
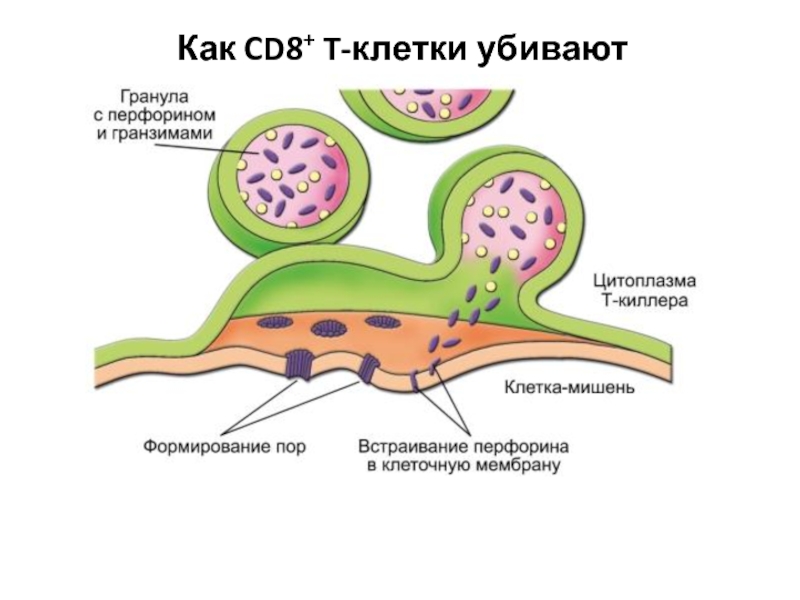
Слайд 19CD8+ T-клетки играют роль цитотоксических T-лимфоцитов (ЦТЛ) - они распознают и непосредственно
убивают клетки, модифицированные вирусом, опухолевые и другие «изменённые» клетки.
CD4+ T-клетки. Функциональная специализация
CD4+ T-лимфоцитов более разнообразна. Значительная часть CD4+ T-лимфоцитов в процессе развития иммунного ответа становится T-хелперами (помощниками), взаимодействующими с В-лимфоцитами, Т-лимфоцитами и другими клетками при прямом контакте или через растворимые факторы (цитокины). В определённых случаях из них могут развиться CD4+ ЦТЛ.Слайд 21Субпопуляции T-хелперов
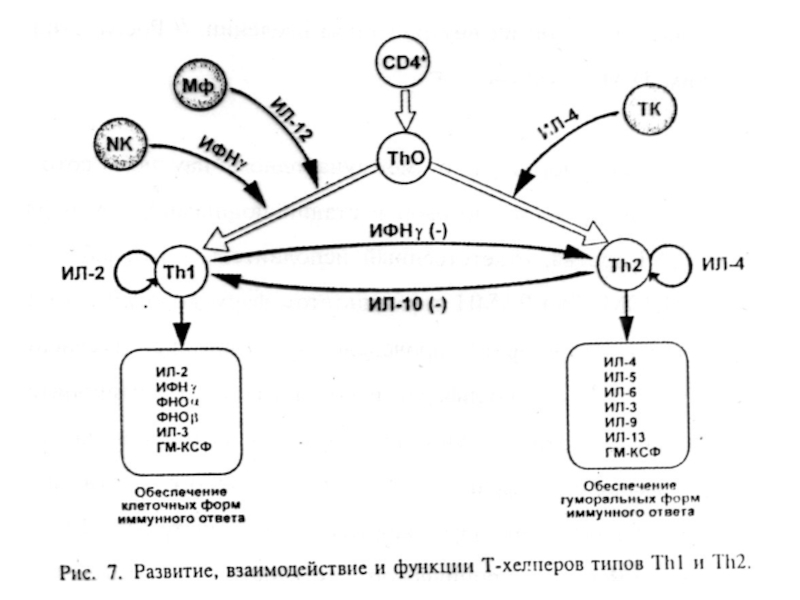
С конца 80-х годов XX века было принято выделять
2 субпопуляции T-хелперов (в зависимости от того, какой набор цитокинов
они продуцируют) - Th1 и Th2. В последние годы спектр субпопуляций CD4+ Т-клеток продолжает расширяться. Обнаружены такие субпопуляции, как: Th17, T-регуляторы, Tr1, Th3, Tfh и др.Слайд 22• Th0 - CD4+ Т-лимфоциты на ранних стадиях развития иммунного ответа, они
продуцируют только ИЛ-2 (митоген для всех лимфоцитов).
• Th1 - дифференцированная субпопуляция CD4+ Т-лимфоцитов
(продукция ИФНγ, ФНОβ и ИЛ-2). Регуляция многих реакций клеточного иммунитета, включая гиперчувствительность замедленного типа (ГЗТ) и активацию ЦТЛ. Кроме того, Th1 стимулируют продукцию В-лимфоцитами опсонизирующих антител класса IgG, запускающих каскад активации комплемента. Развитие избыточного воспаления с последующим повреждением тканей напрямую связано с активностью Th1-субпопуляции.Слайд 23• Th2 - дифференцированная субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на выработке ИЛ-4, ИЛ-5, ИЛ-6,
ИЛ-10 и ИЛ-13. Эта субпопуляция участвует в активации В-лимфоцитов и
способствует секреции ими больших количеств антител разных классов, особенно IgE. Кроме того, Th2-субпопуляция участвует в активации эозинофилов и развитии аллергических реакций.Слайд 25Th17 - субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на образовании ИЛ-17. Эти клетки осуществляют
противогрибковую и антимикробную защиту эпителиальных и слизистых барьеров, а также
играют ключевую роль в патологии аутоиммунных заболеваний.В последнее время появляется описание всё новых популяций CD4+ Т-лимфоцитов, классифицированных по типу преимущественно продуцируемого ими цитокина:
Th18, Th9, Th23
Слайд 26Tfh ( follicular helper - фолликулярный хелпер) находятся в лимфоидных фолликулах и
осуществляют хелперную функцию для В-лимфоцитов, секретируя ИЛ-21, вызывая их дифференцировку
в плазматические клетки. Кроме ИЛ-21 Tfh могут также продуцировать ИЛ-6 и ИЛ-10, необходимые для дифференцировки В-лимфоцитов. Нарушение функций этой популяции приводит к развитию аутоиммунных заболеваний или иммунодефицитов.Слайд 27Т-регуляторы - CD4+ Т-лимфоциты, подавляющие активность других клеток иммунной системы: секретируя иммуносупрессорные
цитокины - ИЛ-10 (ингибитор активности макрофагов и Th1-клеток) и ТФРβ -
ингибитор пролиферации лимфоцитов. Ингибиторный эффект может также достигаться индукцией апоптоза.CD4+ регуляторные Т-лимфоциты: естественные (Treg), созревающие в тимусе (CD4+CD25+, экспрессируют фактор транскрипции Foxp3), и индуцированные - локализованные преимущественно в слизистых оболочках пищеварительного тракта и переключившиеся на образование ТФРβ (Th3) или ИЛ-10 (Tr1). Нормальное функционирование Т-регуляторов предотвращает развитие аутоиммунных заболеваний.
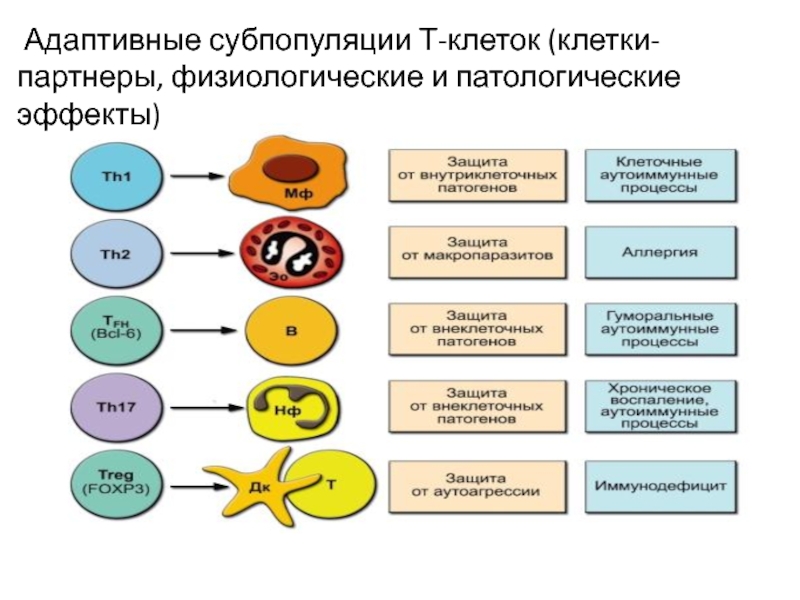
Слайд 28 Адаптивные субпопуляции Т-клеток (клетки-партнеры, физиологические и патологические эффекты)
Слайд 29γδT-лимфоциты
Подавляющее большинство (99%) T-лимфоцитов, проходящих лимфопоэз в тимусе, составляют αβT-клетки;
менее 1% - γδT-клетки. Последние в большинстве дифференцируются вне тимуса,
в первую очередь в слизистых оболочках пищеварительного тракта. В коже, лёгких, пищеварительном и репродуктивном трактах они являются доминирующей субпопуляцией внутриэпителиальных лимфоцитов. Среди всех T-лимфоцитов организма γδT-клетки составляют от 10 до 50%. В эмбриогенезе γδT-клетки появляются раньше αβT-клеток.Слайд 30γδT-клетки
• не экспрессируют CD4.
• связывают нативные антигены независимо от
классических молекул MHC - для них не обязателен или вовсе
не нужен предварительный процессинг антигена АПК.• Разнообразие γδTCR меньше, чем αβTCR или иммуноглобулинов,
γδT-клетки способны распознавать в основном фосфолипидные антигены микобактерий, углеводы, белки теплового шока.