Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алюминий и его органические производные
Содержание
- 1. Алюминий и его органические производные
- 2. Простое вещество алюминий — лёгкий парамагнитный металл
- 3. Нахождение в природеБокситы — Al2O3 · H2O
- 4. Алюминийорганические соединенияАлюминийтриалкилы(арилы)Алкил(арил)алюминийгалогенидыАлкил(арил)алюминийгидридыАлкоксиды алюминия
- 5. Алюминийтриалкилы(арилы)Алюминийтриалкилы(арилы) R3Al – один из наиболее важных
- 6. Прямой синтез из алюминия, водорода и олефиновAl
- 7. Химические превращения алюминийтриалкиловТермическое разложение алюминийтриалкиловR2AlR → R2AlH
- 8. Алюминийорганические соединения легко взаимодействуют с соединениями содержащих
- 9. Комплексы также образуются и с другими соединениями,
- 10. АлкилалюминийгалогенидыАлкилалюминийгалогениды представляют собой вязкие бесцветные жидкости Получение
- 11. АлкилалюминийгидридыПолучение :Взаимодействие алюминийтриалкилов с водородомR3Al + H2
- 12. Алкоксиды алюминия Алкоксиды алюминия – бесцветные прозрачные
- 13. Практическое использование алюминийорганических соединенийВ качестве составной части
- 14. Спасибо за внимание!
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Нахождение в природе
Бокситы — Al2O3 · H2O (с примесями SiO2,
Fe2O3, CaCO3)
Нефелины — KNa3[AlSiO4]4
Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
Глинозёмы (смеси каолинов с песком
SiO2, известняком CaCO3, магнезитом MgCO3)Корунд (сапфир, рубин, наждак) — Al2O3
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
Каолинит — Al2O3·2SiO2 · 2H2O
Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
Хризоберилл (александрит) — BeAl2O4.
Слайд 4Алюминийорганические соединения
Алюминийтриалкилы(арилы)
Алкил(арил)алюминийгалогениды
Алкил(арил)алюминийгидриды
Алкоксиды алюминия
Слайд 5Алюминийтриалкилы(арилы)
Алюминийтриалкилы(арилы) R3Al – один из наиболее важных в практическом плане
и доступных типов алюминийорганических соединений. Способы получения алюминийтриалкилов(арилов) достаточно хорошо
разработаны.Получение :
Взаимодействие металлического алюминия с алкил(арил)алюминийгалогенидом
Al + RX → RAlX2 + R2AlX + R3Al
Алкилирование с помощью металлоорганических соединений галогенидов алюминия
AlCl3 + 3RM → AlR3 + 3MCl
AlCl3 • B + 3Na—C≡С—R → Al(C≡С—R) 3 • B + 3NaCl
В качестве алкилирующего агента могут быть использованы литийалюминийтетраалкилы
3LiAlR4 + AlCl3 → 4R3Al +3LiCl
Ртутьорганические соединения в среде эфира реагируют с металлическим алюминием , давая эфираты триалкилалюминия
2Al + 2HgR2 → 2R3Al + 3Hg
Реакция гидрофильного присоединения AlH3 к олефинам протекает исключительно легко
AlH3 + 3СH2=CRR’ → Al(CH2CHRR’)3
Синтез Циглера
Al + 1,5H2 + 3СH2=CR → Al(CH2CH2R)3
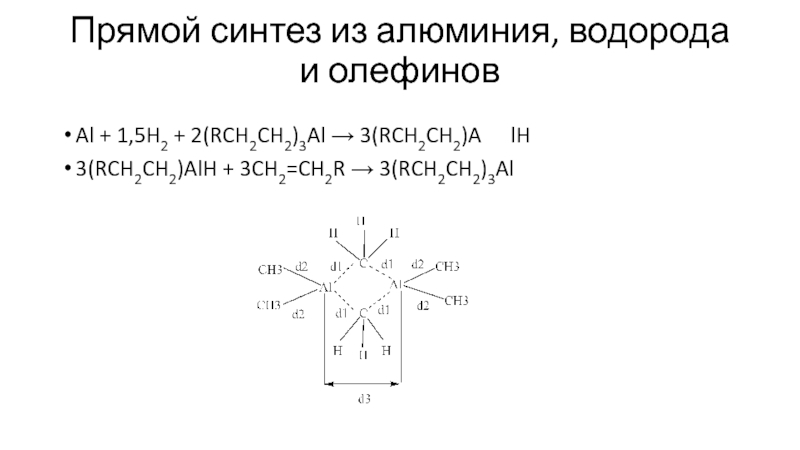
Слайд 6Прямой синтез из алюминия, водорода и олефинов
Al + 1,5H2 +
2(RCH2CH2)3Al → 3(RCH2CH2)A lH
3(RCH2CH2)AlH + 3CH2=CH2R → 3(RCH2CH2)3Al
Слайд 7Химические превращения алюминийтриалкилов
Термическое разложение алюминийтриалкилов
R2AlR → R2AlH + CH2=CH2—R’
R2AlH →
RAlH2 + CH2=CH—R’
3 RAlH2 → 2AlH3 + 3CH2=CH—R’ + Al
AlH3
→ Al + 1,5H2При повышененом давлении и температуре алюминийтриалкилы реагируют с водородом с разрывом связи Al—C
R3Al + H2 → R2AlH + RH
Алюминийорганические соединения являются хорошими алкирующими средствами
R3Al + BCl3 → R3B + Al
4R3Al + 3SiCl4 → 3SiR4 + 4AlCl3
R3Al + AlCl3 → R2AlCl + RAlCl2
R3Al + B(OR’)3 → R3B + Al(OR’)3
R3Al + PCl3 → RPCl2 + R2PCl + R3P
Взаимодействие алюминийтриалкилов с галогенами
R3Al + Cl2 → R2AlCl + RCl
Слайд 8Алюминийорганические соединения легко взаимодействуют с соединениями содержащих подвижный водород
R3Al +
3H2O → Al(OH)3 + 3RH
R3Al + 3R’OH → Al(OR’)3 +
3RHR3Al + 3R’SH → Al(SR’)3 + 3RH
R3Al + 3R’COOH → (R’COO)3 + 3RH
Взаимодействие алюминийорганическихсоединений с аммиаком и аминами проходит через образование комплекса
R3Al + NH3 → R3Al • NH3 → R2AlNH2 + RH
R3Al + R’2NH → R3Al • NHR’2 → R2AlNR’2 + RH
Органоаминосиланы и силазаны реагируют алюминийтриалкилами с образованием соединений со связью Si—N—Al
≡Si AlR2 + H Si ≡ → ≡Si —Si ≡ + RH
C гидразином алюминийтриалкилы образуют симметричные бис(диалкилалюминий)гидразины
2R3Al + NH2—NH2 → R2AlNH—NHAlR2 + 2RH
Третичные амины и органозамещенные гидразины, не содержащие связей =N—H, образуют с триалкилалюминием комплексы состава 1:1
R3Al + R’3N → R3Al •NR’3
+ R3Al → ≡Si
AlR2 + RH
Слайд 9Комплексы также образуются и с другими соединениями, в которых есть
атомы с неподеленной парой электронов
R3Al + PR’3 → R3Al •
PR’3Алюминийорганические соединения легко окисляются кислородом воздуха
R3Al → R2AlOR → RAl(OR)2 → Al(OR)3
Cвязь Al—C в алюминийорганических соединениях способна участвовать в реакции присоединения к двойной связи олефинов
R3Al + 3CH2=CH2 → (R—CH2—CH2—)3Al
Присоединение идет с участием всех трех связей Al—C
R3Al + 3nCH2=CH2 → [R—(CH2—CH2)n—]3Al
Повышение температуры и давления меняет характер взаимодействия алюминийтриалкила с олефином
[R—(C2H4)n ]3Al + 3CH2=CH2 → (C2H5)3Al + 3R—(C2H4)n-2—CH=CH2
Диоксид углерода взаимодействует с алюминийтриалкилами
R3Al + CO2 → R2AlOC(O)R → RAl[OC(O)R] 2
Алюминийорганические соединения с радикалами изостроения могут изомеризоваться в радикалы нормально строения
(изо-СnH2n+1)3Al → (н-СnH2n+1)3Al
Комплексные соединения алюминийтриалкилов со щелочными металлами при электролизе со свинцовым анодом позволяет получить тетраорганопроизводные свинца
Pb + 4NaAl(C2H5)4 → Pb(C2H5)4 + 4Al(C2H5)3 + 4Na
½ O2
½ O2
½ O2
20-100 C °
180--200 C °
Слайд 10Алкилалюминийгалогениды
Алкилалюминийгалогениды представляют собой вязкие бесцветные жидкости
Получение :
Взаимодействие галогеналкилов с
металлическим алюминием
Al + RX → RAlX2 + R2AlX + R3Al
Алкилирование
тригалогенида алюминия алюминийтриалкиламиR3Al + AlX3 → R2AlX + RAlX2 + R2Al2X3
Дегалогенирование сесквигалогенидов алюминия металлическим натрием или магнием
2R3Al2X3 + 3Na → 3R2AlX + 3NaX + Al
Слайд 11Алкилалюминийгидриды
Получение :
Взаимодействие алюминийтриалкилов с водородом
R3Al + H2 → R2AlH +
RH
Восстановление алюминийтриалкилов гидридами щелочных металлов
(C2H5)3Al + NaH → Na[(C2H5)3AlH]
Прямой синтез
триэтилалюминия из металлического алюминия, на первой стадии образуется диалкилалюминийгидридAl + 2R3Al + 1,5H2 → 3R2AlH
Связь =Al—H проявляеь высокую реакционную способность в реакциях присоединения
R2AlH + СH ≡ CH → R2AlCH=CH2
Алкилалюминийгидриды являются хорошими восстановителями
R2AlH + R’3SiOCH=CH2 → R2AlOCH=CH2 + R’3SiH
Связь ≡Al—H способна замещаться на органический радикал при действии металорганических соединений
2(C2H5)2AlH + Mg(C2H5)2 → (C2H5)3Al + MgH2
Слайд 12Алкоксиды алюминия
Алкоксиды алюминия – бесцветные прозрачные жидкости или твердые
кристаллические вещества
Получение :
Регулируемое окисление алюминийтриалкилов протекает ступенчато
R3Al → R2AlOR
→ RAl(OR)2 → Al(OR)3Взаимодействие алюминийтриалкилов со спиртами
R3Al + R’OH → Al(OR’)3 + 3RH
Взаимодействие алюминия со спиртом
Al + 3ROH → Al(OR)3 + 1,5 H2
Алкоксигруппы у алюминия чувствительны к гидролизу
Al(OR’)3 → (RO)2AlOH + ROH
Реакция переэтерефикации и гетрефункциональной конденсации также характерны для алкоголятов алюминия
Al(OR’)3 + 3R’OH Al(OR’)3 + 3ROH
Al(OR’)3 + 3HOSiR’3 Al(OSiR’3) + 3ROH
½ O2
½ O2
½ O2
H2O
Слайд 13Практическое использование алюминийорганических соединений
В качестве составной части катализаторов Циглера-Натта
В качестве
компонентов металлокомплексных катализаторов используемых в процессах:
Полимеризации и сополимеризации ненасыщенных углеводородов
и мономеров Олигомеризации и циклизации ненасыщенных углеводородов
Гидрирования ненасыщенных углеводородов
Диспропорционирования ненасыщенных углеводородов
Использования в качестве алкилирующих агентов в органическом синтезе
Восстанавливающая способность алюминийорганических соединений очень высока, поэтому в ряде случаев они обеспечивают очень высокую селективность в процессе восстановления
В виду самовоспламенения на воздухе данные соединения используются в качестве добавок к ракетному топливу, так как способствуют лучшему воспламенению топлива


![Алюминий и его органические производные Нахождение в природеБокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, Нахождение в природеБокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)Нефелины — KNa3[AlSiO4]4Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3Глинозёмы (смеси](/img/thumbs/3a23d89af0541cf239238ca2840fc0c3-800x.jpg)