Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АМИНОКИСЛОТЫ. ПЕПТИДЫ. БЕЛКИ
Содержание
- 1. АМИНОКИСЛОТЫ. ПЕПТИДЫ. БЕЛКИ
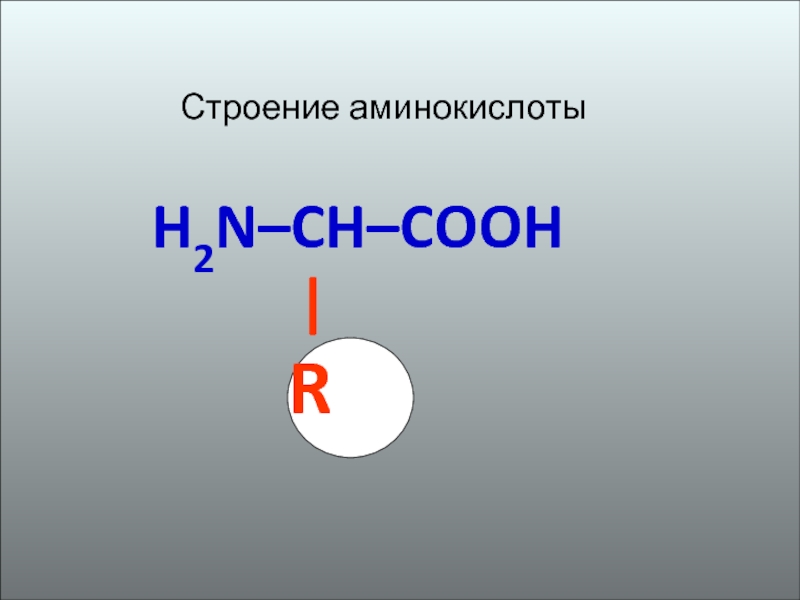
- 2. Строение аминокислоты H2N–CH–COOH
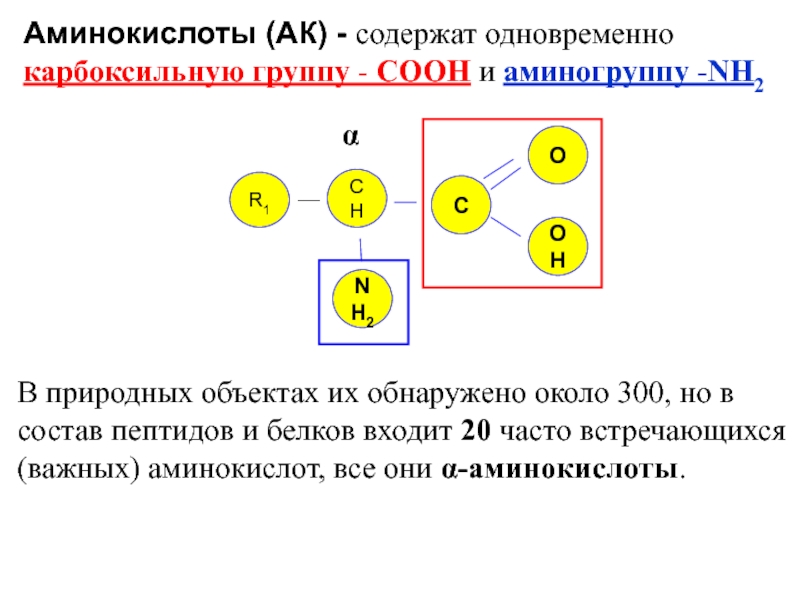
- 3. В природных объектах их обнаружено около 300,
- 4. Классификация аминокислот1. Моноаминомонокарбоновые2. Моноаминодикарбоновые3. Диаминомонокарбоновые4. Серусодержащие5. Имеющие спиртовую группу6. Циклические
- 5. Слайд 5
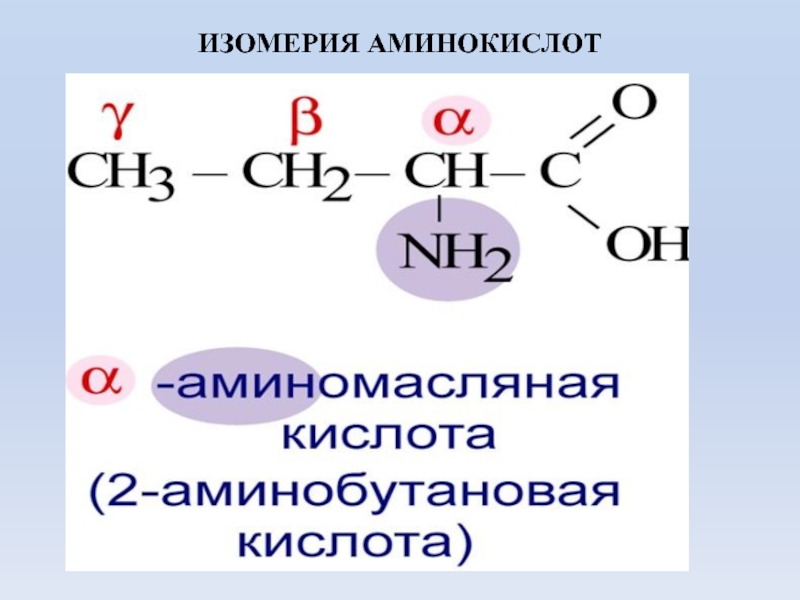
- 6. ИЗОМЕРИЯ АМИНОКИСЛОТ
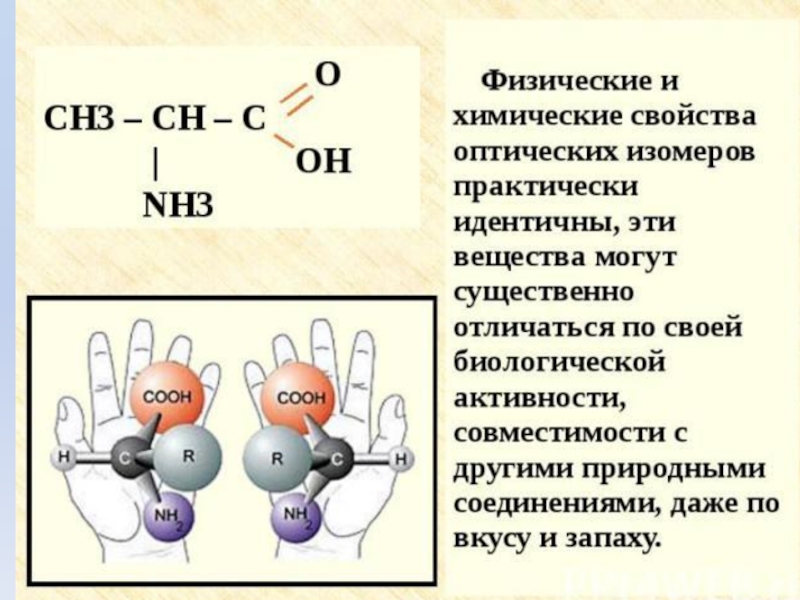
- 7. Оптическая изомерия аминокислоты существуют в виде зеркальных изомеров
- 8. Стереоизомерия. Все природные a-аминокислоты (кроме глицина) являются хиральными соединениями.
- 9. Слайд 9
- 10. Слайд 10
- 11. По кислотно-основным свойствам аминокислоты делят на три
- 12. Слайд 12
- 13. Изоэлектрическая точка (ИЭТ) – это значение
- 14. Биологически важные реакции α-аминокислот1.Образование оснований Шиффа2. Декарбоксилирование3. Дезаминирование4. Трансаминирование5. Образование полипептидов
- 15. Образование оснований Шиффа. При взаимодействии аминокислот с
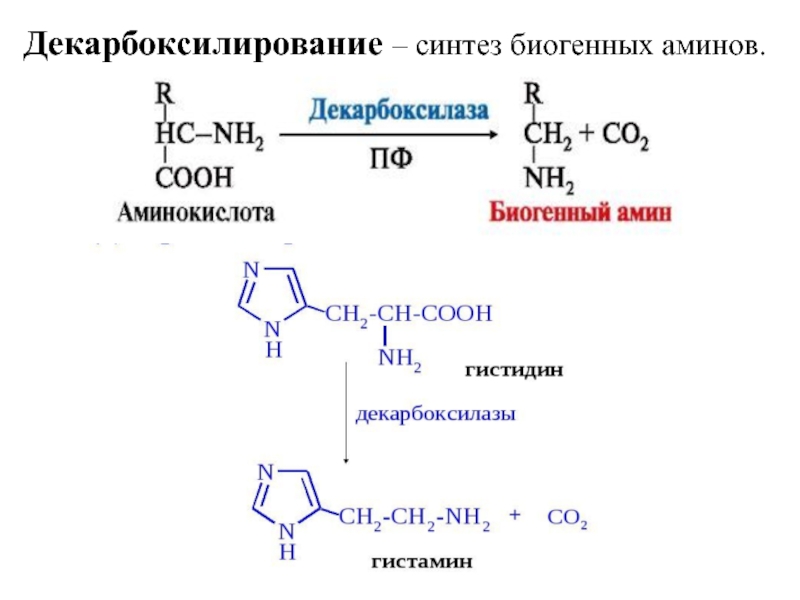
- 16. Декарбоксилирование – синтез биогенных аминов.
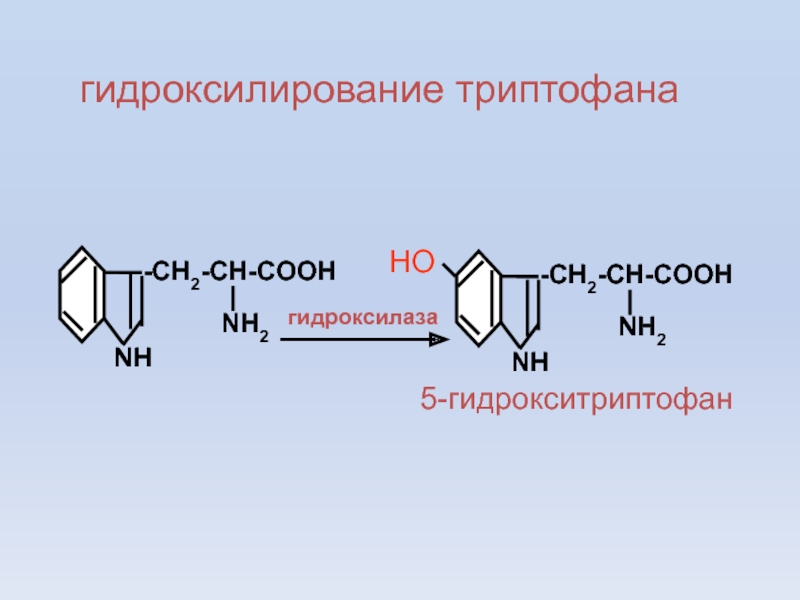
- 17. -CH2-CH-COOHNH2NHгидроксилирование триптофана-CH2-CH-COOHNH2NHНОгидроксилаза5-гидрокситриптофан
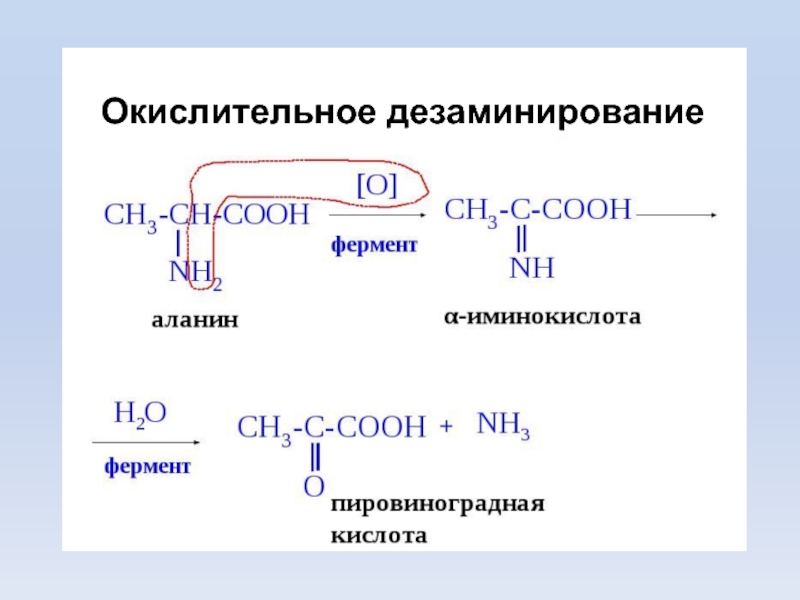
- 18. Дезаминирование – удаления α-АК, которая выделяется в
- 19. Слайд 19
- 20. Слайд 20
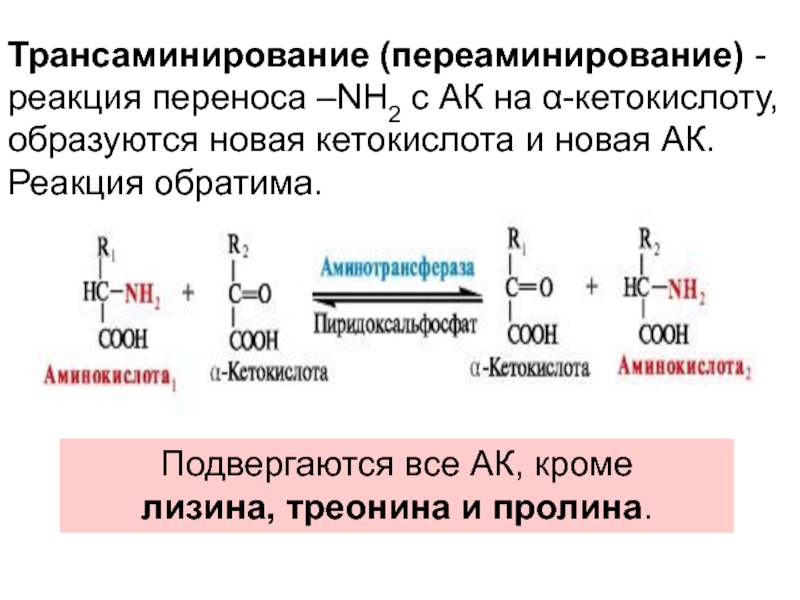
- 21. Трансаминирование (переаминирование) - реакция переноса –NH2 с
- 22. Слайд 22
- 23. H2N–CH–CO
- 24. Образование пептидной связи
- 25. Строение белковой молекулы
- 26. Слайд 26
- 27. Слайд 27
- 28. Первичная структура белка - линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. аминокислоты
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
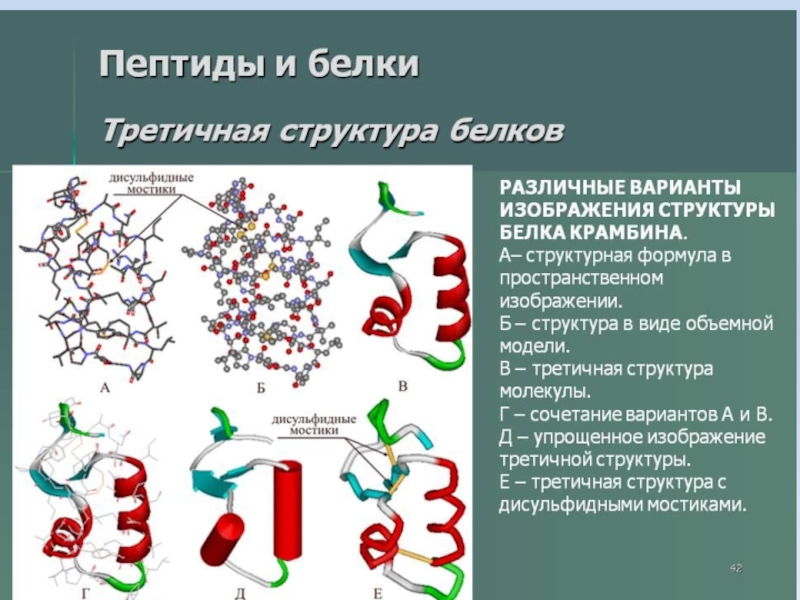
- 32. Слайд 32
- 33. Слайд 33
- 34. Слайд 34
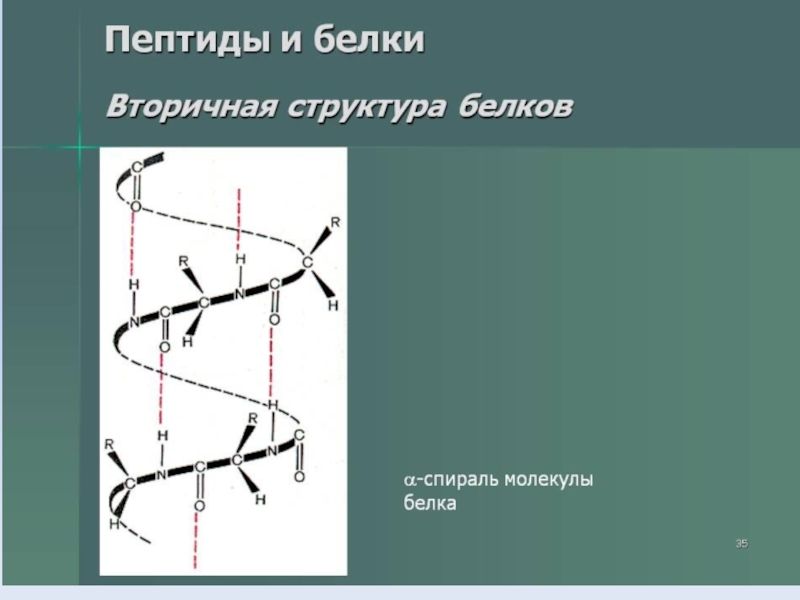
- 35. Слайд 35
- 36. Слайд 36
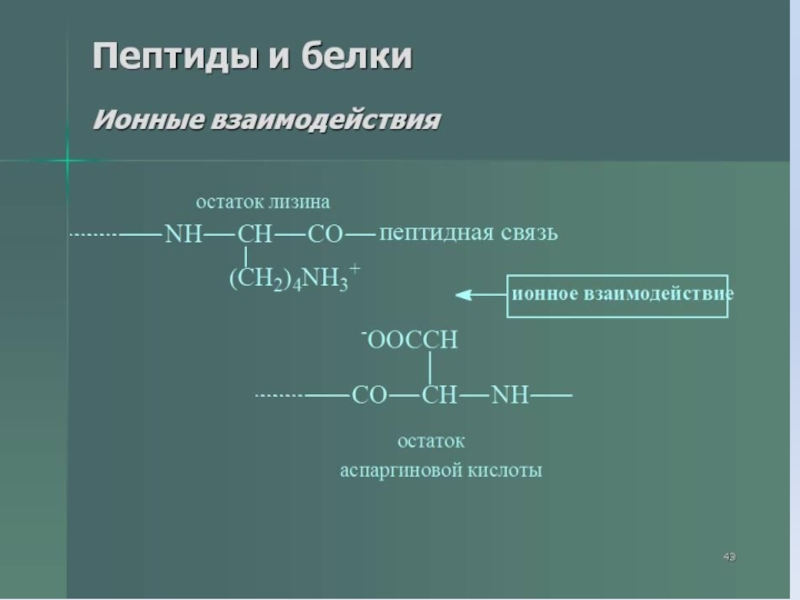
- 37. Слайд 37
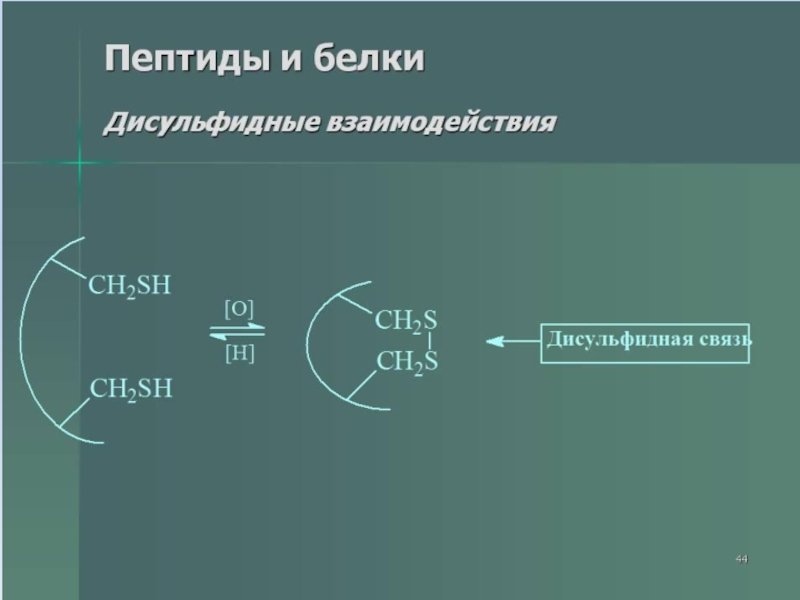
- 38. Слайд 38
- 39. БЕЛКИПРОТЕИНЫ (простые белки)В составе только остатки АКПРОТЕИДЫ
- 40. Скачать презентанцию
Строение аминокислоты H2N–CH–COOH | R
Слайды и текст этой презентации
Слайд 3В природных объектах их обнаружено около 300, но в состав
пептидов и белков входит 20 часто встречающихся (важных) аминокислот, все
они α-аминокислоты.Аминокислоты (АК) - содержат одновременно карбоксильную группу - СООН и аминогруппу -NН2
Слайд 4Классификация аминокислот
1. Моноаминомонокарбоновые
2. Моноаминодикарбоновые
3. Диаминомонокарбоновые
4. Серусодержащие
5. Имеющие спиртовую группу
6. Циклические
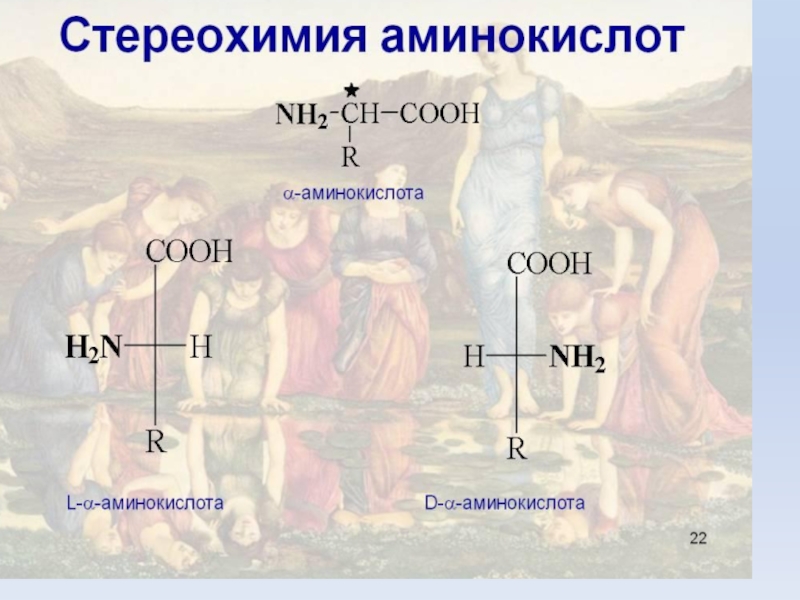
Слайд 8Стереоизомерия.
Все природные a-аминокислоты (кроме глицина)
являются хиральными соединениями. По конфигурации хирального центра
в положении 2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся к L-ряду.
Большинство
аминокислот содержат один хиральный
центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют (кроме цистина) 4 стереоизомера, из которых только один встречается в составе белков.
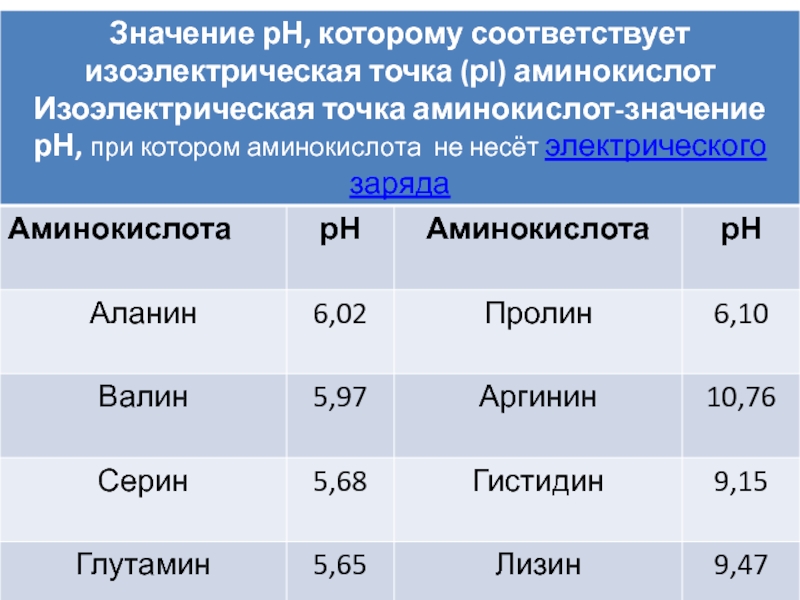
Слайд 11По кислотно-основным свойствам аминокислоты делят на три группы:
Кислые -
с карбоксильными группами в боковом радикале:
аспарагиновая и глутаминовая кислоты.
Основные
- в боковом радикале имеющие гуанидиновую, имидазольную или аминогруппы:лизин, аргинин и гистидин.
Все остальные - нейтральные.
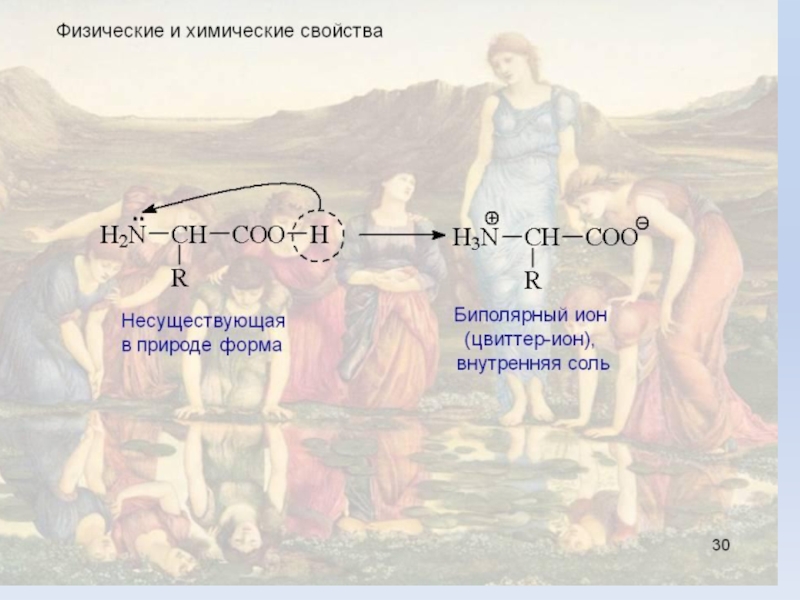
Слайд 13Изоэлектрическая точка (ИЭТ) – это значение pH раствора,
при котором молекулы существуют в виде диполярных ионов.
Состояние при котором
белок находится в виде диополярного иона (цвиттер-иона), называется изоэлектрическим состоянием (ИЭС).Слайд 14Биологически важные реакции
α-аминокислот
1.Образование оснований Шиффа
2. Декарбоксилирование
3. Дезаминирование
4. Трансаминирование
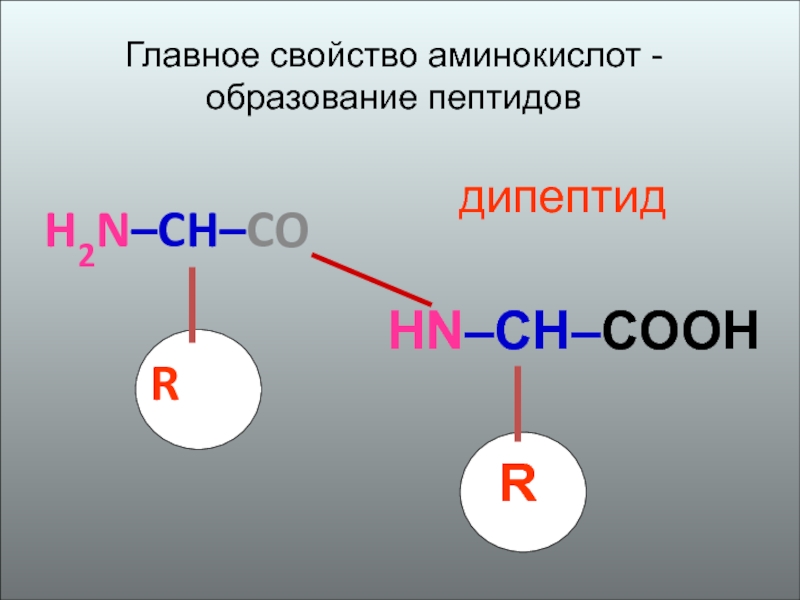
5. Образование
полипептидов
Слайд 15 Образование оснований Шиффа. При взаимодействии аминокислот с альдегидами образуются замещенные имины) через
стадию образования карбиноламинов
По данному механизму осуществляется взаимодействие карбонилсодержащих соединений (стероидных
гормонов) с аминогруппами белков рецепторов; образуется связь витамина А (ретиналя) с белковой частью родопсина (светочувствительного пигмента палочек сетчатки глаза).Слайд 17-CH2-CH-COOH
NH2
NH
гидроксилирование триптофана
-CH2-CH-COOH
NH2
NH
НО
гидроксилаза
5-гидрокситриптофан
Слайд 18Дезаминирование –
удаления α-АК, которая выделяется в виде NH3 и
образования α-кетокислоты. Общее количество АК уменьшается.
Дезаминированию не подвергаются
лизин и
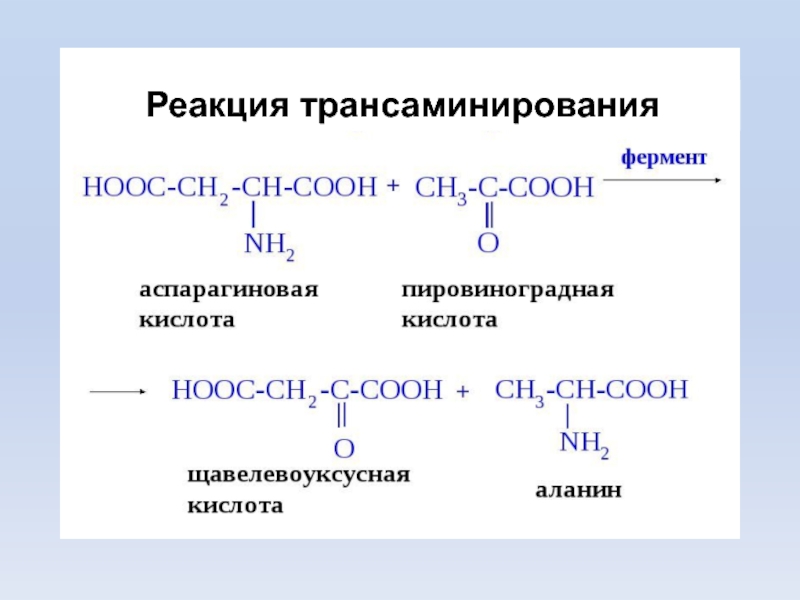
пролин. Слайд 21Трансаминирование (переаминирование) - реакция переноса –NH2 с АК на α-кетокислоту,
образуются новая кетокислота и новая АК. Реакция обратима.
Подвергаются все АК,
кроме лизина, треонина и пролина.
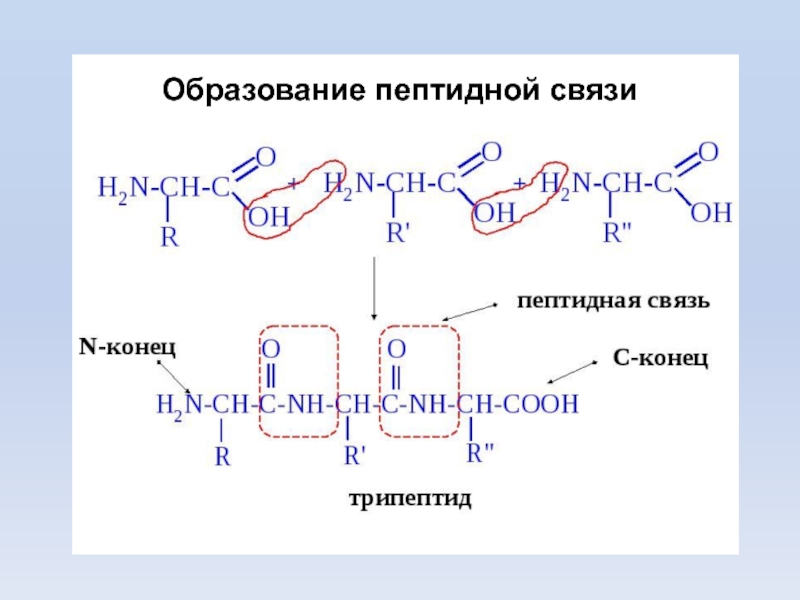
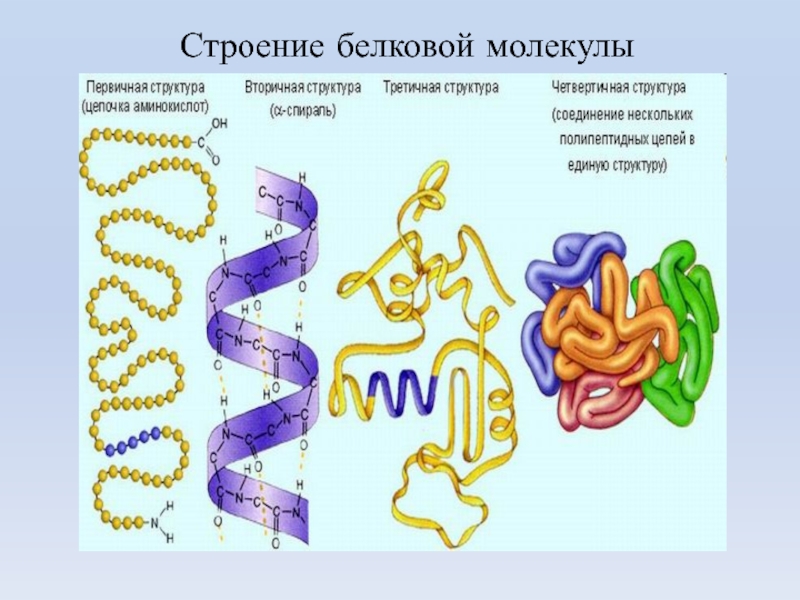
Слайд 28Первичная структура белка - линейная полипептидная цепь из аминокислот, соединенных
между собой пептидными связями. аминокислоты
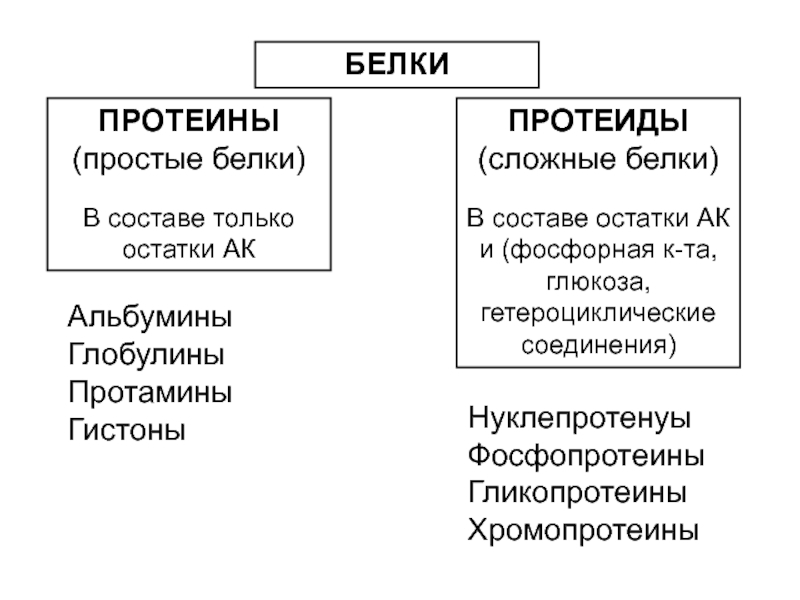
Слайд 39БЕЛКИ
ПРОТЕИНЫ
(простые белки)
В составе только остатки АК
ПРОТЕИДЫ
(сложные белки)
В составе
остатки АК и (фосфорная к-та, глюкоза, гетероциклические соединения)
Альбумины Глобулины
Протамины Гистоны
Нуклепротенyы Фосфопротеины Гликопротеины Хромопротеины