Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную
Содержание
- 1. Ароматичность молекулы означает ее повышенную устойчивость, обусловленную
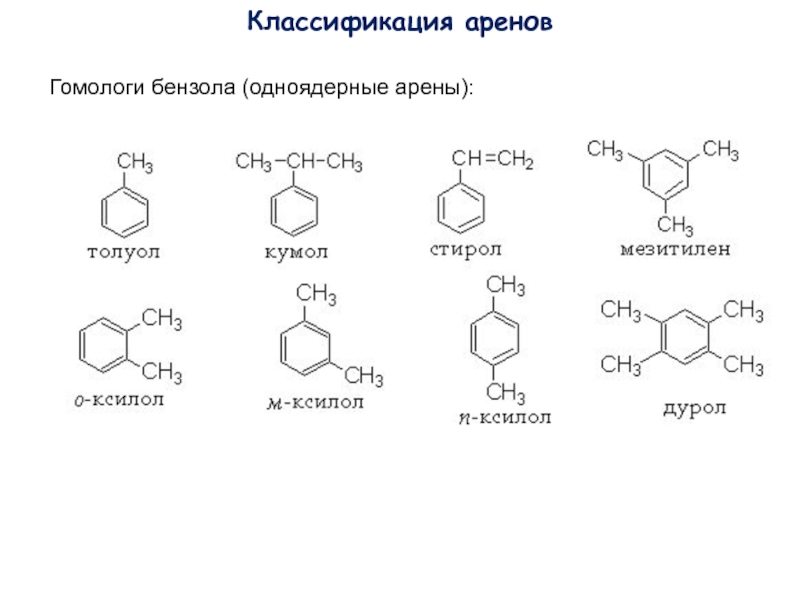
- 2. Классификация ареновГомологи бензола (одноядерные арены):
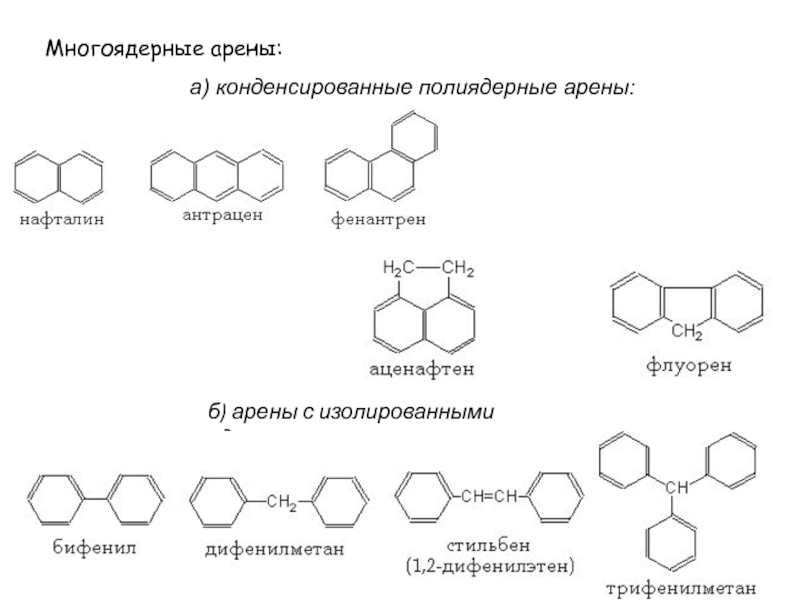
- 3. Многоядерные арены: а) конденсированные полиядерные арены:б) арены с изолированными ядрами
- 4. Слайд 4
- 5. В отличие от
- 6. Строение бензола Каждый из шести
- 7. р-Электроны всех атомов углерода взаимодействуют между собой
- 8. Все связи
- 9. С10Н8Строение нафталина Молекулярная формула нафталина - Углеродные
- 10. Однако, по данным рентгеноструктурного анализа, в отличие
- 11. Строение молекулы бифенила В молекуле бифенила бензольные
- 12. По химическим свойствам арены отличаются от предельных
- 13. Реакции электрофильного замещения – SEХимические свойства аренов
- 14. I стадия: сближение
- 15. Cl2 > Br2 >> I2 В присутствии
- 16. При хлорировании нафталина
- 17. Бензол и его гомологи нитруют
- 18. Антрацен в зависимости от условий
- 19. Как реагенты сульфирования бензола используют концентрированную серную
- 20. РЕАКЦИИ ФРИДЕЛЯ-КРАФТСААлкилирование – это введение алкильной группы,
- 21. Замещение в алкилбензолах Ацилирование - это введение
- 22. Это объясняется взаимным влиянием атомов на реакционную
- 23. Влияние заместителей на направление и скорость реакций
- 24. Заместители I рода активируют ароматическое ядро в
- 25. Заместители II рода дезактивируют ароматическое
- 26. Порядок введения заместителей в ароматическое ядро может иметь значения в реакциях превращений:
- 27. Направление замещения в монозамещенных нафталинах определяется:
- 28. Заместитель II рода:
- 29. Если два заместителя в бензольном ядре
- 30. Место вхождения третьего заместителя определяется ориентантом
- 31. 3. Если два электроноакцепторных заместителя II рода
- 32. Реакции присоединения нехарактерны для аренов, так
- 33. Нафталин восстанавливается легче. При каталитическом гидрировании
- 34. Для гомологов бензола в этих условиях легче
- 35. Окисление При обычных условиях бензол не окисляется
- 36. Нафталин окисляется легче бензола: Замещенные нафталины
- 37. Антрацен и фенантрен легко окисляются до хинонов:
- 38. Методы получения аренов Основными природными
- 39. 1. Каталитический риформинг бензинов
- 40. Изомеризация алкилциклопентанов в циклогексаны
- 41. Гидрокрекинг (дегидроизомеризация)Дегидроциклизация (дегидрирование и циклизация) алканов в
- 42. Гидродеалкилирование толуола проводят в присутствии катализаторов –
- 43. Диспропорционирование толуола.
- 44. Дегидрирование алкилбензолов.
- 45. Реакция Фриделя-Крафтса - алкилирование бензола галогеналканами или алкенами в присутствии безводного хлорида алюминия:
- 46. Циклотримеризация алкинов Конденсация бензола с ацетиленом Реакция
- 47. Применение ароматических углеводородов Бензол (С6Н6)
- 48. Слайд 48
- 49. Возможная экологическая опасность аренов
- 50. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией p-электронов в
циклической системе.
Слайд 5 В отличие от бензола и его
производных, где нумерация углеродных атомов ароматического кольца произвольна и зависит
от типа заместителей и их взаимного расположения, для полиядерных аренов принята постоянная закрепленная нумерацияС-атомов:
нафталин
антрацен
фенантрен
бифенил
Слайд 6Строение бензола
Каждый из шести атомов углерода в
молекуле бензола находится в состоянии sp2-гибри-
дизации и связан с двумя
соседними атомами углерода и атомом водорода тремя s-связями. Валентные углы между каждой парой s-связей равны 120°. Таким образом, скелет s-связей
представляет собой правильный шестиугольник, в котором все атомы углерода и все s-связи
С-С и С-Н лежат в одной плоскости:
Кроме этого, в молекуле бензола каждый С-атом имеет негибридную р-орбиталь,
которая расположена перпендикулярно плоскости молекулы и может принимать
участие в образовании -связей.
Бензол С6Н6
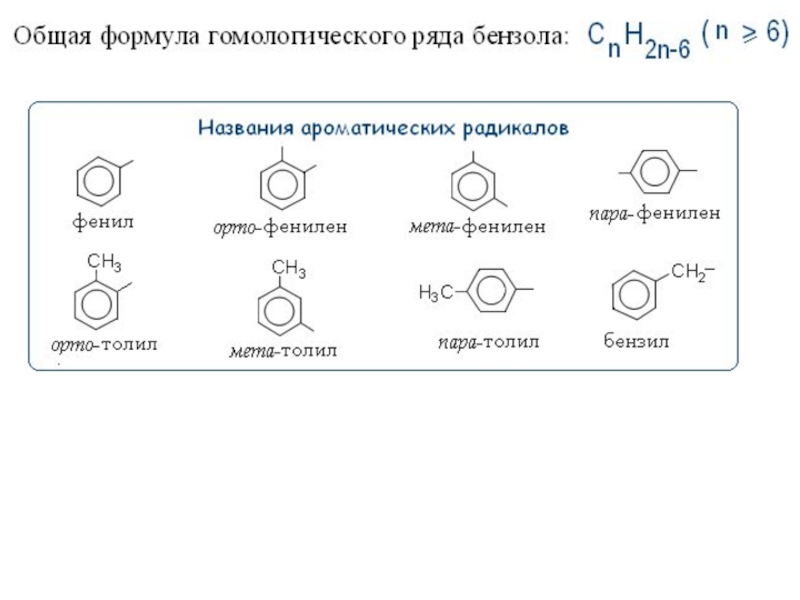
Молекулярная формула бензола – С6Н6
Слайд 7р-Электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания
соседних 2р-АО и образуют единое циклическое (делокализованное) p-электронное облако,
сосредоточенное
над и под плоскостью кольца:p-электроны
p-электроны
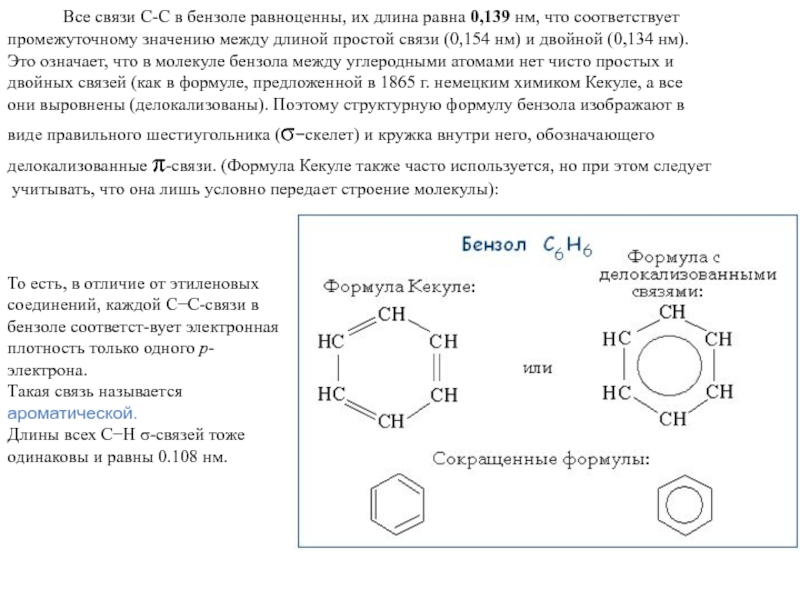
Слайд 8 Все связи С-С в бензоле
равноценны, их длина равна 0,139 нм, что соответствует
промежуточному значению
между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и
двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Кекуле, а все
они выровнены (делокализованы). Поэтому структурную формулу бензола изображают в
виде правильного шестиугольника (s-скелет) и кружка внутри него, обозначающего
делокализованные p-связи. (Формула Кекуле также часто используется, но при этом следует
учитывать, что она лишь условно передает строение молекулы):
То есть, в отличие от этиленовых соединений, каждой СС-связи в бензоле соответст-вует электронная плотность только одного р-электрона.
Такая связь называется ароматической.
Длины всех СН -связей тоже одинаковы и равны 0.108 нм.
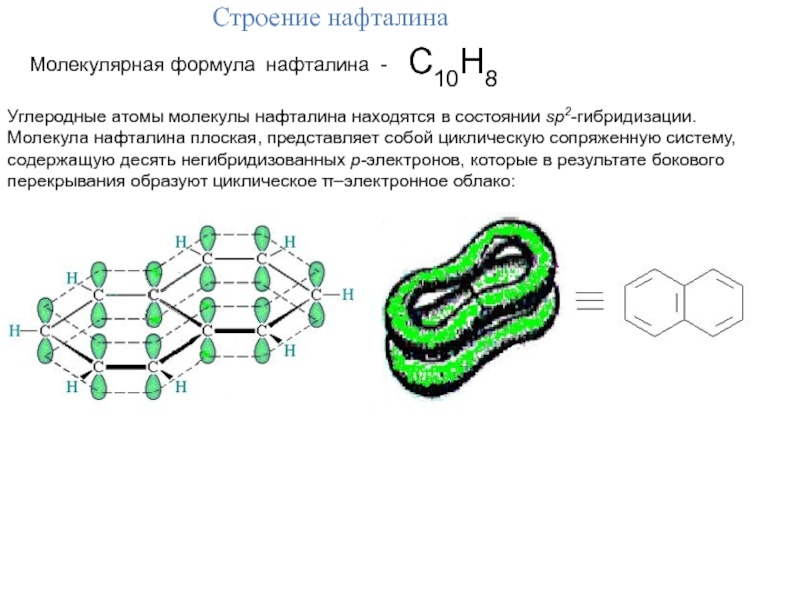
Слайд 9С10Н8
Строение нафталина
Молекулярная формула нафталина -
Углеродные атомы молекулы нафталина
находятся в состоянии sp2-гибридизации.
Молекула нафталина плоская, представляет собой циклическую
сопряженную систему, содержащую десять негибридизованных р-электронов, которые в результате бокового
перекрывания образуют циклическое –электронное облако:
Слайд 10Однако, по данным рентгеноструктурного анализа, в отличие от бензола, СС-связи
в
молекуле нафталина неравноценны, а электронная плотность распределена не совсем
равномерно: -углеродные атомы имеют небольшой избыток электронной плотности, а
-углеродные атомы электронодефицитны. Вследствие этой неравноценности углеродных
атомов нафталин и его гомологи более реакционноспособны в реакциях электрофильного
замещения, которые происходят преимущественно в -положение. Кроме этого, нафталин
легче, чем бензол вступает в реакции присоединения и окисления.
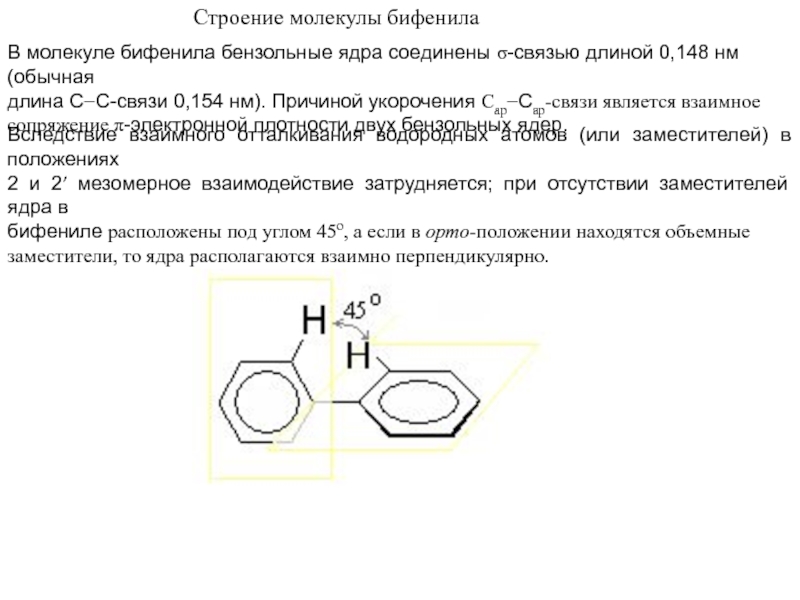
Слайд 11Строение молекулы бифенила
В молекуле бифенила бензольные ядра соединены -связью
длиной 0,148 нм (обычная
длина СС-связи 0,154 нм). Причиной укорочения
СарСар-связи является взаимное сопряжение -электронной плотности двух бензольных ядер.
Вследствие взаимного отталкивания водородных атомов (или заместителей) в положениях
2 и 2 мезомерное взаимодействие затрудняется; при отсутствии заместителей ядра в
бифениле расположены под углом 45о, а если в орто-положении находятся объемные
заместители, то ядра располагаются взаимно перпендикулярно.
Слайд 12По химическим свойствам арены отличаются от предельных и непредельных
углеводородов.
Это объясняется особенностями строения бензольного кольца.
Делокализация шести p-электронов в
циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов.
Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут
к нарушению ароматичности. Для них наиболее характерны реакции, идущие с сохранением
ароматической системы, а именно, реакции замещения атомов водорода, связанных с
ароматическим ядром.
Наличие областей повышенной p-электронной плотности с двух сторон плоского
ароматического цикла приводит к тому, что бензольное кольцо является нуклеофилом и в
связи с этим легко подвергается атаке электронодефицитными электрофильными
реагентами. Таким образом, для ароматических соединений наиболее типичны реакции
электрофильного замещения - SЕ.
Слайд 13Реакции электрофильного замещения – SE
Химические свойства аренов
К реакциям электрофильного
замещения (SE) относятся; нитрование (HNO3+H2SO4),
галогенирование (X2+AlCl3), сульфирование (H2SO4), и
реакции Фриделя-Крафтса (RX+AlCl3 – алкилирование; RCXO+ AlCl3 - ацилирование).
Схему SE-реакции можно записать в общем виде:
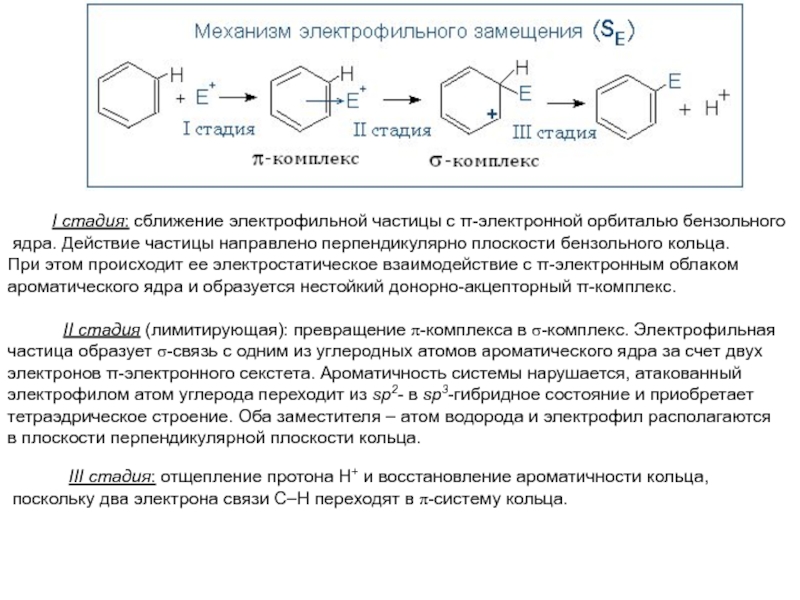
Слайд 14 I стадия: сближение электрофильной частицы с
-электронной орбиталью бензольного
ядра. Действие частицы направлено перпендикулярно плоскости бензольного
кольца. При этом происходит ее электростатическое взаимодействие с -электронным облаком
ароматического ядра и образуется нестойкий донорно-акцепторный -комплекс.
II стадия (лимитирующая): превращение p-комплекса в s-комплекс. Электрофильная
частица образует s-связь с одним из углеродных атомов ароматического ядра за счет двух
электронов -электронного секстета. Ароматичность системы нарушается, атакованный
электрофилом атом углерода переходит из sp2- в sp3-гибридное состояние и приобретает
тетраэдрическое строение. Оба заместителя – атом водорода и электрофил располагаются
в плоскости перпендикулярной плоскости кольца.
III стадия: отщепление протона Н+ и восстановление ароматичности кольца,
поскольку два электрона связи С–Н переходят в p-систему кольца.
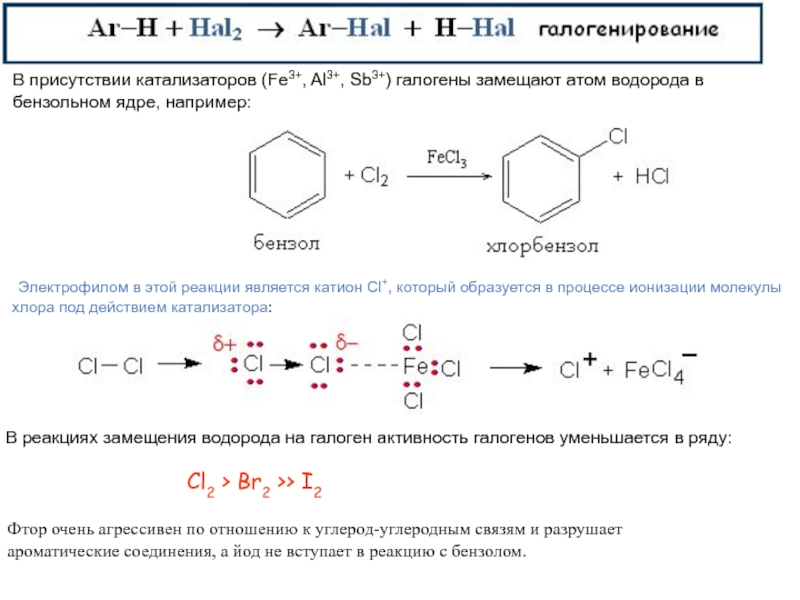
Слайд 15Cl2 > Br2 >> I2
В присутствии катализаторов (Fe3+,
Al3+, Sb3+) галогены замещают атом водорода в
бензольном ядре, например:
Электрофилом в этой реакции является катион Cl+, который образуется в процессе ионизации молекулыхлора под действием катализатора:
В реакциях замещения водорода на галоген активность галогенов уменьшается в ряду:
Фтор очень агрессивен по отношению к углерод-углеродным связям и разрушает
ароматические соединения, а йод не вступает в реакцию с бензолом.
Слайд 16 При хлорировании нафталина в присутствии FeCl3
и температуре 90-110оС образуется
преимущественно -хлорнафталин. Бромирование осуществляется без катализатора
черезстадию присоединения в положения 1,4 с последующим отщеплением галогеноводорода и
образованием монобромпроизводного:
Антрацен (при 0ОС) и фенантрен тоже сначала присоединяют галоген в положения 9,10, а
затем при нагревании отщепляют галогеноводород с образованием 9-галогенпроизводного
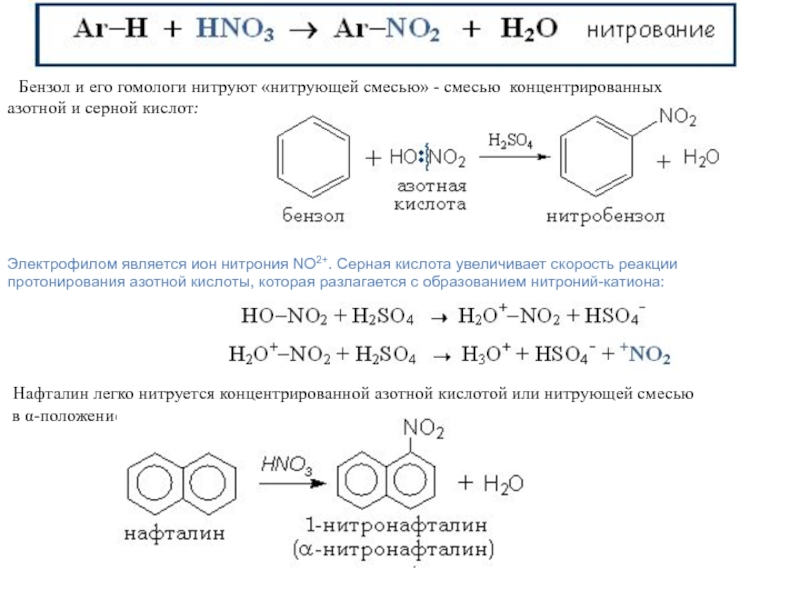
Слайд 17
Бензол и его гомологи нитруют «нитрующей смесью» -
смесью концентрированных
азотной и серной кислот:
Электрофилом является ион нитрония NO2+.
Серная кислота увеличивает скорость реакции протонирования азотной кислоты, которая разлагается с образованием нитроний-катиона:
Нафталин легко нитруется концентрированной азотной кислотой или нитрующей смесью
в -положение
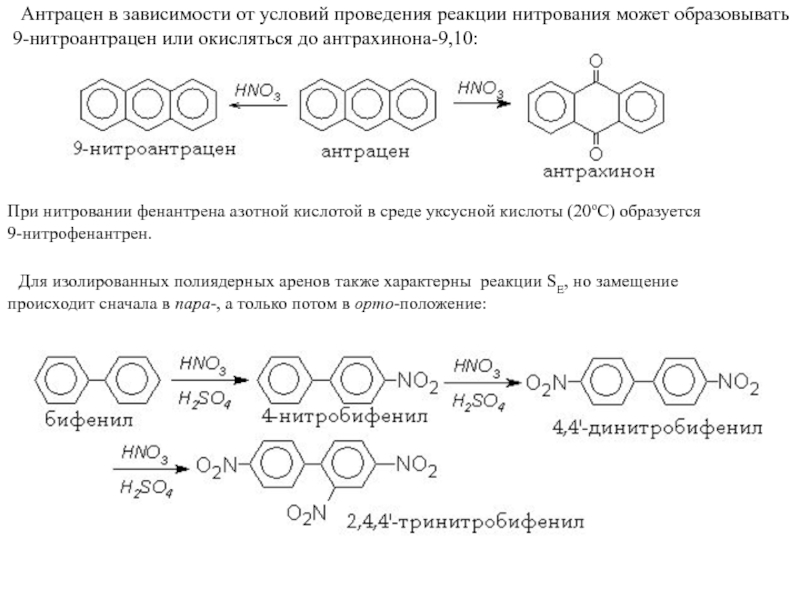
Слайд 18 Антрацен в зависимости от условий проведения реакции нитрования
может образовывать
9-нитроантрацен или окисляться до антрахинона-9,10:
При нитровании фенантрена азотной
кислотой в среде уксусной кислоты (20оС) образуется 9-нитрофенантрен.
Для изолированных полиядерных аренов также характерны реакции SE, но замещение
происходит сначала в пара-, а только потом в орто-положение:
Слайд 19Как реагенты сульфирования бензола используют концентрированную серную кислоту, олеум,
оксид
серы (VI), хлористый сульфурил, например:
Электрофил - катион гидросульфония –
образуется в концентрированной серной кислоте по схеме: Нафталин сульфируется концентрированной серной кислоты, причем направление реакции
определяется температурой реакционной среды:
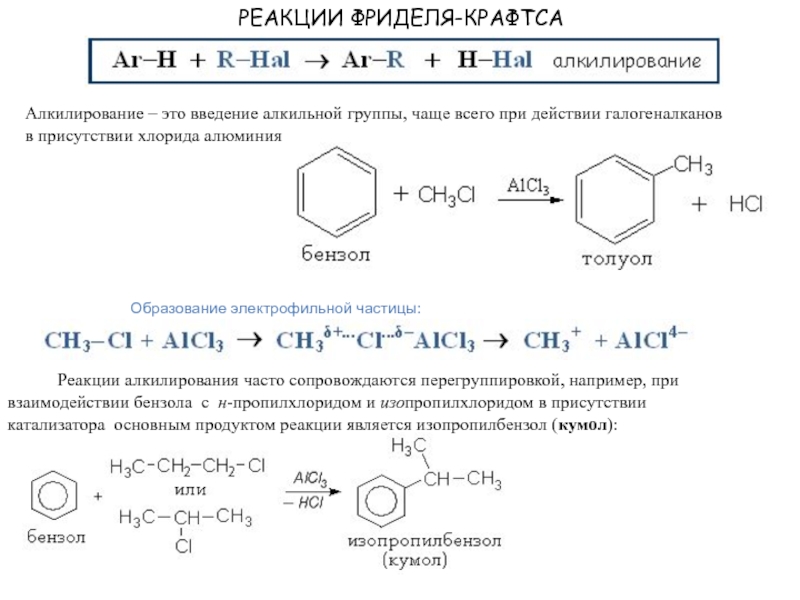
Слайд 20РЕАКЦИИ ФРИДЕЛЯ-КРАФТСА
Алкилирование – это введение алкильной группы, чаще всего при
действии галогеналканов
в присутствии хлорида алюминия
Образование электрофильной частицы:
Реакции алкилирования часто сопровождаются перегруппировкой, например, при взаимодействии бензола с н-пропилхлоридом и изопропилхлоридом в присутствии
катализатора основным продуктом реакции является изопропилбензол (кумол):
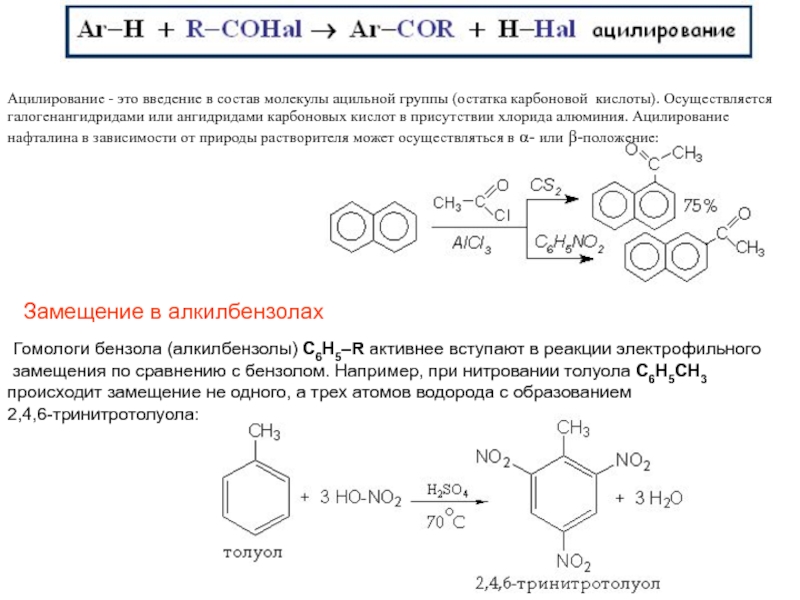
Слайд 21Замещение в алкилбензолах
Ацилирование - это введение в состав молекулы
ацильной группы (остатка карбоновой кислоты). Осуществляется галогенангидридами или ангидридами карбоновых
кислот в присутствии хлорида алюминия. Ацилирование нафталина в зависимости от природы растворителя может осуществляться в - или -положение: Гомологи бензола (алкилбензолы) С6Н5–R активнее вступают в реакции электрофильного
замещения по сравнению с бензолом. Например, при нитровании толуола С6Н5CH3
происходит замещение не одного, а трех атомов водорода с образованием
2,4,6-тринитротолуола:
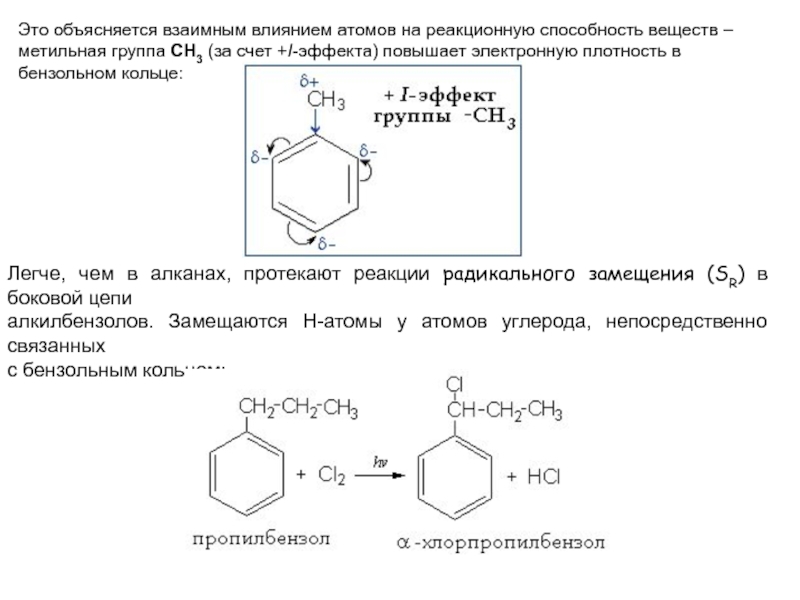
Слайд 22Это объясняется взаимным влиянием атомов на реакционную способность веществ –
метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в
бензольном кольце:
Легче, чем в алканах, протекают реакции радикального замещения (SR) в боковой цепи
алкилбензолов. Замещаются Н-атомы у атомов углерода, непосредственно связанных
с бензольным кольцом:
Слайд 23Влияние заместителей на направление и скорость реакций электрофильного
замещения в
аренах
Ориентация замещения в бензольном ядре
В молекуле бензола электронная плотность
распределена равномерно и все связи равноценны, но с введением заместителя равномерность распределения -электронной
плотности нарушается и происходит ее перераспределение. Место вхождения
последующего заместителя определяется природой предыдущего заместителя, поэтому
первый заместитель называют ориентантом.
Заместители делят на две группы - заместители I рода, которые ориентируют в орто- и
пара-положения, и заместители II рода - мета-ориентанты.
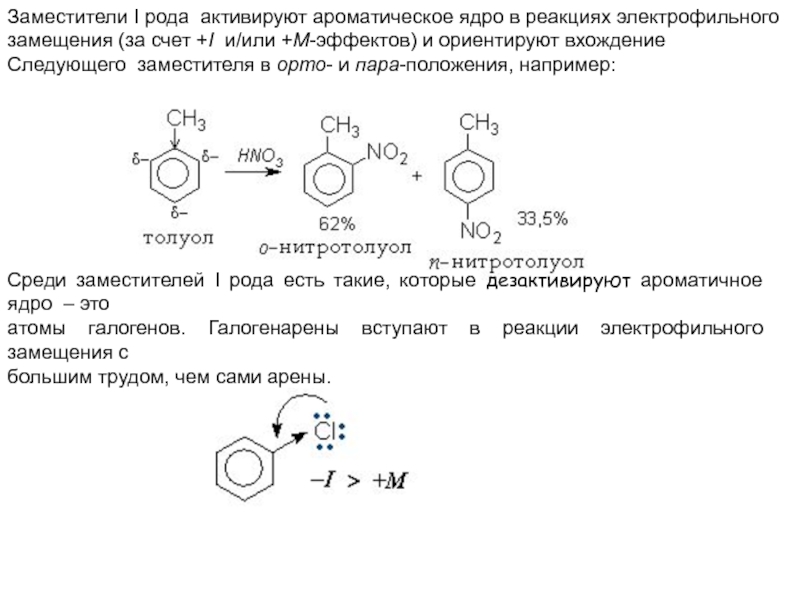
Слайд 24Заместители I рода активируют ароматическое ядро в реакциях электрофильного
замещения (за
счет +І и/или +М-эффектов) и ориентируют вхождение
Следующего заместителя в
орто- и пара-положения, например: Среди заместителей I рода есть такие, которые дезактивируют ароматичное ядро – это
атомы галогенов. Галогенарены вступают в реакции электрофильного замещения с
большим трудом, чем сами арены.
Слайд 25 Заместители II рода дезактивируют ароматическое ядро в реакциях
электрофильного замещения (за счет I и/или М-эффектов) и ориентируют
вхождение
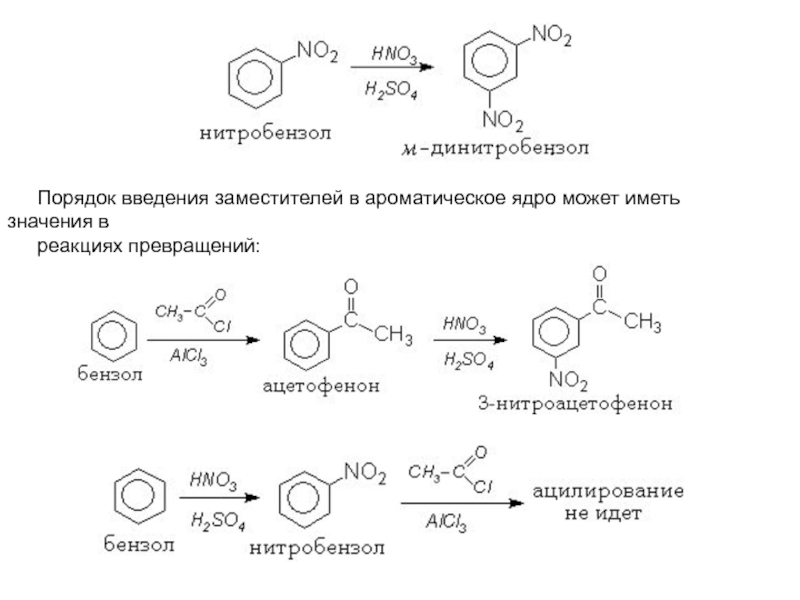
следующего заместителя в мета-положение. Слайд 26Порядок введения заместителей в ароматическое ядро может иметь значения в
реакциях превращений:
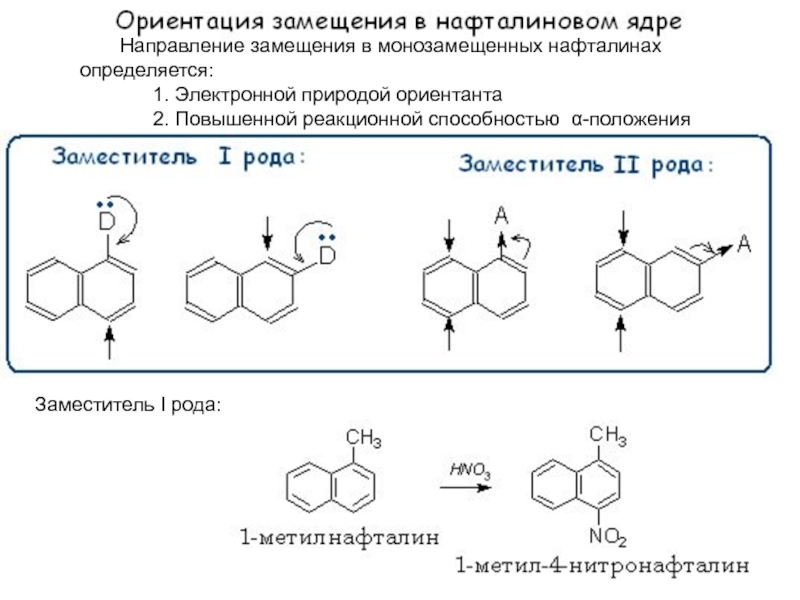
Слайд 27Направление замещения в монозамещенных нафталинах определяется:
1. Электронной
природой ориентанта
2. Повышенной реакционной способностью -положения
Заместитель I
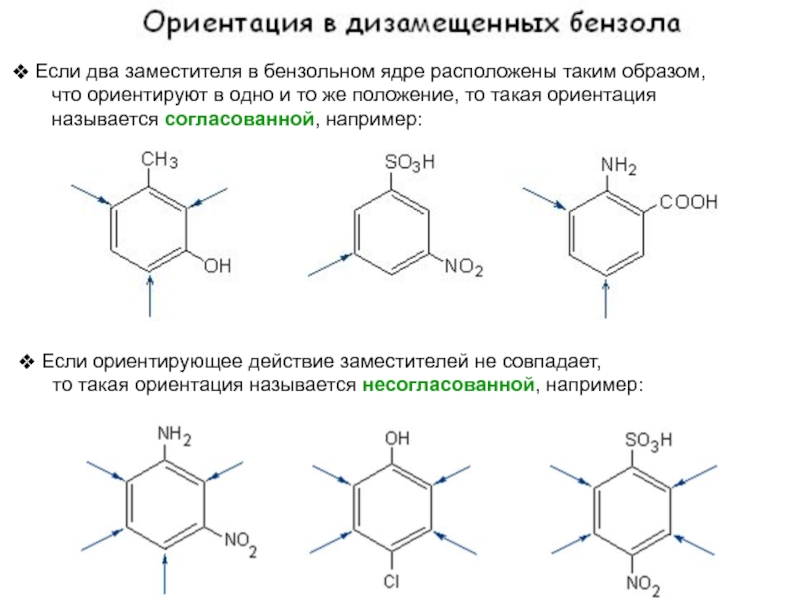
рода: Слайд 29 Если два заместителя в бензольном ядре расположены таким образом,
что ориентируют в одно и то же положение,
то такая ориентация называется согласованной, например:
Если ориентирующее действие заместителей не совпадает,
то такая ориентация называется несогласованной, например:
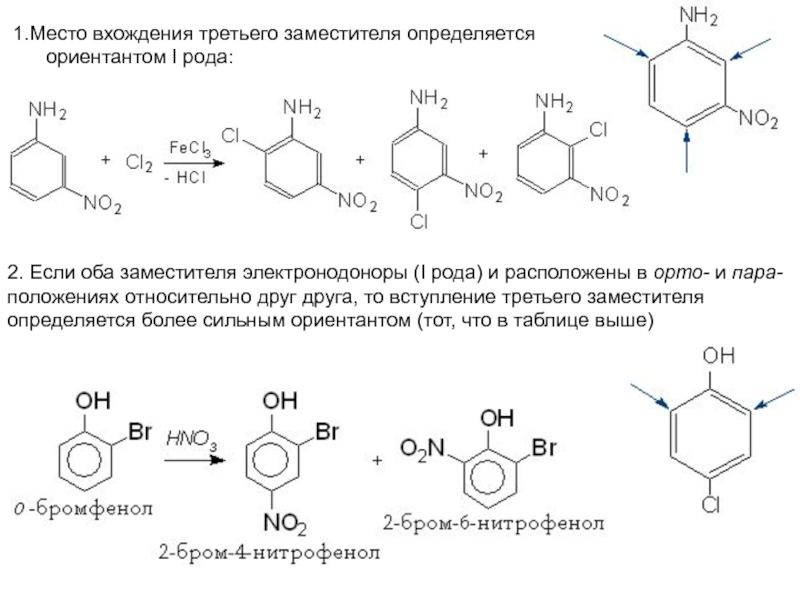
Слайд 30Место вхождения третьего заместителя определяется
ориентантом I рода:
2. Если
оба заместителя электронодоноры (I рода) и расположены в орто- и
пара-положениях относительно друг друга, то вступление третьего заместителя определяется более сильным ориентантом (тот, что в таблице выше)Слайд 313. Если два электроноакцепторных заместителя II рода находятся в орто-
и пара-
положениях, то вход третьего заместителя определяется более
сильным ориентантом (тем, что в таблице ниже)
Слайд 32 Реакции присоединения нехарактерны для аренов, так как для их
осуществления
необходимо преодолеть энергетический барьер сопряженной системы -электронов.
Поэтому эти
реакции возможны при действии частиц с неспаренными электронами(свободных радикалов).
Реакции присоединения - AR
1. Каталитическое гидрирование
Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении
в присутствии катализаторов. Бензол и его гомологи гидрируются с образованием соответствующих
циклогексанов над никелем Ренея (температура 120-150о и давление 100-150 атм.). Самыми
эффективными являются катализаторы платиновой группы.
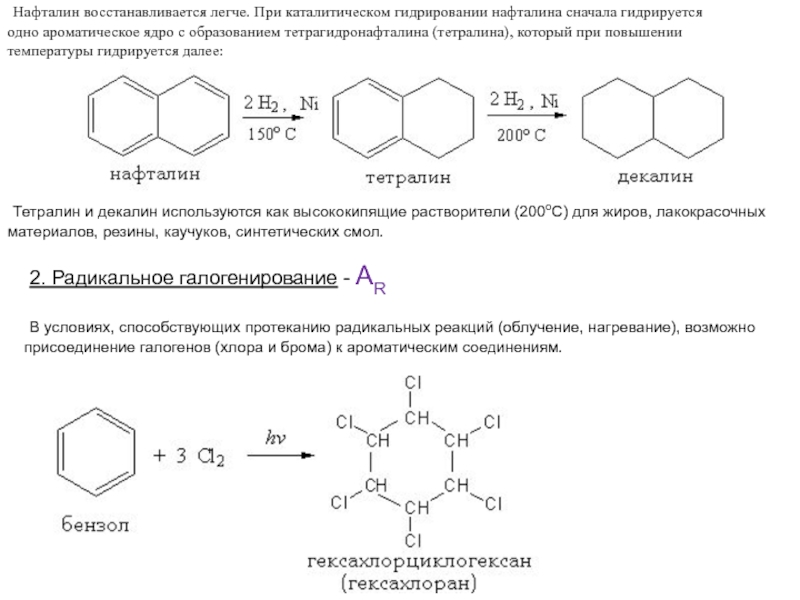
Слайд 33 Нафталин восстанавливается легче. При каталитическом гидрировании нафталина сначала гидрируется
одно ароматическое ядро с образованием тетрагидронафталина (тетралина), который при повышении
температуры гидрируется далее:
Тетралин и декалин используются как высококипящие растворители (200оС) для жиров, лакокрасочных
материалов, резины, каучуков, синтетических смол.
2. Радикальное галогенирование - AR
В условиях, способствующих протеканию радикальных реакций (облучение, нагревание), возможно
присоединение галогенов (хлора и брома) к ароматическим соединениям.
Слайд 34Для гомологов бензола в этих условиях легче протекает реакция радикального
замещения - SR
водородных атомов в боковой цепи:
3. Диеновый синтез
При
УФ-облучении бензол способен вступать в реакцию циклоприсоединения (реакция Дильса-Альдера, диеновый синтез) с малеиновым ангидридом:
Антрацен также легко присоединяет малеиновый ангидрид и другие диенофилы.
Слайд 35Окисление
При обычных условиях бензол не окисляется даже под
действием таких сильных окислителей как
KMnO4 и K2Cr2О7. При окислении
кислородом воздуха в присутствии ванадиевого катализатора происходитчастичное окисление бензола до малеинового ангидрида:
В отличие от бензола его гомологи довольно легко окисляются до карбоновых кислот под действием таких
окислителей как бихромат натрия в кислой среде, оксид хрома (VI) в уксусной кислоте либо перманганат
калия. Причем, независимо от длины боковой углеводородной цепи, карбоксильная группа образующейся
кислоты всегда соединена с ароматическим ядром:
Слайд 36Нафталин окисляется легче бензола:
Замещенные нафталины окисляются в зависимости
от типа заместителя в ядре: если в ядре
присутствует электронодонорный
заместитель, то будет окисляться именно это ядро, если это электроноакцепторный заместитель, то будет окисляться незамещенное ядро.
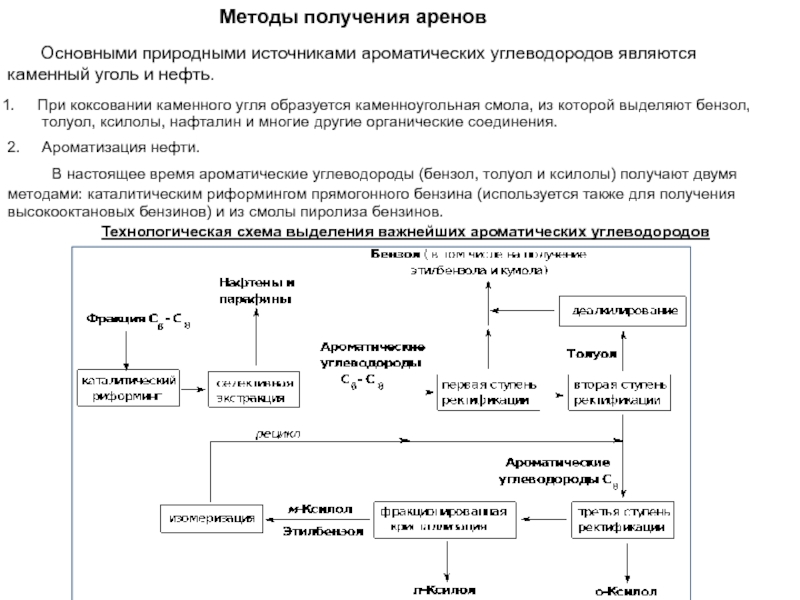
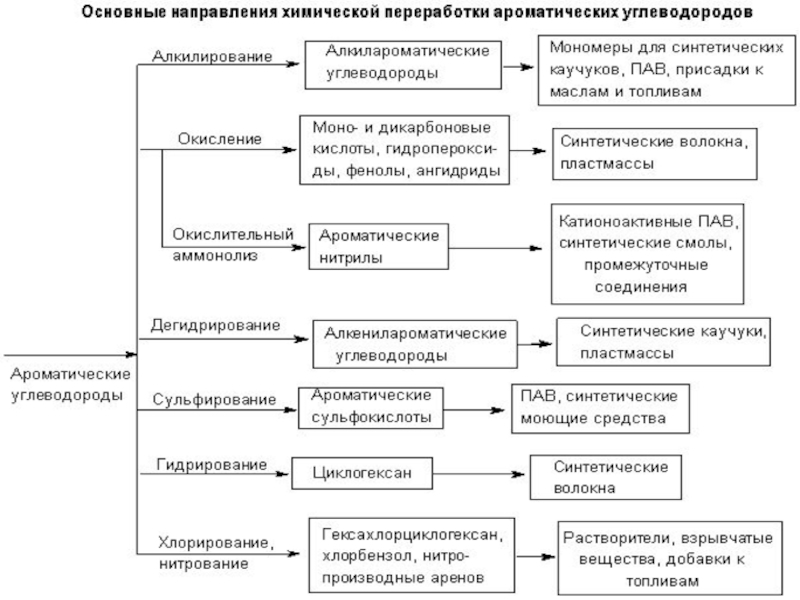
Слайд 38Методы получения аренов
Основными природными источниками ароматических углеводородов
являются
каменный уголь и нефть.
При коксовании каменного угля образуется каменноугольная
смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
2. Ароматизация нефти.
В настоящее время ароматические углеводороды (бензол, толуол и ксилолы) получают двумя
методами: каталитическим риформингом прямогонного бензина (используется также для получения
высокооктановых бензинов) и из смолы пиролиза бензинов.
Технологическая схема выделения важнейших ароматических углеводородов
Слайд 391. Каталитический риформинг бензинов
Каталитический риформинг - один из важнейших нефтехимических процессов,
который применяется
для повышения октанового числа легких дистиллятов, чтобы их можно было использовать в качестве топлива в мощных двигателях внутреннего сгорания.
При нагревании фракции нефти С6С8 до температуры 500525оС и давлении
1040 атм. в присутствии катализаторов (платина, нанесенная на высокочистую окись
алюминия) происходят три основные группы процессов: дегидроциклизация парафинов,
изомеризация и дегидрирование нафтенов с образованием бензола, толуола, этилбензола
и ксилолов.
Большинство углеводородов, содержащихся в исходном сырье, реагирует в процессе
риформинга сразу по нескольким направлениям.
Изомеризация:
Изомеризация н.парафинов в изопарафины
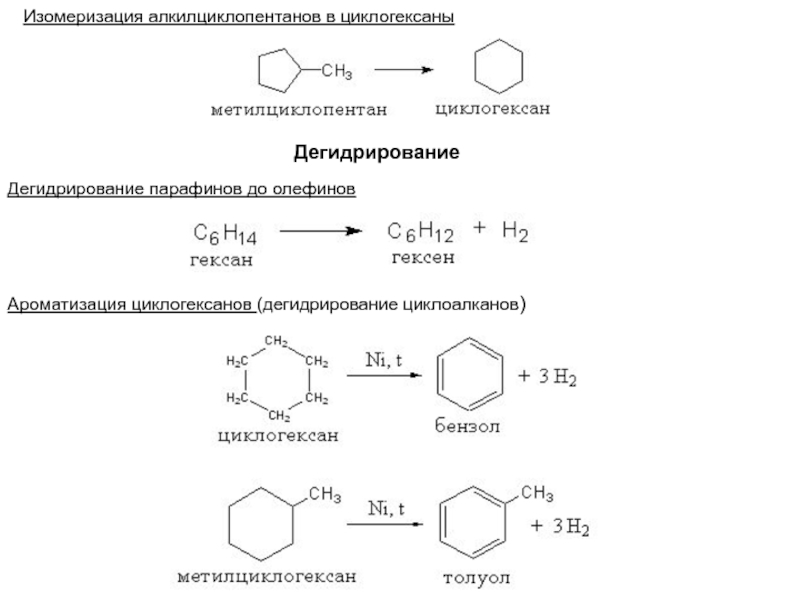
Слайд 40Изомеризация алкилциклопентанов в циклогексаны
Дегидрирование
Дегидрирование
парафинов до олефинов
Ароматизация циклогексанов (дегидрирование циклоалканов)
Слайд 41Гидрокрекинг (дегидроизомеризация)
Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора
2.
Деалкилирование ароматических углеводородов
Потребность в бензоле значительно превышает потребность в
толуоле, а толуол в избыточном количестве образуется при каталитическом риформинге и при пиролизе. Поэтому часть бензола получают
деалкилированием или диспропорционированием толуола. Процесс деалкилирования используется
также для получения нафталина из алкилнафталинов.
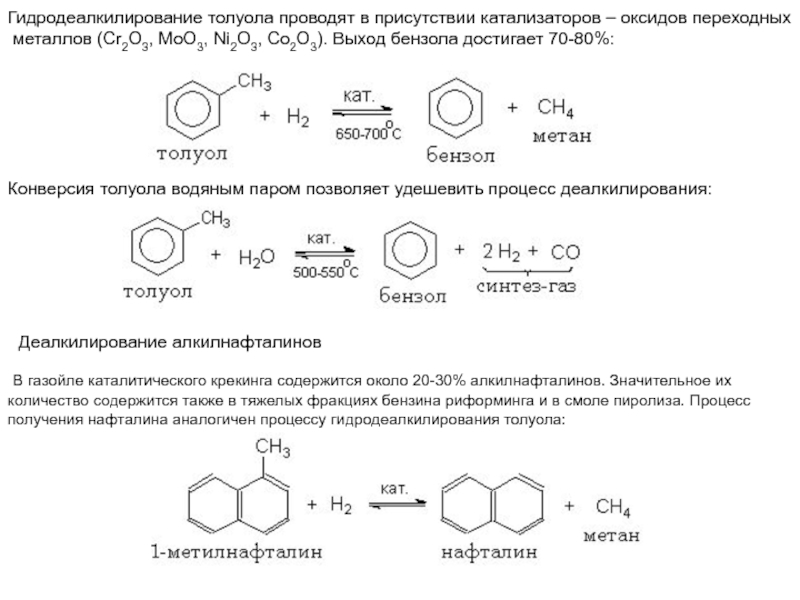
Слайд 42Гидродеалкилирование толуола проводят в присутствии катализаторов – оксидов переходных
металлов
(Cr2O3, MoO3, Ni2O3, Co2O3). Выход бензола достигает 70-80%:
Конверсия толуола водяным
паром позволяет удешевить процесс деалкилирования: Деалкилирование алкилнафталинов
В газойле каталитического крекинга содержится около 20-30% алкилнафталинов. Значительное их
количество содержится также в тяжелых фракциях бензина риформинга и в смоле пиролиза. Процесс
получения нафталина аналогичен процессу гидродеалкилирования толуола:
Слайд 43Диспропорционирование толуола.
Этот процесс позволяет
получать бензол и ксилолы. Процесс проводят при 350-520оС
и давлении
10-12 атм. Ксилолы могут затем подвергаться изомеризации с целью получения п-ксилола:
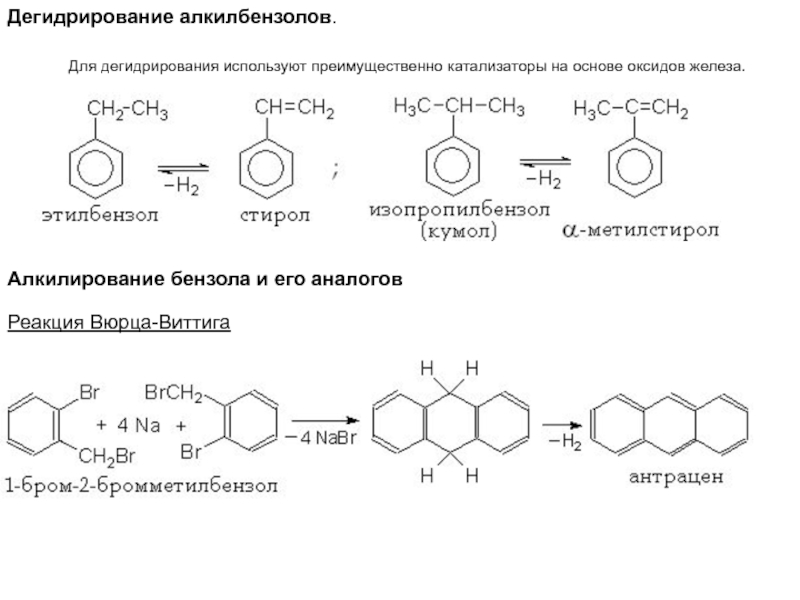
Слайд 44Дегидрирование алкилбензолов.
Для дегидрирования
используют преимущественно катализаторы на основе оксидов железа.
Алкилирование бензола и его
аналогов Реакция Вюрца-Виттига
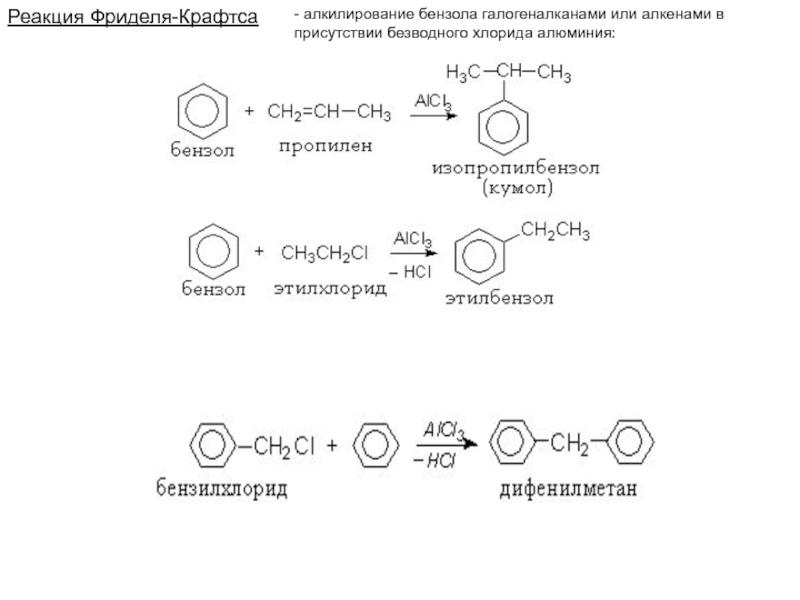
Слайд 45Реакция Фриделя-Крафтса
- алкилирование бензола галогеналканами или алкенами в
присутствии
безводного хлорида алюминия:
Слайд 46Циклотримеризация алкинов
Конденсация бензола с ацетиленом
Реакция Ульмана
При пропускании паров
алкинов при температуре 400-600оС над активированным углем происходит
циклотримеризация с
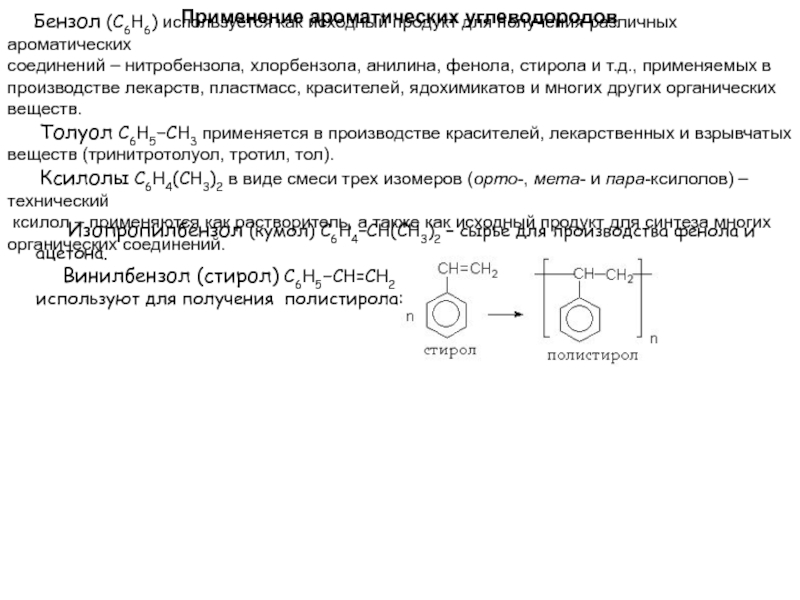
образованием ароматического ядра:Слайд 47Применение ароматических углеводородов
Бензол (С6Н6) используется как исходный
продукт для получения различных ароматических
соединений – нитробензола, хлорбензола, анилина,
фенола, стирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и взрывчатых
веществ (тринитротолуол, тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета- и пара-ксилолов) – технический
ксилол – применяются как растворитель, а также как исходный продукт для синтеза многих
органических соединений.
Изопропилбензол (кумол) С6Н4СН(СН3)2 – сырье для производства фенола и ацетона.
Винилбензол (стирол) C6H5-CН=СН2
используют для получения полистирола:
Слайд 49 Возможная экологическая опасность аренов
Крупным
источником загрязнения окружающей среды является коксохимическое
производство, потому что, как
и раньше, кокс остается необходимым компонентом для металлургии. В процессе коксования угля образуются и попадают в окружающую среду
арены, фенолы, крезолы, нафталин и другие полиядерные арены, которые отравляют
растительный и животный мир на значительной территории вокруг коксохимического
производства. Ароматические углеводороды токсичны и для человека. Хроническое
отравление ароматическими соединениями поражает почки, костный мозг и угнетает
кроветворение.
Крупнотоннажные производства алкилбензолов, процессы, основанные на их
использовании (получение СМС, фенола, ацетона, карбоновых кислот и их производных,
ароматических аминов и красителей на их основе) относятся к еще более вредным
производствам.