Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотная кислота. Свойства и получение
Содержание
- 1. Азотная кислота. Свойства и получение
- 2. Краткая характеристика:Одноосновная кислота Сильная БесцветнаяЯвляется ядовитой При
- 3. Получение
- 4. Химические свойства1. С основными и амфотерными оксидами
- 5. Химические свойства Окисление неметаллов: S +
- 6. Химические свойстваВзаимодействие бромидов и иодидов с HNO3:
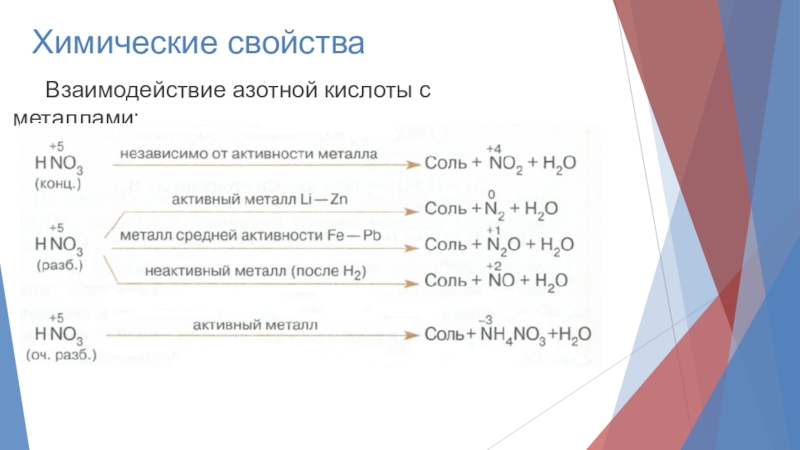
- 7. Химические свойства Взаимодействие азотной кислоты с металлами:
- 8. Химические свойстваБлагородные Ме не реагируют с HNO3
- 9. ПрименениеВ производстве минеральных удобрений В военной промышленности
- 10. ИнтересноеСмесь азотной и серной кислот носит название
- 11. Скачать презентанцию
Краткая характеристика:Одноосновная кислота Сильная БесцветнаяЯвляется ядовитой При хранении разлагается и за счет бурого NO2 приобретает желтоватый цвет 4HNO3=4NO2+2H2O+O2
Слайды и текст этой презентации
Слайд 2Краткая характеристика:
Одноосновная кислота
Сильная
Бесцветная
Является ядовитой
При хранении разлагается и за счет бурого
NO2 приобретает желтоватый цвет
4HNO3=4NO2+2H2O+O2
Слайд 3Получение
Промышленный способ
4NH3 + 5O2 =
4NO + 6H2O (t = 800°С, kat - Pt)
2NO +
O2 = 2NO24NO2 + O2 + 2H2O = 4HNO3 (p = 50 а.т.м) В лаборатории можно получить 100% HNO3, осушая твердый NaNO3 H2SO4 конц:
NaNO3 тв. + H2SO4 конц = HNO3↑ + NaHSO4 (t ≈ 40°С)
Слайд 4Химические свойства
1. С основными и амфотерными оксидами
CuO + 2HNO3 = Cu(NO3)2 + H2O
2. С основаниями:
HNO3 + NaOH = NaNO3 + H2O
3. С солями слабых кислот:
2HNO3 + Na2CO3 = 2NaNO3 + CO2 + H2O
Слайд 5Химические свойства
Окисление неметаллов:
S + 6HNO3(60%) = H2SO4 +
6NO2 + 2H2O
S + 2HNO3(40%) = H2SO4 + 2NO
P +
5HNO3 (60%) = H3PO4 + 5NO2 + H2O
3P + 5HNO3 (30%) + 2H2O = 3H3PO4 + 5NO
I2 + 10HNO3 (60%) → t → 2HIO3 + 10NO2 ↑ + 4H2O
Слайд 6Химические свойства
Взаимодействие бромидов и иодидов с HNO3:
NaBr + HNO3 (60%!)
= Br2 + NrNO3 + H2O + NO2
3CaBr2 + 8HNO3
(разб) = 3Br2 + 3Ca(NO3)2 + 2NO + 4H2O
KI + HNO3 (60%) = I2 + KNO3 + H2O + NO2
6NaI + 8HNO3 (разб) = I2 + NaNO3 + H2O + NO Аналогичные реакции с HI и HBr.
Слайд 8Химические свойства
Благородные Ме не реагируют с HNO3 любой концентрации, но
растворяются в смеси HCl и HNO3 («царская водка»), взятой в
пропорции 3:1 соответственно:Au + HNO3 конц. + 4НСlконц. = H[AuCl4] + NO↑ + 2H2O
НЕ реагируют с концентрированной HNO3 Fe, Al, Cr (пассивируются), только при нагревании!
Слайд 9Применение
В производстве минеральных удобрений
В военной промышленности (дымящая — в производстве взрывчатых
веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ,
в том числе отравляющих)В ювелирном деле — основной способ определения золота в золотом сплаве
В органическом синтезе (нитроалканы, анилин, нитроцеллюлоза)
Слайд 10Интересное
Смесь азотной и серной кислот носит название «меланж».
Во времена М.В.
Ломоносова и вплоть до середины XX века азотная кислота в
обиходе именовалась крепкой водкойАзотную кислоту впервые получили алхимики из селитры и железного купороса 4KNO3 + 2FeSO4 ∙ 7H2O → Fe2O3 + 2K2SO4 + 2HNO3↑ + 2NO2↑ + 6H2O