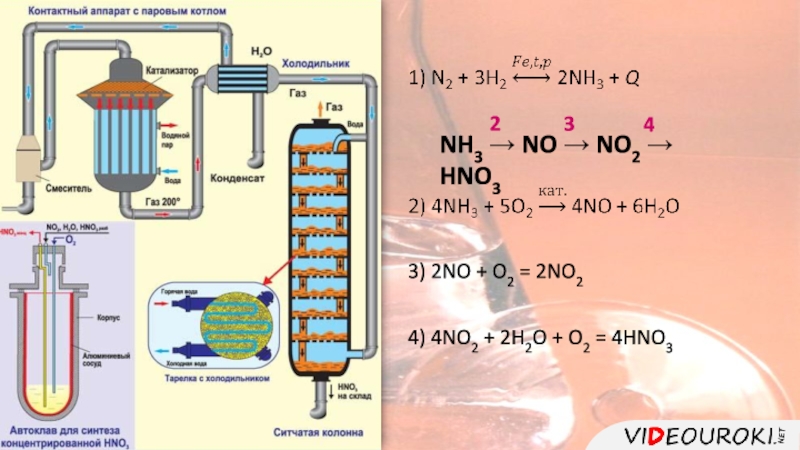
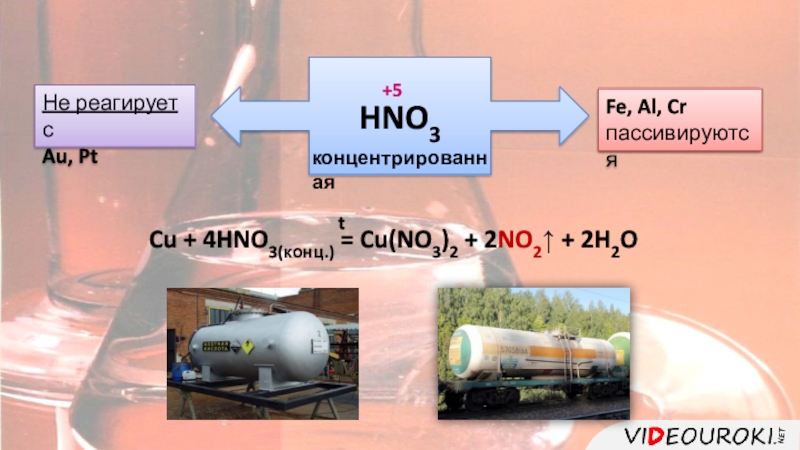
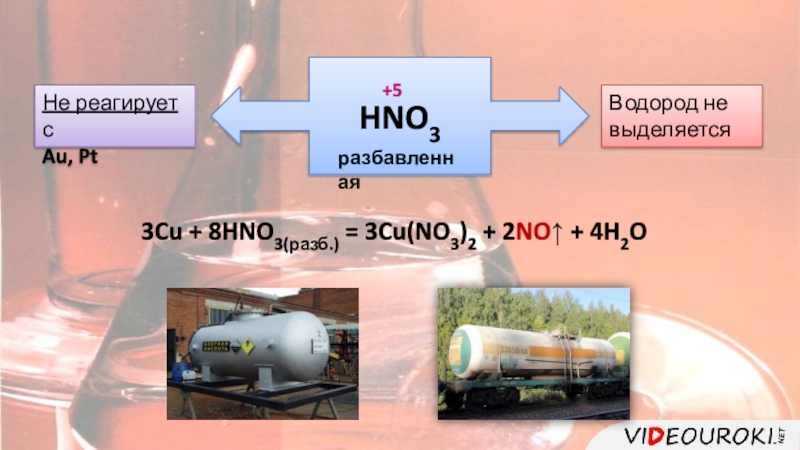
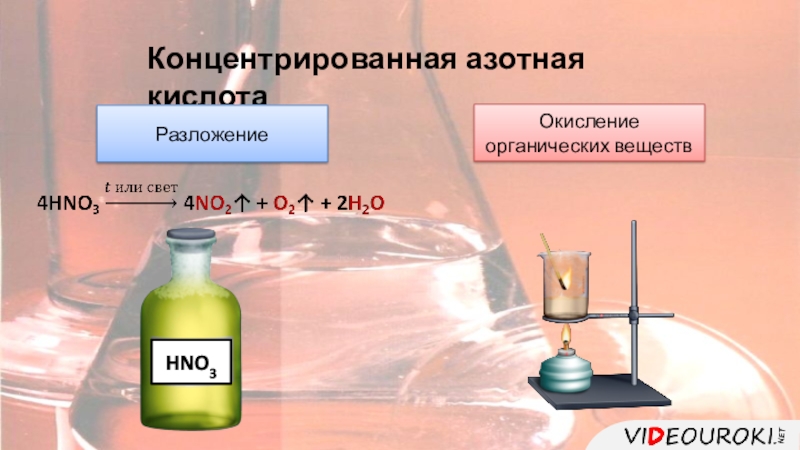
цвет.
3. Обладает резким раздражающим запахом.
4. Кипит при температуре 83 0С.
5.
С водой смешивается в любых соотношениях.Азотная кислота: