Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Бензол и его алкилзамещённые
Содержание
- 1. Бензол и его алкилзамещённые
- 2. БензолБензол(C6H6) - простейший ароматический углеводородНа протяжении истории
- 3. “Центрическая” формула Армстронга - Байера Армстронг и
- 4. Диагональная формула КлаусаБыла отвергнута и почти забыта,
- 5. Призматическая формула ЛаденбургаХимик А. Ладенбург предложил структуру
- 6. Формула ЧичибабинаЧичибабин полагал, что в бензоле атомы углерода трёхвалентны, поэтому структура бензола выглядит так:
- 7. Формулы Дьюара и Хюккеля Дьюар и Хюккель предлагали формулы с малыми циклами и двойными связями:
- 8. Формулы Кекуле и ТилеНедостатки формулы Кекуле: не
- 9. Реальное строение молекулы бензолаНаиболее верной считается структурная
- 10. Электронное строение бензолаКаждый атом С в молекуле
- 11. Электронное строение бензолаТретья p-орбиталь атома углерода не
- 12. Электронное строение бензолаВ результате шесть p-электронов (всех
- 13. Номенклатура. ИзомерияИзомерия обусловлена изомерией углеродного скелета имеющихся
- 14. Получение ароматических углеводородов в промышленности:1.Синтетические способы получения:
- 15. Получение ароматических углеводородов в промышленности:б)
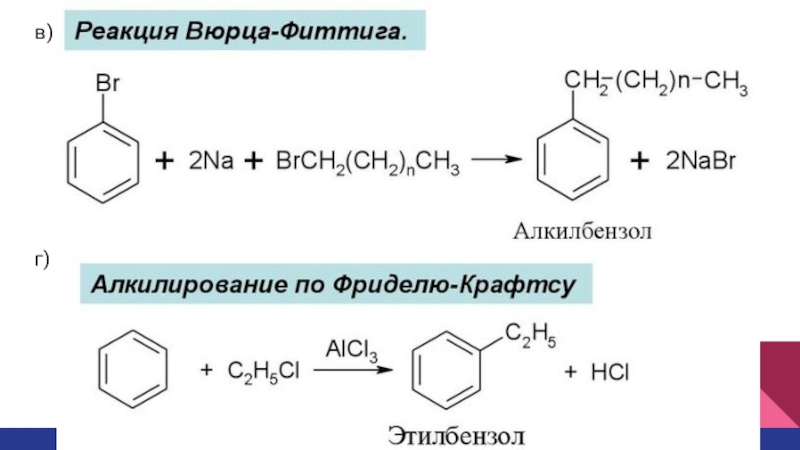
- 16. в)г)
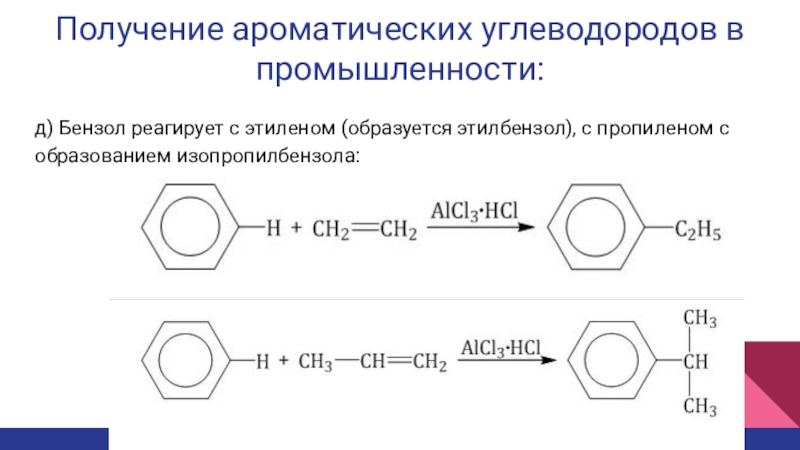
- 17. Получение ароматических углеводородов в промышленности:д) Бензол реагирует с этиленом (образуется этилбензол), с пропиленом с образованием изопропилбензола:
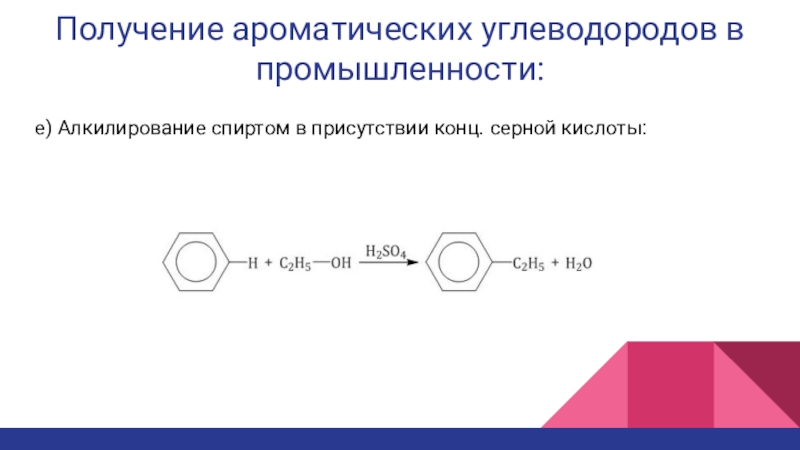
- 18. Получение ароматических углеводородов в промышленности:е) Алкилирование спиртом в присутствии конц. серной кислоты:
- 19. Физические свойства бензолаБензол – бесцветная, летучая, огнеопасная
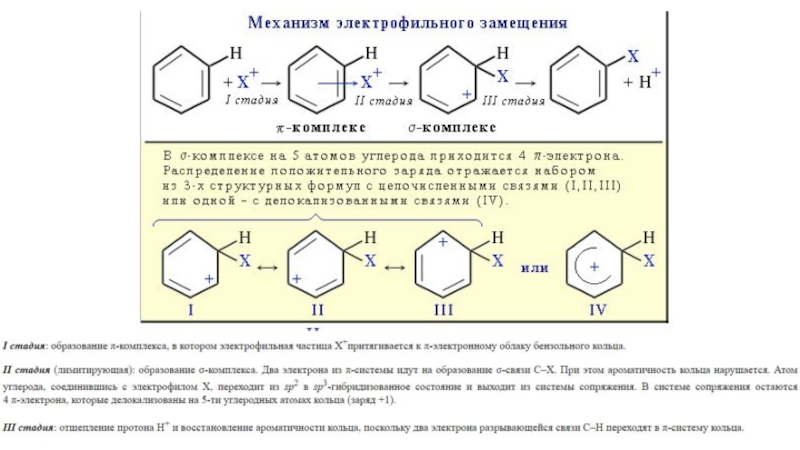
- 20. Химические свойства бензола1) Химические свойства бензола определяется
- 21. Реакции замещения.
- 22. Реакции присоединения
- 23. Слайд 23
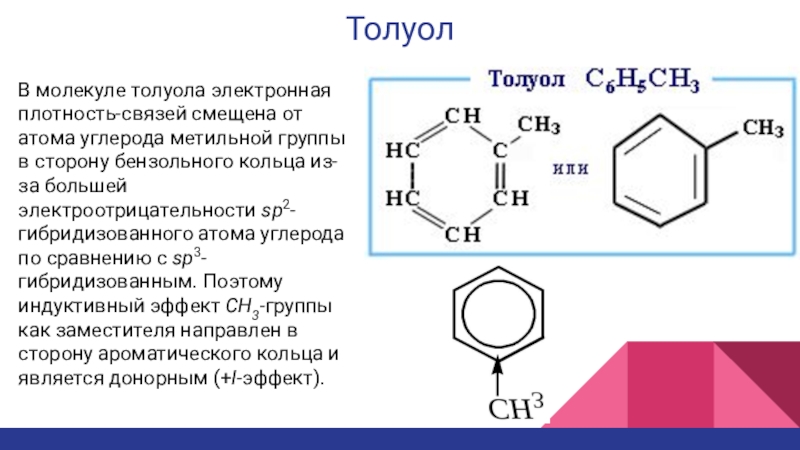
- 24. ТолуолВ молекуле толуола электронная плотность-связей смещена от
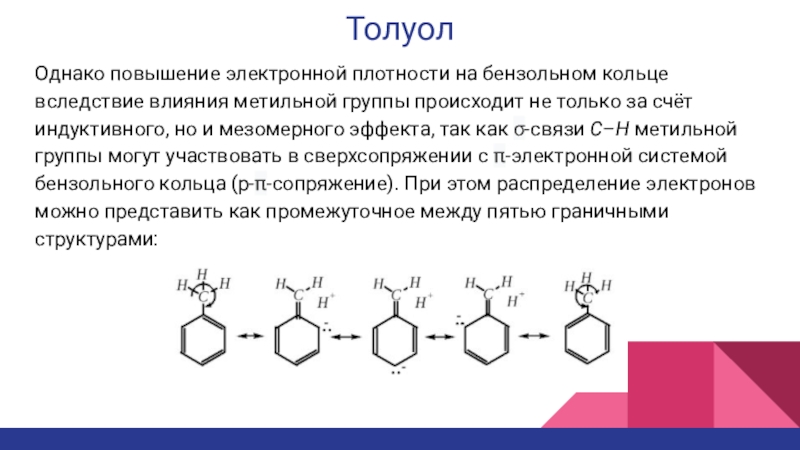
- 25. ТолуолОднако повышение электронной плотности на бензольном кольце
- 26. Толуол В результате взаимодействия СН3-группы с бензольным
- 27. Эффект Натана-Бейкера, скорость реакции
- 28. Спасибо за внимание!
- 29. Скачать презентанцию
БензолБензол(C6H6) - простейший ароматический углеводородНа протяжении истории среди учёных существовало много точек зрения относительно строения бензола. На данный момент наиболее верными считаются формула Кекуле и, особенно, формула Тиле. Далее более подробно
Слайды и текст этой презентации
Слайд 2Бензол
Бензол(C6H6) - простейший ароматический углеводород
На протяжении истории среди учёных существовало
Слайд 3“Центрическая” формула Армстронга - Байера
Армстронг и Байер высказали предположение
о том, что в молекуле бензола четвёртые валентности атомов углерода
направлены к центру молекулы и все 6 вместе насыщают друг другаДостоинство этой формулы в том, что она показывает равноценность как всех атомов углерода, образующих бензольное кольцо, так и соединяющих их связей. Однако в представлениях Армстронга - Байера есть неопределённость относительно причин и характера одновременного взаимного насыщения четвёртых валентностей всех шести атомов углерода
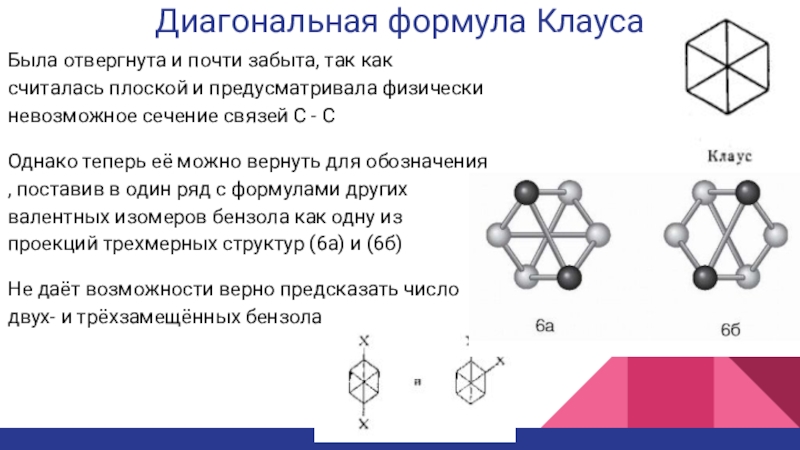
Слайд 4Диагональная формула Клауса
Была отвергнута и почти забыта, так как считалась
плоской и предусматривала физически невозможное сечение связей C - C
Однако
теперь её можно вернуть для обозначения , поставив в один ряд с формулами других валентных изомеров бензола как одну из проекций трехмерных структур (6а) и (6б)Не даёт возможности верно предсказать число двух- и трёхзамещённых бензола
Слайд 5Призматическая формула Ладенбурга
Химик А. Ладенбург предложил структуру бензола в виде
треугольной призмы
В 1973 году в США было синтезировано полициклическое соединение
с подобной структурой, носит название “призман” или бензол ЛаденбургаЭта формула формально верно передаёт число изомеров замещённых производных бензола, но была отвергнута, так как она несовместима с надёжно установленным плоским расположением углеродных атомов в бензоле
Слайд 6Формула Чичибабина
Чичибабин полагал, что в бензоле атомы углерода трёхвалентны, поэтому
структура бензола выглядит так:
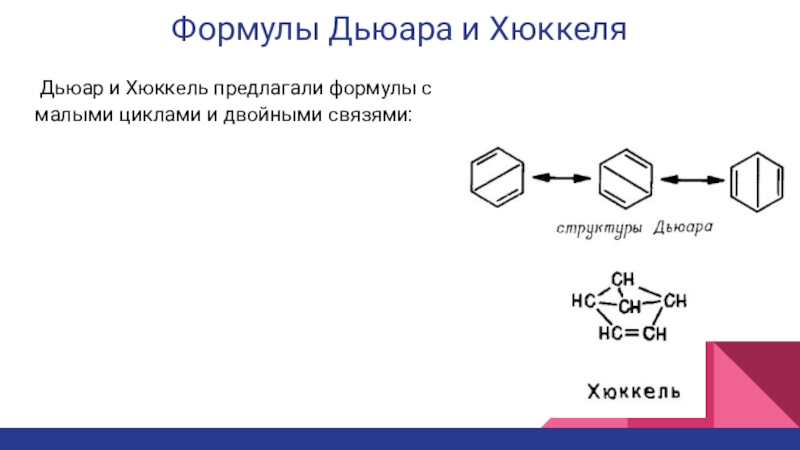
Слайд 7Формулы Дьюара и Хюккеля
Дьюар и Хюккель предлагали формулы с
малыми циклами и двойными связями:
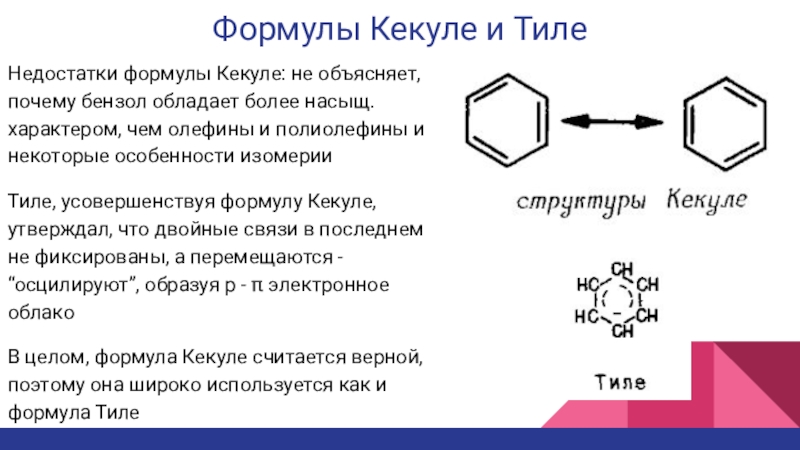
Слайд 8Формулы Кекуле и Тиле
Недостатки формулы Кекуле: не объясняет, почему бензол
обладает более насыщ. характером, чем олефины и полиолефины и некоторые
особенности изомерииТиле, усовершенствуя формулу Кекуле, утверждал, что двойные связи в последнем не фиксированы, а перемещаются - “осцилируют”, образуя p - π электронное облако
В целом, формула Кекуле считается верной, поэтому она широко используется как и формула Тиле
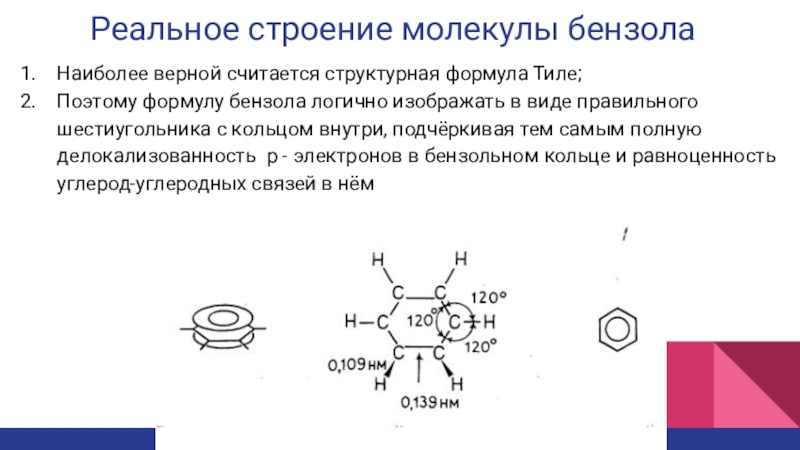
Слайд 9Реальное строение молекулы бензола
Наиболее верной считается структурная формула Тиле;
Поэтому формулу
бензола логично изображать в виде правильного шестиугольника с кольцом внутри,
подчёркивая тем самым полную делокализованность p - электронов в бензольном кольце и равноценность углерод-углеродных связей в нёмСлайд 10Электронное строение бензола
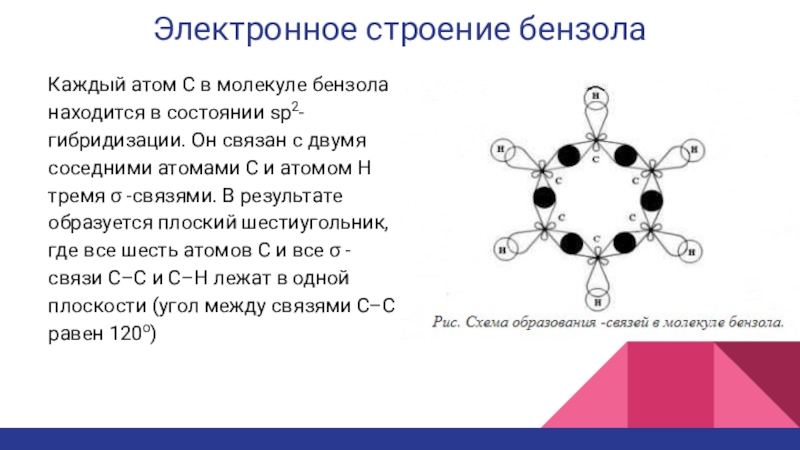
Каждый атом С в молекуле бензола находится в
состоянии sp2-гибридизации. Он связан с двумя соседними атомами С и
атомом Н тремя σ -связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все σ -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o)Слайд 11Электронное строение бензола
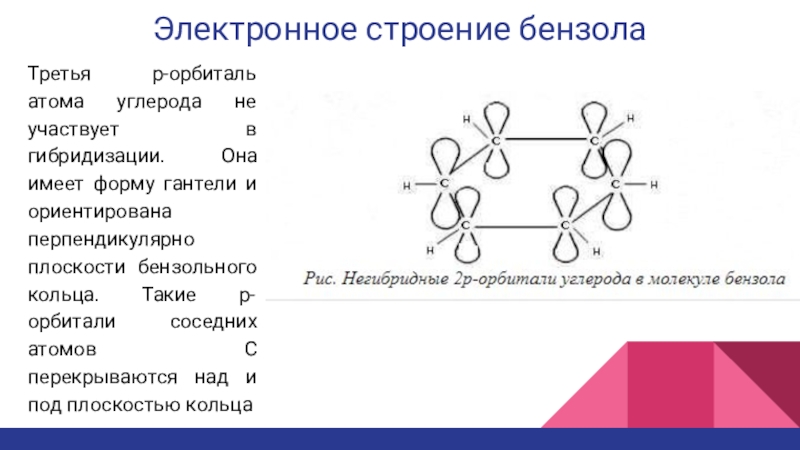
Третья p-орбиталь атома углерода не участвует в гибридизации.
Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца.
Такие p-орбитали соседних атомов С перекрываются над и под плоскостью кольцаСлайд 12Электронное строение бензола
В результате шесть p-электронов (всех шести атомов С)
образуют общее p-π - электронное облако и единую химическую связь
для всех атомов Сp-π - электронное облако обусловливает сокращение расстояния между атомами С
В молекуле бензола они одинаковы и равны 0,139 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическая связь. Чтобы показать равномерное распределение p-π электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С):
Слайд 13Номенклатура. Изомерия
Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их
взаимным положением в бензольном кольце. Положение двух заместителей указывают с
помощью приставок: орто- (о-), если они находятся у соседних углеродных атомов (положение 1, 2-), мета- (м-) для разделенных одним атомом углерода (1, 3-) и пара- (п-) для находящихся напротив друг друга (1, 4-)Радикалы ароматических углеводородов называют арильными радикалами. Радикал С6Н5 — называется фенил
Например, для диметилбензола (ксилола):
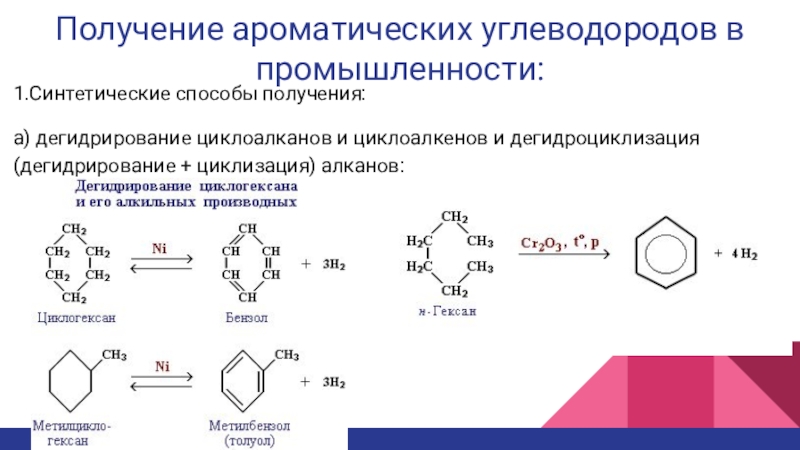
Слайд 14Получение ароматических углеводородов в промышленности:
1.Синтетические способы получения:
а) дегидрирование циклоалканов
и циклоалкенов и дегидроциклизация (дегидрирование + циклизация) алканов:
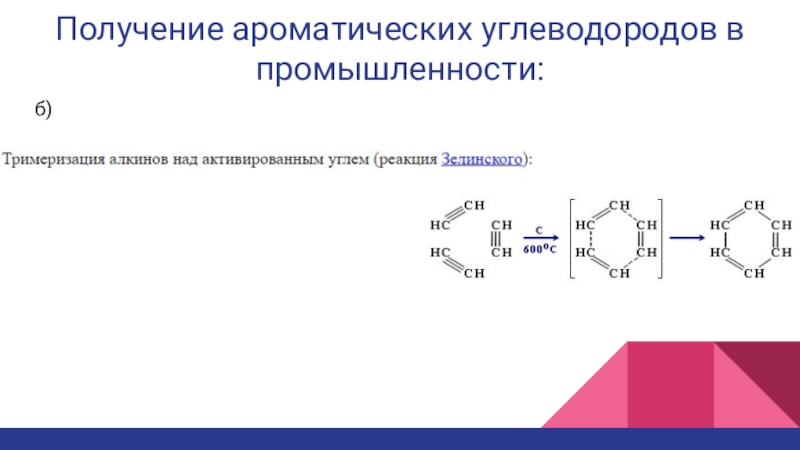
Слайд 17Получение ароматических углеводородов в промышленности:
д) Бензол реагирует с этиленом (образуется
этилбензол), с пропиленом с образованием изопропилбензола:
Слайд 18Получение ароматических углеводородов в промышленности:
е) Алкилирование спиртом в присутствии конц.
серной кислоты:
Слайд 19Физические свойства бензола
Бензол – бесцветная, летучая, огнеопасная жидкость с неприятным
запахом. Он легче воды ( =0,88 г/см3) и с ней
не смешивается, но растворим в органических растворителях, и сам хорошо растворяет многие вещества. Бензол кипит при 80,1 С, при охлаждении легко застывает в белую кристаллическую массу. Бензол и его пары ядовиты. Систематическое вдыхание его паров вызывает анемию и лейкемиюСлайд 20Химические свойства бензола
1) Химические свойства бензола определяется строением его молекулы
2) Ароматическая система обладает повышенной устойчивостью
3) Поэтому хотя
бензол является непредельным углеводородом, он проявляет свойства, характерные для предельных (склонность к реакциям замещения, устойчивость к действию окислителей)Слайд 24Толуол
В молекуле толуола электронная плотность-связей смещена от атома углерода метильной
группы в сторону бензольного кольца из-за большей электроотрицательности sp2-гибридизованного атома
углерода по сравнению с sp3-гибридизованным. Поэтому индуктивный эффект CH3-группы как заместителя направлен в сторону ароматического кольца и является донорным (+I-эффект).Слайд 25Толуол
Однако повышение электронной плотности на бензольном кольце вследствие влияния метильной
группы происходит не только за счёт индуктивного, но и мезомерного
эффекта, так как σ-связи C–H метильной группы могут участвовать в сверхсопряжении с π-электронной системой бензольного кольца (p-π-сопряжение). При этом распределение электронов можно представить как промежуточное между пятью граничными структурами:Слайд 26Толуол
В результате взаимодействия СН3-группы с бензольным кольцом электронная плотность
на нём повышается, причём главным образом в орто- и пара-положениях
Однако
необходимо иметь в виду, что оба донорных эффекта (индуктивный и мезомерный) достаточно слабые, повышение электронной плотности на ароматическом кольце невелико и не столь ярко выражено, как могло быть при наличии других функциональных групп, обладающих значительным донорным эффектом При обсуждении геометрического строения толуола необходимо иметь в виду, что атом углерода метильной группы боковой цепи имеет тетраэдрическое строение в отличие от углеродных атомов бензольного кольца