Слайд 1ЛЕКЦИЯ
«Биохимия эритроцита. Структура гемоглобина. Синтез гема»
Слайд 2
ЭРИТРОЦИТЫ
Эритроциты (erythrosytus) это форменные элементы крови.
Функция эритроцитов:
1.Основные функции
эритроцитов - регуляция в крови КОС,
2.Транспорт по организму О2
и СО2.
Эти функции реализуются с участием гемоглобина.
3.Эритроциты на своей клеточной мембране адсорбируют и транспортируют аминокислоты, антитела, токсины и ряд лекарственных веществ.
Слайд 3
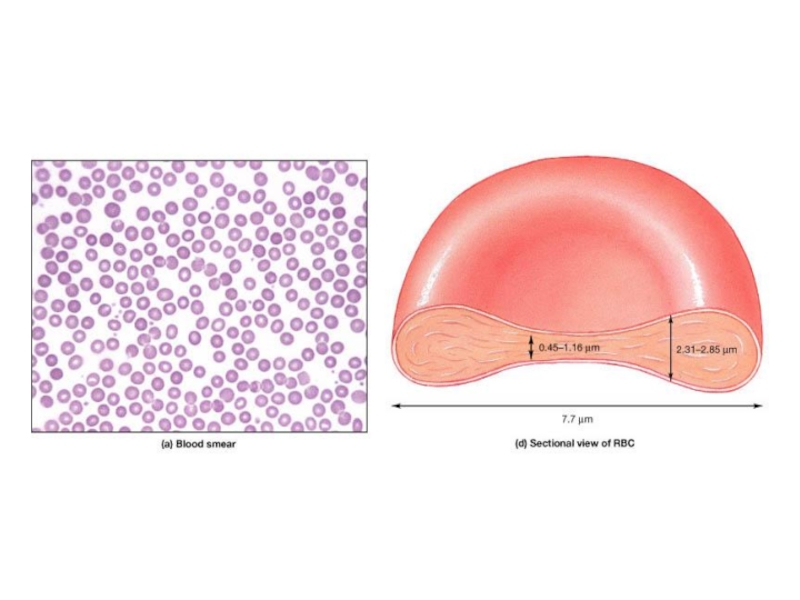
Строение и химический состав эритроцитов
Эритроциты в токе крови
обычно (80%) имеют форму двояковогнутых дисков и называются дискоцитами.
Это
создаёт наибольшую площадь поверхности по отношению к объёму, что обеспечивает максимальный газообмен, а также обеспечивает большую пластичность при прохождении эритроцитами мелких капилляров.
Диаметр Эр у человека колеблется от 7,1 до 7,9 мкм, толщина эритроцитов в краевой зоне - 1,9 - 2,5 мкм, в центре - 1 мкм.
75% всех эритроцитов - нормоциты;
большие размеры (свыше 8,0 мкм) - 12,5 % - макроциты.
может быть 6 мкм и меньше - микроциты.
Слайд 5
Плазмолемма эритроцитов
Плазмолемма эритроцитов имеет толщину около 20 нм.
Она состоит из примерно равного количества липидов и белков, а
также небольшого количества углеводов.
Слайд 6
Липиды
Бислой плазмолеммы образован:
глицерофосфолипидами,
сфингофосфолипидами,
гликолипидами,
холестерином.
Внешний слой содержит
гликолипиды (около 5% от общего количества липидов) и много холина
(фосфатидилхолин, сфингомиелин)
Внутренний - много фосфатидилсерина и фосфатидилэтаноламина.
Слайд 7
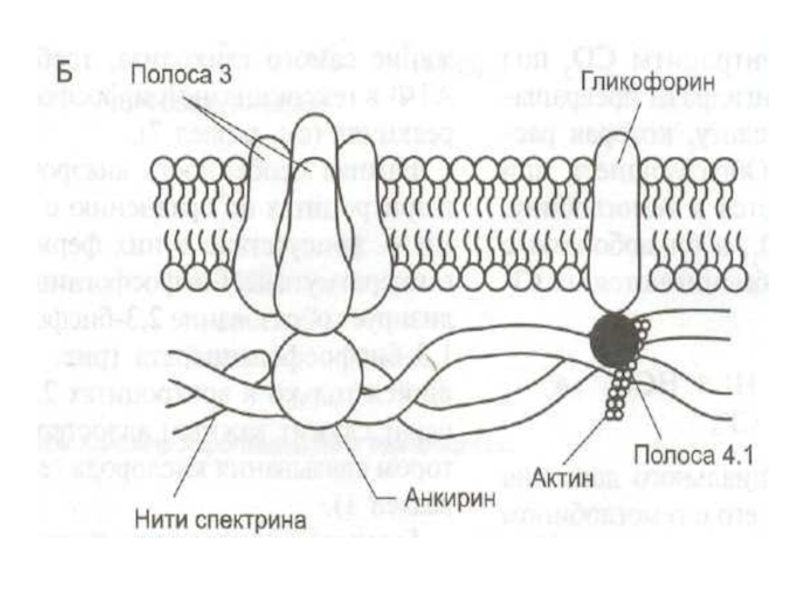
Белки
В плазмолемме эритроцита идентифицировано 15 главных белков.
Более 60% всех мембранных белков приходится на спектрин,
гликофорин (есть только в мембране эритроцитов) и белок полосы 3.
Слайд 10
Спектрин - основной белок цитоскелета эритроцитов, имеет
вид фибриллы, состоящей из двух антипаралельно перекрученых друг с другом
цепей α-спектрина и β-спектрина.
Слайд 11
Белок полосы 3 - трансмембранный гликопротеид,
его полипептидная цепь много раз пересекает бислой липидов.
является компонентом цитоскелета
и анионным каналом, который обеспечивает трансмембранный антипорт для ионов НСО3- и Сl-.
Слайд 12
Гликофорин - трансмембранный гликопротеин, который пронизывает
плазмолемму в виде одиночной спирали.
Гликофорины формируют цитоскелет и, через
олигосахариды, выполняют рецепторные функции.
Слайд 13
Na+,K+-АТФ-аза мембранный фермент, обеспечивает поддержание градиента концентраций Na+ и К+
по обе стороны мембраны.
Са2+-АТФ-аза — мембранный фермент, осуществляющий выведение
из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны.
Слайд 14
Углеводы
Олигосахариды (сиаловая кислота и антигенные олигосахариды) гликолипидов и гликопротеидов, расположенные
на наружной поверхности плазмолеммы, образуют гликокаликс. Олигосахариды гликофорина определяют антигенные
свойства эритроцитов. Агглютиногены появляются на мембране на ранних стадиях развития эритроцита.
На поверхности эритроцитов имеется также агглютиноген - резус-фактор (Rh-фактор). Он присутствует у 86% людей, у 14% отсутствует.
Слайд 15
Цитоплазма эритроцитов
содержится около 60% воды и 40% сухого остатка.
95%
сухого остатка составляет гемоглобин
5% сухого остатка приходятся на органические
(глюкоза, промежуточные продукты ее катаболизма) и неорганические вещества.
В цитоплазме эритроцитов присутствуют ферменты гликолиза, ПФЦ, АОЗ и метгемоглобинредуктазной системы, карбоангидраза.
Слайд 16
Особенность белкового обмена в эритроцитах:
1.В зрелом эритроците белки не синтезируются,
т.к. у него нет рибосом, ЭПР, аппарата Гольджи и ядра.
Однако в цитоплазме синтезируется пептид глутатион.
Биосинтез глутатиона осуществляется в 2 стадии:
1стадия катализируется γ−глутамилцистеинсинтетазой,
2 стадия – глутатионсинтетазой.
2.Катаболизм белков в эритроците неферментативный:разрушаются и инактивируются под действием неблагоприятных факторов(СРО, гликозилирования, взаимодействия с тяжелыми металлами и токсинами).
Слайд 17
Особенность обмена нуклеотидов в эритроцитах:
В зрелом эритроците:
1.из ФРПФ (из рибозо-5ф)
и аденина может синтезироваться АМФ.
2.АМФ с участием АТФ превращается
в АДФ.
3.В реакциях субстратного фосфорилирования (гликолиз) АДФ превращается в АТФ.
4.В гликолизе НАД+ восстанавливается в НАДН2, который используется для регенерации гемоглобина из метгемоглобина.
5.В ПФЦ НАДФ+ восстанавливается в НАДФН2, который используется для функционирования антиоксидантной системы.
Слайд 18
Особенность липидного обмена в эритроцитах:
1.В зрелом Эр липиды не синтезируются,
однако Эр может обмениваться липидами с липопротеинами крови.
2.Катаболизм липидов
неферментативный, повреждение и разрушение липидов происходит в реакция ПОЛ.
Слайд 19
Особенность углеводного обмена в эритроцитах:
1.В зрелых Эр углеводы не синтезируются.
2.Катаболизм
углеводов происходит на 90% в анаэробном гликолизе и на 10%
в ПФЦ, основной субстрат – глюкоза.
В процессе гликолиза с участием фосфоглицераткиназы и пируваткиназы образуется АТФ, а с участием 3-ФГА дегидрогеназы восстанавливается НАДН2. В окислительной стадии ПФЦ с участием глюкозо-6-фосфат дегидрогеназы и 6-фосфоглюконат дегидрогеназы восстанавливается НАДФН2.
Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и направляется преимущественно в печень для глюконеогенеза.
Слайд 20
Энергетический обмен в эритроцитах:
1.Образующаяся в анаэробном гликолизе АТФ используется для
работы АТФаз, для работы цитоскелета и синтеза некоторых веществ.
За 1 час все эритроциты крови потребляют 0,7г глюкозы.
2.Генетический дефект любого фермента гликолиза приводит к уменьшению образования АТФ, в результате падает активность Na+,К+-АТФ-азы, повышается осмотическое давление и возникает осмотический шок.
Слайд 21
Обезвреживание активных форм кислорода в эритроцитах:
Источники АФК:
1). Ηb (Fe2+) →
Мet Нb (Fe3+)+e-
2). e- + О2 →
О∙2
различные окислители - нитраты, сульфаниламиды и т.д.
Для сдерживания СРО в эритроците функционирует ферментативная антиоксидантная система. Для ее работы необходим глутатион и НАДФН2.
Слайд 22
Образование эритроцитов
образуются из полипотентных стволовых клеток костного мозга. Стволовая клетка
превращается в эритроцит за две недели.
Размножение стимулирует ростовой фактор интерлейкин-3
(цитокин).
Дальнейшую пролиферацию и дифференцировку регулирует гормон эритропоэтин, который синтезируется в почках.
На стадии эритробласта происходят интенсивный синтез гемоглобина, конденсация хроматина, уменьшение размера ядра и его удаление. Образующийся ретикулоцит ещё содержит глобиновую мРНК и активно синтезирует гемоглобин. Циркулирующие в крови ретикулоциты лишаются рибосом, ЭР, митохондрий и в течение двух суток превращаются в эритроциты.
Слайд 23
Количество эритроцитов
Организм взрослого человека содержит около 25*1012 эритроцитов.
Концентрация эритроцитов
у мужчины составляет 3,9*1012 - 5,5*1012 /л,
у женщины -
3,7*1012 - 4,9*1012/л.
Более высокое содержание эритроцитов у мужчин обусловлено стимулирующим эритропоэз влиянием андрогенов. Женские половые гормоны, наоборот тормозят эритропоэз.
Увеличение числа эритроцитов называют эритроцитозом (эритремией), а уменьшение - эритропенией (анемией). Они бывают абсолютными и относительными.
Слайд 24
Абсолютный эритроцитоз (увеличение числа эритроцитов в организме) –
при снижении барометрического давления (на высокогорье), у больных с хроническими
заболеваниями лёгких и сердца вследствие гипоксии, которая стимулирует эритропэз.
Относительный эритроцитоз (увеличение числа эритроцитов в единице объёма крови без увеличения их общего количества в организме) - наблюдается при сгущении крови (при обильном потении, ожогах, холере и дизентерии). Он возникает при тяжёлой мышечной работе вследствие выброса эритроцитов из кровяного депо.
Слайд 25
Абсолютная эритропения развивается вследствие пониженного образования, усиленного разрушения эритроцитов или
после кровопотери.
Относительная эритропения возникает при разжижении крови за счёт быстрого
увеличения жидкости в кровотоке.
Слайд 26
Старение и гибель эритроцитов
При старении в эритроцитах:
1.Уменьшается активность ферментов гликолиза
и ПФЦ. Нарушается процесс образования АТФ, НАДН2, НАДФН2.
2.Снижение активности Na+,
К+ АТФ-азы и увеличение проницаемости мембраны сопровождается выходом ионов калия в плазму и увеличением в эритроцитах содержания натрия.
3.Ухудшает отдачу О2 тканям.
4.Увеличивается чувствительность к осмотическому давлению и механическим воздействиям.
Слайд 27
5.Снижение активности ферментов антиоксидантной системы способствует активации ПОЛ.
6.Снижение активности
метгемоглобинредуктазной системы способствует накоплению в эритроцитах метгемоглобина и нарушению их
газообменной функции.
7.При деградации белков в плазмолемме появляются рецепторы к аутоантителам
8.В гликокаликсе снижается содержание сиаловых кислот, определяющих отрицательный заряд оболочки. Отмечаются изменения цитоскелетного белка спектрина:преобразование дисковидной формы в сферическую.
Слайд 28
Эр циркулируют в крови около 120 дней и
потом разрушаются макрофагами в печени, селезёнке и костном мозге.
В
сутки обновляется 1% эритроцитов, т.е. в течение одной секунды в кровоток поступает около 2 млн эритроцитов.
Слайд 29
ГЕМ
- это порфирин, в центре которого находиться Fe2+.
Fe2+ включается в молекулу порфирина с помощью 2 ковалентных и
2 координационных связей.
В основе порфиринов находится порфин, который представляет собой конденсированную систему из 4 пирролов, соединенных между собой метиленовыми мостиками (-СН=).
Молекула гема имеет плоское строение. При окислении железа, гем превращается в гематин (Fe3+).
Слайд 31
Использование гема
Гем является простетической группой многих белков: гемоглобина, миоглобина, цитохромов
митохондриальной ЦПЭ, цитохрома Р450, ферментов каталазы, пероксидазы, цитохромоксидазы и др.
Наибольшее количество гема содержат Эр, заполненные гемоглобином, мышечные клетки, имеющие миоглобин, и клетки печени, содержащие цитохром Р450.
Слайд 32
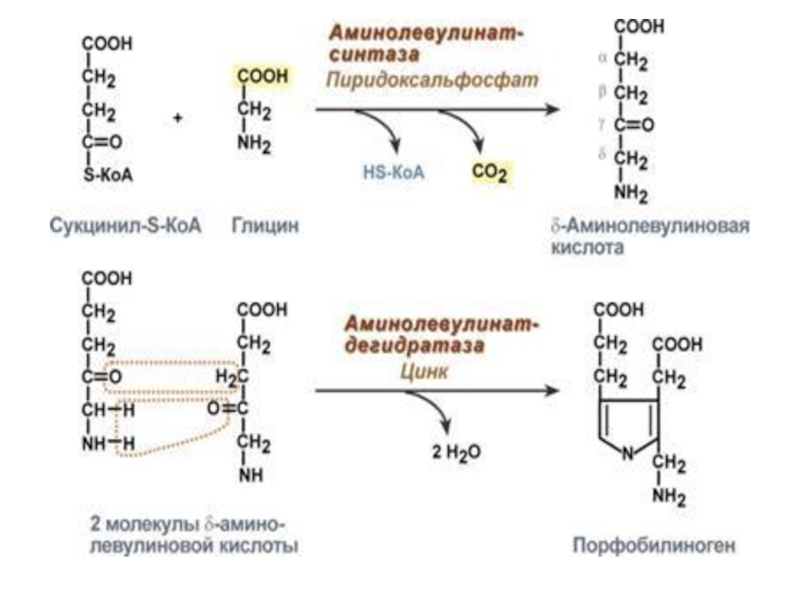
Синтез гема
Для синтеза гема требуются глицин, сукцинил-КоА. Синтез
гема начинается в Мх, затем продолжается в цитозоле и снова
переходит в Мх.
1. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. "дельта") происходит в митохондриях. Реакцию ингибирует и репрессирует гем.
2. Следующая реакция при участии аминолевулинатдегидратазы протекает в цитозоле. Реакцию ингибирует гем.
Слайд 34
3.После синтеза порфобилиногена четыре его молекулы конденсируются в
тетрапиррол.
Различают два вида тетрапирролов - уропорфириноген типа I и
уропорфириноген типа III.
В синтезе обоих видов порфиринов принимает участие уропорфириноген I-синтаза, в образования уропорфириногена III дополнительно принимает участие фермент уропорфириноген III-косинтаза.
Слайд 35
4.Далее уропорфириногены превращаются в соответствующие копропорфириногены.
Копропорфириноген III окисляется в протопорфириноген IX и далее в протопорфирин
IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
Слайд 37
Регуляция синтеза гема
1. Скорость синтеза глобиновых цепей зависит от наличия
гема, он ускоряет биосинтез "своих" белков.
2. Основным регуляторным ферментом синтеза
гема является аминолевулинатсинтаза.
Слайд 38
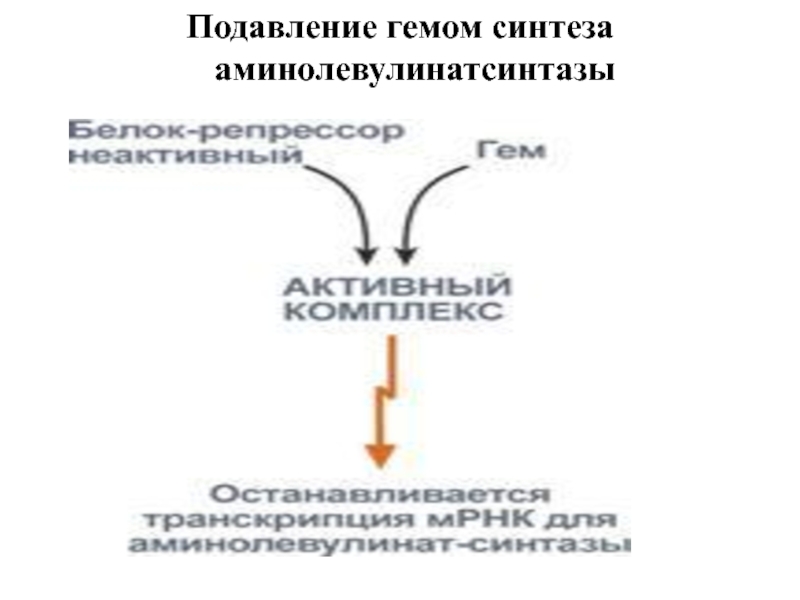
Подавление гемом синтеза аминолевулинатсинтазы
Слайд 39
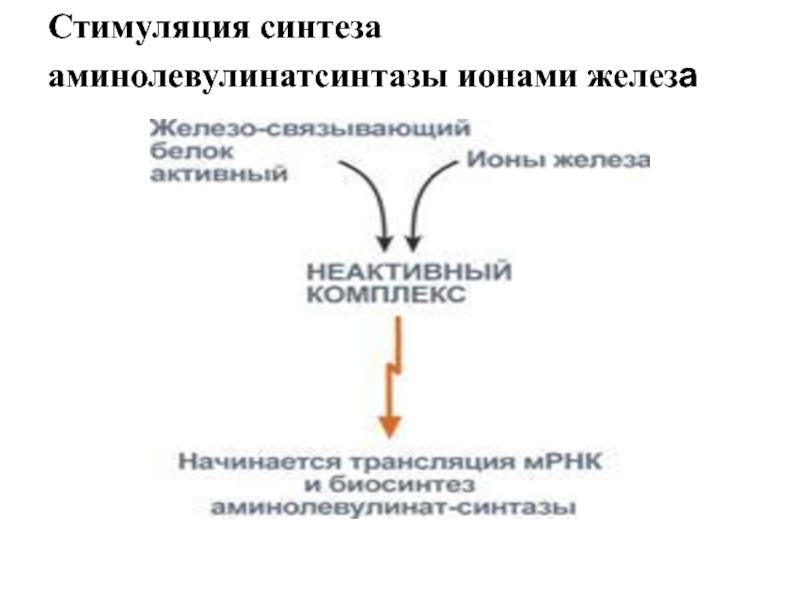
Стимуляция синтеза
аминолевулинатсинтазы ионами железа
Слайд 40
Нарушения синтеза гема. Порфирии
Порфирии - гетерогенная группа заболеваний,
вызванная нарушениями синтеза гема вследствие дефицита одного или нескольких ферментов.
Слайд 41
Классификации порфирий
Порфирии делят по причинам на:
Наследственные. Возникают при дефекте
гена фермента, участвующего в синтезе гема;
Приобретенные. Возникают при ингибирующем влиянии
токсических соединений (гексохлорбензол, соли тяжелых металлов - свинец) на ферменты синтеза гема.
Слайд 42
Синтез гемоглобина
Синтезированный в митохондриях гем индуцируется синтез цепей глобина на
полирибосомах. Гены цепей глобина расположены в 11 и 16 хромосоме.
Цепи
глобина формируют глобулы и соединяются с гемом. 4 глобулы нековалентно соединяются в гемоглобин.
Слайд 43
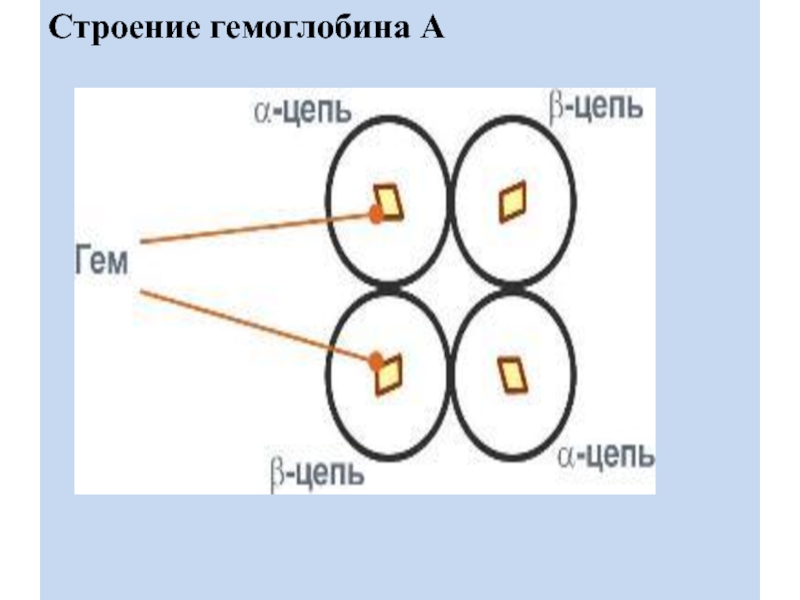
Строение гемоглобина
Нb представляет собой белок, включающий 4 гемсодержащие
белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями
по принципу комплементарности.
Белковые субъединицы в нормальном Нb могут быть представлены различными типами полипептидных цепей: α, β ,γ , δ , ξ . В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот.
Слайд 45
Функции гемоглобина
1.Обеспечивают перенос кислорода от легких к тканям;
2.Участвует в переносе
углекислого газа и протонов от тканей к легким;
3.Регулирует КОС крови.
Слайд 46
производных гемоглобина:
оксигемоглобин HbО2 (Fe2+) – соединение молекулярного кислорода с гемоглобином.
Процесс называется оксигенацией; обратный процесс - дезоксигенацией.
карбоксигемоглобин HbСО (Fe2+).
Связь гема с СО в двести раз прочнее, чем с О2. В норме в крови содержится 1% HbСО. При отравлении СО, из-за недостаточного снабжения тканей кислородом может наступить смерть.
метгемоглобин HbОН (Fe3+). Образуется при воздействии на гемоглобин окислителей (оксидов азота, метиленового синего, хлоратов). В норме в крови содержится <1% HbОН. Накопление метгемоглобина при некоторых заболеваниях (например, нарушение синтеза ГЛ-6-фосфатДГ), отравлении окислителями может стать причиной смерти, так как метгемоглобин не способен к переносу кислорода;
цианметгемоглобин HbСN (Fe3+). Образуется при присоединении СN- к метгемоглобину. Эта реакция спасает организм от смертельного действия цианидов. Поэтому для лечения отравлений цианидами применяют метгемоглобинообразователи (нитрит Na);
Слайд 47
Карбгемоглобин образуется, когда гемоглобин связывается с СО2. Однако СО2 присоединяется
не к гему, а к NН2 – группам глобина, с
образованием карбаматов:
HbNH2 + CO2= HbNHCOO- + H+
Дезоксигемоглобин Hb (Fe2+). Форма гемоглобина не связанная с кислородом. Дезоксигемоглобин связывает больше СО2, чем оксигемоглобин.
В цитохромах гем присоединяется к белковой части через 5 и 6 координационные связи железа.
Слайд 48
Виды гемоглобинов
Нормальные формы гемоглобина:
HbР – примитивный гемоглобин, встречается в эмбрионе
между 7-12 неделями жизни,
HbF – фетальный гемоглобин, содержит 2α- и
2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Слайд 49
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма
гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма обычно
образуется спонтанно. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
Слайд 50
Болезни гемоглобинов
Болезни гемоглобинов называют гемоглобинозами, их насчитывают более 200.
Гемоглобинозы делятся
на гемоглобинопатии и таласемии.
Гемоглобинопатии, возникают в результате точечных мутаций в
структурных генах, кодирующих полипептидные цепи гемоглобина. Поэтому в крови появляется аномальный гемоглобин.
Талассемия – генетическое заболевание, обусловленное отсутствием или снижением синтеза одной из цепей гемоглобина. При данном заболевании отсутствуют дефекты в структурных генах, кодирующих α, β, γ,δ -цепи.
Слайд 51
Для всех этих заболеваний характерны некоторые общие закономерности:
1). нарушаются пропорции
в составе гемоглобина крови.
2). эритроциты приобретают не нормальную форму
(мишеневидную, каплевидную). Такие эритроциты в пределах 1 дня захватываются ретикулярной соединительной тканью (например, селезенкой) и подвергаются распаду (по этой причине селезёнка оказывается гипертрофированной), что приводит к развитию гемолитической анемии.