Слайд 3Распространенность и минералы
C – 11 место, CO2, CaCO3 (известняк, кальцит,
мрамор), уголь, нефть, прир. газ
Si – 2 место; SiO2 (кремнезем,
кварц), силикаты, алюмосиликаты
Ge – 54 место, Cu3GeS4 (германит)
Sn – 27 место, SnO2 (касситерит)
Pb – 60 место, PbS (галенит), PbSO4, PbCO3
Слайд 4Открытие элементов
C –известен с древнейших времен; лат «карбон» - уголь
Si
– 1883 г., швед Берцелиус; от лат. «силекс» - кремень
Ge
- предсказан Менделеевым в 1871 г., открыт нем. Винклер в 1885 г., в честь Германии
Sn – известен давно, от лат. «станнум» - стойкий
Pb – известен давно, происхождение названия не ясно
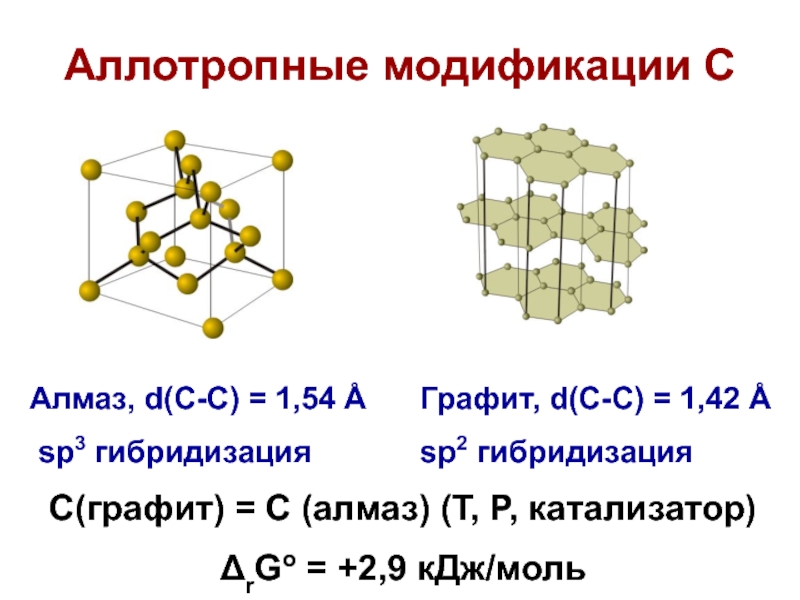
Слайд 5Аллотропные модификации С
Алмаз, d(С-С) = 1,54 Å
sp3 гибридизация
Графит, d(С-С)
= 1,42 Å
sp2 гибридизация
С(графит) = С (алмаз) (T, P, катализатор)
rGo
= +2,9 кДж/моль
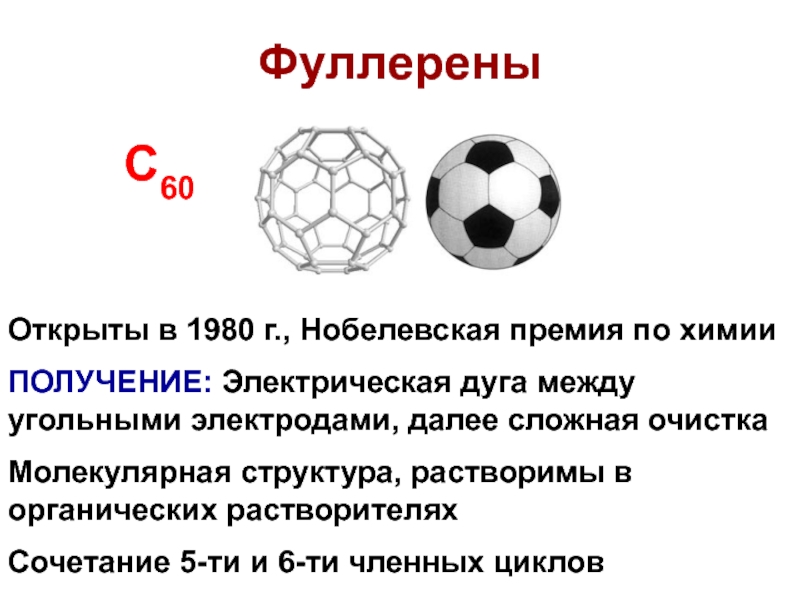
Слайд 6Фуллерены
Открыты в 1980 г., Нобелевская премия по химии
ПОЛУЧЕНИЕ: Электрическая дуга
между угольными электродами, далее сложная очистка
Молекулярная структура, растворимы в органических
растворителях
Сочетание 5-ти и 6-ти членных циклов
С60
Слайд 7Фуллерены
K3C60 – сверхпроводник при Tc = 18K
P. 550 C60 +
[(С2Н4)Pt(PPh3)2] = [Pt(PPh3)2C60] + С2Н4
Полиеновая молекула??
Gd@C60
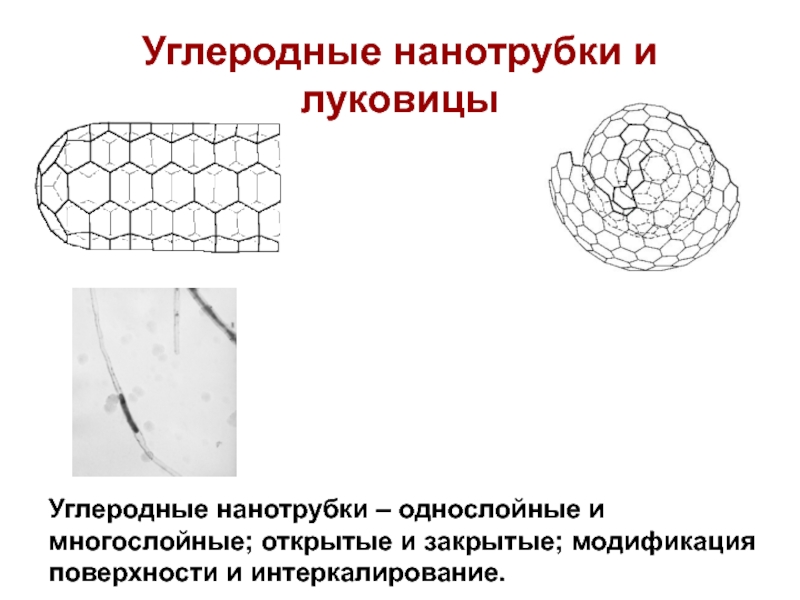
Слайд 8Углеродные нанотрубки и луковицы
Углеродные нанотрубки – однослойные и многослойные; открытые
и закрытые; модификация поверхности и интеркалирование.
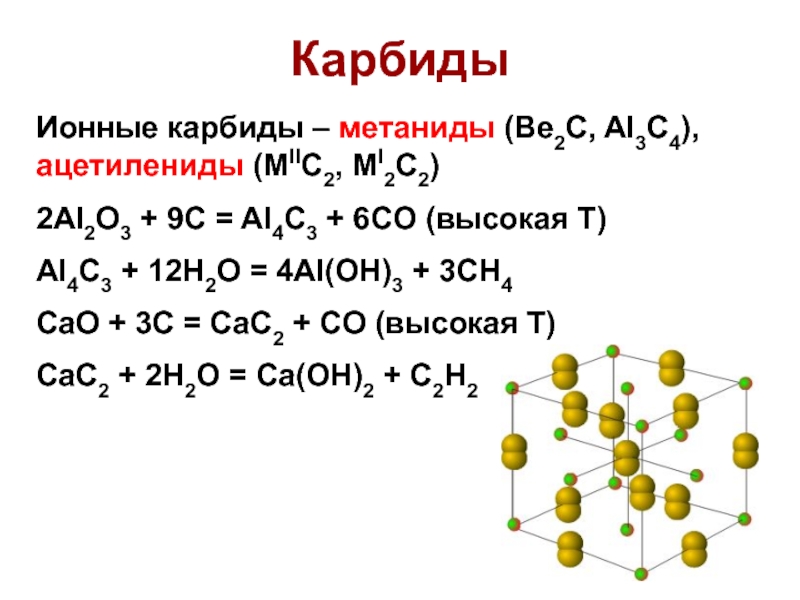
Слайд 9Карбиды
Ионные – щелочные и щелочноземельные металлы + Al.
Металлоподобные – d
и f металлы, металлический блеск, проводимость, очень твердые. WC –
режущие инструменты, аппаратура высокого давления. Fe3C – составная часть чугуна и стали
Ковалентные – B4C (правильнее B12C3) и SiС (карборунд, структура алмаза, но хрупкий), очень твердые
Слайд 10Карбиды
Ионные карбиды – метаниды (Be2C, Al3C4), ацетилениды (MIIC2, MI2C2)
2Al2O3 +
9C = Al4C3 + 6CO (высокая Т)
Al4C3 + 12H2O =
4Al(OH)3 + 3CH4
CaO + 3C = CaC2 + CO (высокая Т)
CaC2 + 2H2O = Ca(OH)2 + C2H2
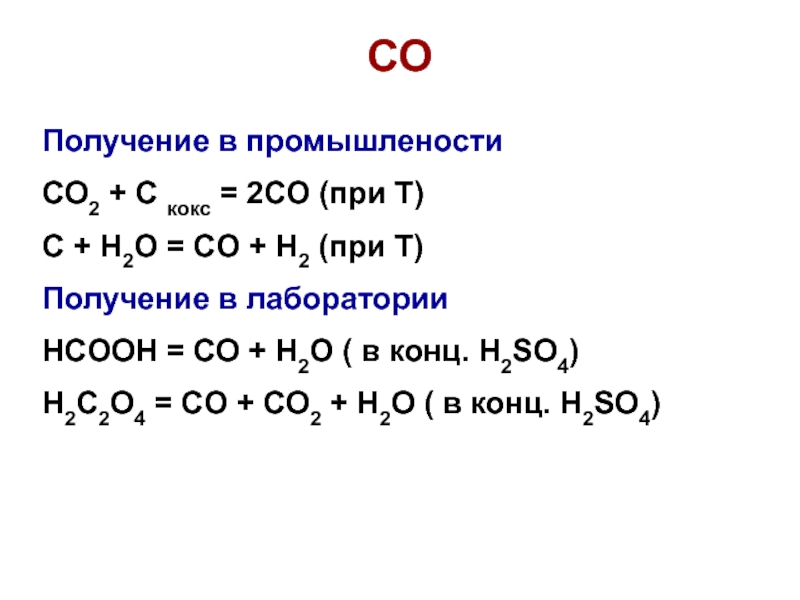
Слайд 11СО
Получение в промышлености
CO2 + C кокс = 2CO (при Т)
С
+ H2O = CO + H2 (при Т)
Получение в лаборатории
HCOOH
= СO + H2O ( в конц. H2SO4)
H2C2O4 = СO + CO2 + H2O ( в конц. H2SO4)
Слайд 12Каталитические синтезы
1) Синтез уксусной кислоты (процесс Monsanto) – катализатор [Rh(CO)2I2]-
CH3OH
+ CO = CH3COOH
2) Синтез альдегидов – катализатор [Co2(CO)8]
RCH=CH2
+ CO + H2 = RCH2CH2CHO
3) Синтез метанола
СO + 2H2 = CH3OH
Слайд 13Cвойства СО
Солеобр. окид: CO+NaOHр-р= HCOONa(120oC,5атм)
Окисление: 2CO + O2 = 2CO2
Восстановление:
СO + PdCl2 + H2O = Pd + CO2 +
2HCl
Комплексы (карбонилы):
Ni + CO = Ni(CO)4
Fe + 5CO = Fe(CO)5
Карбонилы Mx(CO)y известны для всех d-металлов, кроме Ti, Zr, Hf, Nb, Ta, Pd, Pt
Слайд 14Карбонилы металлов
Правило 18 электронов: s2p6d10 2 + 6 +
10 = 18
[Cr(CO)6]: 6+2x6 = 18
[Fe(CO)5]: 8+2x5 = 18
[Ni(CO)4]: 10+2x4
= 18
Слайд 15СO2
Получение в промышлености:
СaCO3 = CaO + CO2 (1000oC)
Получение в лаборатории:
CaCO3
+ 2HCl = CaCl2 + CO2 + H2O (в аппарате
Киппа)
СВОЙСТВА:
Окислитель: Активные металлы (Mg, Na, K) горят в СО2
2Mg + CO2 = 2MgO + C
Слайд 16Карбонаты и гидрокарбонаты
Кислотные св-ва: СO2 + H2O = H2CO3
(Ka1
= 4.10-7, Ka2 = 5.10-11)
2NaOH изб. + CO2 = Na2CO3
(техническая сода)
NaOH + CO2 изб. = NaHCO3 (питьевая сода)
Соли гидролизуются.
Растворимые соли: Na+, K+, NH4+
Нерастворимые соли MCO3 (M = Mg, Ca, Cu, Zn, Pb, Ba)
(NH4)2CO3 = H2O + (NH2)2C=O (при Т, мочевина)
Слайд 17Галогениды и оксогалогениды
CX4, X = F, Cl, Br, I (газ
-- твердое), не реагируют с водой (хотя по термодинамике реакции
должны идти)
СCl4 + 4Na = 4NaCl +C (ВЗРЫВ)
СO + Cl2 = Cl2C=O Фосген, газ, сильно ядовит
Cl2CO + H2O = CO2 + 2HCl
Cl2CO + 2ROH = (RO)2CO + 2HCl
Cl2CO + 2NH3 = (NH2)2CO + 2HCl
Слайд 18Соединения с S
CS – очень неустойчив, но известны комплексы (аналоги
карбонилов)
CS2 – Tкип = 44оС, запах, легко возгорается, растворитель P4,
S8, I2
C + 2S = CS2 ( пары серы и раскаленный уголь)
CS2 + K2S = K2CS3 тиокарбонат
K2CS3 + 2HCl = 2KCl + H2CS3 тиоугольная к-та
Ka1 = 2.10-3, Ka2 = 7.10-9
H2CS3 = H2S + CS2 (медленно при Т)
Слайд 19Соединения с N
HCN – циановодород, Ткип = 26оС, ядовит, растворим
в воде
Таутомерия: H-C≡N = H-N≡C ( равновесие в воде сдвинуто
сильно влево)
CH3-C≡N нитрилы; CH3-N≡C изонитрилы
ПОЛУЧЕНИЕ
2СH4 + 2NH3 + 3O2 = 2HCN + 6H2O (800oC, кат.)
2NaCN + H2SO4 = Na2SO4 + 2HCN
CaC2 + N2 = Ca(CN2) 1100oC, цианамид кальция (производное цианамида NH2-C≡N )
Ca(CN2) + C + Na2CO3 = 2NaCN + CaCO3
Слайд 20Соединения с N
1) Синильная кислота HCN слабая, pKa = 9.
Соли
цианиды гидролизуются, но не полностью:
KCN + H2O = HCN +
KOH
2) CN- образует многочисленные комплексы: K4[Fe(CN)6] – желтая кровяная соль; K3[Fe(CN)6] – красная кровяная соль
Слайд 21Соединения с N
3) Восстановительные свойства:
2Cu2+ + 10CN- = (CN)2↑ +
2[Cu(CN)4]3-
CN радикал называют псевдогалогенидом
2Сu2+ + 4I- = I2 +
2CuI↓
(CN)2 + 2NaOH = NaCN + NaNCO (цианат) +H2O
I2 + 2NaOH = NaI + NaIO + H2O
4) Таутомерия: H-O-C≡N = H-N=C=O
(равновесие сдвинуто вправо)
Циановая кислота неустойчива, соли KNCO, AgNCO
Изомер H-O-N=C – гремучая кислота и ее соли взрываются
Слайд 22Соединения с N и S
HSCN – родановодородная (тиоциановая) кислота, сильная
(Ка = 0,5)
Таутомерия: H-S-C≡N = H-N=C=S
KCNтв + S = KSCN
– роданид, не гидрол.
Качественная реакция на Fe3+:
Fe3+ + 3SCN- = Fe(SCN)3 красный
Pt2+, Ag+ - донорный атом S (тиоцианаты)
Cr3+, Co2+ - донорный атом N (изотиоцианаты)
«Фараонова змея»
2Hg(SCN)2 + 5O2 = 2HgO + 2SO2 + 2CO2 + 2N2
Слайд 23Кремний
Аморфный и кристаллический – одна структура (алмаза)
ПОЛУПРОВОДНИК, МАТЕРИАЛ 20 ВЕКА
SiCl4г
+ 2H2г = Siтв. + 4HClг
SiO2 +2C = 2CO +
Si (1900oC)
Получение монокристаллического Si
Метод Чохральского
99,9999%
Слайд 24Кремний
Аморфный кремний более реакционноспособен, чем кристаллический
Si + O2 = SiO2
(при Т)
Si + 2Cl2 = SiCl4 (при Т)
Si + C
= SiC (2000oC) карбид кремния
2Si + N2 = 2SiN (+ Si3N4) (2000oC)
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O
Si + 2KOH +H2O = K2SiO3 + 2H2
Mg + Si = Mg2Si (+MgxSiy) - силициды
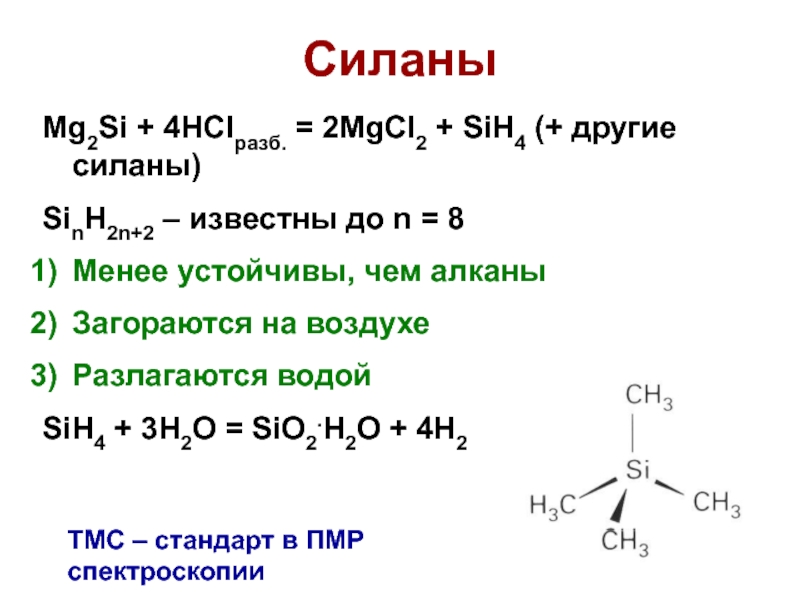
Слайд 25Cиланы
Mg2Si + 4HClразб. = 2MgCl2 + SiH4 (+ другие силаны)
SinH2n+2
– известны до n = 8
Менее устойчивы, чем алканы
Загораются на
воздухе
Разлагаются водой
SiH4 + 3H2O = SiO2.H2O + 4H2
ТМС – стандарт в ПМР спектроскопии
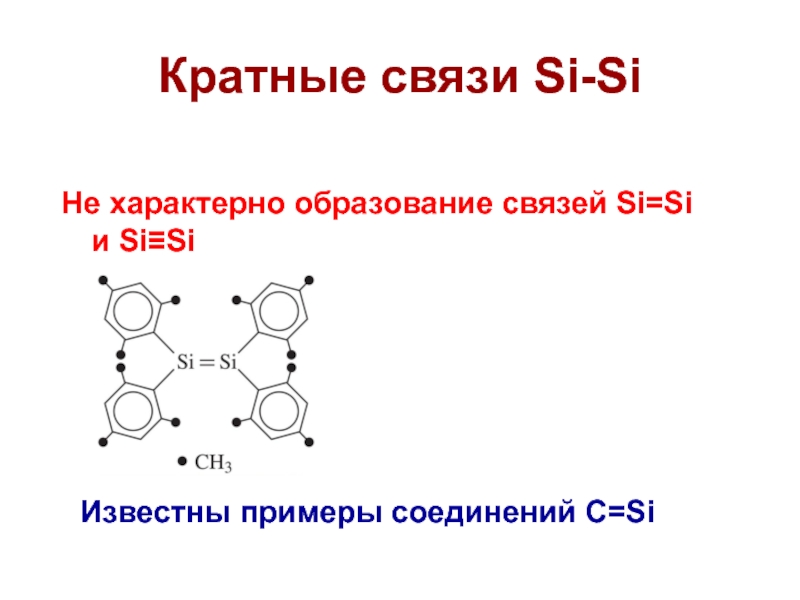
Слайд 26Кратные связи Si-Si
Не характерно образование связей Si=Si и Si≡Si
Известны примеры
соединений C=Si
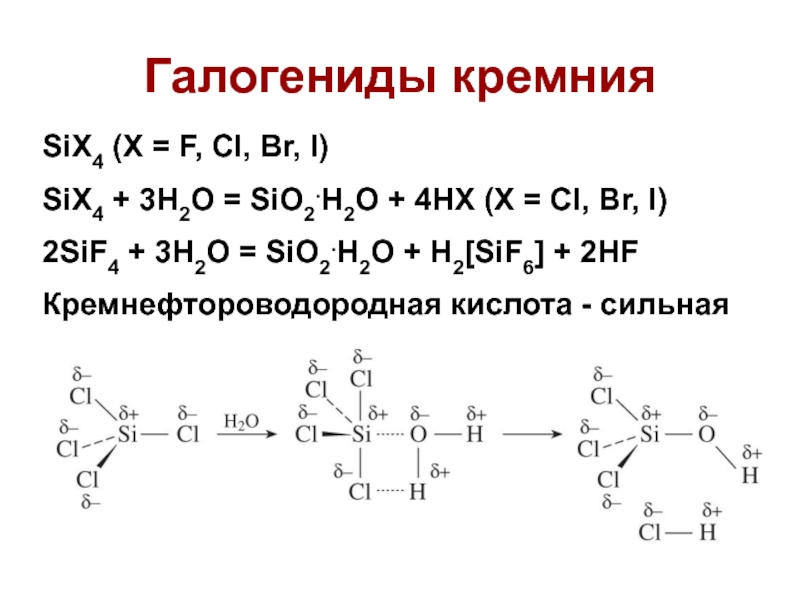
Слайд 27Галогениды кремния
SiX4 (X = F, Cl, Br, I)
SiX4 + 3H2O
= SiO2.H2O + 4HX (X = Cl, Br, I)
2SiF4 +
3H2O = SiO2.H2O + H2[SiF6] + 2HF
Кремнефтороводородная кислота - сильная
Слайд 28Алюмосиликаты
Al или замещает Si (тетраэдр) или имеет октаэдр. окружение
Усеченный октаэдр
Цеолит
А
[Na96(H2O)216][Al96Si96O384]
Диаметр входа 4Å
Слайд 29Алюмосиликаты
Цеолит Х
[Na58(H2O)240][Al58Si134O384]
Диаметр входа 8Å
ПРИМЕНЕНИЕ
Ионный обмен
Разделение молекул
Катализ
Ship in the Bottle
Слайд 30Оксиды SiO и SiO2
SiO2 + Si = 2SiO (Возгоняется при
1200оС)
SiO2:
Н/р в воде, минеральных кислотах, растворах щелочей
SiO2 + 6HF =
H2[SiF6] + 2H2O
SiO2 + 2NaOHтв = Na2SiO3 + H2O
КРЕМНИЕВЫЕ К-ТЫ: Мета H2SiO3, орто H4SiO4
Слабее угольной pKa1 = 10, pKa2 = 13
Получение: действие минеральных к-т на р-ры силикатов; гидролиз галогенидов, алкоголятов
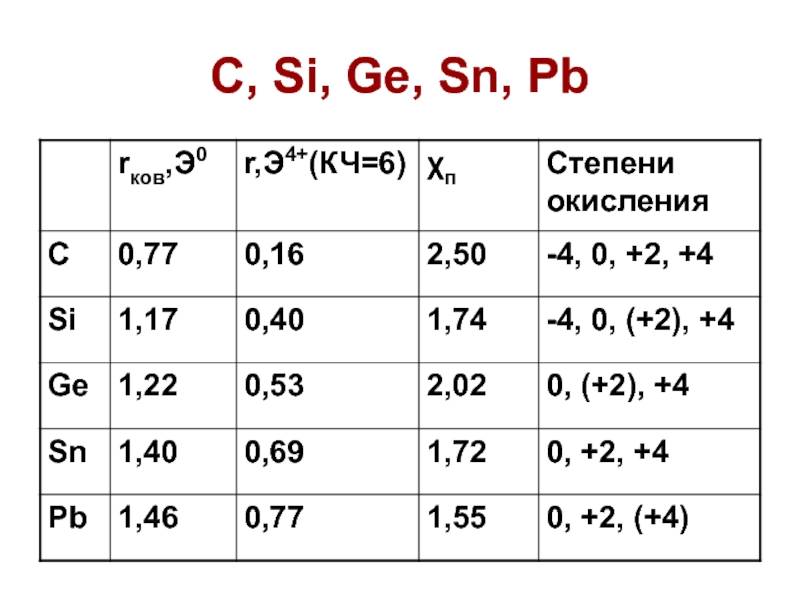
Слайд 31Ge, Sn, Pb
Увеличение металлических свойств в в ряду Ge-Sn-Pb
Ge –
структура алмаза, по свойствам похож на Si, полупроводник
Sn - ,
, . Переход --- ускоряется при низкой Т («оловянная чума»)
Pb – кубическая гранецентрированная
Слайд 32Ge, Sn, Pb
С кислотами: Ge, Pb нет р-ций с р-рами
HCl и H2SO4
Sn + 3HCl конц = H[SnCl3] +
H2 (так же Pb)
2) C кислотами окислителями:
M + HNO3 разб = H2GeIVO3, SnII(NO3)2, PbII(NO3)2
M + 4HNO3 конц = H2MO3 +4NO2 + H2O (M = Ge, Sn)
M + 4H2SO4 конц = M(SO4)2 + 2SO2 + 4H2O (M = Ge, Sn)
Pb + 3H2SO4 конц = Pb(HSO4)2 + SO2 + 2H2O
4) С щелочами: Ge – нет реакции, Sn -->[SnII(OH)3]-, Pb --> [PbII(OH)4]2-
Слайд 33Соединения Ge,Sn, Pb с H
(Германид) Mg2Ge +4HCl = 2MgCl2 +
GeH4 – герман
Германоводороды GenH2n+2 (n< 10)
SnCl4 + Li[AlH4] = SnH4
+ LiCl + AlCl3 - станнан
Sn2H6 – крайне неустойчив
PbH4 – плюмбан, крайне неустойчив, получают небольшие к-ва при действии HCl на сплав Pb и Mg.
Устойчивость ЭН4 уменьшается в ряду C, Si, Ge, Sn, Pb
ЭН4 = Э + 2Н2
Слайд 34Ge, Sn, Pb
Pb4+ - сильный окислитель (Mn2+ --> MnO4-)
Ge2+ -
более сильный восстановитель, чем Sn2+
Слайд 35ЭО2 (Э = Ge, Sn, Pb)
GeO2 + 4HCl конц =
GeCl4 + 2H2O
GeO2 + 2NaOH р-р + 2H2O =Na2[Ge(OH)6]
GeO2
+ 2NaOH расплав = Na2GeO3 + H2O (или Na4GeO4)
Слайд 36Кислоты Э4+ (Э = Ge, Sn)
xЭО2.yH2O – неопределенный состав.
Растворы GeO2
в воде, очень слабая pKa =10
Оловянные кислоты и -
формы
Sn4+ + 4NH3 + 4H2O = Sn(OH)4↓ +4NH4+
Sn + 4HNO3 конц = H2SnO3↓ + 4NO2 + H2O
SnCl4 + 4H2O = Sn(OH)4 ↓ + 4HCl
Слайд 37Оловянные кислоты
xSnО2.yH2O
: y x, растворима в к-тах и
щелочах
: y < x, НЕ растворима в к-тах и щелочах
Sn(OH)4
+ 2H2SO4 разб. = Sn(SO4)2 + 4H2O
Sn(OH)4 + 2KOHр-р = K2[Sn(OH)6]
Старение оловянных кислот: --->
Слайд 38Соединения Pb4+
Pb(OAc)2 + CaOCl2 + H2O = PbO2↓+ CaCl2 +
2HOAc
PbO2 + H2SO4 конц = Pb(SO4)2 + 2H2O (Гидролиз!)
PbO2 +
4HCl = PbCl2 + Cl2 + 2H2O
Плюмбаты:
PbO2 тв + CaO тв = CaPbO3 (мета); Ca2PbO4 (орто)
В растворах [Pb(OH)6]2-
Галогениды: только PbCl4, желтая жидкость
[PbX6]2- - гексагалогеноплюмбаты (X =Cl, Br, I)
Комплексообразование стабилизирует высшие степени окисления
Слайд 39Свинцовый сурик
6PbO + O2 = 2Pb3O4 (400-500oC) – красно-оранжевый
2Pb3O4 =
O2 + 6PbO желтый (>500oC)
PbII2PbIVO4
Pb3O4 + 4HNO3 р-р = PbO2↓
+ 2Pb(NO3)2 + 2H2O
Слайд 40Соединения Э2+ (Э = Ge, Sn, Pb)
Уменьшение восстановительных свойств в
ряду Ge-Sn-Pb
Соединения Sn2+ - удобные мягкие восстановители
ЭО и Э(ОН)2
– амфотерные, но с преобладанием основных свойств
Для ЭО и Э(ОН)2 основные св-ва в ряду Ge-Sn-Pb увеличиваются
Слайд 41Соединения Ge2+
GeO2 + Ge = 2GeO желто-красный
GeO + 2HCl =
GeCl2 + H2O
GeCl2 + 2NaOH = Ge(OH)2↓+ 2NaCl
Ge(OH)2 + H2SO4
= GeSO4 + 2H2O
Ge(OH)2 + NaOH = Na[Ge(OH)3]
Диспропорционирование при нагревании:
2GeCl2 = GeCl4 + Ge
Слайд 42Соединения Sn2+
Sn(OH)2 = SnO + H2O (при Т) Сине-черный
Sn(OH)2 +
H2SO4 = SnSO4 + 2H2O
Sn(OH)2 + NaOH = Na[Sn(OH)3], известны
[Sn(OH)n](n-2)-
n = 3 - 6
Диспропорционирование при нагревании
2Na[SnII(OH)3] = Sn0 + Na2[SnIV(OH)6]
Слайд 43Соединения Sn2+
Растворимые соли SnX2: X = Cl,Br,I,NO3,1/2SO4
Гидролиз: Sn2+ + H2O
= Sn(OH)+ + H+
Комплексообразование: SnCl2 + Cl- = [SnCl3]-
Пирамидальное строение,
донор эл. пары
[PtCl3(SnCl3)]2-, [PtCl2(SnCl3)2]2- и другие
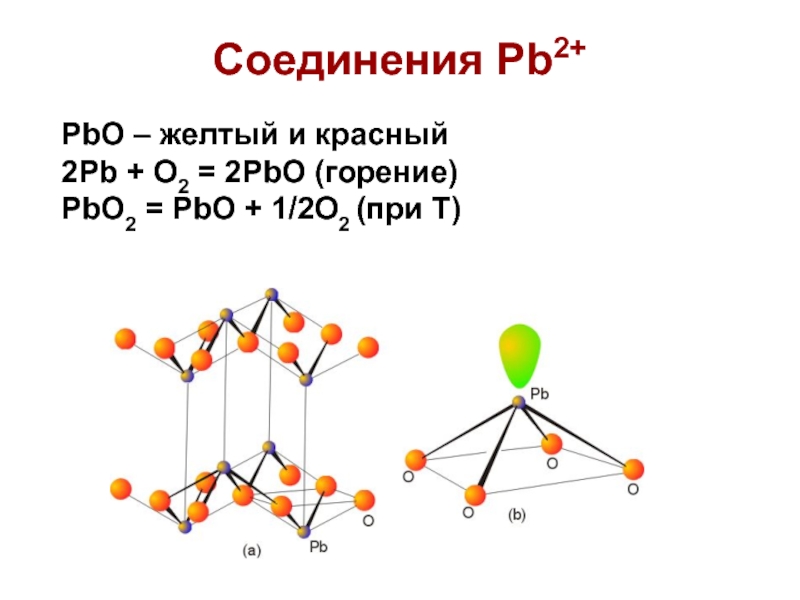
Слайд 44Соединения Pb2+
PbO – желтый и красный
2Pb + O2 = 2PbO
(горение)
PbO2 = PbO + 1/2O2 (при Т)
Слайд 45Соединения Pb2+
PbO + 2AcOH = Pb(OAc)2 + H2O
Pb(OH)2 + 2HCl
= PbCl2 + 2H2O
Pb(OH)2 + 2NaOH = Na2[Pb(OH)4]
Pb(NO3)2, Pb(OAc)2 свинцовый
сахар – растворимы
Не растворимые соли PbX2
(X = F,Cl,Br,I,1/2SO4)
Слайд 46Примеры Ox-red
Sn2+ - удобный мягкий восстановитель
2MnO4- + 5Sn2+ +
16H+ = 2Mn2+ +5Sn4+ + 8H2O
2MnO4- + [Sn(OH)3]- + 3OH-
= 2MnO42- + [Sn(OH)6]2-
PbO2 сильный окислитель, особенно в кислой среде
5PbO2 + 2Mn2+ +4H+ = 5Pb2+ + 2MnO4- + 2H2O
4PbO2 тв + H2S газ = PbSO4 + 3PbO + H2O (воспламенение)
Слайд 47Сульфиды и тиосоли
GeS, SnS, PbS – не обладают кислотными св-вами
и не реагируют с Na2S
НО!!! ЭIIS + Na2S2 = Na2ЭIVS3
(Э = Ge,Sn)
GeS2, SnS2 – обладают кислотными св-вами
SnS2 + Na2S = Na2SnS3 тиостаннат
Na2SnS3 + 2HCl = SnS2↓ + H2S + 2NaCl
PbS2 = PbII(S2)



![C, Si, Ge, Sn, Pb ФуллереныK3C60 – сверхпроводник при Tc = 18KP. 550 C60 + [(С2Н4)Pt(PPh3)2] = [Pt(PPh3)2C60] + С2Н4Полиеновая молекула??Gd@C60 ФуллереныK3C60 – сверхпроводник при Tc = 18KP. 550 C60 + [(С2Н4)Pt(PPh3)2] = [Pt(PPh3)2C60] + С2Н4Полиеновая молекула??Gd@C60](/img/thumbs/890452730db87401db0c5a641f1bc813-800x.jpg)

![C, Si, Ge, Sn, Pb Каталитические синтезы1) Синтез уксусной кислоты (процесс Monsanto) – катализатор [Rh(CO)2I2]-CH3OH + Каталитические синтезы1) Синтез уксусной кислоты (процесс Monsanto) – катализатор [Rh(CO)2I2]-CH3OH + CO = CH3COOH 2) Синтез альдегидов](/img/thumbs/3041c0ba413bd672c92cd3586fd979fb-800x.jpg)

![C, Si, Ge, Sn, Pb Карбонилы металловПравило 18 электронов: s2p6d10 2 + 6 + 10 Карбонилы металловПравило 18 электронов: s2p6d10 2 + 6 + 10 = 18[Cr(CO)6]: 6+2x6 = 18[Fe(CO)5]: 8+2x5](/img/thumbs/20d25ab84ab5084e167b2b9cfa9fec62-800x.jpg)






![C, Si, Ge, Sn, Pb Соединения с N3) Восстановительные свойства:2Cu2+ + 10CN- = (CN)2↑ + 2[Cu(CN)4]3-CN Соединения с N3) Восстановительные свойства:2Cu2+ + 10CN- = (CN)2↑ + 2[Cu(CN)4]3-CN радикал называют псевдогалогенидом 2Сu2+ + 4I-](/img/thumbs/0eb439d3bf1a531c113d5af293977ccc-800x.jpg)



![C, Si, Ge, Sn, Pb АлюмосиликатыAl или замещает Si (тетраэдр) или имеет октаэдр. окружениеУсеченный октаэдрЦеолит А[Na96(H2O)216][Al96Si96O384]Диаметр входа 4Å АлюмосиликатыAl или замещает Si (тетраэдр) или имеет октаэдр. окружениеУсеченный октаэдрЦеолит А[Na96(H2O)216][Al96Si96O384]Диаметр входа 4Å](/img/thumbs/9333c057193f015384a79c5da55aa69d-800x.jpg)
![C, Si, Ge, Sn, Pb АлюмосиликатыЦеолит Х[Na58(H2O)240][Al58Si134O384]Диаметр входа 8ÅПРИМЕНЕНИЕИонный обмен Разделение молекулКатализShip in the Bottle АлюмосиликатыЦеолит Х[Na58(H2O)240][Al58Si134O384]Диаметр входа 8ÅПРИМЕНЕНИЕИонный обмен Разделение молекулКатализShip in the Bottle](/img/thumbs/5767623c81503d91bedd34263a7b0150-800x.jpg)