Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ЭЛЕКТРОЛИЗ
Содержание
- 1. ЭЛЕКТРОЛИЗ
- 2. Окислительно-восстановительная реакция, протекающая в растворе или расплаве электролита у электродов при пропускании постоянного тока, называется электролизом.
- 3. Электролизер (электролитическая ячейка) – специальный сосуд с раствором или расплавом, в который погружены электроды.
- 4. Электроды Внимание! Заряжены противоположно знаку заряда электродов
- 5. Виды электролизаРазличаютЭлектролиз расплавов и растворов веществЭлектролиз с инертными и активными электродами
- 6. Факторы, влияющие на электролизСостав электролитаМатериал электродаТемператураНапряжениеСила тока и др.
- 7. Электролиз расплавов с инертным анодомПри электролизе расплавов
- 8. Электролиз расплава соли
- 9. Слайд 9
- 10. Электролиз воды
- 11. Электролиз водных растворов с инертным анодомПри электролизе
- 12. Слайд 12
- 13. При электролизе растворов солей с инертным анодом
- 14. 3. При электролизе растворов солей, содержащих катионы
- 15. Анод:4.При электролизе растворов, содержащих фторид-ион и кислородные
- 16. Слайд 16
- 17. Примеры электролиза водных растворов солей с инертными графитовыми электродами
- 18. Суммарную реакцию в этом случае записать нельзя,
- 19. Ошибка!!
- 20. Электролиз с растворимым анодомНа аноде происходит окисление
- 21. Если в системе присутствуют несколько различных ионов:На
- 22. Слайд 22
- 23. Слайд 23
- 24. n – число ēI – сила тока,
- 25. Выход по токуПри электролизе во многих случаях
- 26. Пример 1. При рафинировании меди ток силой
- 27. Пример 2. Через раствор, содержащий ионы Pb2+, в
- 28. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗАЭлектролиз нашел широкое применение в технике,
- 29. 1. Покрытие металлов слоем другого металла при помощи электролиза (гальваностегия).
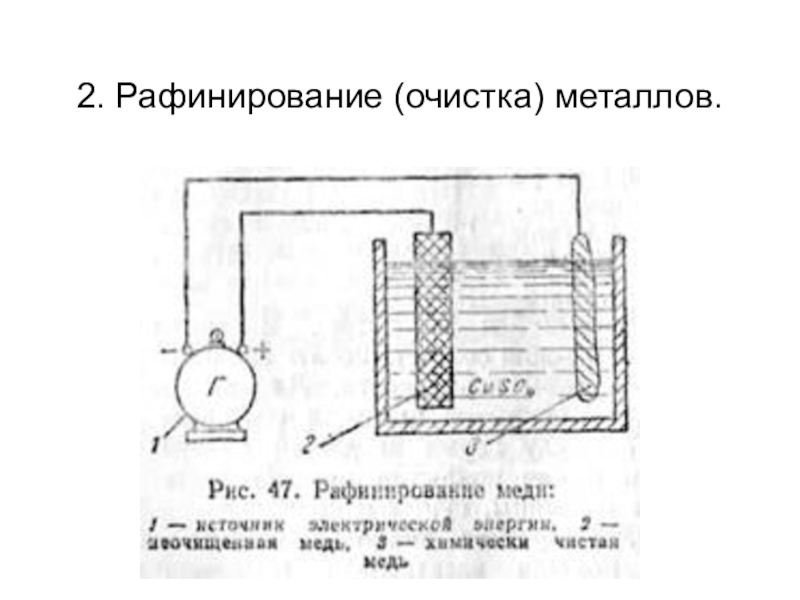
- 30. 2. Рафинирование (очистка) металлов.
- 31. Слайд 31
- 32. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Окислительно-восстановительная реакция, протекающая в растворе или расплаве электролита у электродов
при пропускании постоянного тока, называется электролизом.
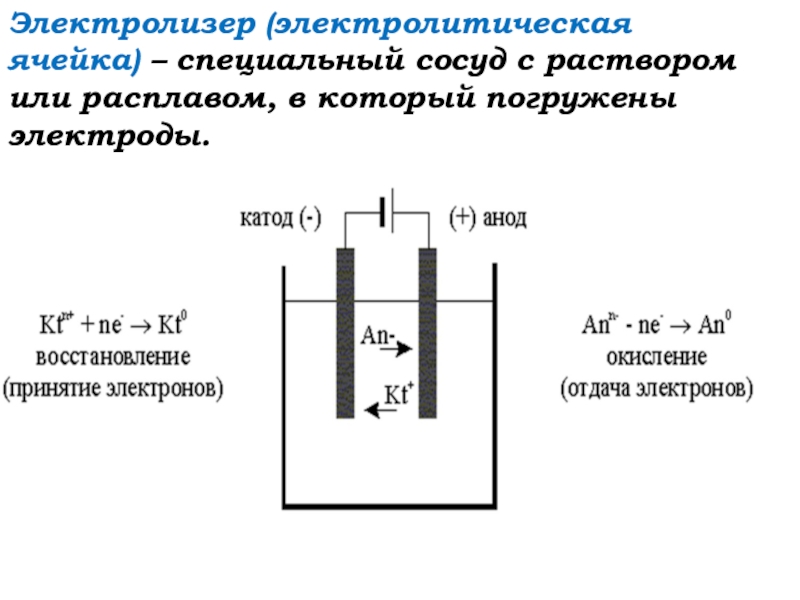
Слайд 3Электролизер (электролитическая ячейка) – специальный сосуд с раствором или расплавом,
в который погружены электроды.
Слайд 4Электроды
Внимание! Заряжены противоположно знаку заряда электродов в гальваническом элементе!
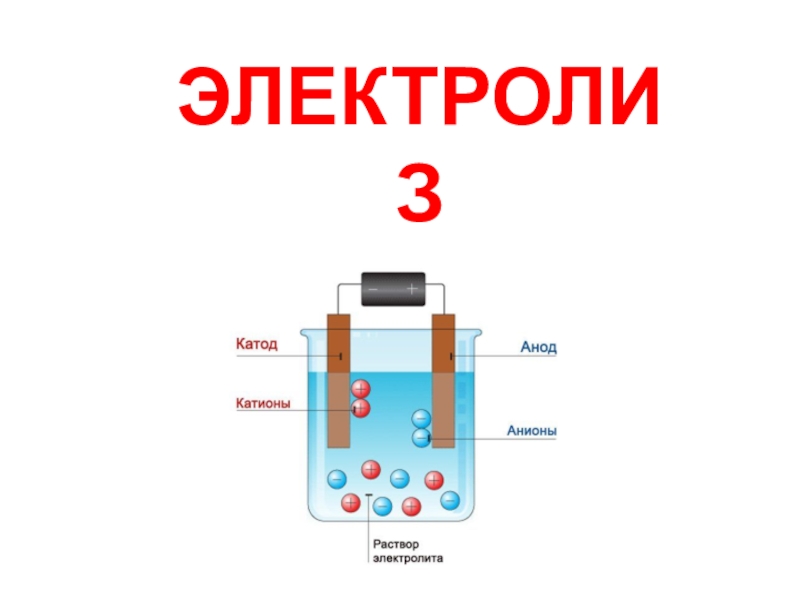
Катод
(-) - электрод, на котором идет реакция восстановления, подключен к
отрицательному полюсу внешнего источника тока.Анод (+) - электрод, на котором протекает реакция окисления, подключен к положительному полюсу источника тока.
Катионы перемещаются к отрицательному электроду - катоду, а анионы - к положительному электроду - аноду.
Таким образом, сущность процесса электролиза заключается в том, что на катоде происходит процесс восстановления, а на аноде - процесс окисления.
Слайд 5Виды электролиза
Различают
Электролиз расплавов и растворов веществ
Электролиз с инертными и активными
электродами
Слайд 6Факторы, влияющие на электролиз
Состав электролита
Материал электрода
Температура
Напряжение
Сила тока и др.
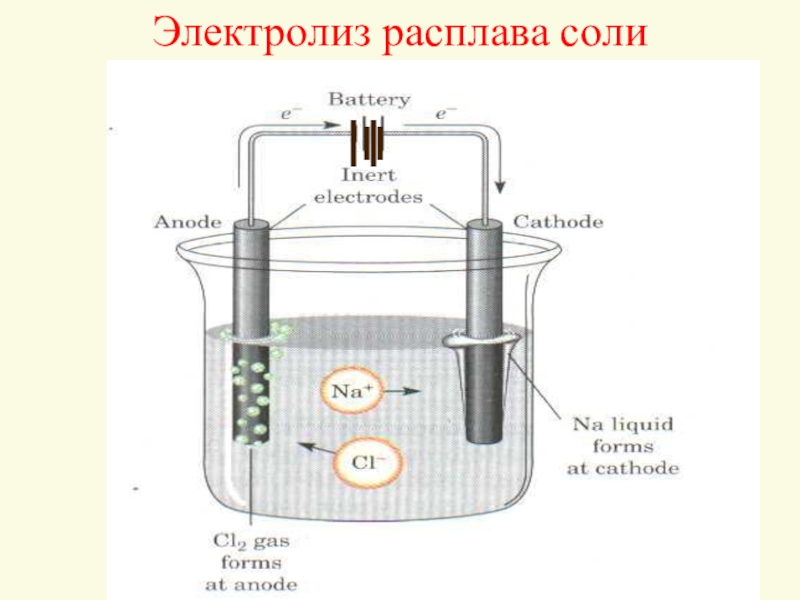
Слайд 7Электролиз расплавов с инертным анодом
При электролизе расплавов соли и щелочи
с инертным анодом на катоде происходит восстановление катионов металла, а
на инертном аноде – окисление анионов кислотных остатков (электролиз расплава солей) или гидроксид-анионов (электролиз расплава щелочи).Слайд 11Электролиз водных растворов с инертным анодом
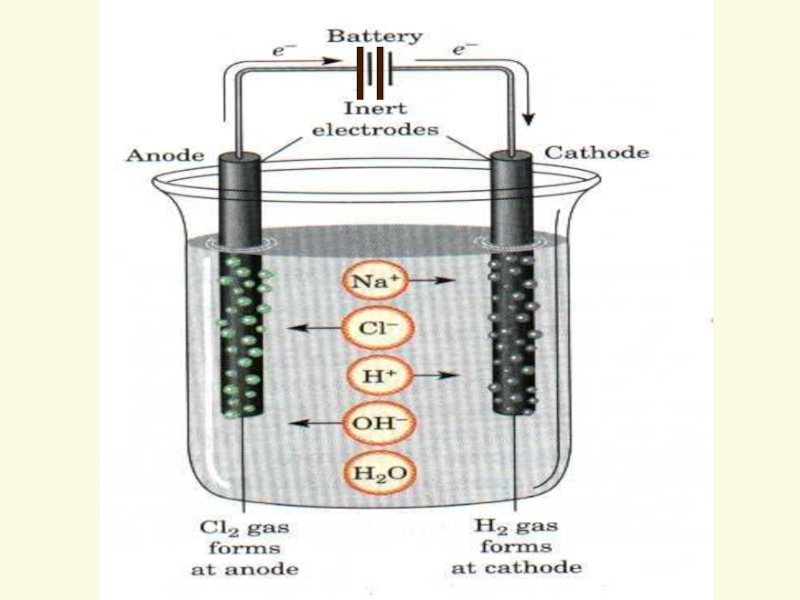
При электролизе водных растворов электролитов
на электродах, наряду с разряжением катионов и анионов или вместо
них, могут восстанавливаться или окисляться молекулы воды.Слайд 13При электролизе растворов солей с инертным анодом используют правила:
Катод:
1. При
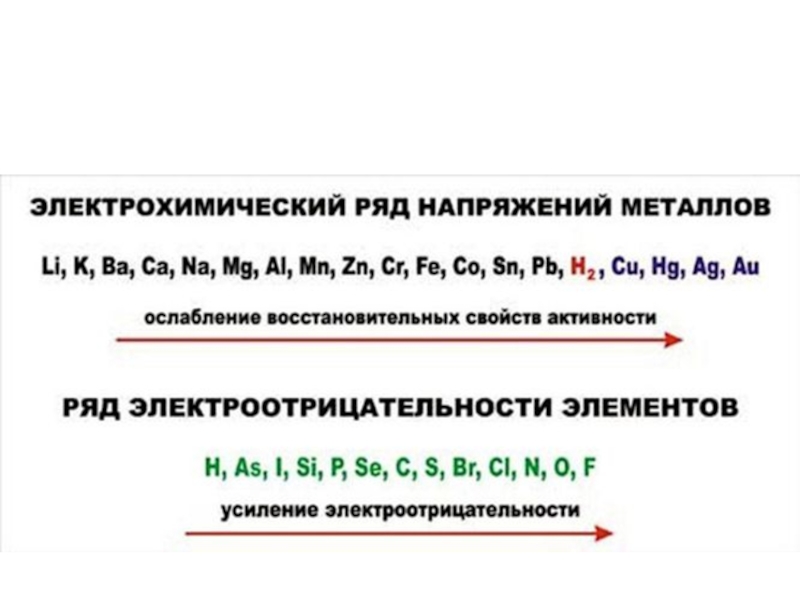
электролизе растворов солей, содержащих катионы металлов, расположенных в электрохимическом ряду
напряжений правее водорода (Еº298 Ме > 0), на катоде восстанавливаются катионы этих металлов:2. В растворах солей, содержащих катионы металлов, расположенных в ряду напряжений левее Mn (Zn) (со стандартными электродными потенциалами ниже – 1,18 В) на катоде восстанавливаются молекулы воды:
Слайд 143. При электролизе растворов солей, содержащих катионы металлов, расположенных в
электрохимическом ряду напряжений между Al и Cu (-1,18В < Еº298
Ме < 0), на катоде восстанавливаются катионы этих металлов и молекул воды:Слайд 15Анод:
4.При электролизе растворов, содержащих фторид-ион и кислородные анионы (SO42-, NO3-,
PO43-,CO32-), у анода окисляются молекулы воды и выделяется кислород:
5. При
электролизе растворов, содержащих анионы бескислородных кислот (Cl-, Br-, J-, S2-) и гидроксид-ионы OH- , окисляются у анода только эти анионы:6. При окислении анионов органических кислот происходит процесс:
Слайд 18Суммарную реакцию в этом случае записать нельзя, т.к. неизвестно, какая
часть пропущенного электричества затрачивается в катодном процессе на восстановление воды,
а какая на восстановление ионов цинка.Слайд 20Электролиз с растворимым анодом
На аноде происходит окисление металла.
На катоде протекает
процесс также, как и при электролизе с инертным анодом.
Пример: Электролиз
водного раствора CuSO4 c медным растворимым анодомСлайд 21Если в системе присутствуют несколько различных ионов:
На катоде в первую
очередь восстанавливаются металлы, стоящие правее в ряду напряжений (т.е. имеющие
большее значение электродного потенциала и являющиеся более сильными окислителями).На аноде в первую очередь будут окисляться анионы с меньшей электроотрицательностью (т.е. имеющие меньшее значение электродного потенциала и являющиеся более сильными восстановителями)
Слайд 24n – число ē
I – сила тока, А
- время,
сек; М – молярная масса, г/моль
F=96500 Кл/моль
Закон Фарадея
I·τ=Q – количество
электричества, КлСлайд 25Выход по току
При электролизе во многих случаях выделяется меньше вещества,
чем должно получиться по законам Фарадея. Этo oбъяcняeтcя тeм, чтo,
нaряду c ocнoвными элeктрoдными прoцeccaми oкиcлeния и вoccтaнoвлeния, практически всегда протекают побочные реакции. К их числу можно отнести взаимодействие образовавшихся при электролизе веществ с элeктрoлитoм, выдeлeниe, нaряду c мeтaллoм, нa кaтoдe вoдoрoдa и другие. Кроме того, часть электрической энергии тратится на преодоление сопротивления электролита. Поэтому для экономической оценки процесса электролиза вводят такие понятия, как выход по току и расход энергии на получение единицы продукции энергии.Выход по току рассчитывается как степень отклонения массы фактически прореагировавшего на электроде вещества mфакт от теоретически рассчитанной по закону Фарадея mтеор:
Слайд 26Пример 1. При рафинировании меди ток силой в 50 А
выделил - за 5 ч чистую медь массой 281 г.
Какому выходу по току это соответствует?Решение. Число участвующих в электродном процессе электронов z равно валентности этого элемента В.
По законам Фарадея можно рассчитать теоретическое значение массы выделившейся меди:
Выход по току находим по формуле:
Слайд 27Пример 2. Через раствор, содержащий ионы Pb2+, в течение 5 мин.
пропускался ток постоянной силы. За это время масса катода увеличилась
на 1,24 г. Какова сила тока, который был использован для электролиза?Решение. Поскольку нет дополнительных сведений, считаем выход по току 100%-ным. Тогда для расчета силы тока можно воспользоваться законом Фарадея: