Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физические основы преобразования и аккумуляции энергии в биологических
Содержание
- 1. Физические основы преобразования и аккумуляции энергии в биологических
- 2. Клеточная мембрана –полупроницаемый барьер, отделяющий цитоплазму клеток
- 3. Биофизика мембран.Основные задачи биофизики мембран: Строение мембран,
- 4. Образование мембранных структур.Изотерма площадь-давление для монослоя длинноцепочечных
- 5. Образование мембранных структур.Создание искусственных бислойных мембран позволяет
- 6. Образование мембранных структур.Этапы формирования бислойной мембраны:123Толстая многослойная
- 7. Образование мембранных структур.Поведение различных веществ в растворах
- 8. Фазовые переходы в мембранах.Природные и искусственные мембраны
- 9. DG = DH– TDSФазовые переходы в мембранах.Фазовый
- 10. Кооперативность фазовых переходов в мембранах.Для оценки степени
- 11. Мембранный транспортМембранный транспортПассивный - транспорт веществ по
- 12. Классификация видов мембранного транспорта
- 13. Энергия пассивного транспорта создается различными градиентами:концентрационнымосмотическимэлектрическимградиентом гидростатического
- 14. Диффузия – это самопроизвольный процесс проникновения вещества
- 15. Пассивный мембранный транспорт. Диффузия.Первый закон Фика:(поток вещества
- 16. Уравнение Коллендера-БернульдагдеС1 и С2 – концентрации вещества
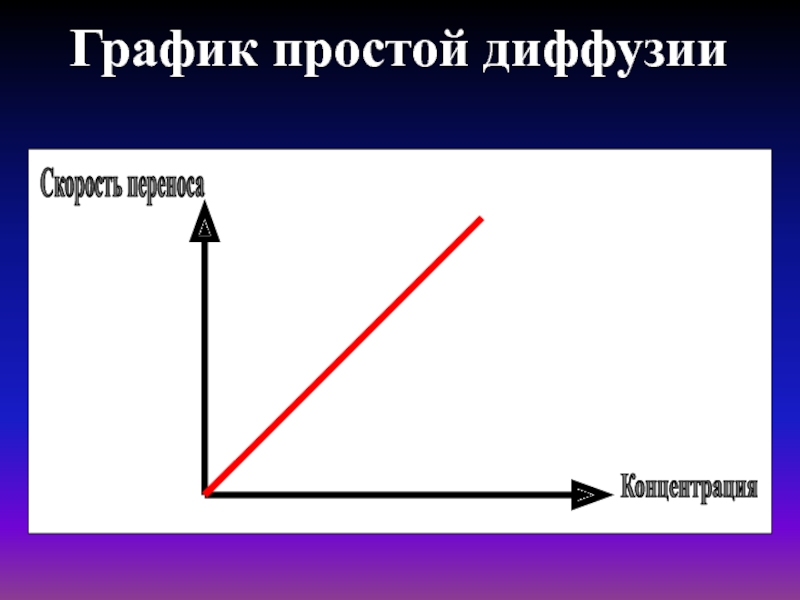
- 17. График простой диффузииСкорость переносаКонцентрация
- 18. Молекулы, имеющие примерно одинаковую массу и размер,
- 19. В ряде
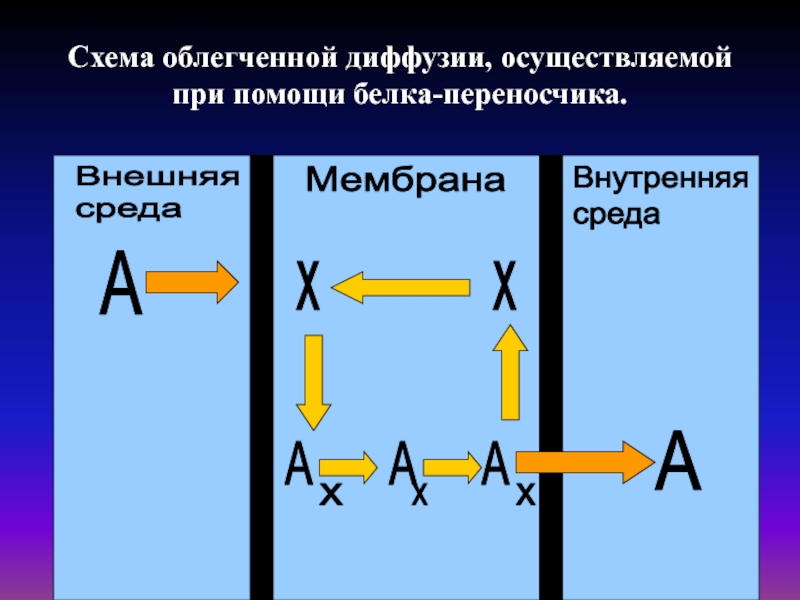
- 20. Схема облегченной диффузии, осуществляемой при помощи белка-переносчика.
- 21. Транспорт ионов.Движущей силой диффузии служит разность химических
- 22. Ионные каналы биомембраны Ионные каналы биомембраны
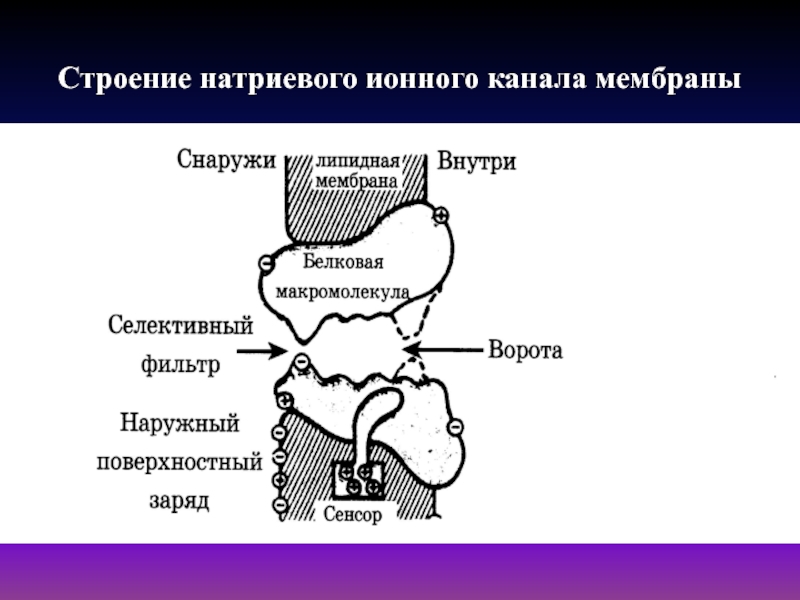
- 23. Строение натриевого ионного канала мембраны
- 24. Активный мембранный транспорт. Натрий-калиевый насос.Рабочий цикл димера
- 25. E- фермент, Х – АТФ, Z- АДФ,
- 26. Активный мембранный транспорт. Натрий-калиевый насос.
- 27. Кинетика облегченной диффузии через мембраны при участии белка-переносчика и каналообразующего белкаСкорость транспорта
- 28. Ферментативный перенос описывается уравнением Михаэлиса-Ментен .
- 29. Обменная диффузия - это ферментативный перенос веществ
- 30. Уравнение, описывающее осмотический перенос воды.Где
- 31. Где r – радиус поры
- 32. Основные этапы Na+ - K+-насоса : образование
- 33. Внешняясреда ВнутренняясредаМЕМБРАНААТФАДФ+Фн2К+3Na+2Mg2+АТФ-аза
- 34. Основные этапы Са2+-насоса :Первый этап: связывание Са2+
- 35. КЛЕТКАМЕМБРАНАМЕЖКЛЕТОЧНОЕ ПРОСТРАНСТВОАТФАДФ+ФнСа2+Mg2+АТФ-аза
- 36. Образующийся в цикле Кребса восстановленный никотинамидадениндинуклеотид (NADH) подхватывается
- 37. Внешняясреда Сопрягающая мембранаВнутренняясредасубстратАТФАДФ+Фнее2Н2Н2Н+++О2АТФ-аза
- 38. Организация дыхательной цепиКомплекс I содержит FMN (флавинмононуклеотид)
- 39. Организация дыхательной цепи
- 40. Физические основы преобразования и аккумуляции энергии в
- 41. Константа равновесия К непосредственно связана с изменением свободной
- 42. Причины высоко экзоэргического характера гидролиза АТФ: сильное отталкивание
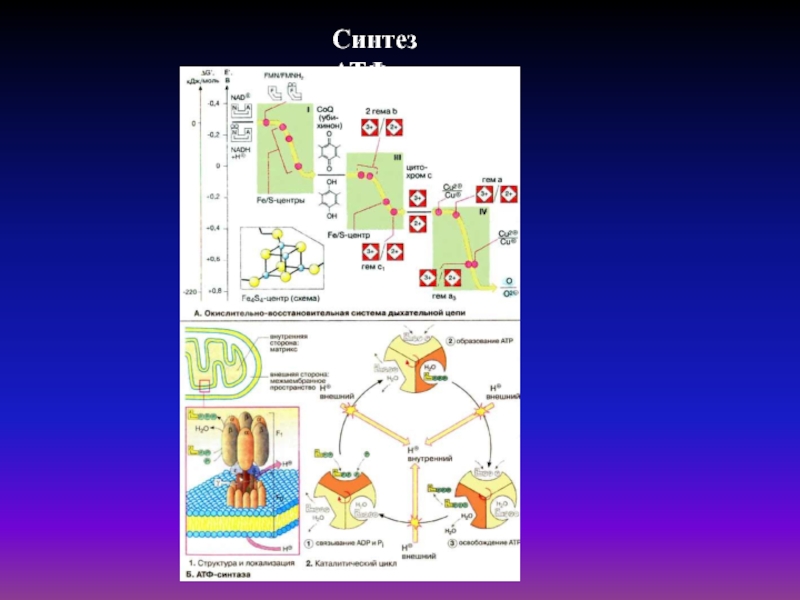
- 43. Механизм синтеза АТФАТФ-синтаза состоит из двух частей:
- 44. Синтез АТФ
- 45. Митохондрии, перенос электроновМитохондриальная цепь переноса электронов. Комплекс
- 46. Направление процесса и сопряженные реакцииНаправление химической реакции
- 47. Механизмы, обеспечивающие протекание сопряженных реакций.Реакция фосфорилирования глюкозы
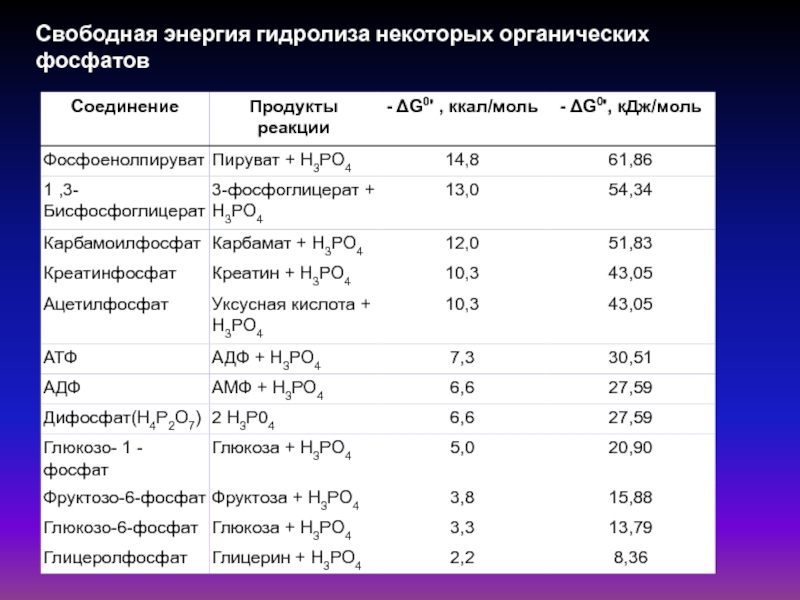
- 48. Свободная энергия гидролиза некоторых органических фосфатов
- 49. АТФ - молекула, богатая энергией, поскольку она
- 50. Некоторые биосинтетические реакции в организме могут протекать
- 51. Биологическое окислениеПод окислением понимают отщепление электронов, а
- 52. Стандартные окислительно-восстановительные потенциалы некоторых сопряжённых пар Величину
- 53. Основные этапы трансформации энергии катаболических процессовЭнергия освобождается
- 54. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Клеточная мембрана –полупроницаемый барьер, отделяющий цитоплазму клеток от окружающей среды
Плазматическая
мембрана.
Слайд 3Биофизика мембран.
Основные задачи биофизики мембран:
Строение мембран, динамические свойства мембранной
структуры, определяющие ее функциональность
Мембранный транспорт
Свойства возбудимых мембран (физика нервного импульса)
Биоэнергетика
мембранФизика процессов рецепции
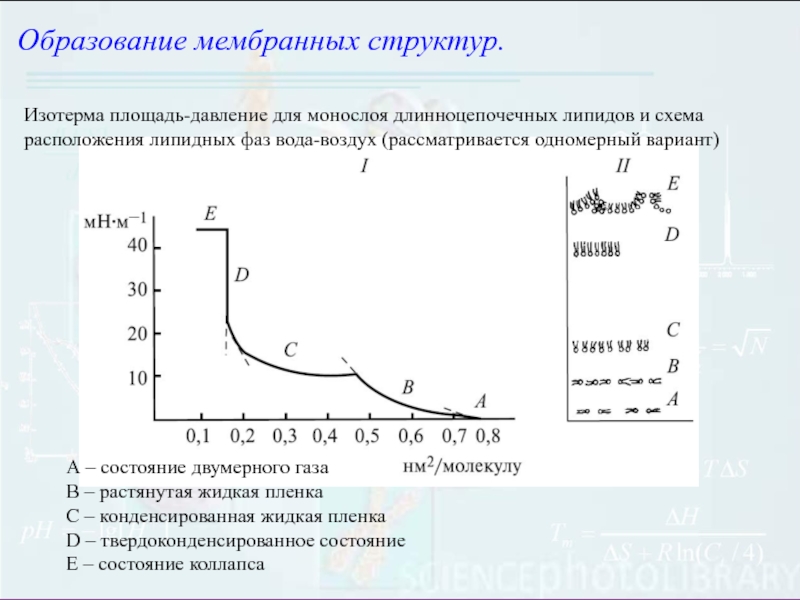
Слайд 4Образование мембранных структур.
Изотерма площадь-давление для монослоя длинноцепочечных липидов и схема
расположения липидных фаз вода-воздух (рассматривается одномерный вариант)
А – состояние двумерного
газаB – растянутая жидкая пленка
C – конденсированная жидкая пленка
D – твердоконденсированное состояние
E – состояние коллапса
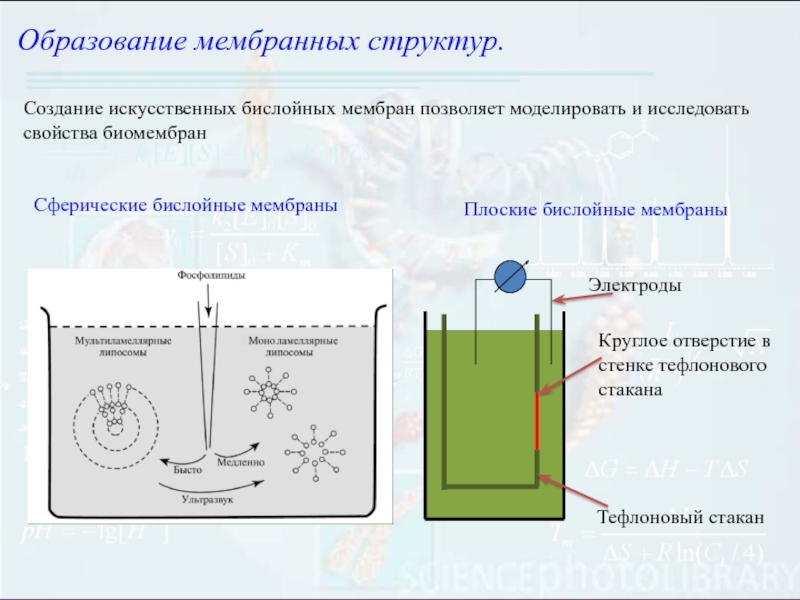
Слайд 5Образование мембранных структур.
Создание искусственных бислойных мембран позволяет моделировать и исследовать
свойства биомембран
Сферические бислойные мембраны
Плоские бислойные мембраны
Электроды
Тефлоновый стакан
Круглое отверстие в
стенке тефлонового стаканаСлайд 6Образование мембранных структур.
Этапы формирования бислойной мембраны:
1
2
3
Толстая многослойная мембрана (~ >
100 нм)
Выпуклая линзоподобная мембрана
Бислойная липидная мембрана
Формирование такой структуры обусловлено поверхностным
натяжением (σ) и Ван-дер-ваальсовым притяжение водных фаз по обе стороны пленки, - расклинивающее давление.Закон Лапласа давления на поверхности раздела двух фаз:
Ri – внутренний и наружный радиусы кривизны поверхности
Слайд 7Образование мембранных структур.
Поведение различных веществ в растворах подчиняется
адсорбционному уравнению
Гиббса:
где σ – поверхностное натяжение, Γi – степень адсорбции,
μ
i – химический потенциал i-го компонента в поверхностном слоеДля бинарной системы (вода-липид):
При низкой концентрации растворенного вещества, сильно адсорбирующегося на поверхности раздела, адсорбцию растворителя можно приравнять к нулю (Г2=0):
Для разбавленных растворов:
a – активность вещества, с - концентрация
- поверхностная активность вещества
Если Г>0, то вещество называется поверхностно активным
(снижает поверхностное натяжение)
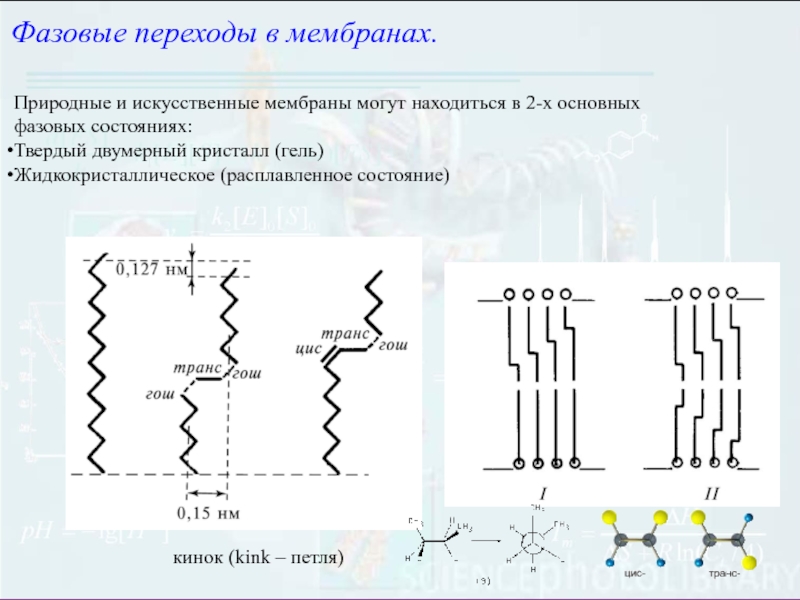
Слайд 8Фазовые переходы в мембранах.
Природные и искусственные мембраны могут находиться в
2-х основных фазовых состояниях:
Твердый двумерный кристалл (гель)
Жидкокристаллическое (расплавленное состояние)
кинок (kink
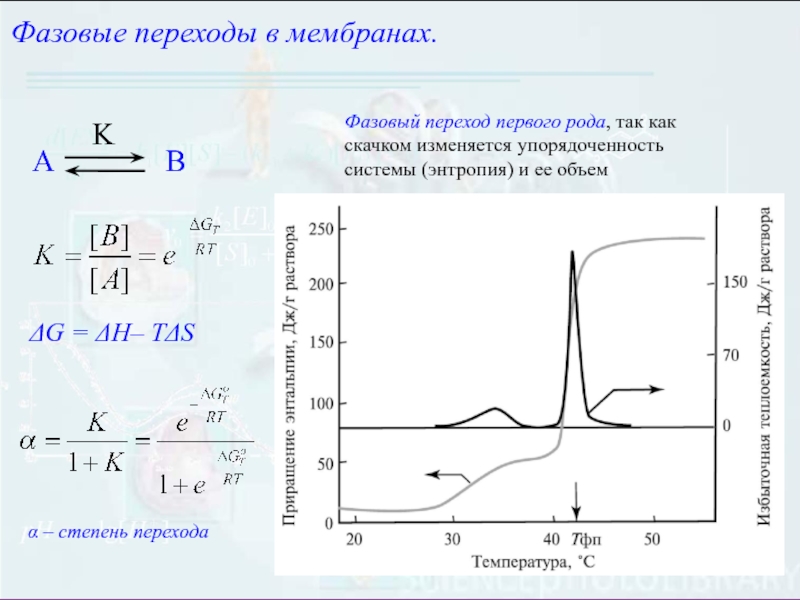
– петля)Слайд 9DG = DH– TDS
Фазовые переходы в мембранах.
Фазовый переход первого рода,
так как скачком изменяется упорядоченность системы (энтропия) и ее объем
a
– степень переходаСлайд 10Кооперативность фазовых переходов в мембранах.
Для оценки степени кооперативности сравнивают изменение
внутренней энергии (DH) и измеряемую калориметрически теплоту перехода DQ.
В общем
случае DH=N·DQ, где N- число молекул в кооперативной единицеПараметр кооперативности:
Переход называется кооперативным, если DQ /DH << 1 (узкий переход)
Существуют теории, детально рассматривающие процессы протекающие при фазовом переходе. Тем не менее, одной из основных задач является вычисление температуры фазового перехода и его теплового эффекта.
Слайд 11Мембранный транспорт
Мембранный транспорт
Пассивный - транспорт веществ по градиенту концентрации, осуществляющийся
за счет диффузии не требующий затрат энергии.
Активный - транспорт веществ
осуществляющийся с затратами энергии. Может происходить против градиента концентраций.Индуцированный транспорт веществ по градиенту концентрации, осуществляющийся за счет «облегченной» диффузии.
Слайд 13Энергия пассивного транспорта создается различными градиентами:
концентрационным
осмотическим
электрическим
градиентом гидростатического давления жидкости
электрохимическим (совокупность
концентрационного и электрического)
Основным механизмом пассивного транспорта веществ, обусловленным наличием концентрационного
градиента, является диффузия.Слайд 14Диффузия –
это самопроизвольный процесс проникновения вещества из области большей
в область меньшей его концентрации в результате теплового хаотического движения
молекул.Простая диффузия описывается уравнением Фика : скорость
диффузии прямо пропорциональна градиенту концентрации и площади S, через которую осуществляется диффузия:
Скорость диффузии - это количество вещества, диффундирующего в единицу времени через данную площадь.
Градиент концентрации - это изменение концентрации вещества, приходящееся на единицу длины, в направлении диффузии.
Знак «-» показывает, что диффузия идет из области большей в область меньшей концентрации.
D - коэффициент диффузии.
Слайд 15Пассивный мембранный транспорт. Диффузия.
Первый закон Фика:
(поток вещества пропорционален градиенту концентрации)
В
случае стационарного потока (dc/dx=const)
(на краях мембраны толщины h
поддерживаются
концентрации с1 и с2,связанные с концентрациями в омывающем
потоке с1` = с1 и с2` = с2, то поток равен:
- коэффициент распределения
Р=D/h – проницаемость мембраны для данного вещества
В случае НЕстационарного потока, уравнение непрерывности потока
Откуда получим второй закон Фика:
Слайд 16Уравнение Коллендера-Бернульда
где
С1 и С2 – концентрации вещества по разные стороны
мембраны
Р – коэффициент проницаемости, аналогичный коэффициенту диффузии
В отличии от
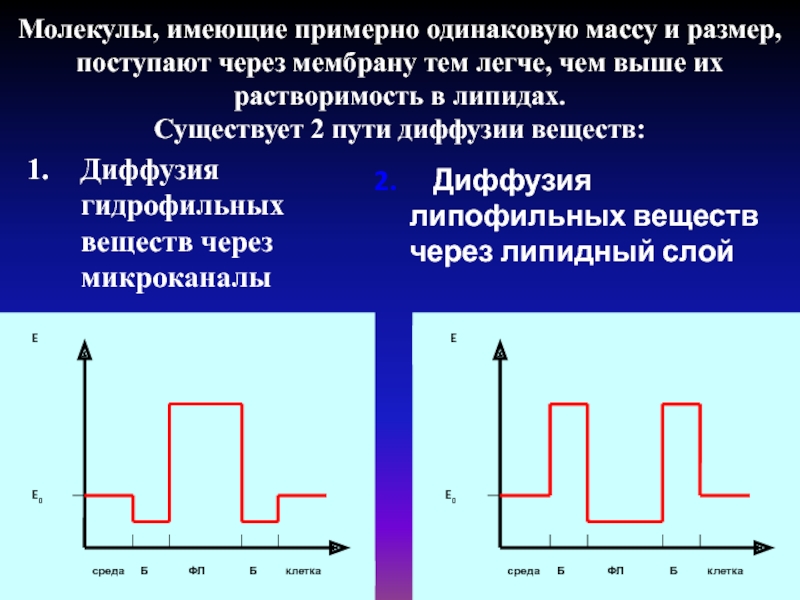
коэффициента диффузии, который зависит только от природы вещества и температуры, коэффициент проницаемости зависит еще от свойств мембраны и от её функционального состояния.Слайд 18Молекулы, имеющие примерно одинаковую массу и размер, поступают через мембрану
тем легче, чем выше их растворимость в липидах. Существует 2 пути
диффузии веществ:Диффузия гидрофильных веществ через микроканалы
Диффузия
липофильных веществ
через липидный слой
Слайд 19 В ряде случаев скорость
диффузии некоторых водорастворимых веществ во много раз выше, чем скорость диффузии
этих веществ в липидной фазе. Такое явление получило название облегченной диффузии.
Облегченная диффузия осуществляется при помощи белка-переносчика или каналообразующего белка.
Примером подвижного белка-переносчика может служить валиномицин, транспортирующий К+.
Примером каналообразующего белка может служить грамицидин, осуществляющий трансмембранный перенос Na+ по градиенту концентрации.
При наличии микроканалов в мембране происходит изменение полярности липидного слоя.
Ограниченная диффузия характеризуется ограничением скорости движения заряженных частиц вследствии уменьшения электрического взаимодействия.
Слайд 21Транспорт ионов.
Движущей силой диффузии служит разность химических потенциалов данного вещества
в двух областях.
Стандартный химический потенциал, зависящий от природы растворителя
Вклад, возникающий
для заряженных частиц (ионов) с зарядом z в потенциале (перенос заряда в электрическом поле)Электрохимический потенциал иона типа i при условиях, когда активность равна концентрации и вкладом гидростатического давления можно пренебречь:
В случае ионного равновесия между двумя растворами, разделенными мембраной (только один тип ионов):
Разность потенциалов:
Слайд 22Ионные каналы биомембраны
Ионные каналы биомембраны - это специализированные
селективные поры, образованные белковыми молекулами, предназначенными для облегченной диффузии определенных
ионов (Na+,K+,Ca2+,Cl- и т.д.).Выделяют три самостоятельные транспортные системы в возбудимых мембранах Na+, K+, Ca2+- каналы, сходные по своим функциям, но отличающиеся избирательностью (селективностью).
С внешней стороны мембраны у входа в канал расположен селективный центр, в основе функционирования которого лежит принцип стерического соответствия. Его назначение - не пропускать в канал и из канала ионы большего и меньшего размеров, а со стороны цитоплазмы располагаются так называемые "ворота", которые управляются трансмембранным электрическим полем при помощи конформационно-лабильного электрического сенсора. По каналу ионы проходят по эстафетному принципу, друг за другом. Ворота могут находиться в двух состояниях:"открыто-закрыто".
Слайд 24Активный мембранный транспорт. Натрий-калиевый насос.
Рабочий цикл димера Na+ насоса в
режиме Na+/K+ обмена
Большая
субъединица
Малая
субъединица
Этапы работы Na-K насоса:
1) связывание Na+ и
K+ в полостях субъединиц, 1) Na+-зависимое фосфорилирование большой субъединицы, 3) обмен катионами между субъединицами, 4) K+-дефосфорилирование и выброс ионов.Слайд 25E- фермент, Х – АТФ, Z- АДФ, Y(Ф)- фосфат, i-
внутренняя сторона мембраны, e – внешняя сторона мембраны, ρ, ν,
κ – стехиометрические коэффициентыОбменное равновесие можно записать в виде:
На внутренней стороне мембраны:
На внешней стороне мембраны:
В случае отсутствия свободных центров:
Общая схема примет вид:
Необходимы упрощения для нахождения распределения концентраций катионов.
Активный мембранный транспорт. Натрий-калиевый насос.
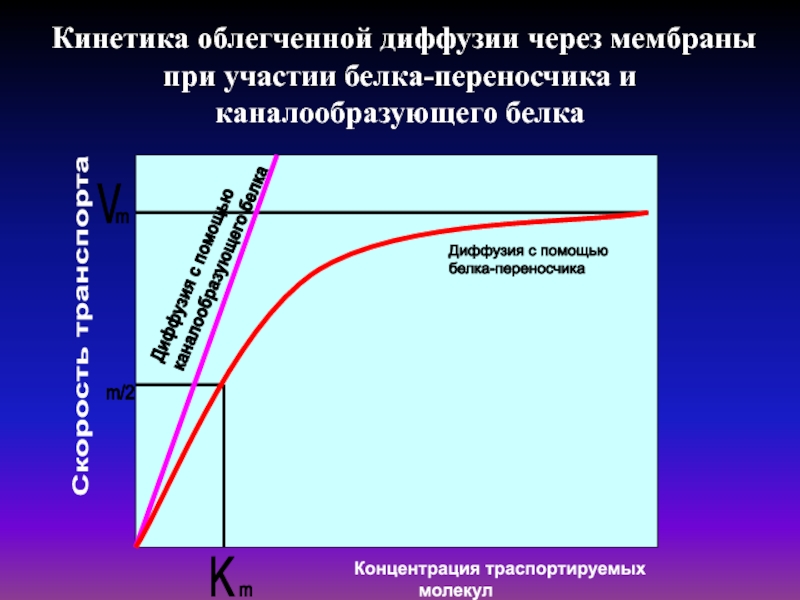
Слайд 27Кинетика облегченной диффузии через мембраны при участии белка-переносчика и каналообразующего
белка
Скорость транспорта
Слайд 28Ферментативный перенос описывается уравнением Михаэлиса-Ментен .
Поток вещества М равен возможной максимальной
скорости Vmax реакции в условиях насыщения фермента и концентрации субстрата С., где k -константа
Из уравнения следует, что при повышении концентрации субстрата скорость потока веществ реакции возрастает и приближается к некоторому постоянному значению, характерному для полного связывания с субстратом.
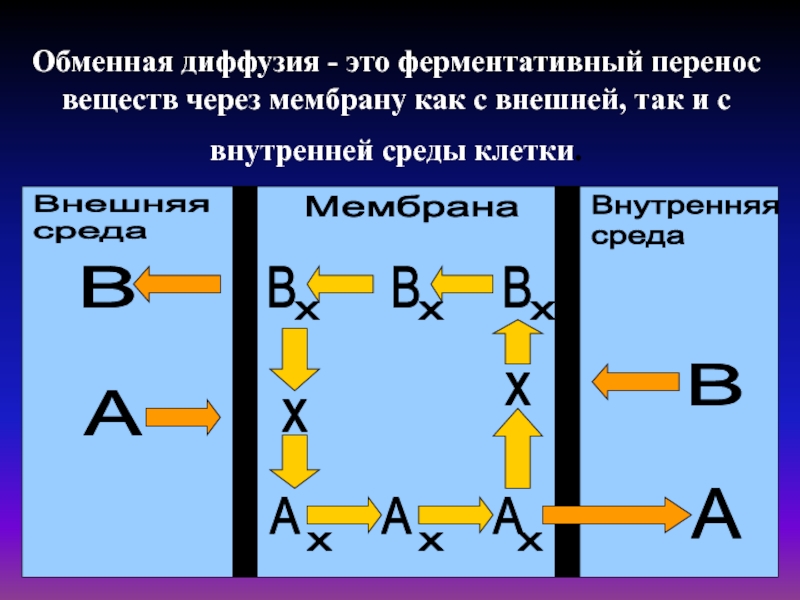
Слайд 29Обменная диффузия - это ферментативный перенос веществ через мембрану как
с внешней, так и с внутренней среды клетки.
Слайд 30Уравнение, описывающее осмотический перенос воды.
Где
-
количество воды, проходящей через мембрану площадью S за единицу времени;
Р1 и Р2 – осмотическое давление растворов по одну и по другую сторону мембраны;k – коэффициент проницаемости.
Осмос - движение молекулы воды через полупроницаемые мембраны из места с меньшей концентрацией растворенного вещества в места с большей концентрацией.
Осмос - это простая диффузия воды из мест с ее большей концентрацией в места с меньшей концентрацией воды. Это явление обуславливает гемолиз эритроцитов в гипотонических растворах.
Слайд 31Где
r – радиус поры
l – длина
поры
η – вязкость жидкости
Р1-Р2 – разность
давления между началом и концом порыV – объем фильтрованной жидкости
Фильтрация – это движение раствора через поры в мембране под действием градиента давления.
Явление фильтрации играет важную роль в процессе переноса воды через стенки кровеносных сосудов
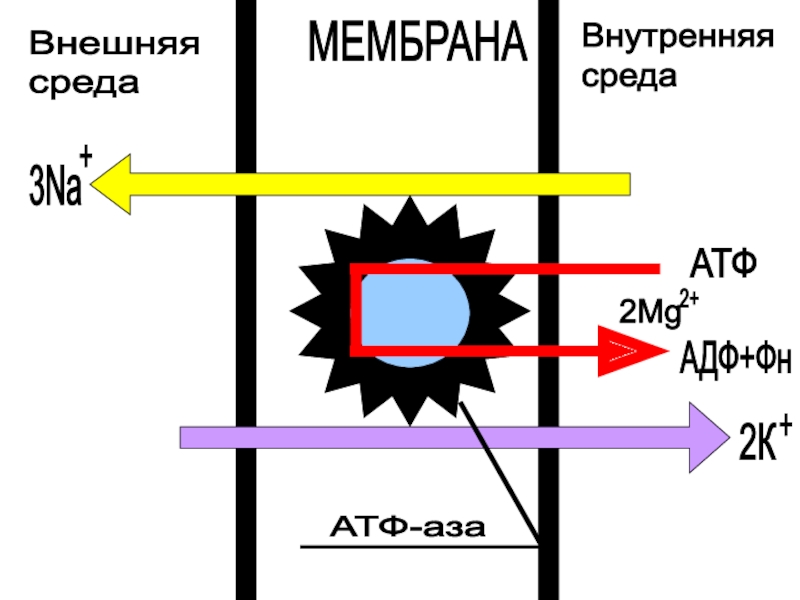
Слайд 32Основные этапы Na+ - K+-насоса :
образование комплекса фермента с АТФ
на внутренней поверхности мембраны (эта реакция активируется ионами магния)
связывание комплексом
трех ионов натрияфосфолирирование фермента с образованием аденозинтрифосфата
переворот фермента внутри мембраны
реакция ионного обмена натрия на калий, происходящая на внешней поверхности мембраны
обратный переворот ферментного комплекса с переносом ионов калия внутрь клетки
возращение фермента в исходное состояние с освобождением ионов калия и неорганического фосфата
Активный транспорт
Принцип работы АТФ-азных-насосов основан на конформационных перестройках белковой макромолекулы при взаимодействии с транспортируемым ионом.
Na+ - K+-насос осуществляется за счет противоградиентного переноса через мембрану трех ионов натрия из клетки и накачивающий два иона калия внутрь клетки
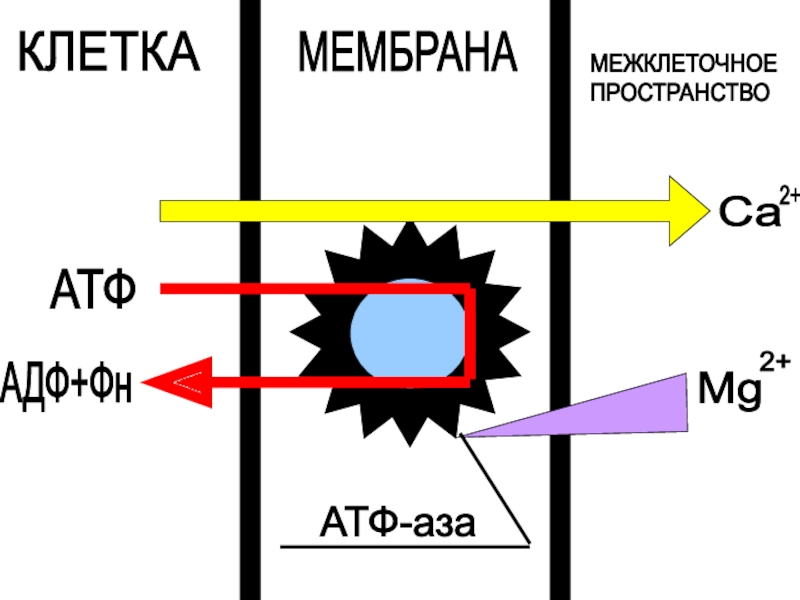
Слайд 34Основные этапы Са2+-насоса :
Первый этап: связывание Са2+ с комплексом Mg-АТФазы
на наружной поверхности саркоплазматической мембраны.
Второй этап: гидролиз АТФ с образованием
фермент-фосфатного комплекса.Третий этап: переход связанного Са2+ через мембрану в клетку.
Четвертый этап: переход кальцийсвязывающих центров на наружную поверхность мембраны
Активный транспорт ионов кальция осуществляется через мембрану саркоплазмотического ретикулума.
Ca2+ - насос идет за счет энергии гидролиза АТФ и переноса двух ионов кальция из клетки в межклеточное пространство.
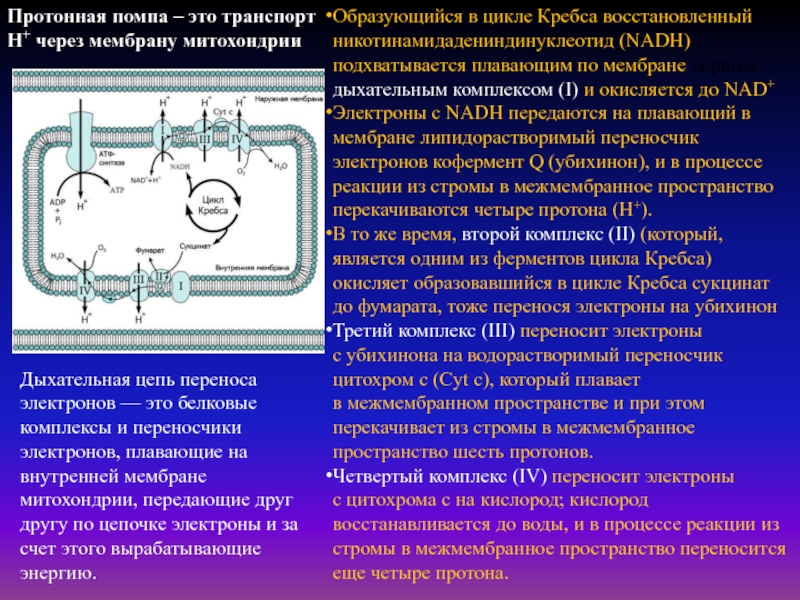
Слайд 36Образующийся в цикле Кребса восстановленный никотинамидадениндинуклеотид (NADH) подхватывается плавающим по мембране
первым дыхательным комплексом (I) и окисляется до NAD+
Электроны с NADH передаются на
плавающий в мембране липидорастворимый переносчик электронов кофермент Q (убихинон), и в процессе реакции из стромы в межмембранное пространство перекачиваются четыре протона (H+).В то же время, второй комплекс (II) (который, является одним из ферментов цикла Кребса) окисляет образовавшийся в цикле Кребса сукцинат до фумарата, тоже перенося электроны на убихинон
Третий комплекс (III) переносит электроны с убихинона на водорастворимый переносчик цитохром c (Cyt c), который плавает в межмембранном пространстве и при этом перекачивает из стромы в межмембранное пространство шесть протонов.
Четвертый комплекс (IV) переносит электроны с цитохрома c на кислород; кислород восстанавливается до воды, и в процессе реакции из стромы в межмембранное пространство переносится еще четыре протона.
Дыхательная цепь переноса электронов — это белковые комплексы и переносчики электронов, плавающие на внутренней мембране митохондрии, передающие друг другу по цепочке электроны и за счет этого вырабатывающие энергию.
Протонная помпа – это транспорт Н+ через мембрану митохондрии
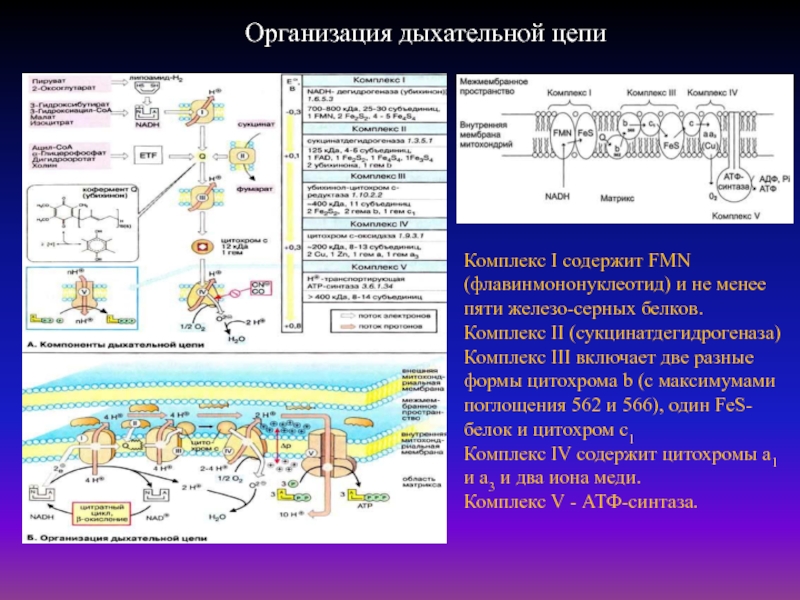
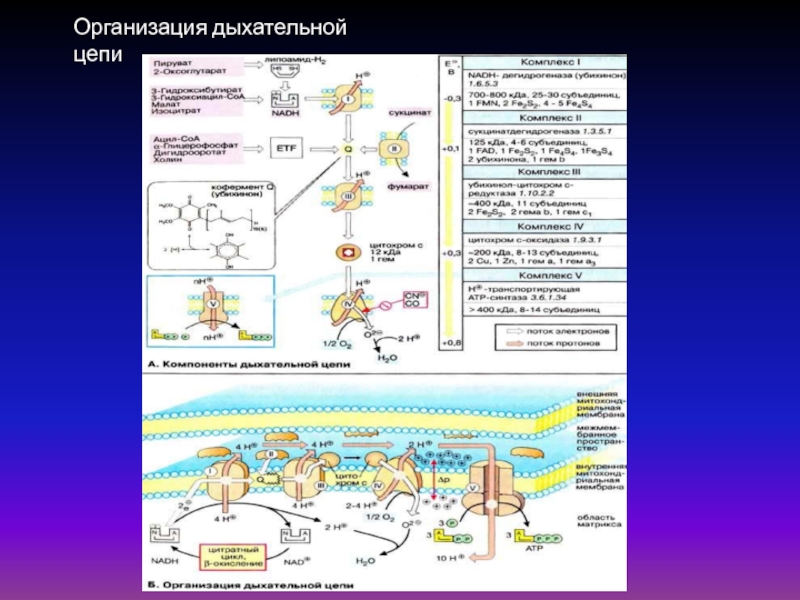
Слайд 38Организация дыхательной цепи
Комплекс I содержит FMN (флавинмононуклеотид) и не менее
пяти железо-серных белков.
Комплекс II (сукцинатдегидрогеназа) Комплекс III включает две
разные формы цитохрома b (с максимумами поглощения 562 и 566), один FeS-белок и цитохром с1 Комплекс IV содержит цитохромы a1 и а3 и два иона меди.
Комплекс V - АТФ-синтаза.
Слайд 40Физические основы преобразования и аккумуляции
энергии в биологических системах
Таблица 1.
Компоненты дыхательной цепи
В дыхательной цепи электроны переносятся от НАДН или
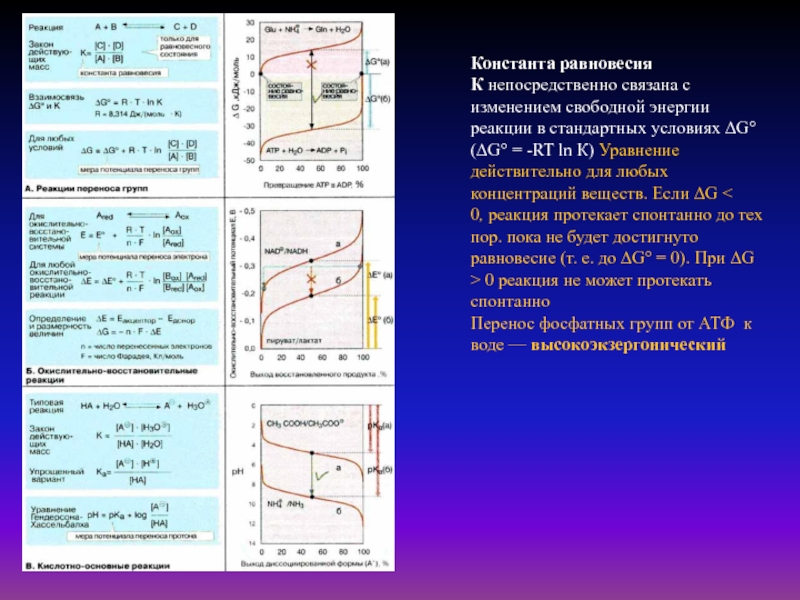
убихинона (QH2) на О2. Выделяющаяся энергия используется для создания протонного градиента на внутренней митохондриальной мембране. Синтез АТФ сопряжен с обратным потоком протонов из межмембранного пространства в матриксСлайд 41Константа равновесия К непосредственно связана с изменением свободной энергии реакции в
стандартных условиях ΔG° (ΔG° = -RT ln К) Уравнение действительно
для любых концентраций веществ. Если ΔG < 0, реакция протекает спонтанно до тех пор. пока не будет достигнуто равновесие (т. е. до ΔG° = 0). При ΔG > 0 реакция не может протекать спонтанноПеренос фосфатных групп от АТФ к воде — высокоэкзергонический
Слайд 42Причины высоко экзоэргического характера гидролиза АТФ: сильное отталкивание отрицательно заряженных атомов
кислорода, которое ослабевает при гидролитическом отщеплении концевой фосфатной группы, и
то, что при гидролизе АТФ возникает свободный фосфат-анион, который лучше гидратирован и более эффективно стабилизирован, чем соответствующий остаток в АТФ.Независимо от того, какая из ангидридных связей АТФ расщепляется, величина ΔGo' остается практически постоянной (1-3). Даже расщепление пирофосфата (4) дает в итоге более -30 кДж/моль, в то время как расщепление сложноэфирной связи между рибозой и фосфатом высвобождает только -9 кДж/моль (5).
К молекулам с высоким потенциалом переноса групп принадлежат фосфоенолпируват (6) и 1,3-дифосфоглицерат (7). Оба соединения являются промежуточными продуктами гликолиза. Также «богаты энергией» ацильные производные кофермента А (8), такие, как сукцинил-КоА, гидролиз которого до сукцината сопряжен в цитратном цикле с синтезом ГТФ и креатинфосфат, с помощью которого в мышце при необходимости может регенерироваться АТФ
http://www.chem.msu.su/rus/teaching/kolman/124.htm
Слайд 43Механизм синтеза АТФ
АТФ-синтаза состоит из двух частей: встроенного в мембрану
протонного канала и каталитической белковой субъединицы. Протонный канал (фактор F0)
содержит гидрофобные полипептиды 3 видов с молекулярным весом 100-150 тыс. Да (1 а, 2 b и 9-12 с). Другая часть фермента представляет собой сферический белок (фактор F1) с молекулярной массой примерно 500 тыс. Да. Он состоит, по крайней мере, из 9 субъединиц (3 — α, 3 — β, по 1 — γ, δ, ε). Фактор F1 легко смывается с мембраны слабыми растворителями. В β-субъединицах он содержит 3 активных центра, участвующих в переносе протона в цикле образования АТФ. Энергия протонного переноса расходуется в основном на поворот одной из субъединиц, что вызывает кон-формационные изменения двух других и высвобождение АТФ, образованной во второй фазе цикла, внутрь клеткиБольшинство ферментов связывают и высвобождают субстраты и продукты спонтанно, но для полного протекания каталитической реакции требуется энергия. В противоположность им, в молекуле АТФ-синтазы энергия требуется не для синтеза АТФ из АДФ и Р1, а для присоединения АДФ и фосфата к ферменту с последующим высвобождением АТФ. Излишек энергии запасается в АТФ. γ, δ и ε-субъедииицы вращаются в цилиндре, сформированном из чередующихся α и β-субъединиц. Это вращение стимулирует структурные изменения в β, изменяющим ее связывающую способность в течение цикла
Слайд 45Митохондрии, перенос электронов
Митохондриальная цепь переноса электронов. Комплекс I содержит FMN
и не менее пяти железо-серных белков (FeS). Комплекс III включает
две разные формы цитохрома b (с максимумами поглощения 562 и 566), один FeS-белок и цитохром с1 Комплекс IV содержит цитохромы a1 и а3 и два иона меди. Комплекс II (сукцинатдегидрогеназа) на рисунке не показан , Комплекс V - АТФ-синтаза.Слайд 46Направление процесса и сопряженные реакции
Направление химической реакции определяется значением ΔG.
Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается
уменьшением свободной энергии. Такие реакции называют экзергоническими. Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими. Если абсолютное значение ΔG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Слайд 47Механизмы, обеспечивающие протекание сопряженных реакций.
Реакция фосфорилирования глюкозы свободным фосфатом с
образованием глюкозо-6-фосфата является эндергонической:
(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат
+ Н2О (ΔG = +13,8 кДж/моль). Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.
(2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль).
При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой, фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима:
(3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
Слайд 49АТФ - молекула, богатая энергией, поскольку она содержит две высокоэнергетические
(макроэргические) фосфоангидридные связи (β, γ). Они обозначены на рисунке знаком
~ (тильда). АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов.При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (рН 7,0, температура 37 °С), фактическое значение ΔG0' для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина
Слайд 50Некоторые биосинтетические реакции в организме могут протекать при участии других
нуклеозидтрифосфатов, аналогов АТФ; к ним относят гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ)
и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ.Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта".
Слайд 51Биологическое окисление
Под окислением понимают отщепление электронов, а под восстановлением -
присоединение электронов. Окисление донора электронов всегда сопровождается восстановлением акцептора электронов.
Этот принцип окислительно-восстановительных процессов применим и к биохимическим системам.Разные редокс-пары обладают различным сродством к электрону. Те, у которых это сродство меньше, отдают электрон тем, у кого оно больше. Мерой сродства редокспары к электрону служит окислительно-восстановительный потенциал, или редокс-потенциал (Е0'), величина которого непосредственно связана с изменением свободной энергии. Величину Еº' выражают в вольтах; чем она меньше (отрицательнее), тем меньше сродство вещества к электронам. Чем больше сродство, тем больше восстановительный потенциал.
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нём участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего компонента и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходят восстановление О2 и синтез Н2О.
Слайд 52Стандартные окислительно-восстановительные потенциалы
некоторых сопряжённых пар
Величину Еº' выражают в
вольтах; чем она меньше (отрицательнее), тем меньше сродство вещества к
электронам.Редокс-потенциалы Е0' связаны с изменением свободной энергии уравнением Нернста
ΔG0´ = - nFΔEº´
где n - число перенесённых в реакции электронов; F - постоянная Фарадея (23 061 ккал B-1 моль-1); ΔЕо' - разность редокс-потенциалов электрондонорной и электронакцепторной пар. Величина ΔЕо' - стандартная величина окислительно-восстановительного потенциала; её определяют в стандартных условиях, когда концентрации всех веществ равны 1 М, давление газов составляет 1 атм, а рН 7,0
Слайд 53Основные этапы трансформации энергии катаболических процессов
Энергия освобождается в процессе ферментативного
окисления метаболитов специфическими дегидрогеназами. В реакциях дегидрирования электроны и протоны
переходят от органических субстратов на коферменты NAD- и FAD-зависимых дегидрогеназ. Электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных коферментов NADH и FADH2 к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. Восстановление молекулы О2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О.Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) - дыхательной цепью.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в форме АТФ, а часть энергии рассеивается в виде тепла. Кроме того, электроны с высоким энергетическим потенциалом, возникающие при окислении различных субстратов, могут быть использованы в реакциях биосинтеза, для которых помимо АТФ требуются восстановительные эквиваленты, например NADPH.