Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Геохимия гидросферы атмосферы
Содержание
- 1. Геохимия гидросферы атмосферы
- 2. Гидрогеохимия (геохимия подземных вод) - это раздел
- 3. Формы подземной воды в недрах:1. Свободные воды.Наиболее
- 4. Формы подземной воды в недрах:2. Поровые воды.Под
- 5. Три типа взаимоотношения между поровыми и пластовыми
- 6. Формы подземной воды в недрах:3. Связанные воды.Взаимодействие
- 7. 1. Молекулярная адсорбция.2. Полимолекулярная адсорбция.3. Поверхностно-осмотический переток воды.4. Капиллярное впитывание.
- 8. ОСМОС - односторонняя диффузия растворителя (такого как
- 9. Классификация форм связанной воды в породах:1. Вода,
- 10. Состав подземных водПриродные воды – сложные водные
- 11. Слайд 11
- 12. Природные воды по величине минерализации (г/кг) делят
- 13. Состав растворенных в подземных водах природных соединений
- 14. Микрокомпоненты – содержатся в подземных водах, как
- 15. Органические веществаВ подземных водах содержится широкая гамма
- 16. Слайд 16
- 17. Слайд 17
- 18. Микрофлора подземных водВсе микроорганизмы подразделяются на микроскопические
- 19. ГазыГазы и вода находятся в постоянном обмене.
- 20. Слайд 20
- 21. Происхождение газов в подземной водевоздушные (N2, O2,
- 22. Выражение химического состава водыФормула М.Г. Курлова
- 23. Выражение химического состава водыв псевдодробь записываются в
- 24. Выражение химического состава водыГрамм-эквивалент - масса
- 25. Формула солевого состава - формула Курлова, где
- 26. ГЕОХИМИЯ АТМОСФЕРЫ19661990
- 27. Классификации природных газовГазы атмосферыГазы гидросферыГазы литосферы (растворенные в воде и свободные, сорбированные минералами и органическими веществами).
- 28. Атмосфера – газовая оболочка Земли мощностью 20
- 29. Тропосфера (высота 8-18км). 80% массы газовой оболочки
- 30. Древняя газовая оболочка Земли была маломощной и
- 31. Источником CO2 (а также следов HF, HCl
- 32. Азот фиксируется синезелёными водорослями и некоторыми др.
- 33. По составу более 20 схем классификации
- 34. Слайд 34
- 35. Слайд 35
- 36. Слайд 36
- 37. Слайд 37
- 38. Слайд 38
- 39. Газовые проявленияВулканические газы по качеств. составу и
- 40. Слайд 40
- 41. ГАЗОВЫЕ ГИДРАТЫГидраты природных газов — газовые гидраты
- 42. В 1940-е годы советские учёные высказывают гипотезу
- 43. Слайд 43
- 44. Слайд 44
- 45. Гидрат метана – газовое топливо будущегоПо прогнозам
- 46. Во-первых, технологии добычи нефти и газа развиваются.
- 47. Третье направление поддержания уровня добычи углеводородов связано
- 48. Гидрат метана это супрамолекулярное соединение метана с
- 49. Слайд 49
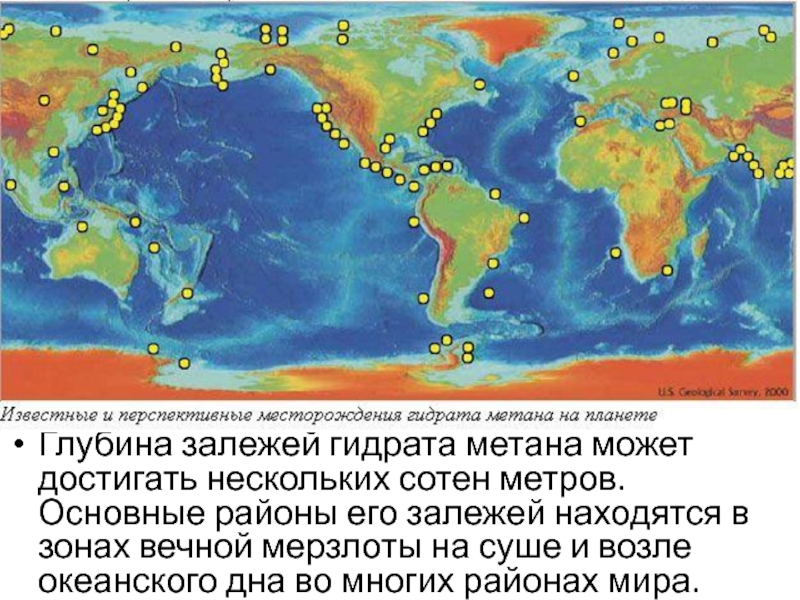
- 50. Глубина залежей гидрата метана может достигать нескольких
- 51. Слайд 51
- 52. Слайд 52
- 53. Слайд 53
- 54. Слайд 54
- 55. Слайд 55
- 56. Слайд 56
- 57. Слайд 57
- 58. Слайд 58
- 59. Слайд 59
- 60. Слайд 60
- 61. Слайд 61
- 62. Слайд 62
- 63. Слайд 63
- 64. Слайд 64
- 65. Слайд 65
- 66. Слайд 66
- 67. Слайд 67
- 68. Слайд 68
- 69. Слайд 69
- 70. Слайд 70
- 71. Слайд 71
- 72. Слайд 72
- 73. Слайд 73
- 74. Слайд 74
- 75. Слайд 75
- 76. Слайд 76
- 77. Скачать презентанцию
Гидрогеохимия (геохимия подземных вод) - это раздел гидрогеологии, который изучает химический состав гидросферы и протекающие в ней геохимические процессы. Под геохимическими процессами понимается формирование химического состава вод и закономерности миграции в
Слайды и текст этой презентации
Слайд 2Гидрогеохимия (геохимия подземных вод) - это раздел гидрогеологии, который изучает
химический состав гидросферы и протекающие в ней геохимические процессы.
геохимическими процессами понимается формирование химического состава вод и закономерности миграции в них химических элементов.Слайд 3Формы подземной воды в недрах:
1. Свободные воды.
Наиболее изученные формы подземных
вод.
Они занимают пустоты, трещины и поры в горных породах,
передвигаются под влиянием силы тяжести и напорного градиента, передают гидростатическое давление. Различают воды зоны аэрации (капиллярные воды) и зоны насыщения (гравитационные воды).
Слайд 4Формы подземной воды в недрах:
2. Поровые воды.
Под поровыми водами (растворами)
понимаются воды, насыщающие поры горных пород, тонкие капилляры, микротрещины, межзерновое
пространство и удерживаемые в породах как самой замкнутой системой микрополостей, так и силами межмолекулярного сцепления.Поровая вода состоит из свободной (гравитационной) воды, а также из связанной воды.
Слайд 5Три типа взаимоотношения между поровыми и пластовыми водами:
1. Поровые воды
более концентрированы, чем пластовые, принимают активное участие в формировании солевого
состава последних (наиболее типичный случай).2. Поровые воды менее минерализованы и обогащены микрокомпонентами, чем пластовые воды.
3. Поровые воды идентичны пластовым водам, когда установилось равновесие в системе порода--поровый раствор--пластовые воды.
Гидрогеохимическая зональность поровых вод:
увеличение минерализации с глубиной.
Слайд 6Формы подземной воды в недрах:
3. Связанные воды.
Взаимодействие твердых минеральных частиц
с водой или водными растворами электролитов приводит к образованию на
границе твердой и жидкой фаз поверхностного «граничного» (межфазного) слоя влаги, обладающего свойствами, которые отличаются от свойств воды в «объеме», - связанной воды.Отмечается ее энергетическая неоднородность, которая определяется количеством активных поверхностных центров, удаленностью молекул воды от поверхности, видом и концентрацией водного раствора, влиянием Р и Т.
Наиболее существенна роль этого слоя влаги для высокодисперсных глинистых пород
Слайд 71. Молекулярная адсорбция.
2. Полимолекулярная адсорбция.
3. Поверхностно-осмотический переток воды.
4. Капиллярное впитывание.
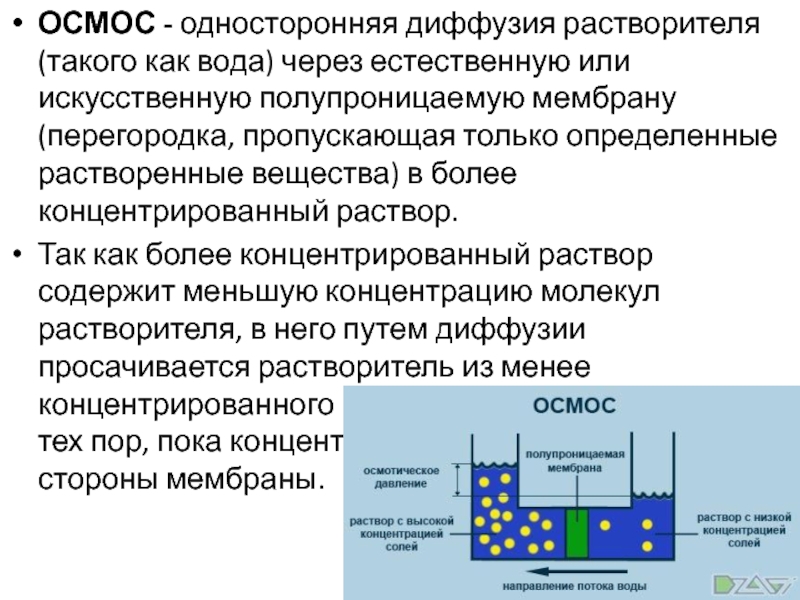
Слайд 8ОСМОС - односторонняя диффузия растворителя (такого как вода) через естественную
или искусственную полупроницаемую мембрану (перегородка, пропускающая только определенные растворенные вещества)
в более концентрированный раствор.Так как более концентрированный раствор содержит меньшую концентрацию молекул растворителя, в него путем диффузии просачивается растворитель из менее концентрированного раствора и разбавляет его до тех пор, пока концентрация не станет равной по обе стороны мембраны.
Слайд 9Классификация форм связанной воды в породах:
1. Вода, связанная в кристаллической
структуре минералов.
2. Вода, адсорбционно-связанная с повехностью минералов.
3. Вода переходного состояния
(от связанной к свободной).Эта вода постепенно замерзает при Т от -12ºС и ниже. Плотность в среднем 1.2-1.5 г/см3. Вязкость связанной воды выше, а растворяющая способность по отношению к солям - ниже, чем у свободной воды.
Объем связанных вод глинистых пород во много раз превышает объем гравитационных подземных вод.
Слайд 10Состав подземных вод
Природные воды – сложные водные растворы (В.И.Вернадский). В
их составе выделяются: макро- и микрокомпоненты, газы, органические вещества, микроорганизмы
(живое вещество). Большое значение имеют изотопы химических элементов как самой воды, так и растворенных веществ.В настоящее время в подземных водах различными методами анализа определяется около 83 химических элементов таблицы Менделеева, характеризующих общий химический тип воды, ее свойства и имеющих разное научное и практическое значение.
Слайд 12Природные воды по величине минерализации (г/кг) делят на следующие группы:
1.
Пресные (< 1).
2. Солоноватые (1-25).
3. Соленые (25-50).
4. Рассолы (>50).
Рассолы, в
свою очередь, делятся на:1. Весьма слабые (50-70).
2. Слабые (70-140).
3. Крепкие (140-270).
4. Весьма крепкие (270-350).
5. Сверхкрепкие (>350).
Слайд 13Состав растворенных в подземных водах природных соединений определяется прежде всего
составом литосферы и распространенностью отдельных составляющих ее элементов.
Макрокомпоненты – определяют
химический тип воды, ее общую минерализацию М (сухой остаток) и название по общему химическому составу.Основными макрокомпонентами являются наиболее распространенные в земной коре катионогенные (Ca, Mg, Na, K, Fe) и анионогенные (Cl, S, C, Si) элементы. Накопление элементов определяется растворимостью соединений главных элементов.
Наиболее минерализованными (М до 760 г/л) являются сверхкрепкие хлоридные кальциевые рассолы, а наименее (<10) ультрапресные гидрокарбонатные кальциевые и гидросиликатные кальциевые воды.
Слайд 14Микрокомпоненты – содержатся в подземных водах, как правило, в незначительных
количествах, определяемых мг, мкг и долями мкг в 1 л.
Общее
число микрокомпонентов, извлекаемых из подземных вод в промышленных масштабах, составляет около 30. При гидрогеохимических поисках месторождений полезных ископаемых используют более 50 элементов.Максимальное содержание микрокомпонентов в кислых и щелочных водах рудных месторождений может достигать граммовых количеств.
В кислых водах может содержаться до (г/л): Al – 13, As – 1.5, Co – 3.6, Cu – 45, Fe – 47, Ni – 30, Zn – 50.
В щелочных водах: Al – 1, F – 15, Si - 13.
Слайд 15Органические вещества
В подземных водах содержится широкая гамма органических соединений. Компонентами
органических веществ являются представители всех химических групп (углеводы, белки, липиды)
и классов (карбоновые кислоты, углеводороды, спирты, альдегиды, кетоны, амины, эфиры), изучаемых в органической химии.Важнейшие характеристики водорастворенных органических веществ – величина их общего количества и содержание химических элементов, входящих в состав индивидуальных органических соединений (Сорг., Nорг. , Pорг. ).
Слайд 18Микрофлора подземных вод
Все микроорганизмы подразделяются на микроскопические одно- и многоклеточные
животные (простейшие) и растения (водоросли, бактерии, дрожжи и плесени). Размеры
их варьируют от долей до десятков и сотен мкм. Наибольшее значение имеют бактерии (аэробные и анаэробные).Аэробы развиваются при наличии свободного кислорода в воде, анаэробы – при его отсутствии. Они используют сульфаты, нитраты, углекислоту и другие кислородсодержащие вещества.
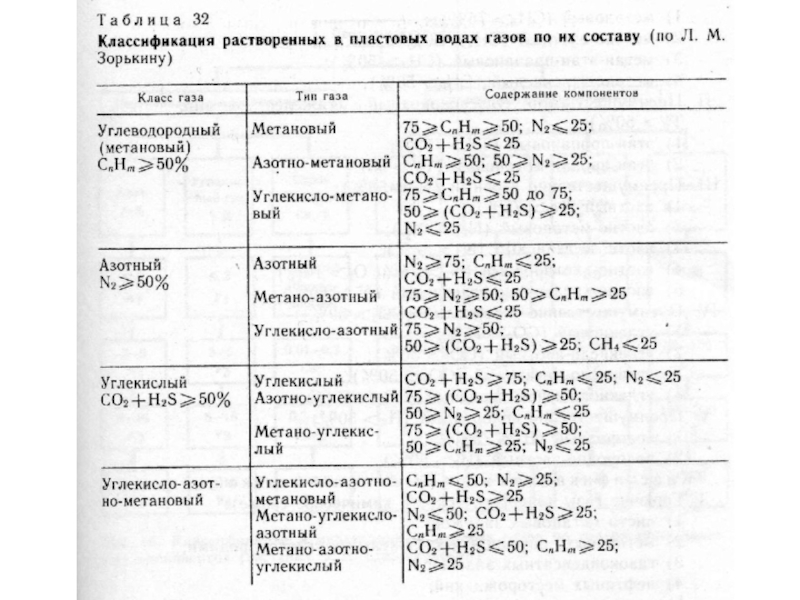
Слайд 19Газы
Газы и вода находятся в постоянном обмене. Различают сорбированные, растворенные
и свободные газы.
Основными газами подземных вод являются: O2, N2, CO2,
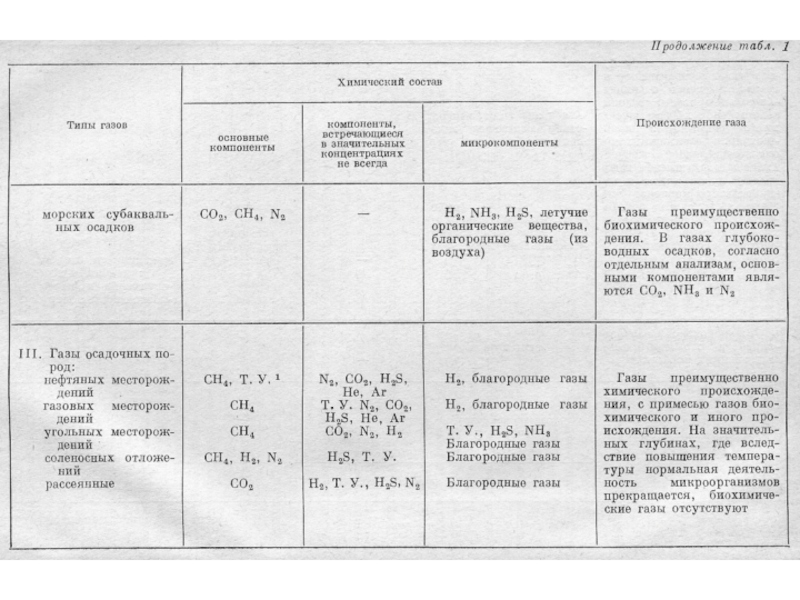
H2S, CnH2n+2, H2, NH3, He, Rn, Ne, Ar, Xe, Kr.Слайд 21Происхождение газов в подземной воде
воздушные (N2, O2, CO2, Ne, Ar),
проникающие в литосферу из атмосферного воздуха);
биохимические (CH4, CO2, N2, H2S,
H2, O2, ТУ – тяжелые углеводороды), образующиеся при разложении микроорганизмами органических и минеральных веществ;химические (CO2, H2S, H2, CH4, CO, N2, HCl, HF, SO2, NH3), образующиеся в результате взаимодействия воды и породы при нормальных и высоких давлении и температуре;
радиоактивные и продукты ядерных реакций (He, Rn).
Слайд 22Выражение химического состава
воды
Формула М.Г. Курлова (1921г.),
«Опыт классификации сибирских
целебных
минеральных вод» вариант И.Ю. Соколова (1970г.):
в левой стороне формулы записывается (в мг/л) содержание газов, а затем микрокомпонентов, если их количество превышает нормы для отнесения подземных вод к минеральным или представляет геохимический интерес;
далее записывается минерализация воды (М) в виде дроби: в числителе – в весовой форме (с точностью до одного десятичного знака), в знаменателе – в эквивалентной форме;
Слайд 23Выражение химического состава воды
в псевдодробь записываются в нисходящем порядке все
катионы (в знаменателе) и анионы (в числителе),содержание которых составляет более
1 экв. % (с точностью до целых процентов);справа от формулы записывают показатели, характеризующие состояние воды: pH, Eh, Т, перманганатная окисляемость в мг О/л. Для сильноминерализованных вод и рассолов в конце формулы проставляют плотность воды.
Слайд 24Выражение химического состава
воды
Грамм-эквивалент - масса вещества в граммах, умноженную
на молярную массу вещества.
Процент-эквивалент - вычисляется путём деления грамм-эквивалента вещества
на сумму всех грамм-эквивалентов веществ смеси (в данном случае - анионов или катионов) и умножением на 100%.Формула читается: гидрокарбонатно-сульфатно-хлоридная кальциево-натриево-магниевая вода.
Слайд 25Формула солевого состава - формула Курлова, где указываются ионы, содержание
которых более 5-10 %-экв.
S - нерастворимые примеси типа Fe
и т.д. G - газы (например, CO2).
M - минерализация - миллиграмм/литр.
A - содержащиеся в воде анионы, расположенные в убывающем порядке по значению процент-эквивалента (%-экв). В общей сумме должно быть 100 %-экв анионов.
C - содержащиеся в воде катионы, расположенные в убывающем порядке по значению процент-эквивалента (%-экв). В общей сумме должно быть 100 %-экв анионов.
pH - кислотность (от 1-HCl до 12- KOH).
T - температура воды в ºС.
D - дебит источника (м3/сутки).
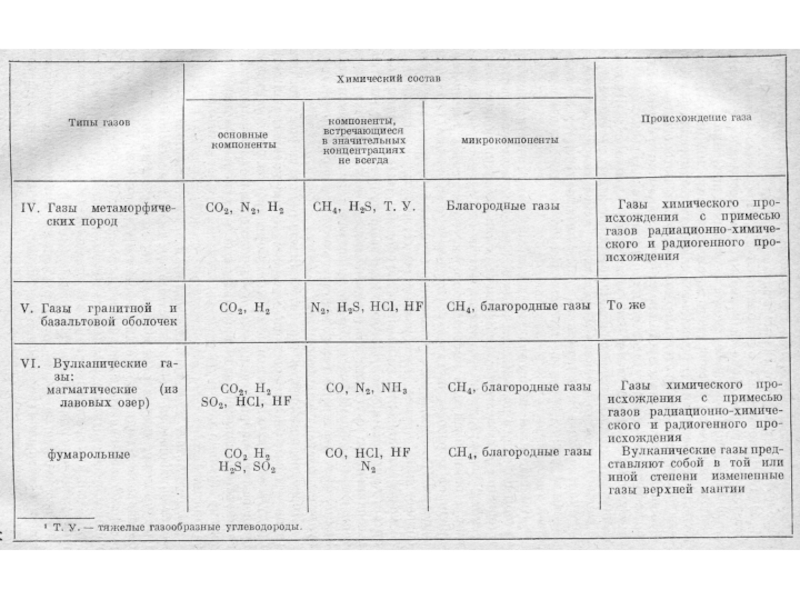
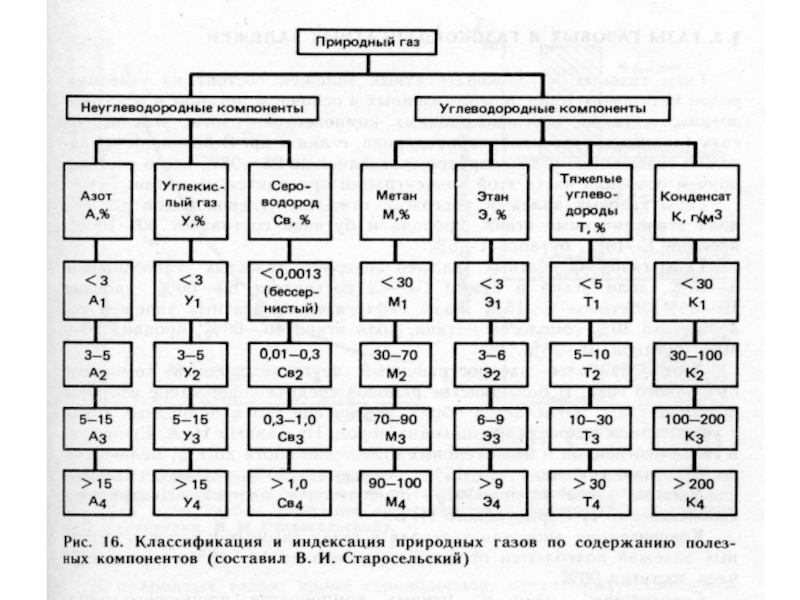
Слайд 27Классификации природных газов
Газы атмосферы
Газы гидросферы
Газы литосферы (растворенные в воде и
свободные, сорбированные минералами и органическими веществами).
Слайд 28Атмосфера – газовая оболочка Земли мощностью 20 тыс. км и
массой около 1015 т.
Азот – 75.5%, кислород – 23.1%, аргон
– 1.28%, углекислый газ – 0.04%, инертные газы.Считается, что кислородная атмосфера и гидросфера сформировались 2.6-2.4 млрд. лет назад. Содержание кислорода тогда составляло примерно 0.2% от настоящего.
Примерно 1 млрд. лет назад содержание O2 было 1% от современного, в начале палеозоя – 10%, 50 млн. лет назад – современный уровень.
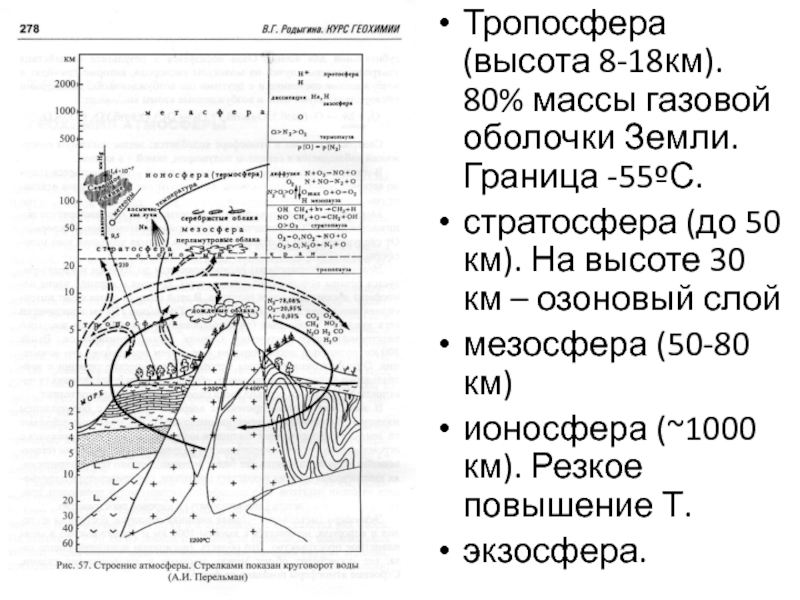
Слайд 29Тропосфера (высота 8-18км). 80% массы газовой оболочки Земли. Граница -55ºС.
стратосфера
(до 50 км). На высоте 30 км – озоновый слой
мезосфера
(50-80 км)ионосфера (~1000 км). Резкое повышение Т.
экзосфера.
Слайд 30Древняя газовая оболочка Земли была маломощной и состояла из CO2,
H2O, возможно CH4 и др. газов.
Современная атмосфера возникла вторично,
с появлением на Земле свободного кислорода в результате фотосинтетической деятельности растений. После этого продукты вулканической эксгаляций S, H2S, NH3, H2, CH4 и др. были окислены, выбыли из атмосферы и осталась современная азотно-кислородная оболочка Земли.Из пород Земли в атмосферу при действии вулканов выделяются лёгкие газы He4, He3, Н, D ("гелиевое дыхание"), которые не удерживаются гравитационным полем Земли и рассеиваются в космическое пространство.
Слайд 31Источником CO2 (а также следов HF, HCl и др.) являются
тоже вулканы.
На содержание в атмосфере CO2 оказывает влияние океан,
поглощающий CO2 в холодных широтах и освобождающий CO2 на экваторе.Изотоп аргона 40Ar накапливается в атмосфере в результате ядерного превращения 40K->40Ar. Ne, Kr, Xe - первичного происхождения.
Атмосфера играет огромную роль в качестве транспортёра многих легколетучих соединений, галогенидов, органических веществ и т. п.
Газы атмосферы участвуют в геохимическом выветривании горных пород, например O2, CO2.
Слайд 32Азот фиксируется синезелёными водорослями и некоторыми др. растениями. После их
гибели в результате метаморфизма их остатков образуется калийная селитра.
Подземные атмосферы,
заполняющие пористые породы, имеют разнообразный состав и образуются различными путями. Атмосферные газы могут быть захвачены осадочными породами. В этом случае для них характерно содержание 40Ar по отношению к N2 около 1%. Азотные струи без 40Ar — результат метаморфизма органического вещества (биогенные газы). Известны подземные атмосферы из CO2, а также струи CO в районах вулканической деятельности, нефтяные газы CH4 и др. углеводороды в нефтеносных областях, сероводород, радиогенные газы — Не, Rn и др.
Слайд 39Газовые проявления
Вулканические газы по качеств. составу и Т условно подразделяются
на:
галогенокислотные (высоко-Т фумаролы);
сернистые (средне-Т сольфатары);
углекислые (низко-Т мофеты).
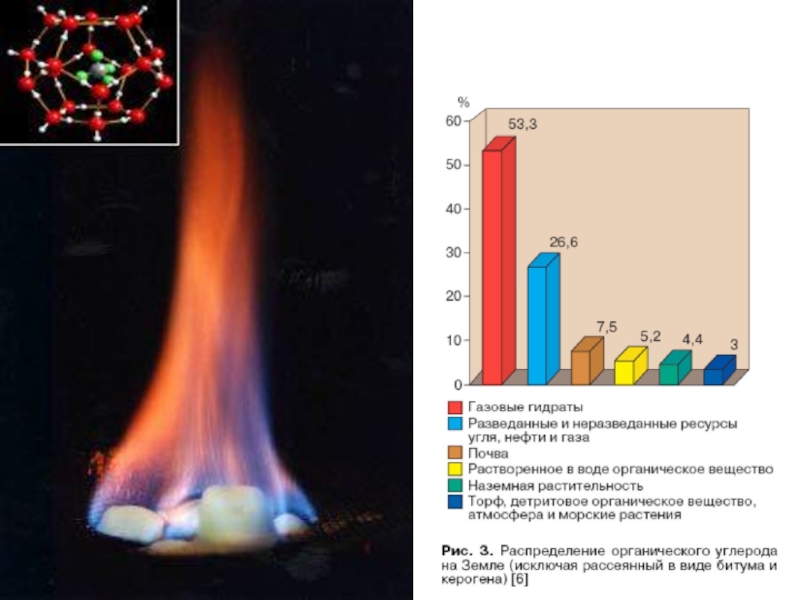
Слайд 41ГАЗОВЫЕ ГИДРАТЫ
Гидраты природных газов — газовые гидраты или клатраты —
кристаллические соединения, образующиеся при определённых термобарических условиях из воды и
газа. Имя клатраты, от латинского «clathratus», что значит «сажать в клетку», было дано Пауэллом в 1948.Гидраты газа относятся к нестехиометрическим соединениям, то есть соединениям переменного состава. Впервые газовые гидраты были описаны в 1810 году. К 1888 году получают гидраты CH4, C2H6, C2H4, C2H2, и N2O.
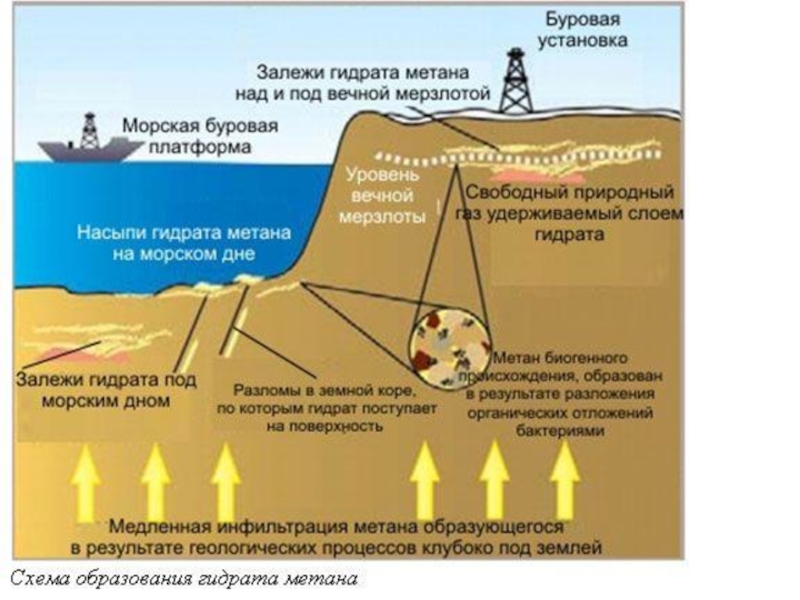
Слайд 42В 1940-е годы советские учёные высказывают гипотезу о наличии залежей
газовых гидратов в зоне вечной мерзлоты.
В 1960-е годы они
же обнаруживают первые месторождения газовых гидратов на севере СССР. С этого момента газовые гидраты начинают рассматриваться как потенциальный источник топлива.Постепенно выясняется их широкое распространение в океанах и нестабильность при повышении температуры. Сейчас природные газовые гидраты приковывают особое внимание как возможный источник ископаемого топлива, а также участник изменений климата.
Слайд 45Гидрат метана – газовое топливо будущего
По прогнозам экспертов ExxonMobil, потребление
энергоресурсов в ближайшие 30 лет на планете возрастет наполовину.
Так как
продуктивность известных месторождений углеводородов снижается, новые крупные месторождения открываются все реже, а использование угля наносит ущерб экологии. Однако скудеющие запасы обычных углеводородов можно компенсировать.
Слайд 46Во-первых, технологии добычи нефти и газа развиваются.
Сегодня в Мексиканском
заливе, например, нефть добывают с глубины 2.5-3 км под поверхностью
воды, такие глубины были немыслимы 15 лет назад.Во-вторых, развиваются технологии переработки сложных видов углеводородов (тяжелых и высокосернистых нефтей) и нефтяных суррогатов (битумы, нефтяные пески). Это позволяет возвращаться к традиционным районам добычи и возобновлять на них работу, а также начинать добычу в новых районах.
Например, в Татарстане, при поддержке компании Shell, начинается добыча, так называемой «тяжелой нефти». В Кузбассе разрабатываются проекты по добыче метана из угольных пластов.
Слайд 47Третье направление поддержания уровня добычи углеводородов связано с поиском путей
использования нетрадиционных их видов.
Среди перспективных новых видов углеводородного сырья
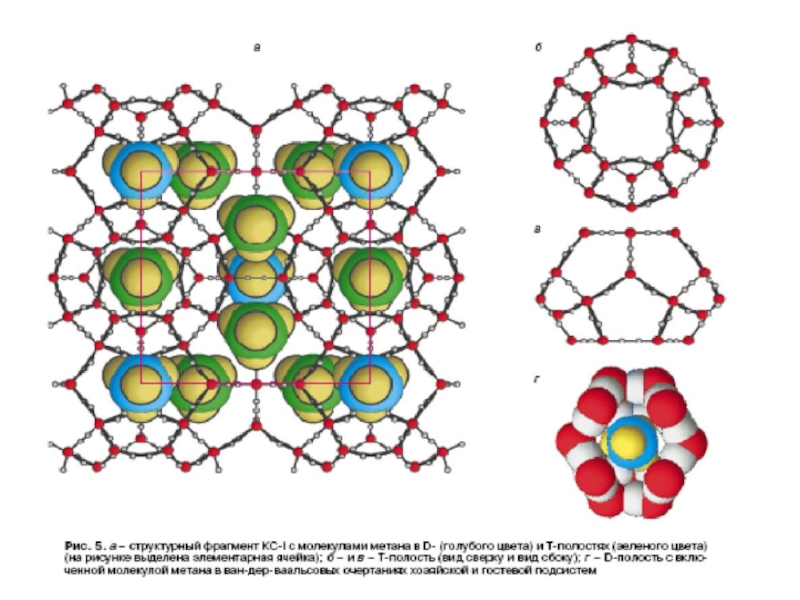
ученые выделяют гидрат метана, запасы которого на планете, по ориентировочным оценкам, составляют не менее 250 триллионов кубических метров (по энергетической ценности это в 2 раза больше ценности всех имеющихся на планете запасов нефти, угля и газа вместе взятых).Слайд 48Гидрат метана это супрамолекулярное соединение метана с водой. Вокруг молекулы
метана образуется решетка молекул воды (льда). Соединение устойчиво при низкой
температуре и повышенном давлении.Например, гидрат метана стабилен при температуре 0°C и давлении порядка 25 бар и выше. Такое давление имеет место на глубине океана около 250 м. При атмосферном давлении гидрат метана сохраняет устойчивость при температуре −80°C. Если гидрат метана нагревается, либо повышается давление, соединение распадается на воду и природный газ (метан).
Из одного кубического метра гидрата метана при нормальном атмосферном давлении можно получить 164 кубических метра природного газа.