периода и одной группы?
Как изменяется число энергетических уровней у элементов
одного периода и одной группы?Какие свойства элемента называются металлическими?
Как изменяются металлические свойства элементов в периодах и группах?
В чем суть периодического изменения свойств химических элементов?
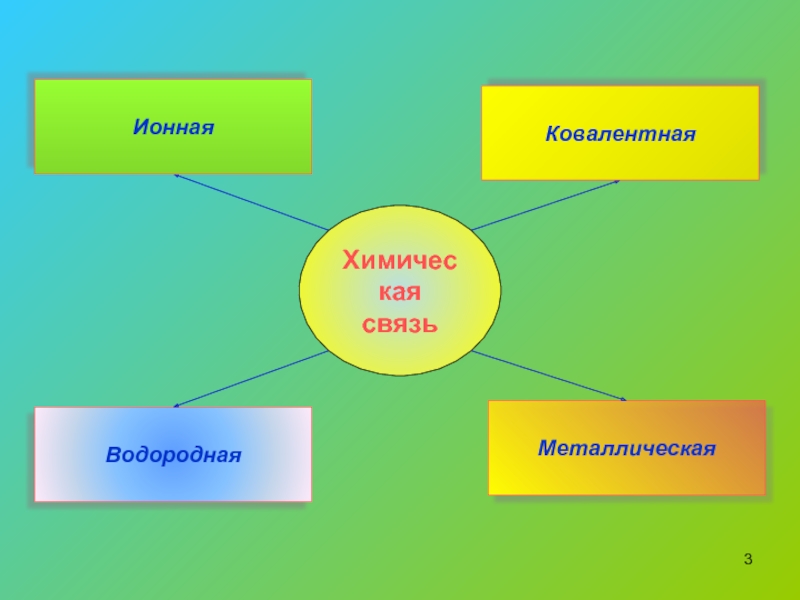
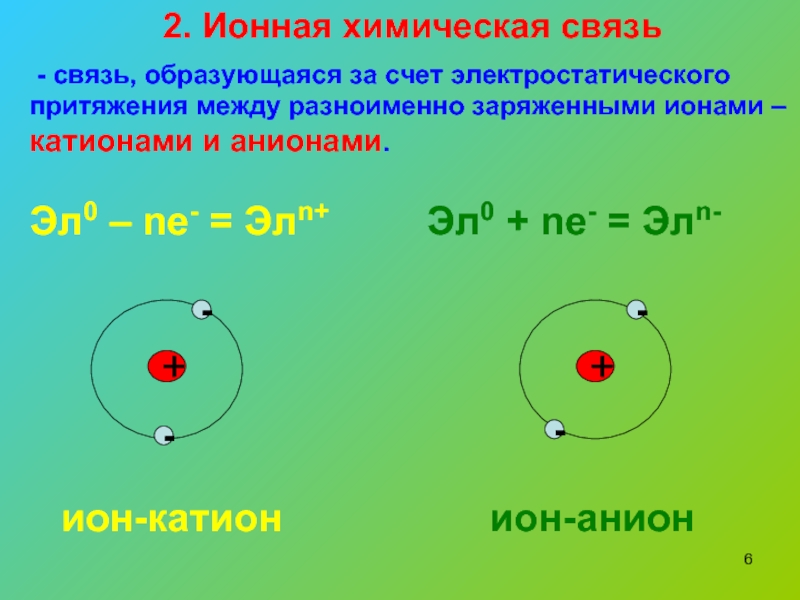
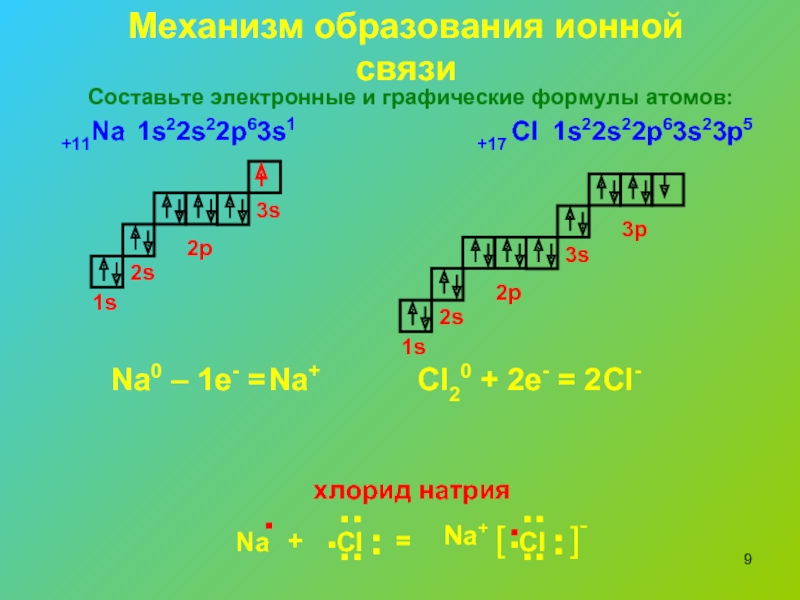
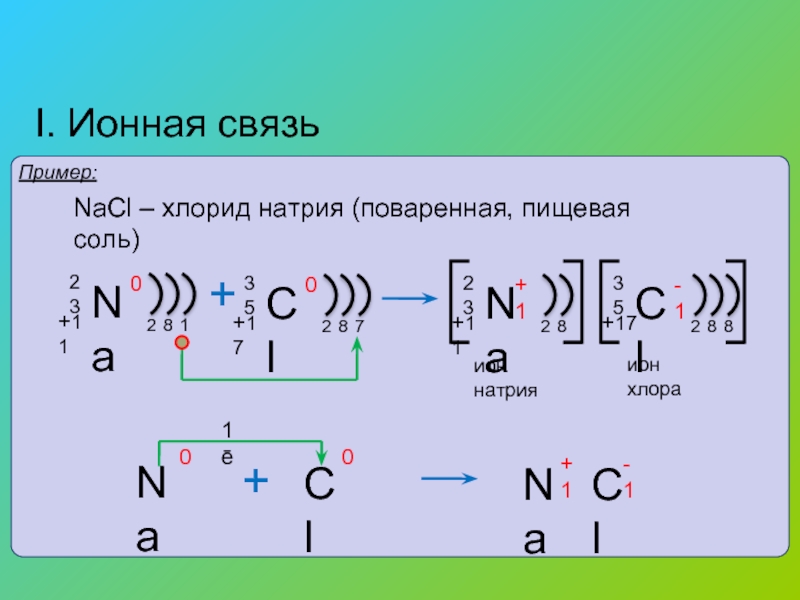
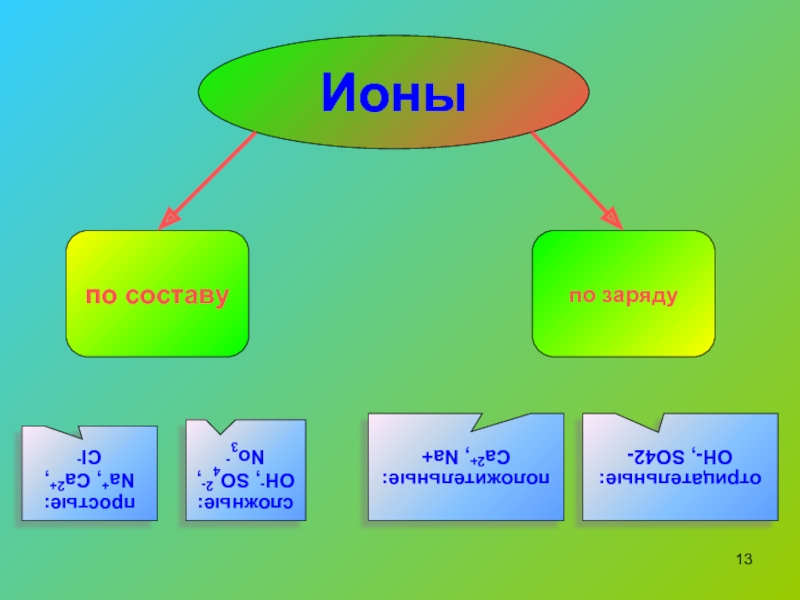
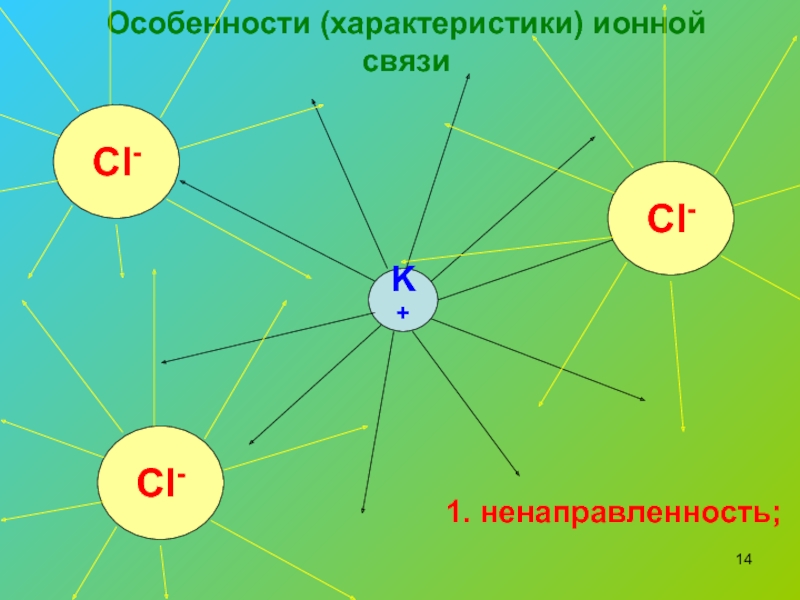
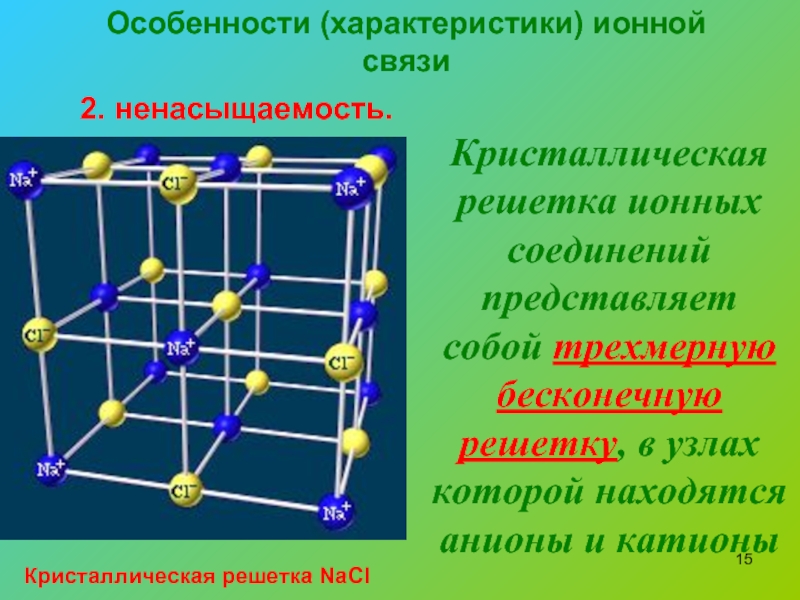
Ионы и ионная химическая связь.