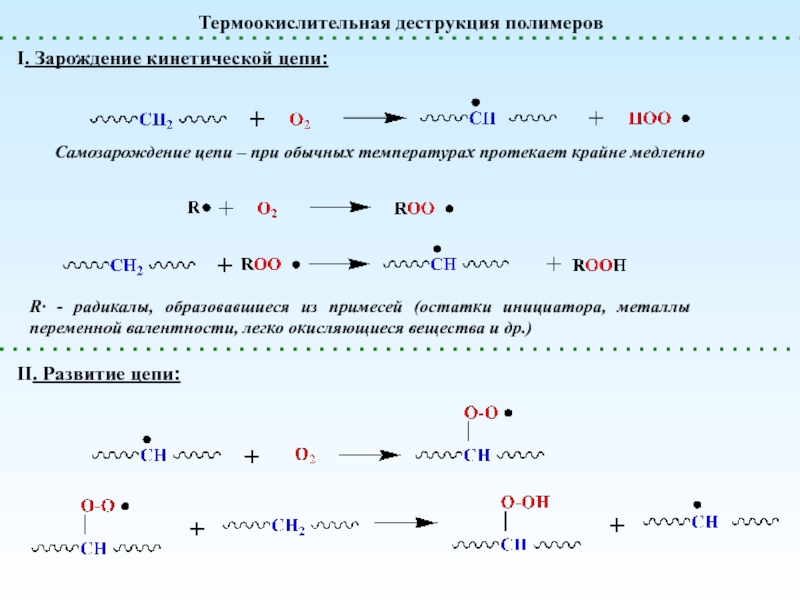
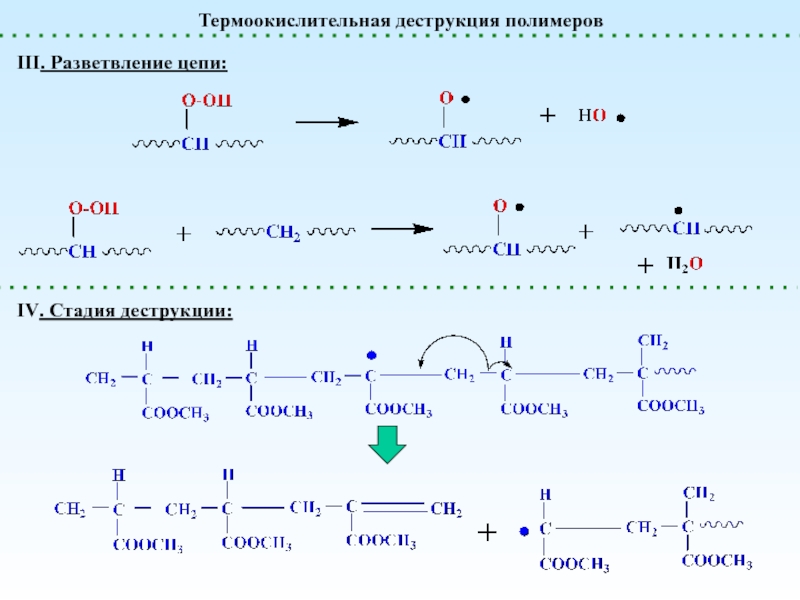
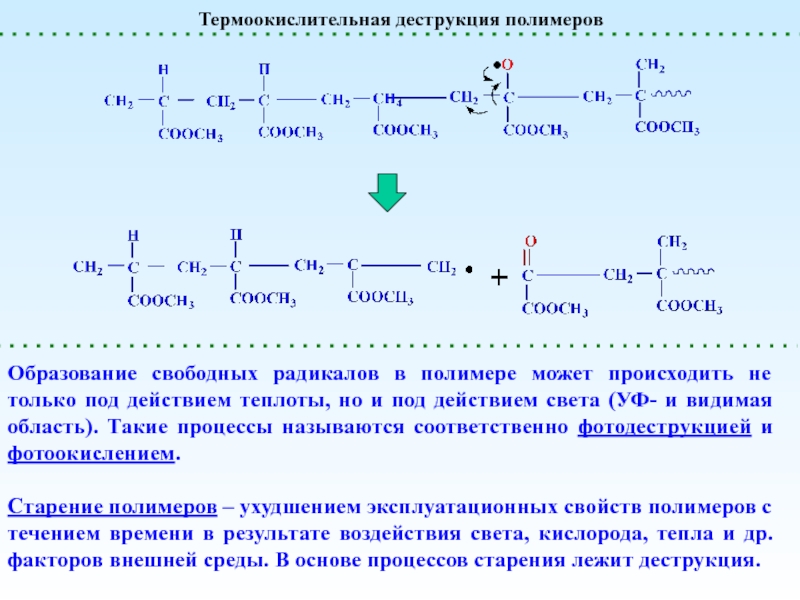
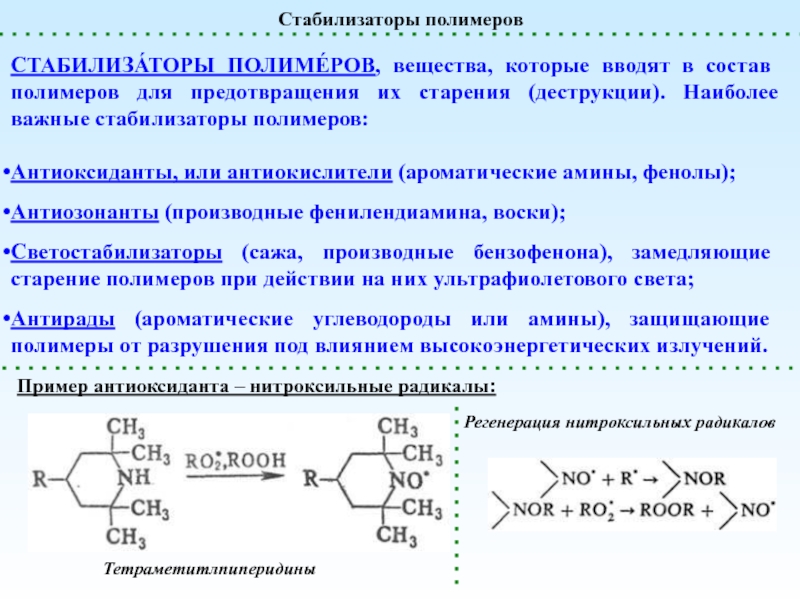
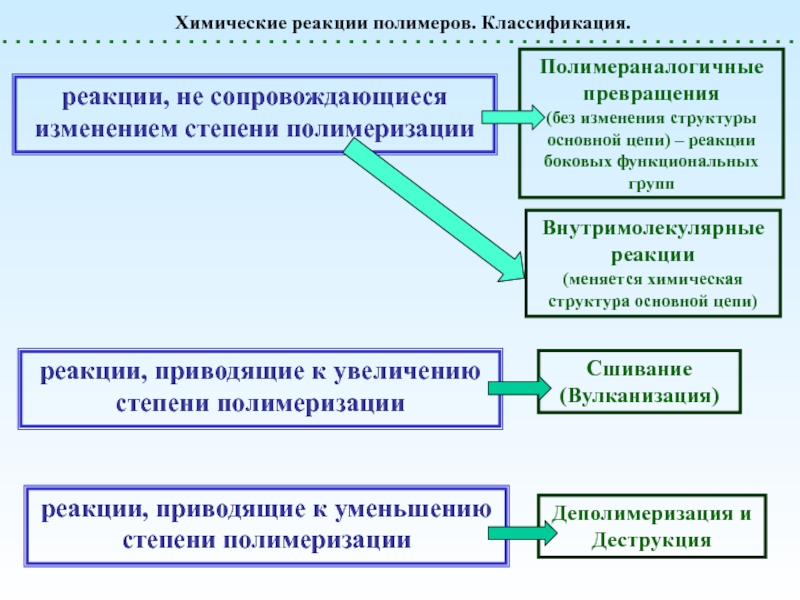
реакции, приводящие к увеличению степени полимеризации
реакции, приводящие к уменьшению степени
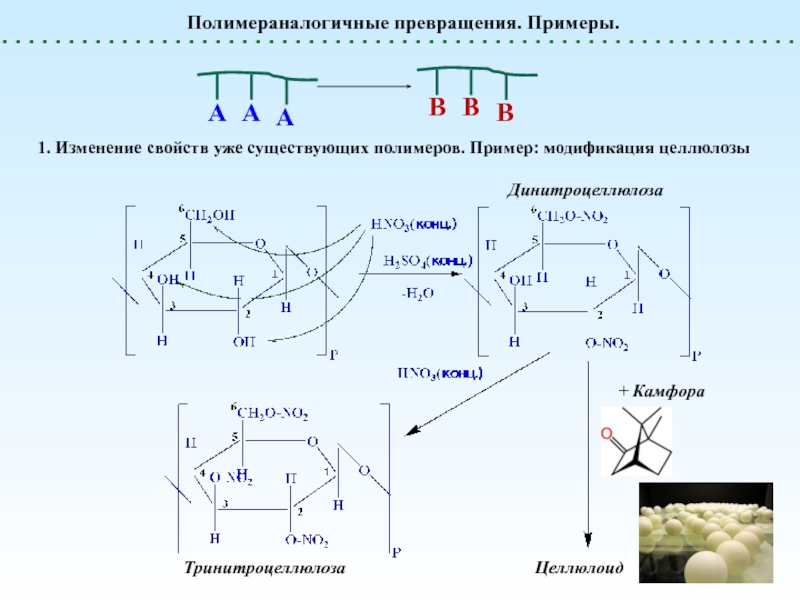
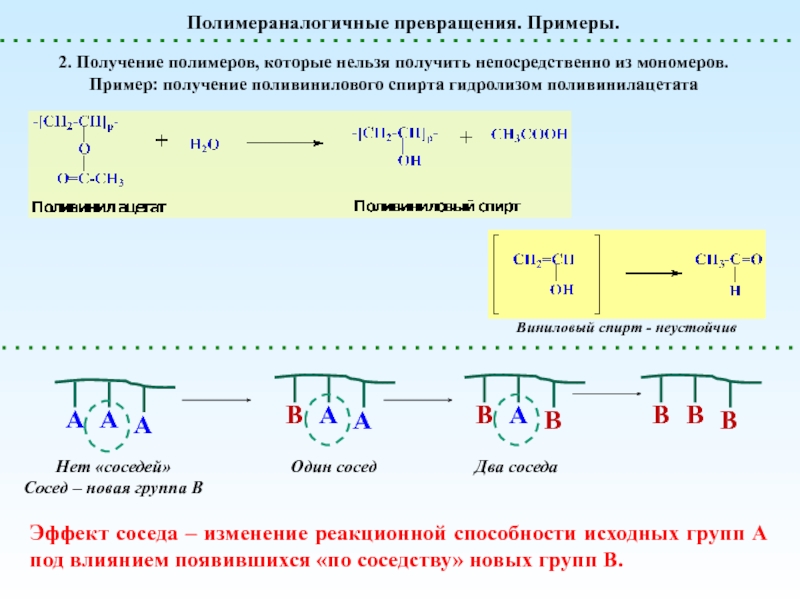
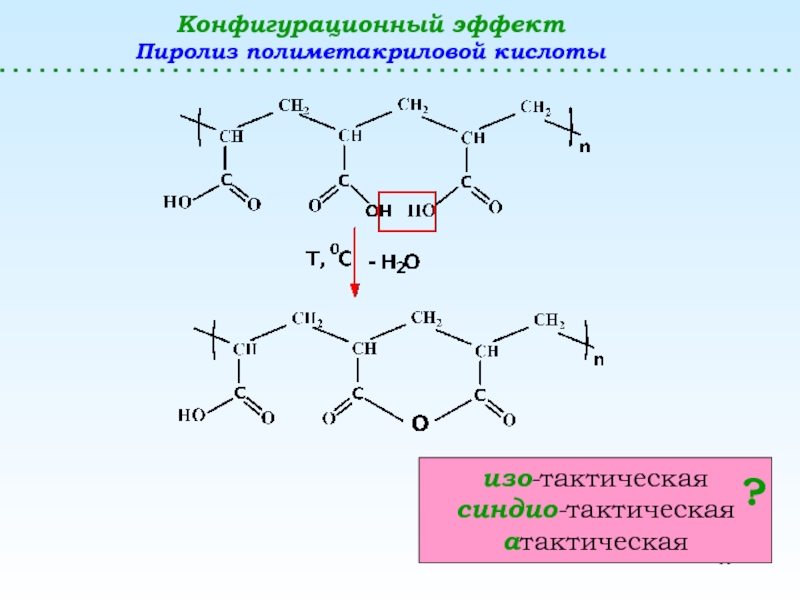
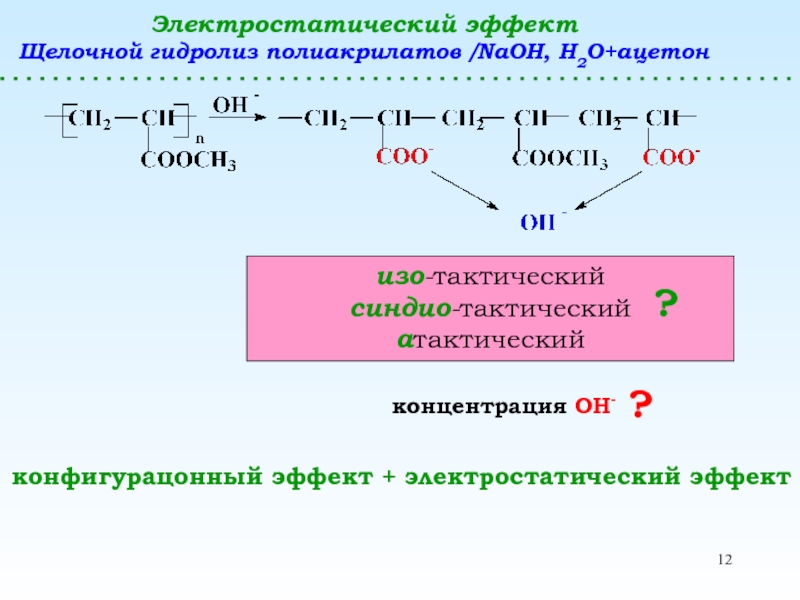
полимеризацииПолимераналогичные превращения
(без изменения структуры основной цепи) – реакции боковых функциональных групп
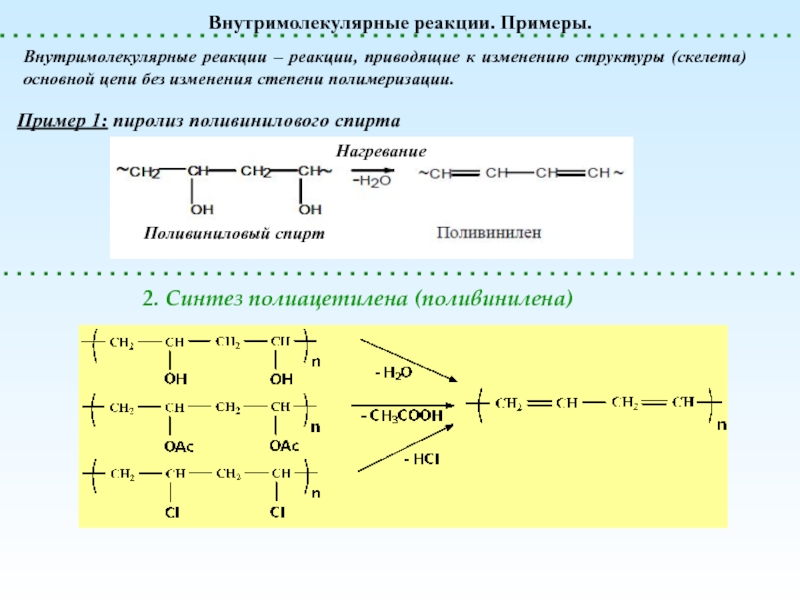
Внутримолекулярные реакции
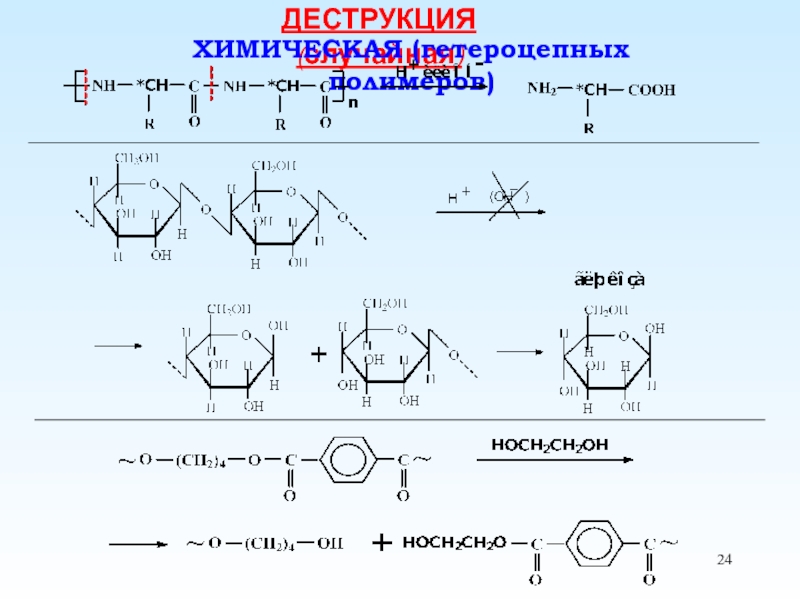
(меняется химическая структура основной цепи)
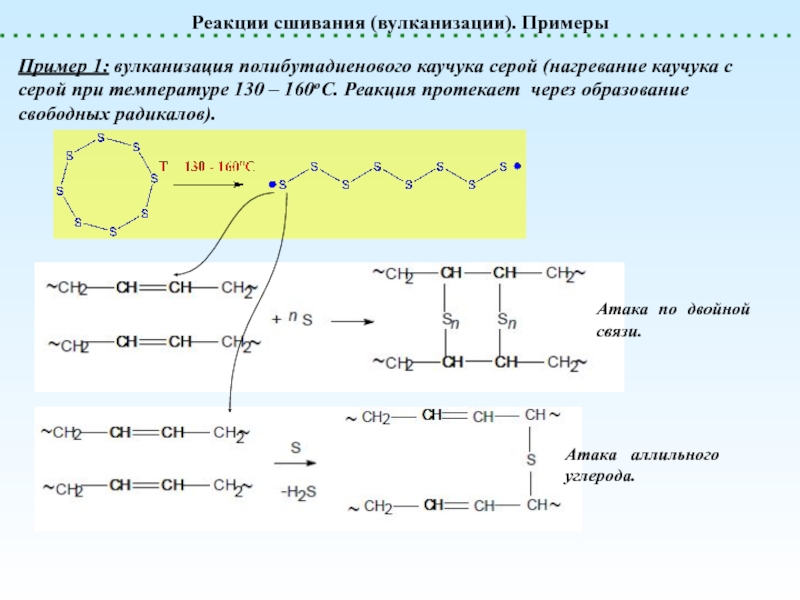
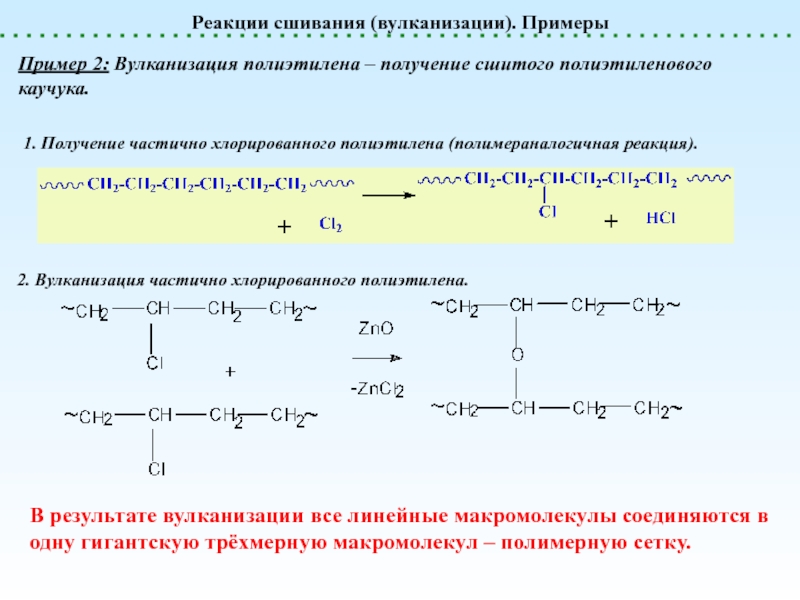
Сшивание (Вулканизация)
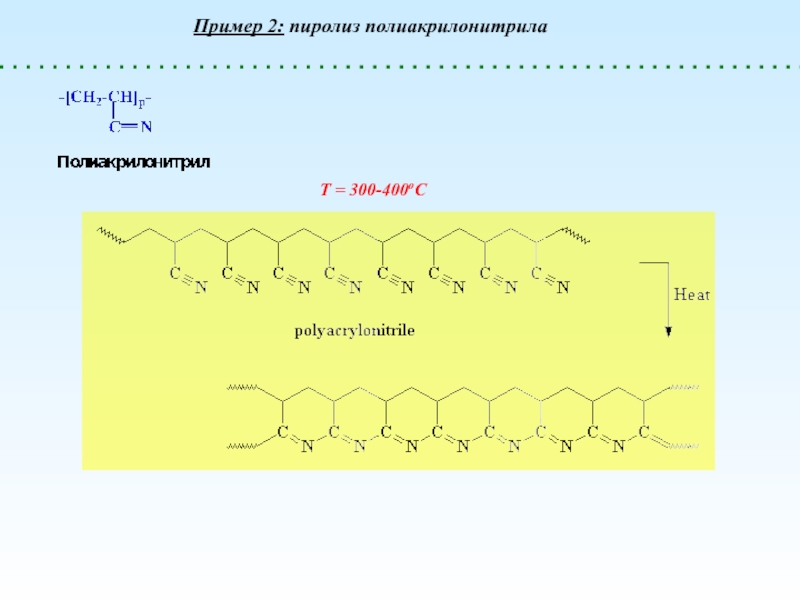
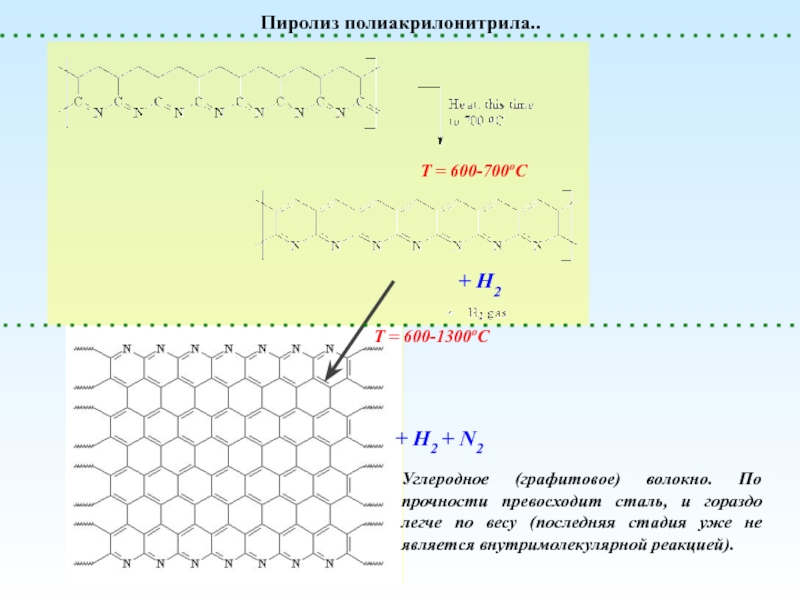
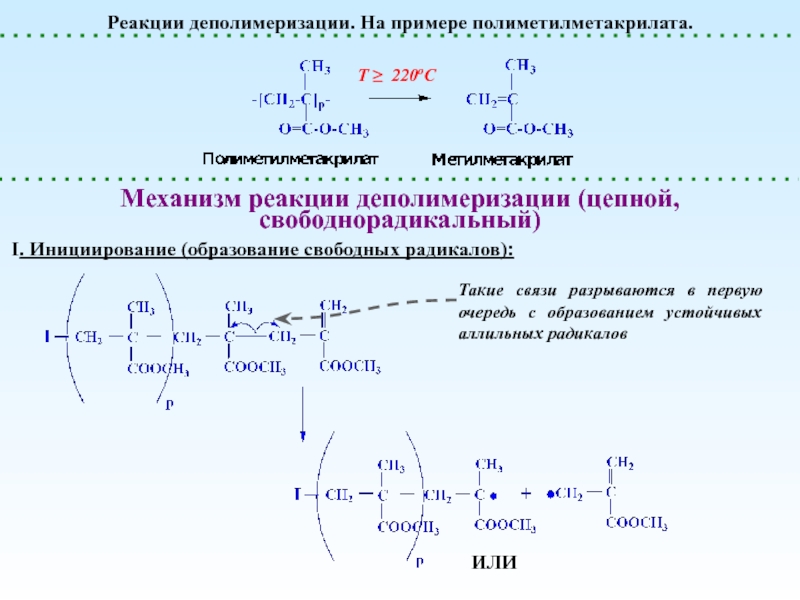
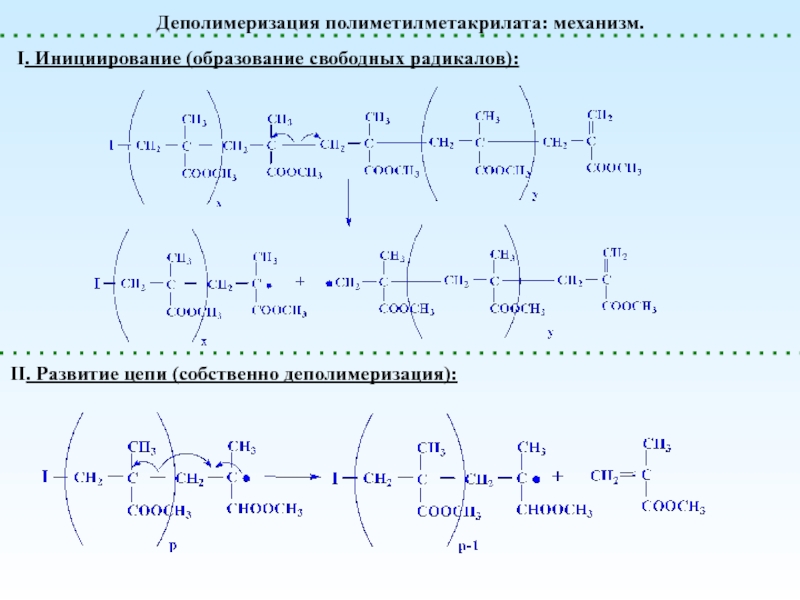
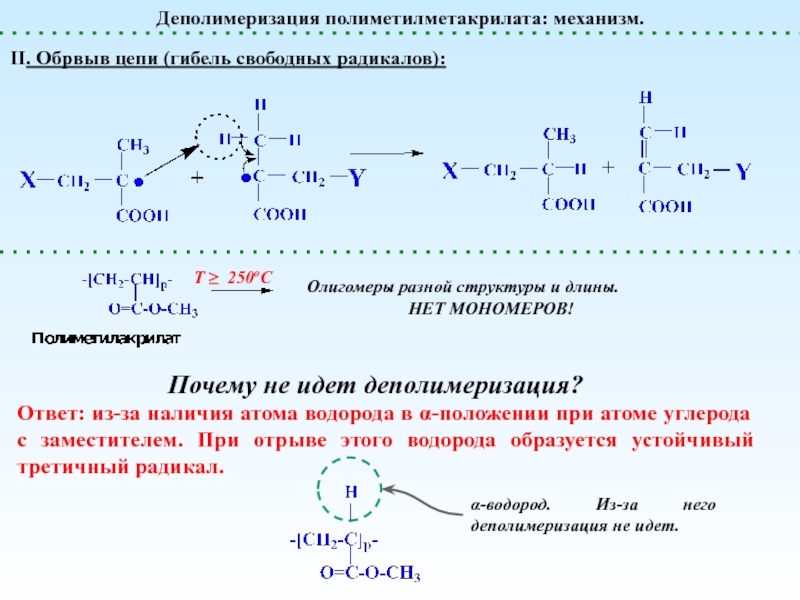
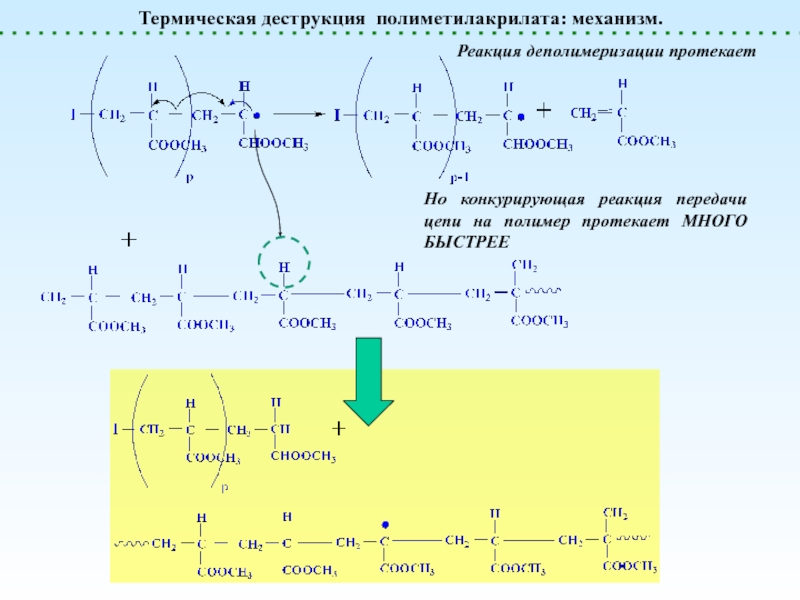
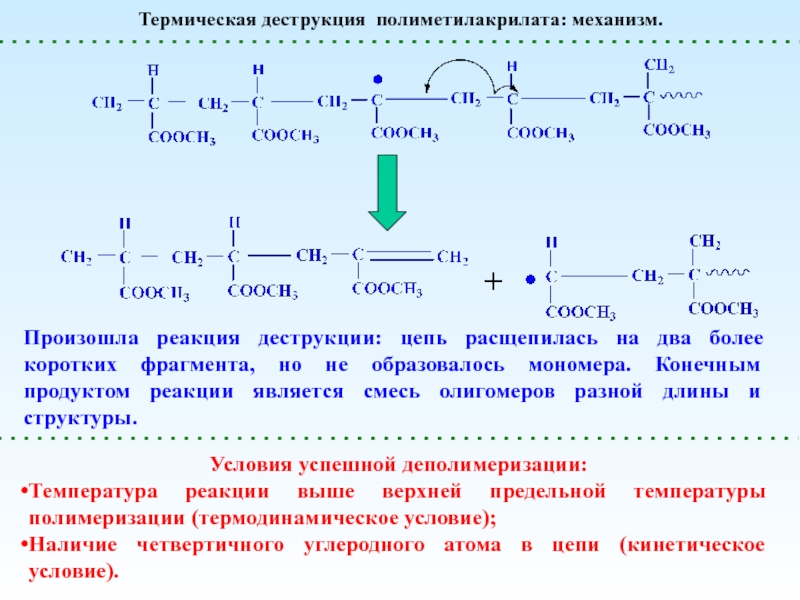
Деполимеризация и Деструкция
![Химические реакции полимеров. Классификация.
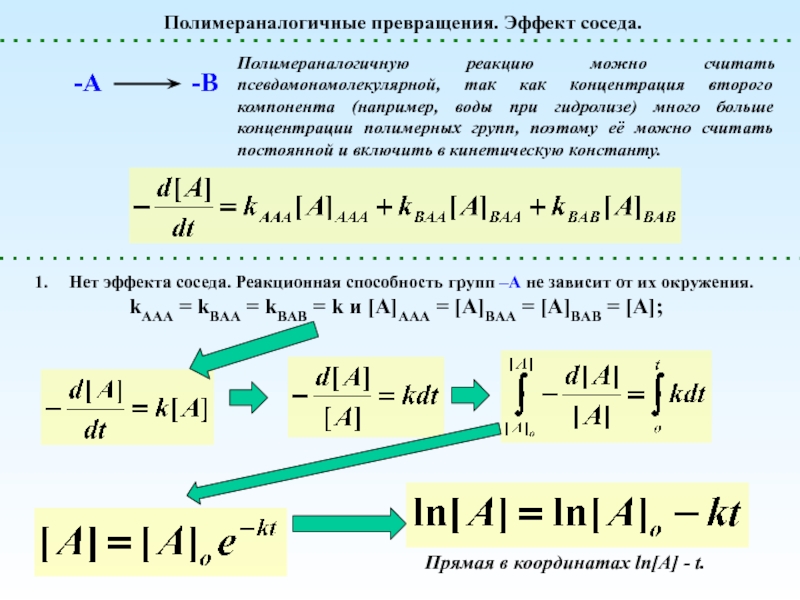
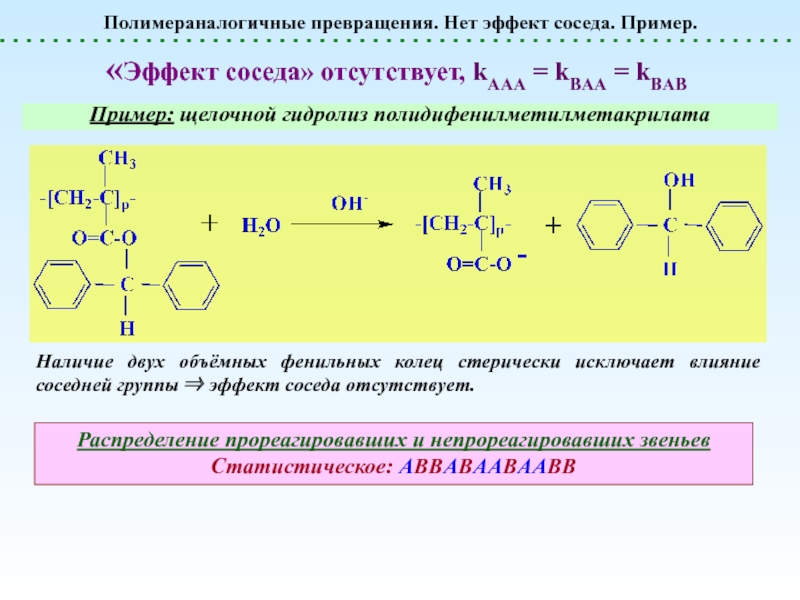
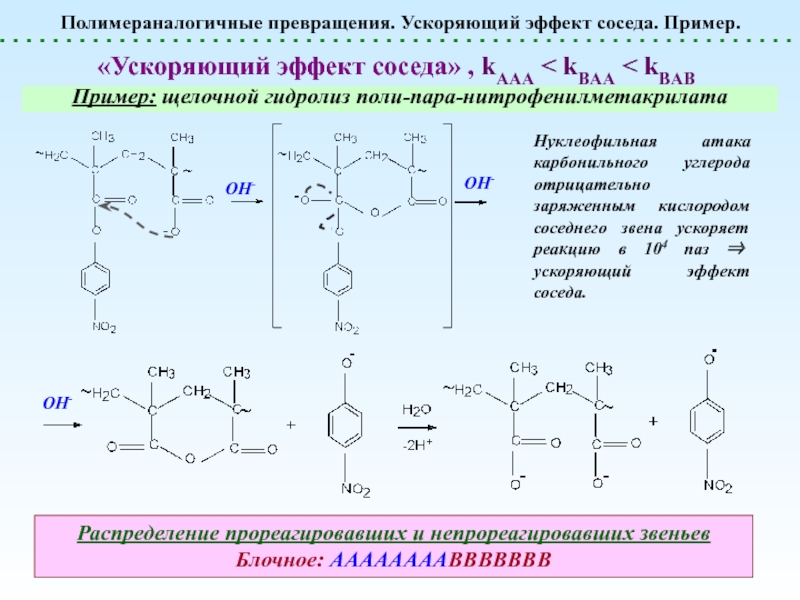
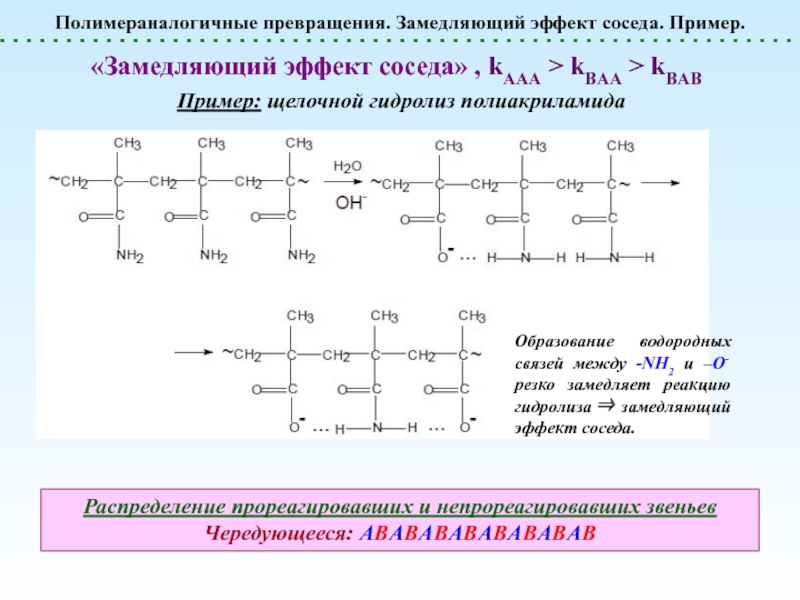
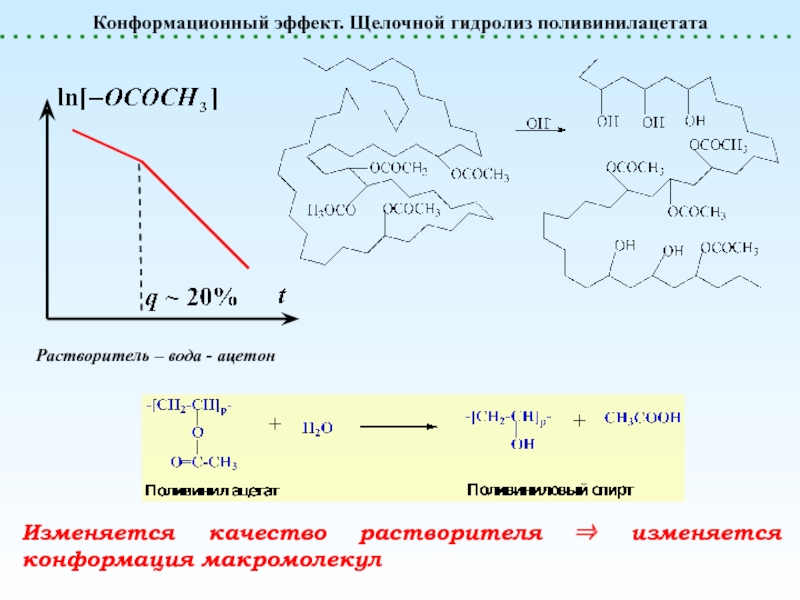
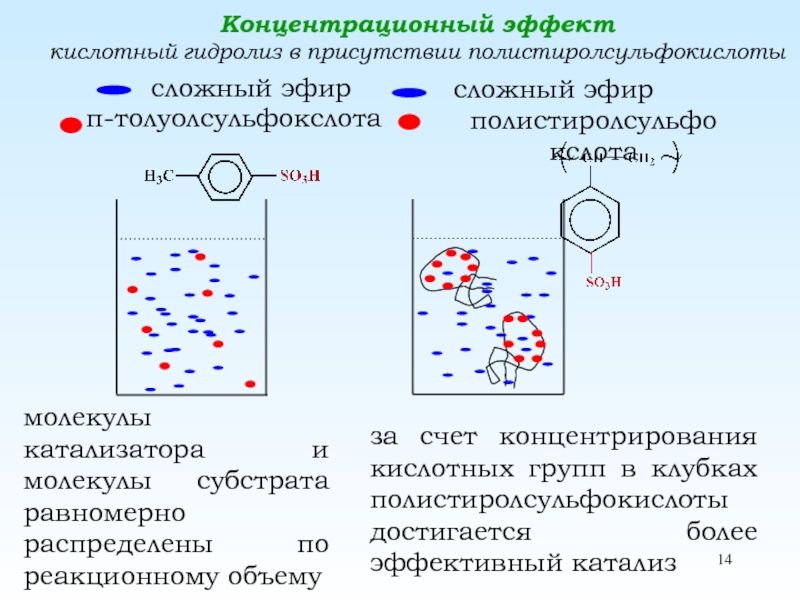
реакции, не сопровождающиеся Полимераналогичные превращения. Эффект соседа. ln[A]t«Эффект соседа» отсутствуетЗамедляющий «эффект соседа» Ускоряющий «эффект Полимераналогичные превращения. Эффект соседа. ln[A]t«Эффект соседа» отсутствуетЗамедляющий «эффект соседа» Ускоряющий «эффект соседа» 2. Ускоряющий эффект соседа. Появление](/img/thumbs/4bfd6c0fe3777e7adba209b77c9dba79-800x.jpg)


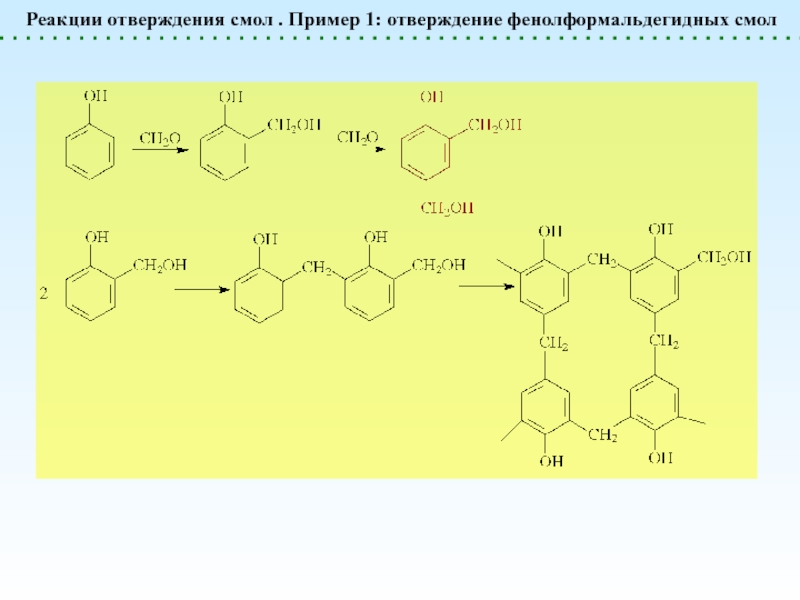
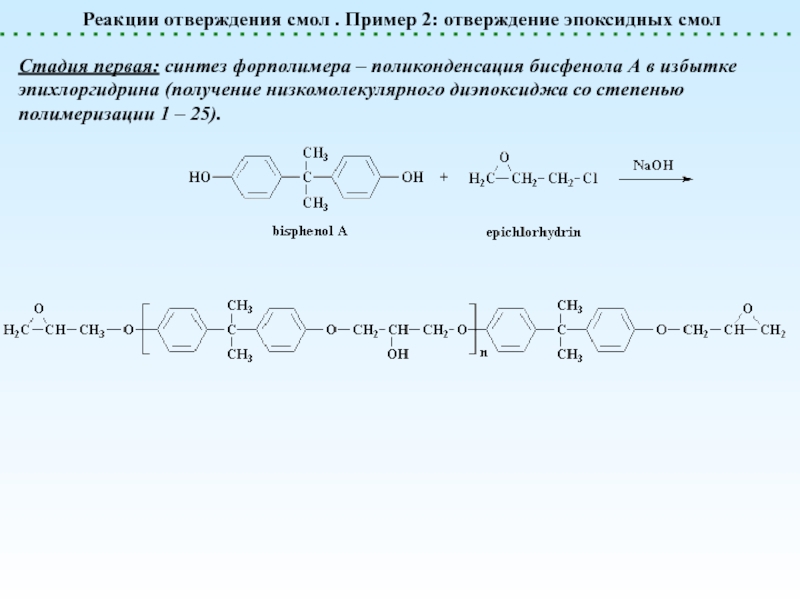
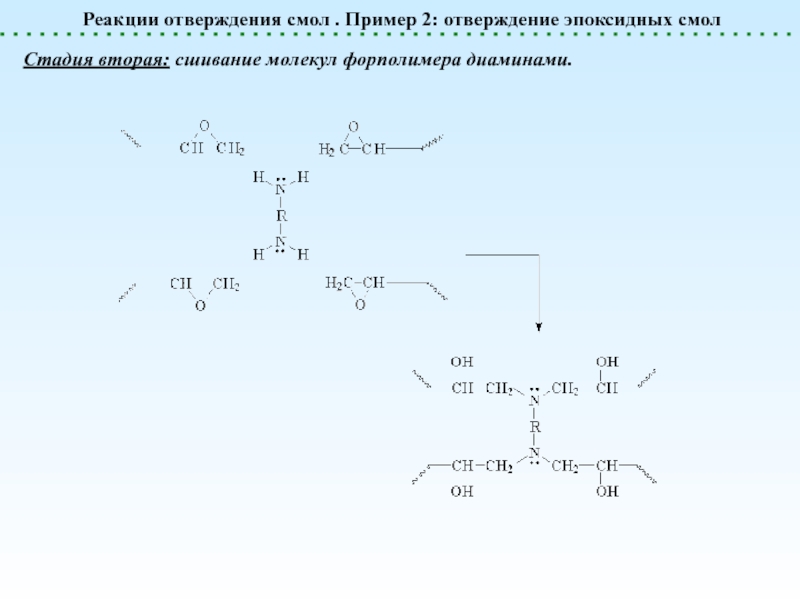
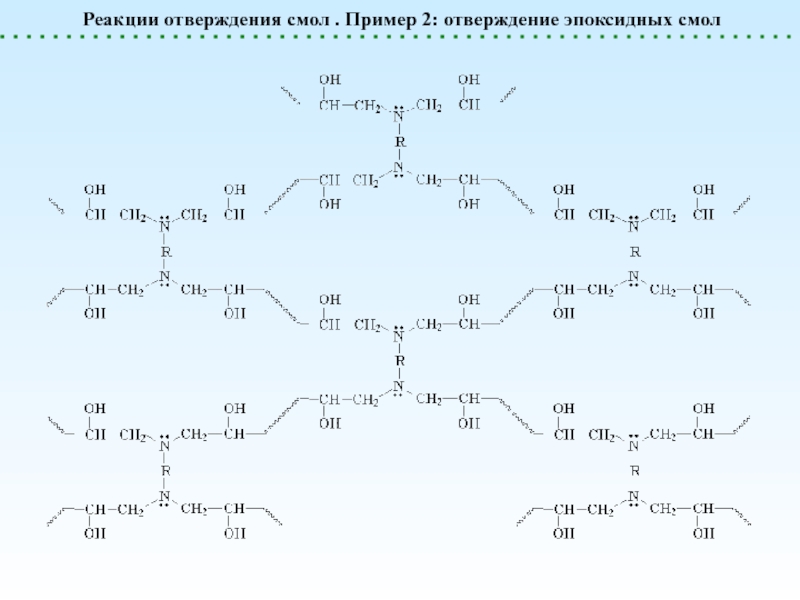
![Химические реакции полимеров. Классификация.
реакции, не сопровождающиеся Термолиз различных полимеров и выход мономера-[CH2-CH2]p--[CF2-CF2]p- Термолиз различных полимеров и выход мономера-[CH2-CH2]p--[CF2-CF2]p-](/img/thumbs/5b5b2d4082c9b2aa76315b86ad6a05af-800x.jpg)