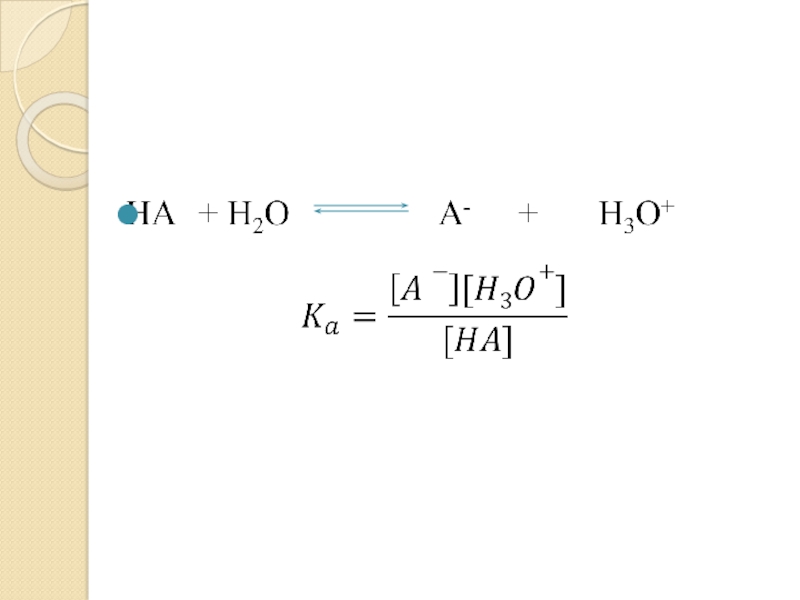Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическое равновесие в аналитической химии. Протолитические равновесия
Содержание
- 1. Химическое равновесие в аналитической химии. Протолитические равновесия
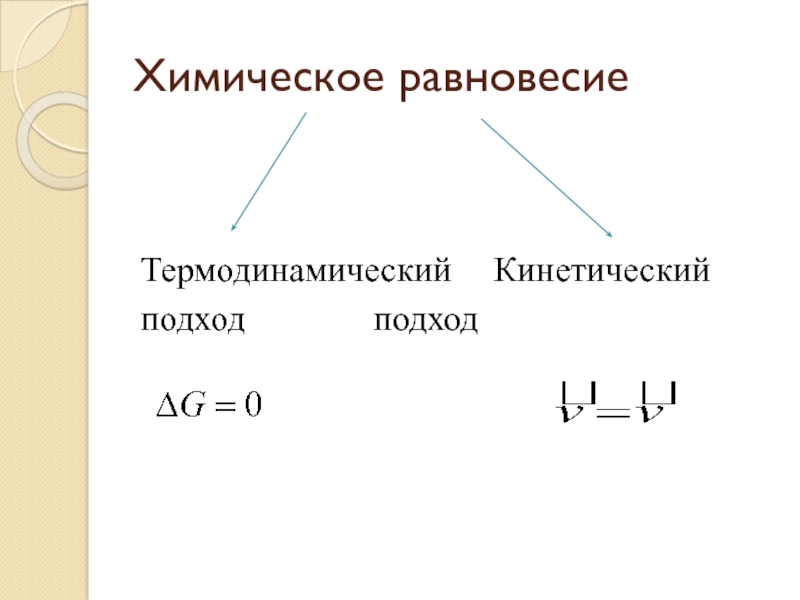
- 2. Химическое равновесиеТермодинамический Кинетическийподход подход
- 3. Константа химического равновесия – отношение произведения концентраций,
- 4. Термодинамический подходРавновесие – состояние системы, при котором ее энергия Гиббса не изменяется.Уравнение изотермы химической реакции
- 5. Кинетический подходРавновесие – такое состояние системы, при котором скорости прямой и обратной реакции равны
- 6. Закон действия масс
- 7. АктивностьАктивность (эффективная концентрация, действующая концентрация) (a) –
- 8. а имеет ту же размерность, что и
- 9. Коэффициент активностиКоэффициент активности (y, γ, f)– поправочный
- 10. Коэффициент активностиМолярный Моляльный Рациональный y = 0 1
- 11. Коэффициент активностиСреднеионный – характеризует поведение электролита в
- 12. Ионная сила раствораАктивность вещества, находящегося в растворе
- 13. Предельный закон Дебая – Хюккеля I < 0,01где
- 14. Расширенное уравнение Дебая-Хюккеля 0,01 < I < 0,1
- 15. Уравнение Дэвиса I > 0,1
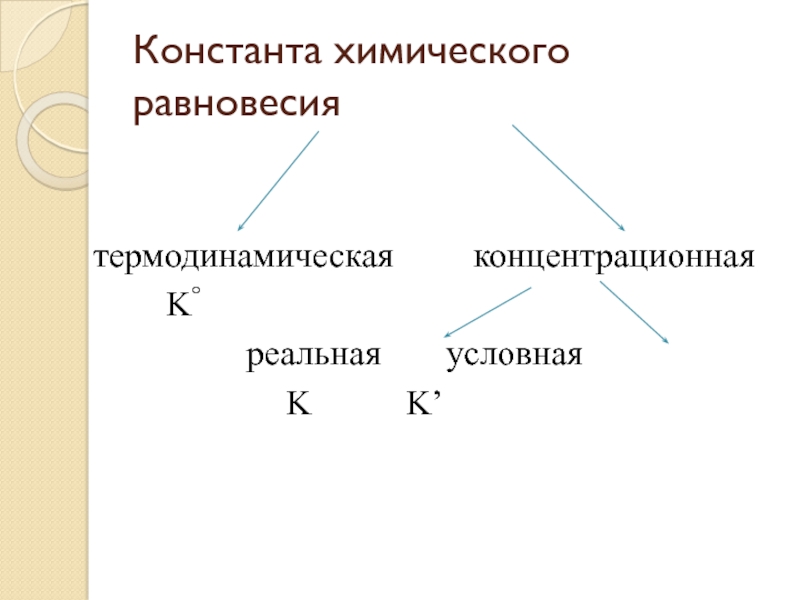
- 16. Константа химического равновесиятермодинамическая концентрационная K° реальная условная K K’
- 17. Термодинамическая константа равновесия выражается как отношение активностей
- 18. Концентрационная константа равновесия представляет собой отношение равновесных
- 19. Условная константа равновесия выражается через общие концентрации
- 20. Равновесная концентрация – концентрация определенной формы вещества,
- 21. Слайд 21
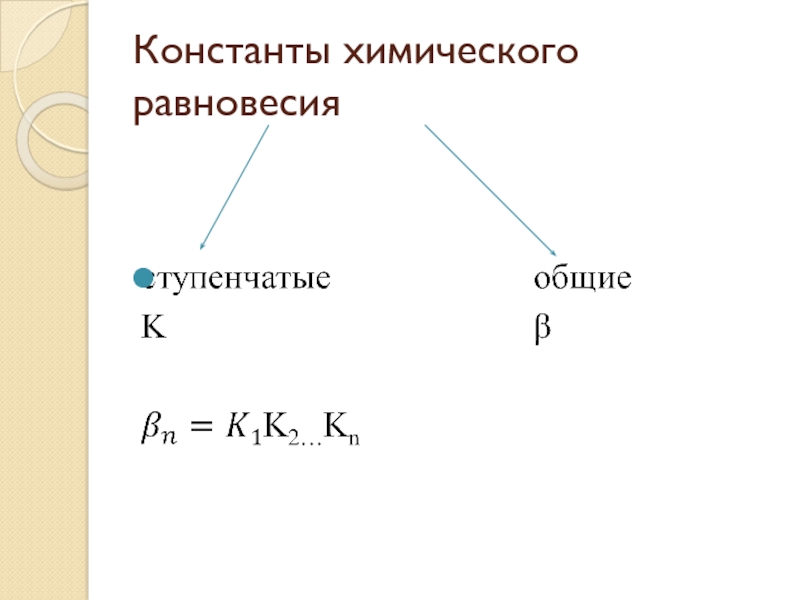
- 22. Взаимосвязь констант равновесия
- 23. Константы химического равновесия
- 24. Показатель константы – отрицательный десятичный логарифм константы равновесия. pK = -lgK
- 25. Теории кислот и основанийИонная теория Аррениуса и ОствальдаПротолитическая теория БрёнстедаЭлектронная теория ЛьюисаТеория Усановича
- 26. Ионная теория Аррениуса и ОствальдаКислота – электролит,
- 27. Кислота и основание взаимодействуют друг с другом
- 28. Недостатки ионной теорииПрименима только для водных растворовНе
- 29. Протолитическая теория БрёнстедаКислота – соединение, способное отдавать
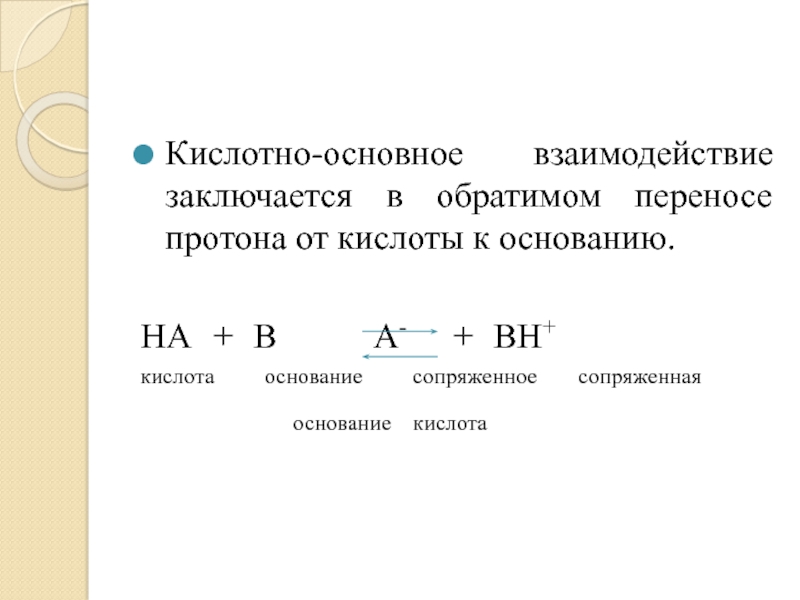
- 30. Кислотно-основное взаимодействие заключается в обратимом переносе протона
- 31. Кислоты и основания существуют как сопряженные пары.В
- 32. Электронная теория ЛьюисаКислота – соединение, способное принимать
- 33. Теория УсановичаКислота – вещество, которое выделяет катионы
- 34. Колическтвенное описание силы кислот и основанийКонстанта кислотности
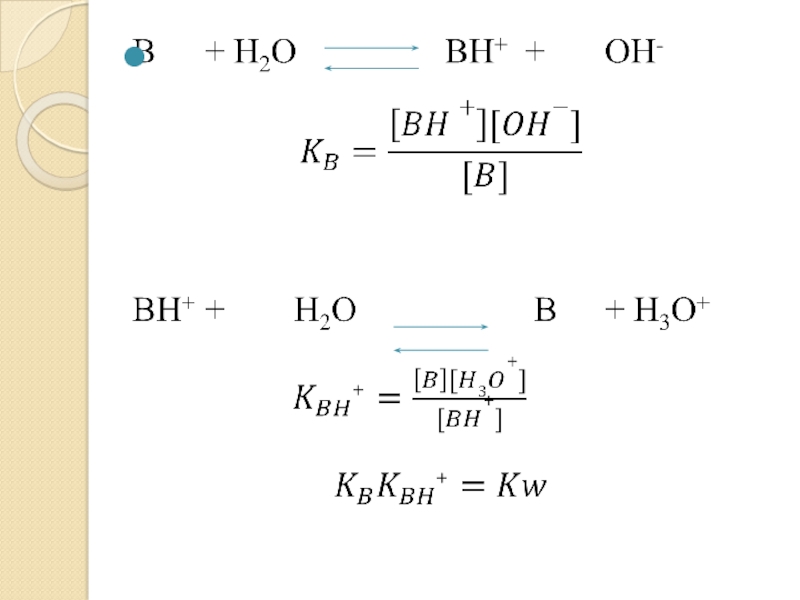
- 35. Слайд 35
- 36. Показатель константы кислотности pKа = -lgKаЧем больше Ka и меньше pKa, тем сильнее кислота
- 37. Слайд 37
- 38. Слайд 38
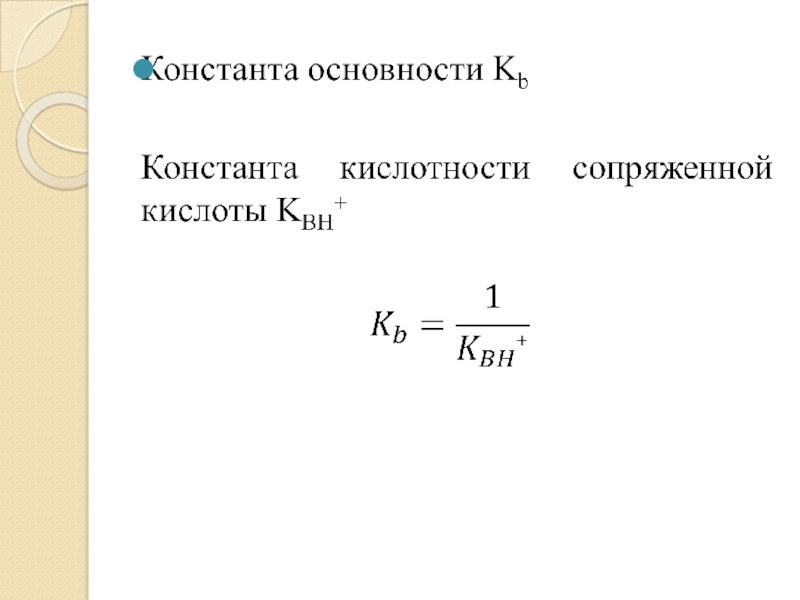
- 39. Показатель константы кислотности сопряженной кислоты pKBH+ = -lgKBH+Чем
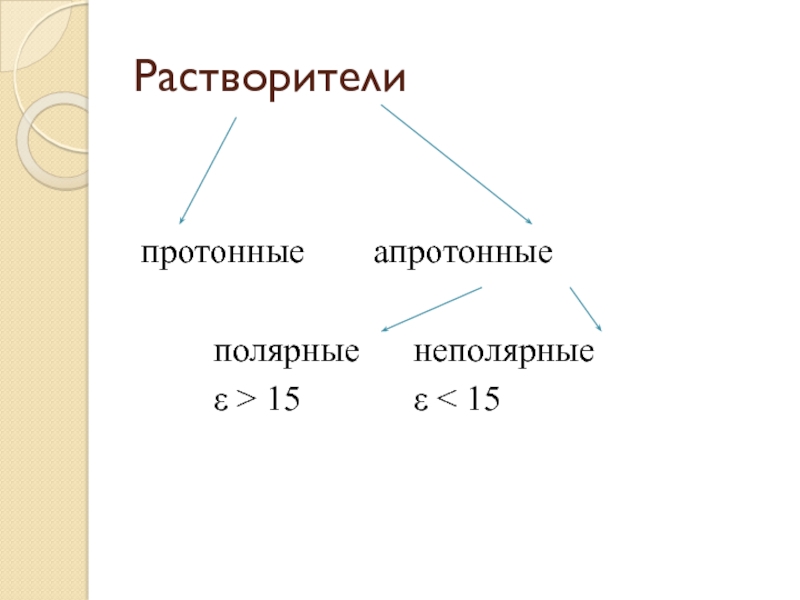
- 40. Растворителипротонные апротонные полярные неполярные ε > 15 ε < 15
- 41. Протонные растворители – растворители, в составе молекул
- 42. РастворителиКислотные (протогенные) – карбоновые кислотыОсновные (протофильные) –
- 43. АвтопротолизАвтопротолиз – процесс кислотно-основного взаимодействия между двумя
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
- 47. Общие принципы расчета состава равновесных системУравнение материального
- 48. Расчет рН водных растворов
- 49. Кислотно-основные буферные системыБуферный раствор – системы, поддерживающие
- 50. Кислотно-основные буферные системы содержат слабые кислоты и
- 51. Механизм действия буферных растворовПри добавлении к буферному
- 52. Расчет рН буферных растворов
- 53. Слайд 53
- 54. Слайд 54
- 55. Спасибо за внимание
- 56. Скачать презентанцию
Химическое равновесиеТермодинамический Кинетическийподход подход
Слайды и текст этой презентации
Слайд 3
Константа химического равновесия – отношение произведения концентраций, находящихся в состоянии
Слайд 4Термодинамический подход
Равновесие – состояние системы, при котором ее энергия Гиббса
не изменяется.
Уравнение изотермы химической реакции
Слайд 5Кинетический подход
Равновесие – такое состояние системы, при котором скорости прямой
и обратной реакции равны
Слайд 7Активность
Активность (эффективная концентрация, действующая концентрация) (a) – это такая концентрация
вещества, при использовании которой свойства данного раствора могут быть описаны
теми же уравнениями, что и свойства идеального раствора.Слайд 8а имеет ту же размерность, что и величина, характеризующая состав
раствора, вместо которой эта активность используется.
а=1 (чистого растворителя, нерастворимых веществ)
а=c (в бесконечно разбавленном растворе)
Слайд 9Коэффициент активности
Коэффициент активности (y, γ, f)– поправочный коэффициент, показывающий, насколько
отличаются свойства реального и идеального раствора.
Коэффициент активности – отношение
активности вещества в данном растворе к его концентрации.Слайд 11Коэффициент активности
Среднеионный – характеризует поведение электролита в целом, устанавливается экспериментально.
AmBn
Индивидуальный
– характеризует активность отдельных ионов, входящих в состав электролита, получаются
расчетным путем.Слайд 12Ионная сила раствора
Активность вещества, находящегося в растворе электролита, зависит от
концентрации всех ионов, находящихся в растворе, и их заряда.
Слайд 13Предельный закон Дебая – Хюккеля
I < 0,01
где А – коэффициент,
зависящий от температуры и диэлектрической проницаемости среды. А ≈ 0,511
Слайд 14Расширенное уравнение Дебая-Хюккеля
0,01 < I < 0,1
где В =
0,328;
а – электрическая константа, характеризующая размер ионной атмосферы, значение величины
а берут из таблицы, (величина а выражена в Å).Слайд 16Константа химического равновесия
термодинамическая концентрационная
K°
реальная условная
K K’
Слайд 17Термодинамическая константа равновесия выражается как отношение активностей (или парциальных давлений
для равновесных реакций, протекающих в газовой фазе) продуктов реакции к
активностям (парциальным давлениям) исходных веществ.K°= f (природы в-в, T, р-ль)
Слайд 18Концентрационная константа равновесия представляет собой отношение равновесных концентраций продуктов реакции
к равновесным концентрациям исходных веществ.
K= f (природы в-в, T, р-ль,
I)Слайд 19Условная константа равновесия выражается через общие концентрации веществ, участвующих в
равновесии.
K’= f (природы в-в, T, р-ль, I, побочные р-и, рН
и т.д.)Слайд 20Равновесная концентрация – концентрация определенной формы вещества, участвующего в равновесии.
Общая
концентрация – сумма всех равновесных концентраций всех форм существования данного
вещества.Слайд 25Теории кислот и оснований
Ионная теория Аррениуса и Оствальда
Протолитическая теория Брёнстеда
Электронная
теория Льюиса
Теория Усановича
Слайд 26Ионная теория Аррениуса и Оствальда
Кислота – электролит, при диссоциации которого
в водном растворе образуются катионы только одно вида – катионы
водорода (Н+).Основание – электролит, при диссоциации которого в водном растворе образуются анионы только одно вида – гидроксид-ионы (ОН-).
Слайд 27Кислота и основание взаимодействуют друг с другом с образованием соли
и воды (реакция нейтрализации).
Если в реакцию нейтрализации вступает хотя бы
один слабый электролит – реакция обратима.Обратная реакция – реакция гидролиза.
Слайд 28Недостатки ионной теории
Применима только для водных растворов
Не описывает кислотно-основных свойства
веществ, не попадающих под определение кислота и основание.
Слайд 29Протолитическая теория Брёнстеда
Кислота – соединение, способное отдавать протон.
Основание – соединение,
способное принимать протон.
Амфолит – вещество, способное проявлять как кислотные, так
и основные свойства.Слайд 30Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к
основанию.
HA + B A- + BH+
кислота основание
сопряженное сопряженнаяоснование кислота
Слайд 31Кислоты и основания существуют как сопряженные пары.
В процессе взаимодействия кислоты
и основания они не исчезают, образуя соль и воду, а
превращаются в новое основание и новую кислоту.Понятия соль и гидролиз отсутствуют.
Протон не существует в растворе в свободном виде, а связывается с молекулами растворителя. (H3O+)
Слайд 32Электронная теория Льюиса
Кислота – соединение, способное принимать пару электронов.
Основание –
соединение, способное присоединять пару электронов.
Взаимодействие кислоты и основания приводит к
образованию ковалентной связи по донорно-акцепторному механизму.Слайд 33Теория Усановича
Кислота – вещество, которое выделяет катионы и взаимодействует с
анионами или электронами.
Основание – вещество, которое отдает протоны или электроны.
Слайд 34Колическтвенное описание силы кислот и оснований
Константа кислотности (Ка) – величина,
характеризующая способность кислоты отдавать протон молекуле растворителя, выступающей в качестве
основания.Слайд 39Показатель константы кислотности сопряженной кислоты
pKBH+ = -lgKBH+
Чем больше KBH+ и
меньше pKBH+ , тем сильнее сопряженная с основанием кислота и
тем слабее само основаниеСлайд 41Протонные растворители – растворители, в составе молекул которых имеется склонный
к ионизации атом водорода. Вода, спирты, карбоновые кислоты
Апротонные неполярные –
гексан, бензол, тетрахлорметан.Апротонные полярные – ацетонитрил, диметилформамид, ацетон.
Слайд 42Растворители
Кислотные (протогенные) – карбоновые кислоты
Основные (протофильные) – аммиак, диетилформамид
Амфотерные –
спирты, вода
Инертные – тетрахлорметан, бензол, гексан, ацетон, ацетонитрил, диметилсульфоксид
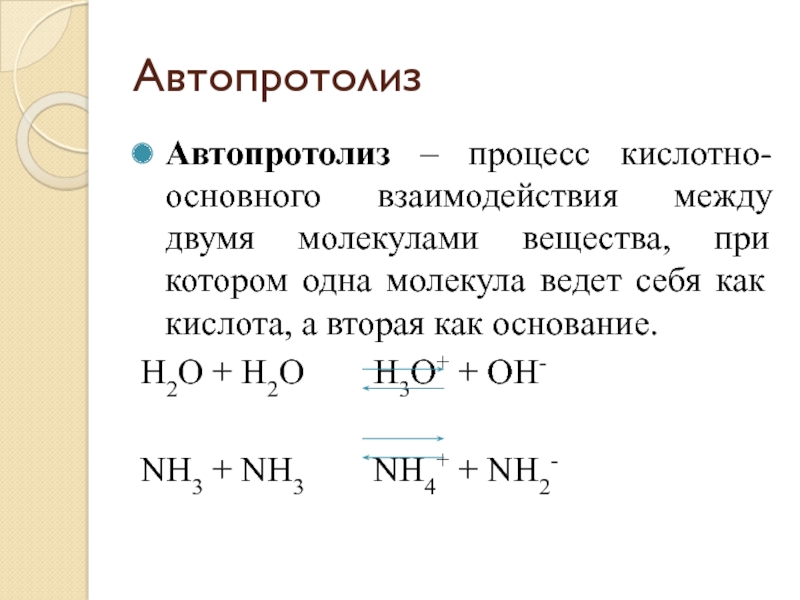
Слайд 43Автопротолиз
Автопротолиз – процесс кислотно-основного взаимодействия между двумя молекулами вещества, при
котором одна молекула ведет себя как кислота, а вторая как
основание.H2O + H2O H3O+ + OH-
NH3 + NH3 NH4+ + NH2-
Слайд 47Общие принципы расчета состава равновесных систем
Уравнение материального баланса отражает тот
факт, что число атомов определенного элемента в изолированной системе остается
неизменным.Уравнение электронейтральности основано на том, что в одном и том же объеме суммарное чиcло положительных зарядов должно быть равно числу отрицательных.
Соблюдаются для равновесных концентраций, но не для активностей
Слайд 49Кислотно-основные буферные системы
Буферный раствор – системы, поддерживающие определенное значение какого-либо
параметра при изменении состава системы.
Кислотно-основный буферный
раствор – раствор, сохраняющий
примерно постоянным значение рН при добавлении к нему не слишком больших количеств сильной кислоты или основания, а также при разбавлении и концентрировании.Слайд 50Кислотно-основные буферные системы содержат слабые кислоты и сопряженные с ними
основания.
Ацетатный CH3COOH + CH3COONa
Аммиачный NH4Cl + NH3
Фосфатный KH2PO4 +
Na2HPO4Гидрокарбонатный CO2˙H2O+ NaHCO3
Карбонатный NaHCO3 + Na2CO3