Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химико-токсикологический анализ веществ, изолируемых дистилляцией (перегонкой с
Содержание
- 1. Химико-токсикологический анализ веществ, изолируемых дистилляцией (перегонкой с
- 2. Приказ МЗ СССР от 25.12.73г. № 1021 В
- 3. Схема химико-токсикологического анализаВыбор объектаПодготовка изолированной пробыАнализ
- 4. Объекты исследованияОтбор проб регламентирован приказом МЗ РФ
- 5. ДистилляцияАзеотропная (селективная) перегонкас органическимрастворителем(для в-в не образующихазеотропы
- 6. Прибор для дистилляции с водяным паром1 –
- 7. Перегонка с водяным паром. Схема прибораПаро-образователь (нагрев
- 8. Схема общего анализа группы веществ, изолируемых перегонкой
- 9. В основе метода лежит закон парциальных давлений;Смеси
- 10. Давление при котором начинается кипение, достигается при
- 11. Примербензол (Ткип. 80,2оС при 760 мм рт.
- 12. Слайд 12
- 13. Химико-токсикологический анализ синильной кислоты1) К 1 мл
- 14. Образование берлинской лазуриNaOH+HCN = NaCN + H2OFeSO4
- 15. Слайд 15
- 16. Продолжение
- 17. Химико-токсикологический анализ хлорсодержащих растворителей (хлороформ, четыреххлористый углерод
- 18. Реакции на органически связанный хлор
- 19. Продолжение3. Реакция дистиллята с 1% свежеприготовленным р-ром
- 20. Образование закиси меди
- 21. Для отличия хлоралгидрата от хлороформа используют реакцию
- 22. Для отличия дихлорэтана от хлороформа и др.
- 23. 2) образования ацетиленида меди: При нагревании 1,2-дихлорэтана с
- 24. Химико-токсикологический анализ формальдегида 1. Реакция с резорцином в
- 25. Продолжение4. С хромотроповой кислотой формальдегид в присутствии
- 26. 5. При нагревании дистиллята с AgNO3 в
- 27. 1. 1 мл дистиллята или исследуемой жидкости
- 28. Обе реакции неспецифичны для ацетона. Уксусный альдегид
- 29. Наиболее характерными и чувствительными реакциями доказательства метанола
- 30. Раствор, содержащий, окисленный до формальдегида, метанол, делят
- 31. 1. Реакция образования йодоформа (неспецифична)Образуются характерные для йодоформа кристаллы. Чувствительность реакции – 0,04 мг/мл.Химико-токсикологический анализ этанола
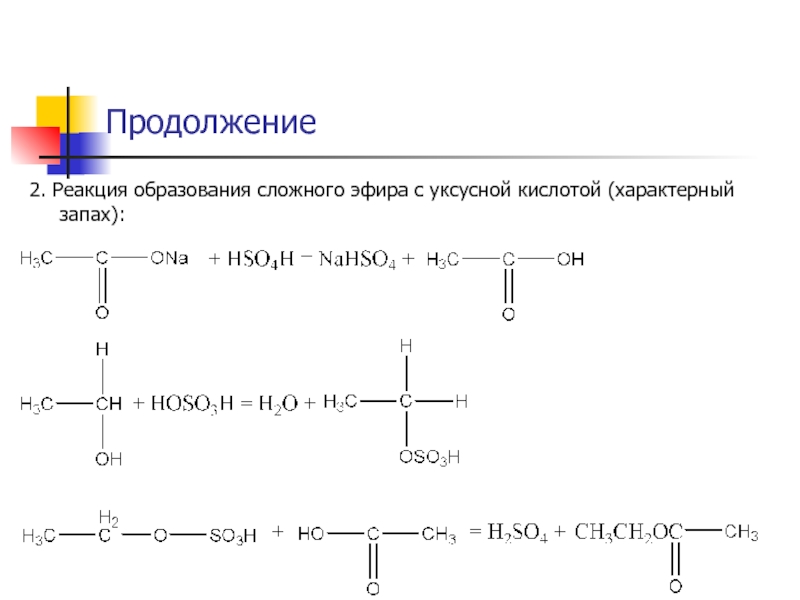
- 32. 2. Реакция образования сложного эфира с уксусной кислотой (характерный запах):Продолжение
- 33. 3. Реакция окисления этанола 5% р-ром бихромата
- 34. Продолжение4. Реакция получения этилбензоата, обладающего специфическим запахом.
- 35. Химико-токсикологический анализ фенола, крезолов1. Реакция с бромной
- 36. 2. К р-ру прибавляют 1-2 капли
- 37. Химико-токсикологическое значение этиленгликоля (т.кип. 195оС – перегонка
- 38. качественные реакцииС ванилином (или салициловым альдегидом) в кислой среде – красная окраскаХимико-токсикологическое значение амилового спирта
- 39. Микродиффузия молекул летучего яда (Токс.) из вытесняющей
- 40. Подготовка пробы к ГЖХ анализуПрямой парофазный анализПробоподготовка, основанная на дериватизации анализируемых соединений
- 41. Прямой парофазный анализ
- 42. Алкилнитрильный методКачественное и количественное определение С1-С5 спиртов
- 43. 0,5 мл 50% трихлоруксусной кислоты0,5 мл дефлегматаЗакрывается
- 44. При проведении количественного определения в качестве внутреннего стандарта в пробу добавляется 0,5 мл 0,1% н-пропанолаМетодика
- 45. Спасибо за внимание!
- 46. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Химико-токсикологический анализ веществ, изолируемых дистилляцией (перегонкой с водяным паром) –
«летучих ядов»
Слайд 2Приказ МЗ СССР от 25.12.73г. № 1021
В первый раздел Перечня
включены:
синильная кислота;
спирты (метиловый, этиловый, пропиловый, бутиловый и амиловый);
формальдегид;
хлороформ, хлоралгидрат, четыреххлористый
углерод, дихлорэтан;фенол, крезолы.
Во второй раздел Перечня включены: этиленгликоль, ацетон, бензол, толуол, ксилол и др.
Слайд 3Схема химико-токсикологического анализа
Выбор объекта
Подготовка изолированной пробы
Анализ
ГЖХ Химический
методСлайд 4Объекты исследования
Отбор проб регламентирован приказом МЗ РФ от 24.04.11 г.
№ 346н
Желудок и кишечник (их содержимое);
Кровь
Легкие
Органы,
осуществляющие элиминацию ксенобиотиков (печень, почки)
Селезенку
Мозг
Моча
Жировая ткань
Слайд 5Дистилляция
Азеотропная
(селективная)
перегонка
с органическим
растворителем
(для в-в не образующих
азеотропы с водой)
Например этиленгликоль
Дериватизация
(для
спиртов)
Микродиффузионный
метод
С водяным паром
Частный метод
дистилляции
с пропусканием
сжатого азота
для HCN и ее
солей
Методы
изолированияПарофазный анализ
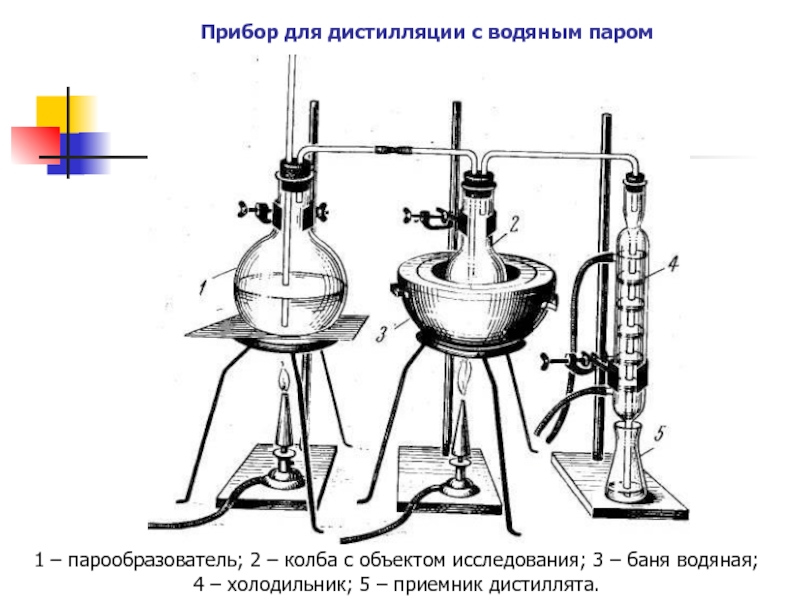
Слайд 6Прибор для дистилляции с водяным паром
1 – парообразователь; 2 –
колба с объектом исследования; 3 – баня водяная;
4 – холодильник;
5 – приемник дистиллята.Слайд 7Перегонка с водяным паром. Схема прибора
Паро-образователь (нагрев на открытом пламени
выше 100оС)
Колба с анализируемым образцом
(нагрев на водяной бане
до 60-70оС)Холодильник
Приемник
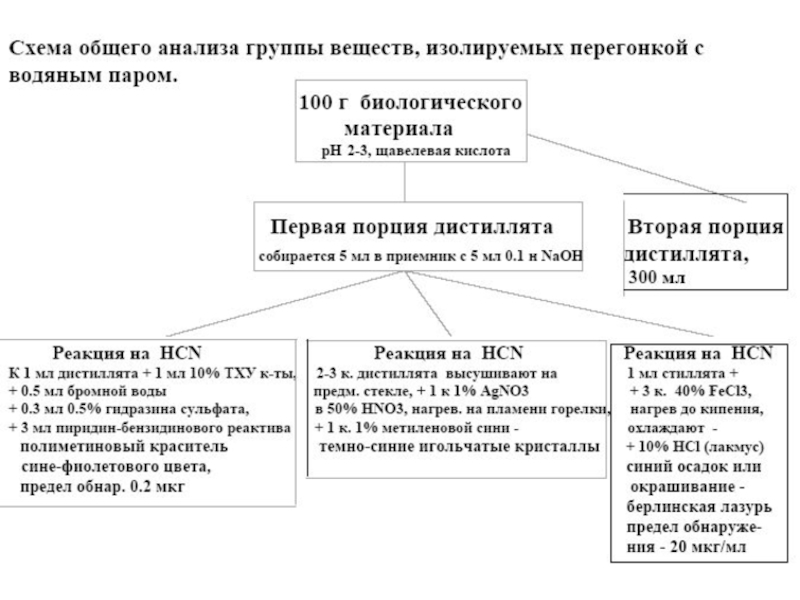
Слайд 8Схема общего анализа группы веществ, изолируемых перегонкой с водяным паром
100
г биологического материала
рН 2-3, щавелевая кислота
1) 5 мл - первая
фракция собирается в приемник с 5 мл 0,1 н NaOH2) 300 мл – вторая фракция
Слайд 9В основе метода лежит закон парциальных давлений;
Смеси взаимно нерастворимых жидкостей
кипят при температуре более низкой, чем температура кипения каждого из
компонентов (азеотроп);Суммарное давление паров компонентов над системой Р, равное сумме давлений р1 + р2 всегда выше давления пара каждого компонента в отдельности
Основы метода
Слайд 10Давление при котором начинается кипение, достигается при температурах, меньших температур
кипения отдельных компонентов;
В отдельных случаях, если вещество с водой не
дает азеотропа, в реакционную смесь дополнительно вводят вещество, образующее с токсичным веществом азеотроп (пример – этиленгликоль)Основы метода
Слайд 11Пример
бензол (Ткип. 80,2оС при 760 мм рт. ст.) перегоняется с
водой (Ткип. 100оС при 760 мм рт. ст.) при температуре
69оС. При этом количественное соотношение в дистилляте (в граммах)m1 M1 P1
------- = -------------- ,
m2 M2 P2
где m1 и m2 - массы данных веществ в дистилляте, M1 и M2 – их молекулярные массы, P1 и P2 – парциальные давления их паров.
Слайд 13Химико-токсикологический анализ
синильной кислоты
1) К 1 мл дистиллята + 1 мл
10% ТХУ + 0,5 мл бромной воды + 0,3 мл
0,5% гидразин сульфата сине-фиолетовый цвет2) 2-3 капли дистиллята высушивают на предметном стекле + 1 к 1% AgNO3 в 50% азотной кислоте, нагрев на пламени горелки, + 1 к 1% метиленовой сини темно-зеленые игольчатые кристаллы
3) 1 мл дистиллята + 3 к 40% FeCl3/FeCl2, нагрев до кипения, охлаждают, + 10% HCl до кислой среды по лакмусовой бумаге берлинская лазурь
Слайд 14Образование берлинской лазури
NaOH+HCN = NaCN + H2O
FeSO4 + 2NaCN =
Fe(CN)2 + Na2SO4
Fe(CN)2 + NaCN = Na4[Fe(CN)6]
3Na4[Fe(CN)6] + 2Fe2(SO4)3 =
Fe4[Fe(CN)6]3 + 6Na2SO4синее окрашивание
Заключение о качественном обнаружении (если синий осадок не выпадает тотчас) или необнаружении HCN дается лишь по истечении 24-48 час, т.к. при следовых количествах HCN в присутствии органических веществ осадок
Берлинской лазури может выпадать медленно.
Чувствительность реакции 20 мкг HCN в 1 мл раствора
Слайд 17Химико-токсикологический анализ
хлорсодержащих растворителей (хлороформ, четыреххлористый углерод и т.д.)
Вторая порция дистиллята
(300 мл)
качественные реакции
Реакция отщепления атома хлора
Реакция образования изонитрила
Реакция с резорцином
Слайд 18Реакции на органически связанный хлор
1.
Общей реакцией на галогенопроизводные является реакция отщепления галоида, что достигается
при нагревании части дистиллята со спиртовым раствором NaOH:+ AgNO3
в HNO3
2. В случае отсутствия осадка или мути проводят реакцию получения изонитрила
Отрицательный результат этой реакции позволяет судить о ненахождении
в исследуемом объекте галогенорганических веществ.
CHCl3 + C6H5NH2 + 3 KOH C6H5CN + 3 KCl + 3 H20
Слайд 19Продолжение
3. Реакция дистиллята с 1% свежеприготовленным р-ром резорцина
(м-диоксибензол) в 10% р-ре NaOH при нагревании:
Появление розового
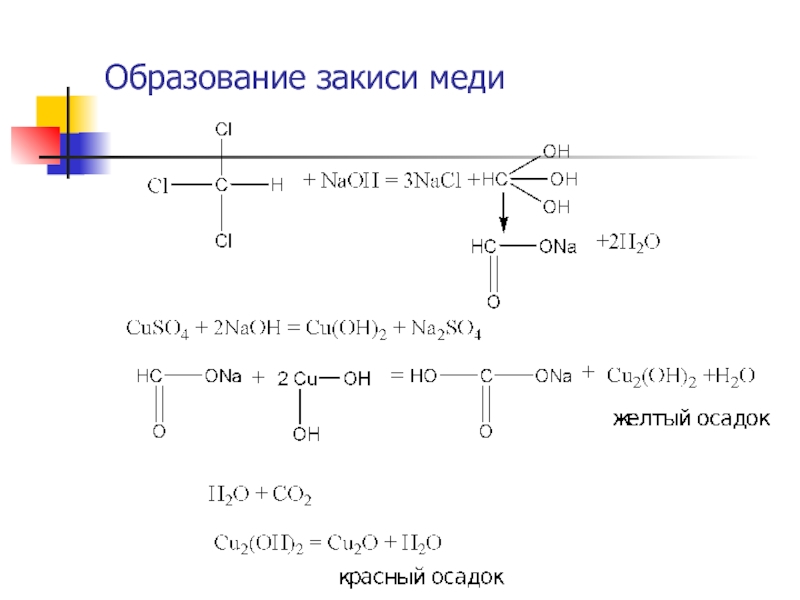
(красного) окрашивания может указывать на наличие Хлороформа, 4-хлористого углерода, хлоралгидрата.4. При значительных количествах ССl3 и хлоралгидрата
проводят реакцию восстановления Cu(OH)2 в Cu2(OH), пере
ходящую далее в Cu2O при кипячении с р-ром Феллинга.
При наличии хлороформа, хлоралгидрата и летучих с
водяным паром альдегидов (формальдегид, уксусный альдегид)
образуется желтый осадок гидрата закиси меди, переходящий
Почти тотчас в красный осадок закиси меди.
Альдегиды исключаются в ходе анализа соответствующими реакциями.
Слайд 21 Для отличия хлоралгидрата от хлороформа используют реакцию с реактивом Несслера:
CCl3CHO
+ K2[HgJ4] + 3KOH
Hg + CCl3CHOK + 4KJ + 2H2OПри наличии хлоралгидрата в исследуемом растворе образуется кирпично-красный осадок, который затем становится грязно-зеленым
Такую же реакцию дают альдегиды и некоторые другие восстанавливающие вещества
Продолжение
Слайд 22 Для отличия дихлорэтана от хлороформа и др. используют реакции:
1)
образования этиленгликоля и обнаружение его после переведения в формальдегид:
При нагревании
1,2-дихлорэтана с раствором карбоната натрия в запаянной ампуле образуется этиленгликоль. При взаимодействии этиленгликоля с периодатом калия образуется формальдегидФормальдегид подтверждают реакциями с хромотроповой и фуксинсернистой кислотой
Такую же реакцию дают альдегиды и некоторые другие восстанавливающие вещества
Продолжение
Слайд 23 2) образования ацетиленида меди:
При нагревании 1,2-дихлорэтана с раствором гидроксида натрия
запаянной ампуле образуется ацетилен, который при взаимодействии с солями меди
(I) дает ацетиленид меди, имеющий розовую или вишневую окраскуПродолжение
Слайд 24Химико-токсикологический анализ
формальдегида
1. Реакция с резорцином в щелочной среде.
Чувствительность -
0,03 мкг в пробе. Реакция не является специфичной и имеет
только отрицательное значение. Белки и продукты их разложения мешают реакции, поэтому ее нельзя проводить (например, для установления факта консервирования формалином) непосредственно с жидкостью, которой залиты внутренние органы трупа.2. Дистиллят смешивают с 5-кратным объемом конц. H2SO4. После охлаждения смеси вносят 0,02-0,03 г кодеина (морфина) – сразу или через несколько минут появляется красно- или сине-фиолетовое окрашивание. Чувствительность - 0,02 мкг в пробе.
3. Дистиллят смешивают с 2-3 каплями конц. H2SO4 или HCl и р-ром фуксинсернистой кислоты – через несколько минут появляется синее или сине-фиолетовое окрашивание. Чувствительность - 0,03 мкг в пробе.
Реакцию дают все альдегиды. Ацетон также дает сине-фиолетовое окрашивание.
Слайд 25Продолжение
4. С хромотроповой кислотой формальдегид в присутствии конц. H2SO4 дает
красно-фиолетовое окрашивание. Чувствительность - 1,0 мкг в пробе.
Слайд 265. При нагревании дистиллята с AgNO3 в аммиачной среде восстанавливается
металлическое серебро:
AgNO3 + NH4OH = AgOH +
NH4NO3;2AgOH = Ag2O + H2O;
Чувствительность – 0,02 мкг в пробе.
Заключение о нахождении формальдегида в биоматериале дается, как правило, при условии получения положительных результатов второй и третьей реакций.
Продолжение
Слайд 271. 1 мл дистиллята или исследуемой жидкости с несколькими каплями
1% свежеприготовленного нитропруссида натрия [Na2Fe(CN)5NO]•2H2O дает оранжево-красное окрашивание, переходящее при
добавлении CH3COOH до кислой реакции в красно-фиолетовой или вишнево-красное окрашивание.2. С р-ром йода в KI в присутствии 10% водного р-ра NH4OH образуется йодоформ (характерный запах) и выпадает желтый кристаллический осадок.
Чувствительность реакции – 0,1 мг/мл.
Химико-токсикологический анализ ацетона
Слайд 28Обе реакции неспецифичны для ацетона. Уксусный альдегид и этанол также
дают эту реакцию, поэтому реакция имеет значение только при отсутствии
этих веществ.3. С 1% р-ром фурфурола в 96°этаноле в присутствии 10% NaOH и дальнейшем подкислении конц. HCl дистиллят, содержащий ацетон, дает интенсивное красное окрашивание. Это общая реакция для альдегидов и кетонов.
Продолжение
Слайд 29 Наиболее характерными и чувствительными реакциями доказательства метанола являются реакции, основанные
на окислении его в формальдегид. Поэтому необходимо убедиться в отсутствии
формальдегида.1. Окисление метанола в дистилляте проводят 2%р-ром KMnO4 в кислой среде (10% H2SO4) при охлаждении холодной водой, добиваясь возможно большей полноты окисления метанола до формальдегида.
CH3OH + 2KMnO4 +3H2SO4= 5H2CO + 2MnSO4 + K2SO4 + 8H2O
Для уничтожения избытка KMnO4 к исследуемой жидкости по каплям прибавляют до обесцвечивания 15% р-р бисульфита натрия или щавелевой кислоты:
2KMnO4 + 5Na2SO3 + 3H2SO4= 2MnSO4+ 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4+ K2SO4 + 10CO2 + 8H2O
Химико-токсикологический анализ метанола
Слайд 30Раствор, содержащий, окисленный до формальдегида, метанол, делят на 2 части
и исследуют:
А) с р-ром кодеина или морфина в конц.H2SO4 –
при наличии H2CO появляется красно-фиолетовое (сине-фиолетовое) окрашивание.Б) с р-ром фуксинсернистой кислоты в присутствии 1 мл конц. HCl - появляется синее или сине-фиолетовое окрашивание.
Чувствительность реакции – 0,1 мг в пробе.
2.Реакция образования метилового эфира салициловой кислоты.
Характерный запах.
Чувствительность реакции – 0,3 мг в пробе.
Продолжение
Слайд 311. Реакция образования йодоформа (неспецифична)
Образуются характерные для йодоформа кристаллы.
Чувствительность
реакции – 0,04 мг/мл.
Химико-токсикологический анализ этанола
Слайд 333. Реакция окисления этанола 5% р-ром бихромата калия в сернокислой
среде до уксусного альдегида – специфический запах:
Чувствительность реакции не
превышает 3 мг в 1 мл дистиллята.Продолжение
Слайд 34Продолжение
4. Реакция получения этилбензоата, обладающего специфическим запахом. Реакция проводится с
дистиллятом и бензоилхлоридом в присутствии 40% NaOH:
Слайд 35Химико-токсикологический анализ фенола, крезолов
1. Реакция с бромной водой – появляется
белый осадок или муть трибромфенола (кристаллы имеют форму игл). При
избытке брома реакция идет дальше с переходом в кетоформу:Слайд 362. К р-ру прибавляют 1-2 капли 5% свежеприготовленного р-ра
FeCl3 появляется синее или сине-фиолетовое окрашивание. Реакция специфична для фенольного
гидроксила.Продолжение
Слайд 37Химико-токсикологическое значение
этиленгликоля
(т.кип. 195оС – перегонка с бензолом)
Метаболизм –летальный синтез
1. Окисление перманганатом
калия в щелочной среде до щавелевой кислоты, подкисление и образование
оксалатов калия при добавлении хлорида кальция – помутнение2. С сульфатом меди в щелочной среде – синяя окраска
CuSO4 + 2 NaOH Na2SO4 + Cu(OH)2
HOCH2CH2OH + Cu(OH)2 (-OCH2CH2O-)Cu + 2 H2O
3. Окисление до формальдегида и обнаружение с реакцией фуксинсернистой кислотой– сине-фиолетовое окрашивание
HOCH2CH2OH + KJO4 2 HCHO + KJO3 + H2O
Слайд 38качественные реакции
С ванилином (или салициловым альдегидом) в кислой среде –
красная окраска
Химико-токсикологическое значение
амилового спирта
Слайд 39Микродиффузия молекул летучего яда (Токс.) из вытесняющей жидкости (ж1) в
абсорбирующую жидкость (ж2) через газовую фазу до выравнивания давления в
системе
Токс
Ж2
Ж1
Слайд 40Подготовка пробы к ГЖХ анализу
Прямой парофазный анализ
Пробоподготовка, основанная на дериватизации
анализируемых соединений
Слайд 42Алкилнитрильный метод
Качественное и количественное определение С1-С5 спиртов
ROH + NaNO2
+ CCl3COOH RONO + CCl3COONa + H2O
Слайд 430,5 мл 50% трихлоруксусной кислоты
0,5 мл дефлегмата
Закрывается пробкой и закатывается
0,5
мл 30% нитрита натрия
Взбалтывается и через 1 мин шприцом отбирается
0,3 мл парогазовой пробы и вводится в испаритель хроматографаМетодика











![Химико-токсикологический анализ веществ, изолируемых дистилляцией (перегонкой с Образование берлинской лазуриNaOH+HCN = NaCN + H2OFeSO4 + 2NaCN = Fe(CN)2 Образование берлинской лазуриNaOH+HCN = NaCN + H2OFeSO4 + 2NaCN = Fe(CN)2 + Na2SO4Fe(CN)2 + NaCN = Na4[Fe(CN)6]3Na4[Fe(CN)6]](/img/thumbs/37312fa0c84a9aece2b115436f8e7370-800x.jpg)





![Химико-токсикологический анализ веществ, изолируемых дистилляцией (перегонкой с Для отличия хлоралгидрата от хлороформа используют реакцию с реактивом Несслера:CCl3CHO + Для отличия хлоралгидрата от хлороформа используют реакцию с реактивом Несслера:CCl3CHO + K2[HgJ4] + 3KOH](/img/thumbs/ce7f174dcdfa4ca174c5c25eafdaacf2-800x.jpg)





![Химико-токсикологический анализ веществ, изолируемых дистилляцией (перегонкой с 1. 1 мл дистиллята или исследуемой жидкости с несколькими каплями 1% 1. 1 мл дистиллята или исследуемой жидкости с несколькими каплями 1% свежеприготовленного нитропруссида натрия [Na2Fe(CN)5NO]•2H2O дает оранжево-красное](/img/thumbs/169e57a4e46c6ddedf9eef5fe54ee8ba-800x.jpg)