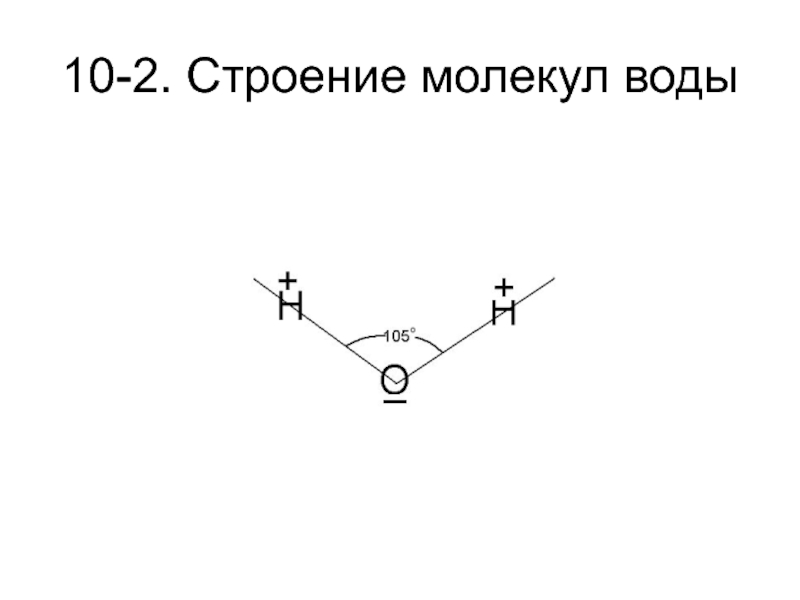
Слайд 210-1. Свойства воды
Вода в природе.
Высокая растворяющая способность (в воде растворяется
наибольшее количество веществ).
Способность присоединяться к молекулам многих веществ.
Обеспечивает диссоциацию веществ.
Высокая
теплоемкость.
Особое поведение при изменении температуры.
Многие другие особенности.
Слайд 410-3. Вода в организме человека
-содержание и распределение между отдельными органами
и тканями,
-состояния, в которых находится вода в организме
(свободная, связанная, иммобильная),
-роль воды в организме
Слайд 510-4. Роль воды в организме человека
Структурная.
Транспортная.
Терморегуляторная.
Участник многих химических реакций.
Обеспечивает диссоциацию
многих веществ на ионы.
Внутренняя среда, в которой происходят практически все
реакции.
Слайд 611-1. Понятие о дисперсных системах
ДС – системы, состоящие их 2-х
или более компонентов (веществ), которые раздроблены до мелких частичек и
равномерно перемешаны.
В дисперсных системах различают дисперсионную среду и дисперсную фазу
Слайд 711-2. Примеры дисперсных систем
Слайд 811-3. Водно-дисперсные системы
Для человека наиболее важны водно-дисперсные системы, в которых
дисперсионная среда – вода.
Представителями таких систем являются кровь, лимфа, межклеточная
жидкость, протоплазма клеток, моча и др.
С водно-дисперсными системами постоянно сталкиваемся в повседневной жизни.
Слайд 911-4. Классификация водно-дисперсных систем (по размеру дисперсной фазы)
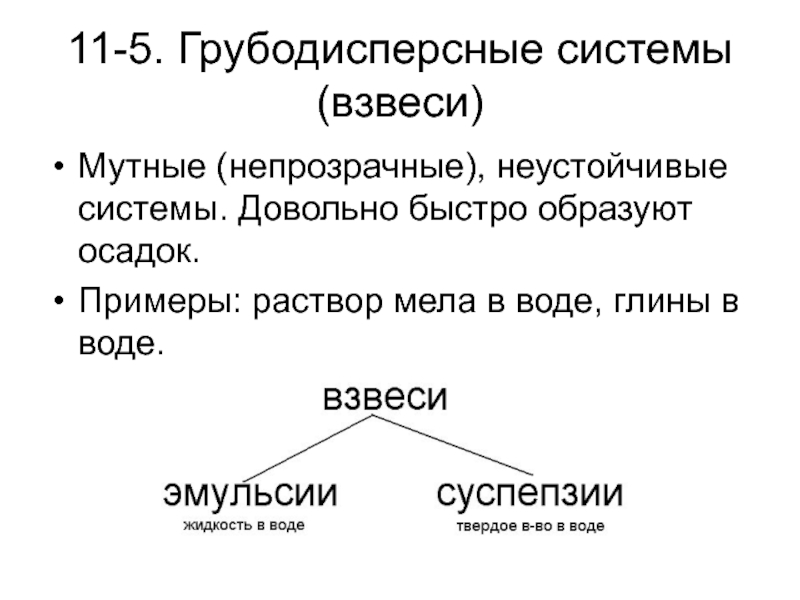
Слайд 1011-5. Грубодисперсные системы (взвеси)
Мутные (непрозрачные), неустойчивые системы. Довольно быстро образуют
осадок.
Примеры: раствор мела в воде, глины в воде.
Слайд 1111-6. Коллоидные растворы
Отличительные особенности: мутные, хорошо виден луч света, относительно
стабильны (осадок выпадает только при каком либо воздействии – например,
добавлении водоотнимающего средства: соли, спирта).
Коллоидные растворы образуют высокомолекулярные вещества: белки, полисахариды.
Слайд 1210-7. Истинные растворы
Растворы низкомолекулярных веществ. Растворенные вещества распадаются до молекул.
Прозрачные,
но могут иметь окраску. Устойчивы даже при длительном стоянии.
Ионные растворы
– когда молекулы низкомолекулярных веществ распадаются на ионы.
Слайд 1311-8. Способы выражения концентрации растворов
Концентрация - количество растворенного вещества в
определенном весовом или объемном количестве раствора или растворителя.
Процентная (массовая доля)
-
определяется количеством весовых частей растворенного вещества в 100 весовых частях раствора.
Концентрации: г%, мг%
Слайд 1411-9. Молярная концентрация
Определяется количеством молей растворенного вещества в 1 литре
раствора.
Бывают 1М; 0,1М; 0,5М; миллимолярные -(1ММоль) и т.д. растворы.
Равные объемы растворов одинаковой молярной кон-ции содержат одинаковое количество молекул растворенного в-ва
Слайд 1511-10. Водно-дисперсные системы организма человека
Кровь
Лимфа
Протоплазма клеток
Слайд 1612-1. Электролитическая диссоциация
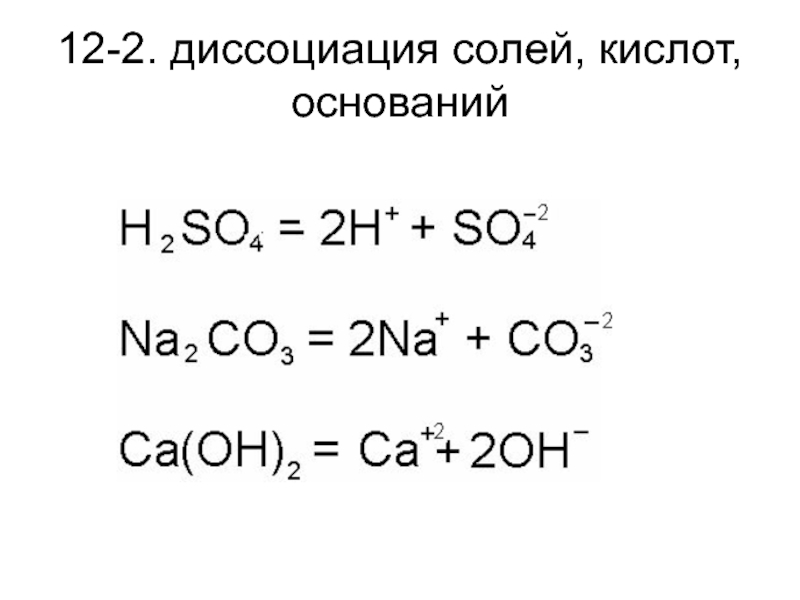
Э.Д. – распад молекул солей, кислот и оснований
на заряженные частички – ионы в водных растворах или в
расплавленных состояниях.
Диссоциации могут подвергаться молекулы с ионной или ковалентной полярной связями. Причина диссоциации – влияние полярных молекул воды, которые ослабляют связи между фрагментами молекул.
Слайд 1712-2. диссоциация солей, кислот, оснований
Слайд 1812-3. степень диссоциации
Степень диссоциации – определяется процентом диссоциировавших на ионы
молекул. Различают:
-сильные электролиты (диссоциирует > 30% молекул),
-слабые (< 3% молекул).
Ступенчатая диссоциация.
Отличие ионов от атомов и молекул:
наличие заряда, хим. активность, по физическим свойствам, биологич. воздействию.
Слайд 1913-1. Активная реакция среды
В водных растворах может быть три вида
активной реакции среды:
кислая , щелочная, нейтральная
В
чем их отличие?
-кислые свойства определяются присутствием ионов водорода
-щелочные – присутствием гидроксильных ионов
Слайд 2013-2. Активная реакция среды
Вода является слабым электролитом и часть молекул
воды находится в диссоциированном состоянии.
Реакция среды в водных растворах определяется соотношением ионов водорода и гидроксила.
В кислой среде преобладают ионы водорода, в щелочной – гидроксила.
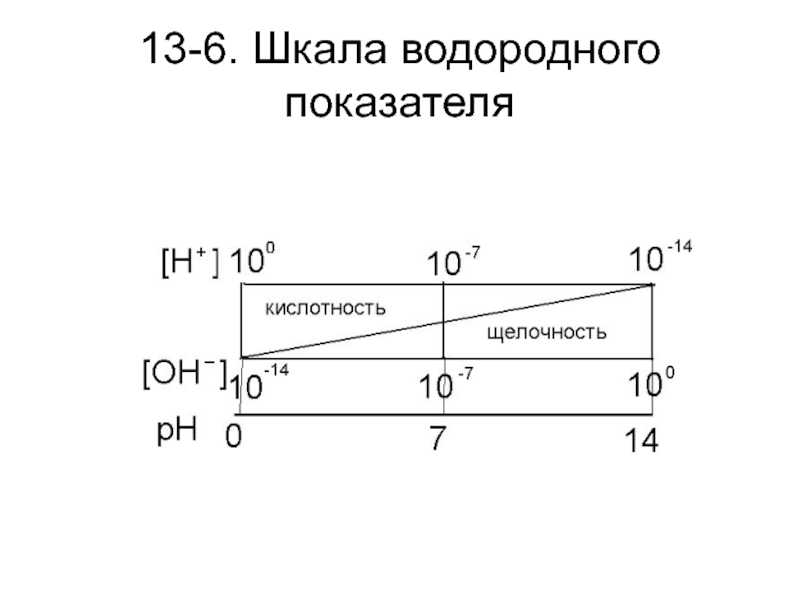
Слайд 2113-3. Ионное произведение воды
Для воды и водных растворов характерна следующая
особенность:
произведение концентраций ионов водорода и гидроксила является постоянной
величиной:
Слайд 2213-4. Кон-ция ионов водорода и гидроксила в разных средах
Слайд 2313-5. Водородный показатель (рН)
Слайд 2413-6. Шкала водородного показателя
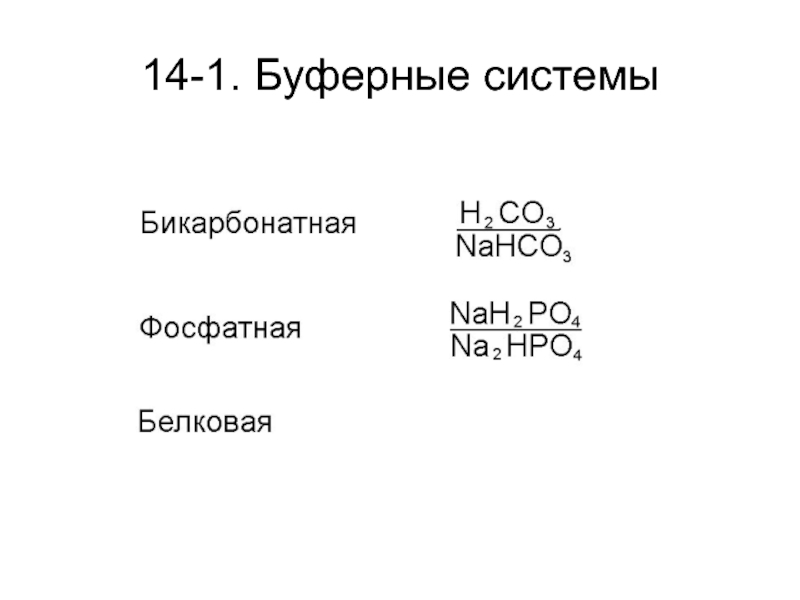
Слайд 2714-3. Поддержание постоянства рН
В поддержании постоянства реакции внутренней среды в
организме человека участвуют легкие и почки.
Через легкие выводится углекислый газ,
что снижает концентрацию угольной кислоты в организме.
Через почки устраняется ион водорода.
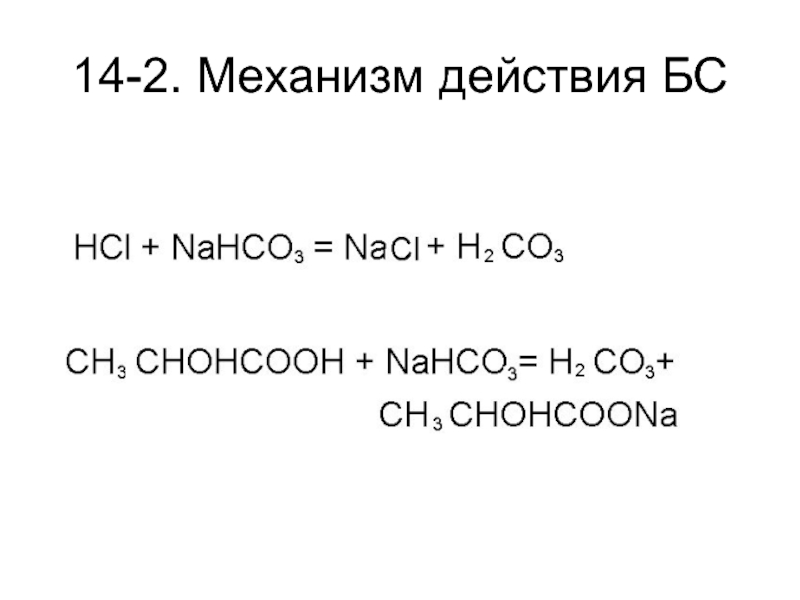
Слайд 2814-4. Спортивная тренировка и буферные системы
Под влиянием систематической тренировки, связанной
с накоплением молочной кислоты, возможности буферных систем (буферная емкость) существенно
повышаются.
Буферная емкость один из факторов, определяющих выносливость в упражнениях субмаксимальной мощности.
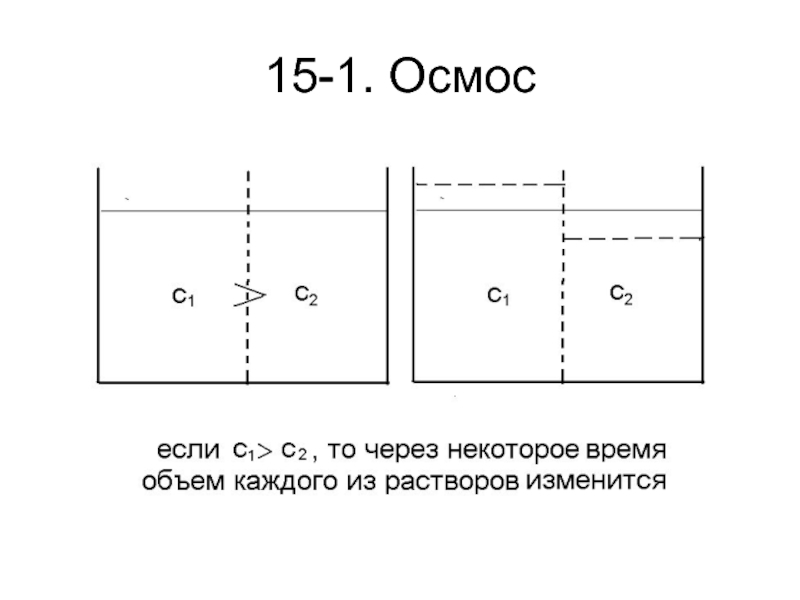
Слайд 3015-2. Осмотическое давление
Осмос – это односторонняя диффузия растворителя из раствора
меньшей (молярной) концентрации в раствор большей концентрации через полупроницаемую перегородку.
Сила,
вызывающая осмос, называется осмотическим давлением.
Оно зависит от молярной концентрации раствора, температуры по абсолютной шкале (273 + t по Цельсию) и т.н. газовой постоянной
Слайд 3115-3. Осмотическое давление
Росм = RТС, где
R – т.н.
газовая постоянная равная
8,314
кПа литр/градус моль
Т – температура по абсолютной шкале,
С – молярная концентрация раствора.
Главными факторами, определяющими осмотическое давление раствора, являются концентрация и температура.
Слайд 3215-4. Характеристика осмотического давления
Осмотическое давление выше в растворе большей концентрации.
Вода
перемещается из раствора с меньшим осмотическим давлением в раствор с
большим осмотическим давлением.
Поэтому осмотическое давление называют сосущей силой.
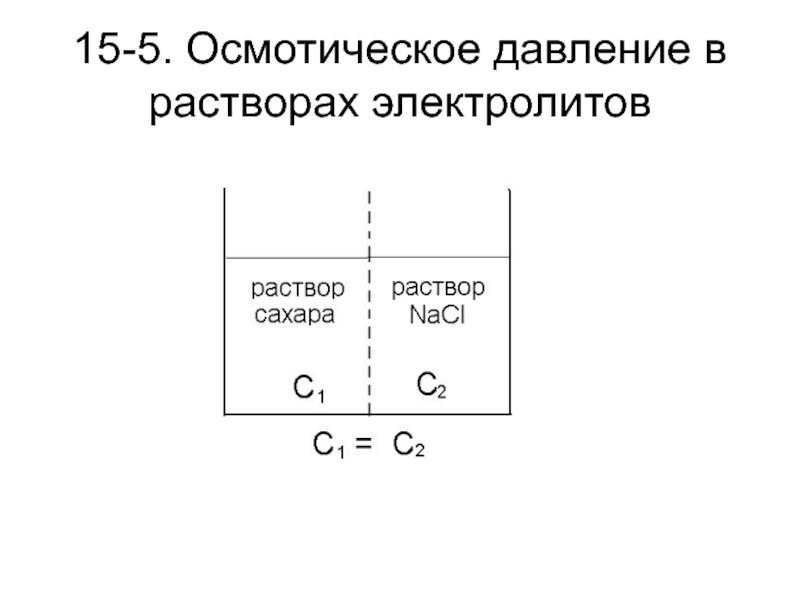
Слайд 3315-5. Осмотическое давление в растворах электролитов
Слайд 3415-6. Осмотическое давление в растворах электролитов
Осмотическое давление в растворах электролитов
всегда выше осмотического давления в растворах не электролитов той же
молярной концентрации.
Причина – молекулы электролитов диссоциируют на ионы, т.е. в растворе электролита больше частичек растворенного вещества.
Слайд 3515-7. Осмотические явления в организме человека
Практически все перемещения воды в
организме осуществляются по законам осмоса.
Образование молочной кислоты при мышечной работе.
Травмы
и ушибы.
Понятие об изотонических, гипертонических и гипотонических растворах. Тургор.