Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Изотопная геохимия нефти и газа
Содержание
- 1. Изотопная геохимия нефти и газа
- 2. Основной геохимический закон В.М. Гольдшмидта гласит: кларки элементов
- 3. Ядро состоит из нуклонов - положительно заряженных
- 4. Если необходимо показать количество нуклонов и массовое
- 5. Структура ядра однозначно не расшифрована Экспериментально установлено,
- 6. Наиболее устойчивы элементы начала таблицы, у которых соотношение протонов и нейтронов равно единице
- 7. Самые устойчивые ядра с четным количеством протонов
- 8. Ядра у которых количество протонов или нейтронов
- 9. Диаграмма нуклидов: изотопы, изотоны, изобарыв 1918 г.
- 10. Классификация нуклидов1. Стабильные нуклиды.2. Долгоживущие природные нестабильные
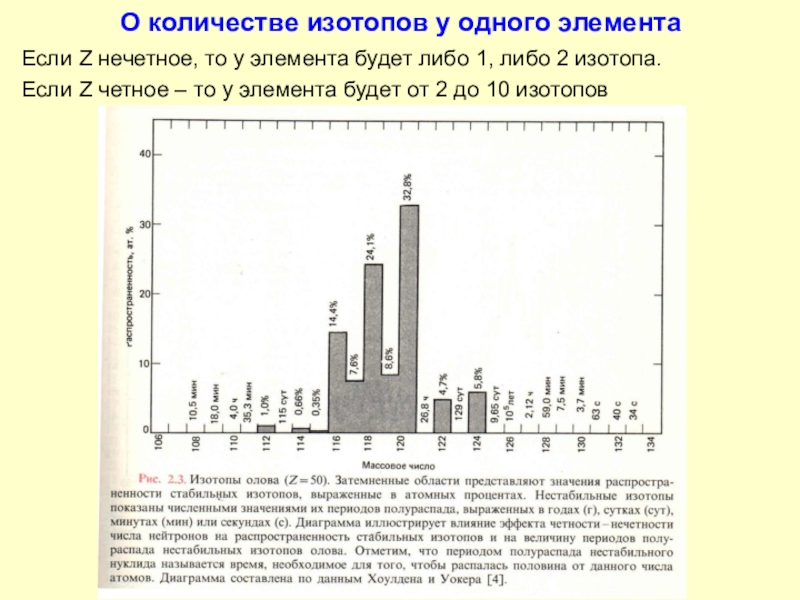
- 11. О количестве изотопов у одного элементаЕсли Z
- 12. Скачать презентанцию
Основной геохимический закон В.М. Гольдшмидта гласит: кларки элементов зависят от строения атомного ядра, а их миграция – от наружных электронов, определяющих химические свойства элементов.Ядра химических элементов характеризуются отсутствием четких границ, малыми размерами
Слайды и текст этой презентации
Слайд 2Основной геохимический закон В.М. Гольдшмидта гласит: кларки элементов зависят от строения
атомного ядра, а их миграция – от наружных электронов, определяющих
химические свойства элементов.Ядра химических элементов характеризуются отсутствием четких границ, малыми размерами 10-13 – 10-14 см, значительной массой (практически равной массе атома) и очень высокой плотностью 3600 млн. – 1 млрд. тонн / см3.
Для сравнения: размеры атомов в среднем 10-8 см (1 ангстрем).
Слайд 3Ядро состоит из нуклонов - положительно заряженных протонов (z) и
не имеющих заряда нейтронов (n).
Массы протона и нейтрона примерно
равны и составляют 1/12 часть атомной массы углерода или 10-24 грамм (1 дальтон). Количество протонов в ядре элемента совпадает с порядковым номером химического элемента в периодической таблице Менделеева и определяет суммарный положительный заряд ядра.
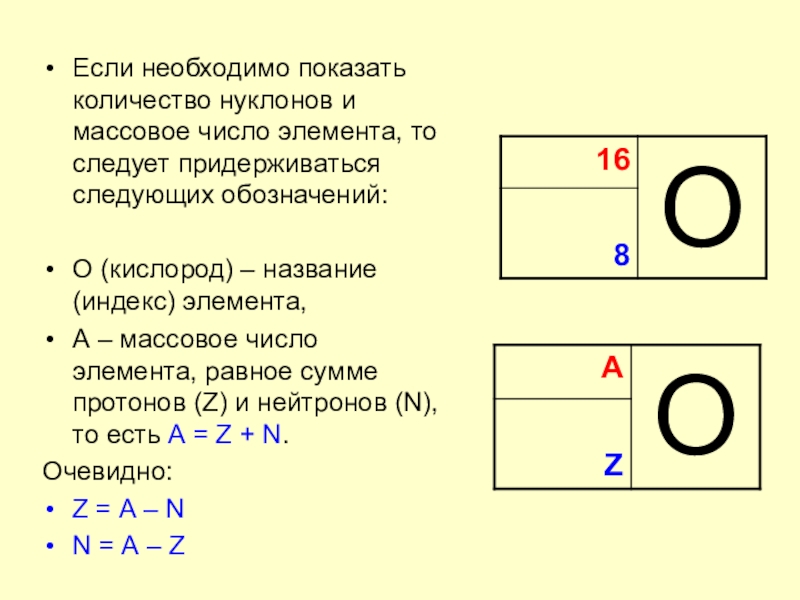
Слайд 4Если необходимо показать количество нуклонов и массовое число элемента, то
следует придерживаться следующих обозначений:
О (кислород) – название (индекс) элемента,
А – массовое число элемента, равное сумме протонов (Z) и нейтронов (N), то есть А = Z + N.
Очевидно:
Z = А – N
N = А – Z
Слайд 5Структура ядра однозначно не расшифрована
Экспериментально установлено, что масса протонов
и нейтронов в ядре всегда меньше их общей массы. Такое
явление называется дефектом масс и объясняется переходом массы в энергию, которая делает ядро устойчивым. Таким образом: чем больше дефект масс – тем устойчивее ядро.Между количеством протонов и нейтронов существует определенный баланс при нарушении которого ядро становится неустойчивым. Начиная с элемента № 83 (Bi) даже дополнительные нейтроны не делают ядро устойчивым.
Слайд 6Наиболее устойчивы элементы начала таблицы, у которых соотношение протонов и
нейтронов равно единице
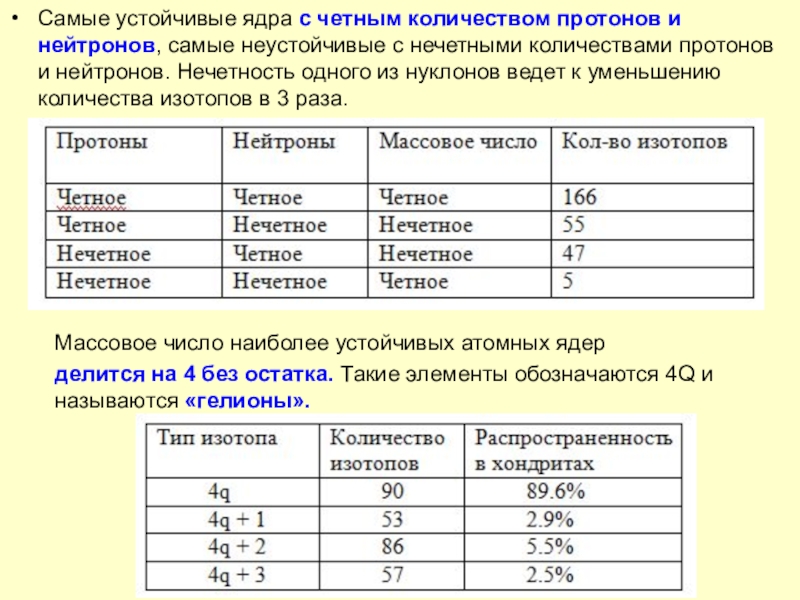
Слайд 7Самые устойчивые ядра с четным количеством протонов и нейтронов, самые
неустойчивые с нечетными количествами протонов и нейтронов. Нечетность одного из
нуклонов ведет к уменьшению количества изотопов в 3 раза.Массовое число наиболее устойчивых атомных ядер
делится на 4 без остатка. Такие элементы обозначаются 4Q и называются «гелионы».
Слайд 8Ядра у которых количество протонов или нейтронов равно 2, 8,
20, 28, 50, 82, 126 - называются магическими.
Дваждымагические ядра
имеют магическое число и протонов и нейтронов. Общий ряд магических ядер:
24He, 816O, 2040Ca, 2860Ni, 3888Sr, 50120Sn, 56138Ba, 82208Pb
В этом ряду He, O, Ca, Pb дваждымагические, они самые устойчивые и важные из всех элементов.
He – элемент космоса, О и Са распространенные элементы земной коры.
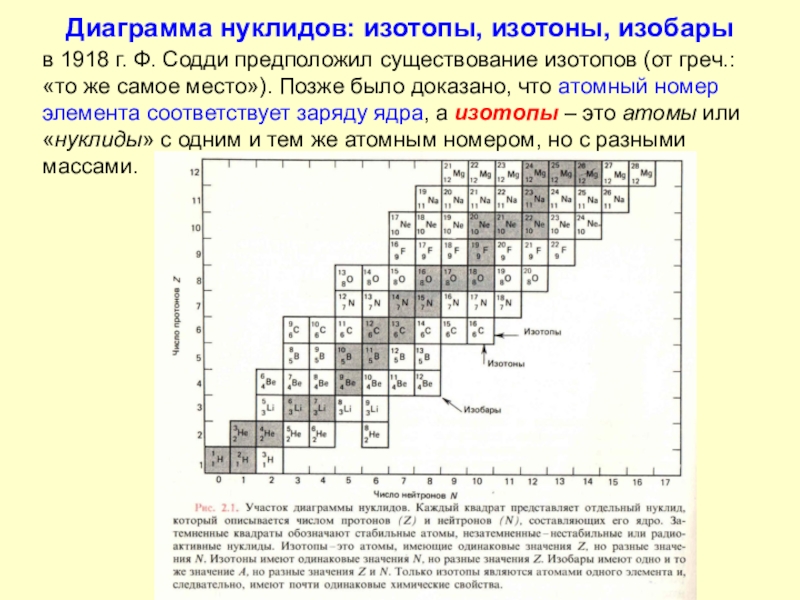
Слайд 9Диаграмма нуклидов: изотопы, изотоны, изобары
в 1918 г. Ф. Содди предположил существование
изотопов (от греч.: «то же самое место»). Позже было доказано,
что атомный номер элемента соответствует заряду ядра, а изотопы – это атомы или «нуклиды» с одним и тем же атомным номером, но с разными массами.Слайд 10Классификация нуклидов
1. Стабильные нуклиды.
2. Долгоживущие природные нестабильные нуклиды
3. Короткоживущие природные
нестабильные нуклиды.
4. Короткоживущие нестабильные нуклиды не встречающиеся в природе.
Численность нуклидов
1
группа – 273 нуклидов2 группа + 3 группа – 67 нуклидов
Всего в природе обнаружены 340 нуклидов
4 группа – 1360 нуклидов
Всего известно около 1700 нуклидов всех химических элементов