Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбонові кислоти та їх функціональні похідні
Содержание
- 1. Карбонові кислоти та їх функціональні похідні
- 2. Класифікація карбонових кислот. Карбонові кислоти – похідні
- 3. Залежно від кількості карбоксильних груп, розрізрізняютьт.-монокарбонові кислоти
- 4. Насичені монокарбонові кислотиметанова (мурашина) кислота НСООН (Acidum
- 5. Дикарбонові насичені кислоти (містять дві –СООН групи)Етандіова
- 6. Ароматичні монокарбонові кислотиКислоти, у яких карбоксильна група
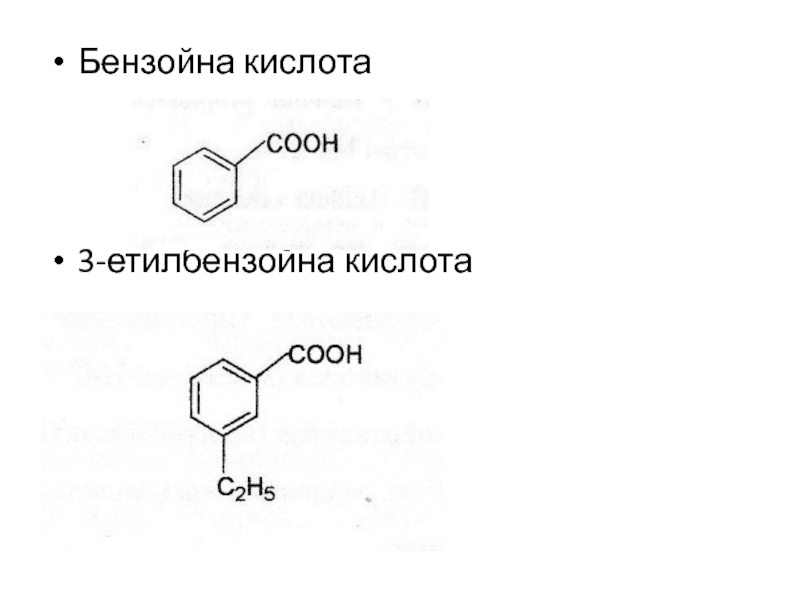
- 7. Бензойна кислота3-етилбензойна кислота
- 8. Трикарбонові кислоти (містять три карбоксильні групи -СООН)Прикладом
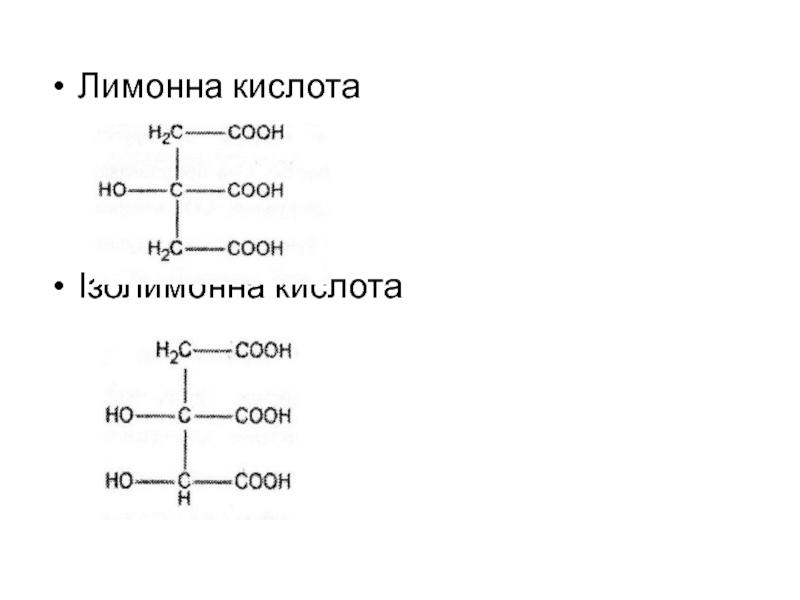
- 9. Лимонна кислотаІзолимонна кислота
- 10. Вищі жирні кислоти (ВЖК) (містять 10-22 атомів
- 11. Ненасичені карбонові кислоти найчастіше містять у своєму
- 12. Хімічні властивості насичених монокарбонових кислотХімічні властивості карбонових
- 13. Кислота (по Бренстеду) – донор протона, а
- 14. Сила карбонових кислот залежиться від будови вуглеводневих
- 15. Оцтова кислота Монохлороцтова кислотаДихлороцтова кислотаТрихлороцтова кислота
- 16. Щавлева кислота сильніша оцтової: НООС-СООН
- 17. Реакції нуклеофільного заміщенняЗагальна схема Sn –реакцій:
- 18. Характерними типами реакцій для карбонових кислот являються
- 19. Найбільш поширеною реакцією в хімічних та біологічних
- 20. Ненасичені монокарбонові кислоти по карбоксильній групі ненасичених
- 21. 2) якісна реакція ненасиченість – реакція Вагнера (окиснення КМnO4 в слабко лужному або нейтральному середовищі):9,10-дигідроксостеариновакислота
- 22. 3) доказом розташування подвійного зв'язку в олеїновій
- 23. Дикарбонові кислоти проявляють всі властивості монокарбонових кислот,
- 24. Особливими властивостями є їхні відношення до нагрівання.Перші
- 25. Наступні представники дикарбонових кислот при нагріванні дегідратуються
- 26. До ненасичених дикарбонових кислот відноситься малеїнова та
- 27. Карбоксильна група являється електроно-акцепторним замісником, знижує електронну
- 28. Галогенкарбонові кислотиявляються вихідними речовинами для синтезу біологічно
- 29. Гетерофункціональні сполуки. Ізомерія.Багато органічних сполук містять в
- 30. Енантіомери – це дві асиметричні молекули, котрі
- 31. Для зображення енантіомерів на площині використовують проекційні
- 32. Протилежне розміщення гідроксо-групи приводить до утворення стереоізомера D-ряду:
- 33. Напрямок відхилення площини поляризації світла (+) або
- 34. Хімічні властивості гетерофункціональних сполук.Загальні властивості окси- та
- 35. Такі реакції оборотні;оскільки циклічні похідні окси- та
- 36. Гідроксикислоти – похідні карбонових кислот, в структурі
- 37. Найпоширенішими представниками природних гідроксикислот є:
- 38. Винна кислота містить два хіральні атоми вуглецю
- 39. Перший та другий стереоізомери являються енантіомерами, дзеркальними
- 40. Слайд 40
- 41. D-(+)- винна кислота міститься у багатьох рослинах:
- 42. Хімічні властивості гідроксикислотХімічні властивості гідроксикислот визначаються наявністю
- 43. По карбоксильній групі гідроксикислоти вступають в
- 44. По гідроксильній групі гідроксикислоти утворюють алкоголяти, прості
- 45. Дегідратація гідроксикислот. Лактиди. Дактони. Як і амінокислоти,
- 46. 3) γ-, δ-гідроксикислоти з більш віддаленим розташуванням
- 47. Оксокислоти Похідні карбонових кислот, котрі містять у
- 48. Піровиеонрадна кислота – проміжний продукт обміну вуглеводів,
- 49. Важливу роль в біохімічних процесах грає
- 50. При деяких патологічних станах (цукровий
- 51. Ацетооцтова кислота утворюється в житті в процесі
- 52. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Залежно від кількості карбоксильних груп, розрізрізняютьт.
-монокарбонові кислоти – мають 1
карбоксильну групу (-СООН);
-дикарбонові кислоти – з 2 карбоксильними групами (-СООН);
-трикарбонові
кислоти – з 3 карбоксильними групами (-СООН);-полікарбонові кислоти – містять більше 3 карбоксильних груп (-СООН).
Слайд 4Насичені монокарбонові кислоти
метанова (мурашина) кислота НСООН (Acidum formicum);
Етанова (оцтова) кислота
Н3С-СООН (Acidum aceticum);
Пропанова (пропіонова) кислота Н3С-СН2-СООН (Acidum propionicum);
Бутанова (масляна) кислота
Н3С-(СН2)2-СООН (Acidum butricum);Пентанова (валеріанова) кислота Н3С-(СН2)3-СООН (Acidum valericum);
Гексанова (капронова) кислота Н3С-(СН2)4-СООН
Слайд 5Дикарбонові насичені кислоти
(містять дві –СООН групи)
Етандіова (щавлева) кислота
НООС-СООН;
Пропандіова (малонова)
кислота НООС-СН2-СООН;
Бутандіова (бурштинова) кислота
НООС-(СН)2-СООН;Пентандіова (глутарова) кислота НООС-(СН2)3-СООН;
Слайд 6Ароматичні монокарбонові кислоти
Кислоти, у яких карбоксильна група безпосередньо звязана з
ароматичним кільцем.
До них відносяться бензойна кислота та її похідні(3-етилбензойна,
фенілбензойна), котрі поширені в клітинахорганізмів. Ці сполуки є продуктами нормального обміну речовин або утворюються в організмі людини в результаті біотрансформації чужорідних хімічних речовин – ксенобіотиків: лікарських препаратів, отрут. Сама бензойна кислота та її солі використовуються в медицині для синтезу лікувальних речовин, також як антисептик.Слайд 8Трикарбонові кислоти
(містять три карбоксильні групи -СООН)
Прикладом є Лимонна кислота (Acidum
citricum) – біологічно важливий представник обміну речовин рослинного та тваринного
світу (існує «цикл лимонної кислоти» в мітохондріях – ЦТК). Вона використовується в харчовій промисловості, а цитрат натрію являється фармацевтичним препаратом, котрий використовується як консервант, а також вона протидіє поза судинному згортанню крові. Знаходиться у великих кількостях у плодах цитрусових рослин (лимони. Апельсини), а також винограді.Слайд 10Вищі жирні кислоти (ВЖК)
(містять 10-22 атомів карбону)
Пальмітинова кислота – С15Н31СООН
Стеаринова
кислота – С17Н35СООН
Олеїнова (мононенасичена) кислота – С17Н33СООН
Лінолева (диненасичена) кислота –
С17Н31СоонЛіноленова (триненасичена) кислота – С17Н29СООН
Арахідонова (тетраненасичена) кислота – С19Н31СООН
Слайд 11Ненасичені карбонові кислоти найчастіше містять у своєму складі від одної
до трьох подвійних звязків, у вигляді цис-ізомерів входять до складу
ліпідів. Поліненасичені кислоти, на відміну від насичених, не синтезуються в організмі, і людина повинна отримувати їх з їжею, в основному з рослинними оліями. Важливу роль в організмі відіграє арахідонова кислота – представник простогландинів, простоциклінів, тромбоксинів, лейкотринів – сильнодіючих біорегуляторів-ейкозаноїдів.Частина молекули карбонової кислоти без гідроксильної групи називається ацильним остатком. В систематичних назвах ацильних залишків суфікс –ова кислота замінюється суфіксом –оіл. Назви кислотних радикалів звязані з латинськими назвами відповідних кислот: R-COOH – карбонова кислота, R-CO- ацил; радикал оцтової кислоти – ацил, мурашинової кислоти – форміл, бензойної кислоти – бензоіл і т.д.
Слайд 12Хімічні властивості насичених монокарбонових кислот
Хімічні властивості карбонових кислот зумовлені, в
основному, наявнічтю карбоксильної групи, котра, на відміну від інших функціональних
груп, містять більш складну будову. Вона представляє собою співвідношення гідроксильної групи –ОН з оксогрупою –СО-, котрі взаємно впливають один на одного. В середині самої функціональної групи знаходиться спряження, котре утворюється за рахунок перекривання p-орбіталі атома оксигену гідроксильної групи з р-орбіталлю атома вуглецю карбоксильної групи. В результаті р-π-спряження відбувається делокалізація неподіленої пари електронів атома оксигену гідроксильноїгрупи. Карбоксильна група по відношенню до –ОН групи виступаю в ролі електроноакцептора. Зв’язок між оксигеном та гідрогеном в групі –ОН сильно поляризована, на атомі гідрогену виникає високий частковий позитивний заряд (δ=), і він легко відщеплюється від протона гідрогену (Н⁺):R-COOH →H⁺ + R-COO⁻ (карбоксилат аніон)
Слайд 13Кислота (по Бренстеду) – донор протона, а основа – акцептор
протона, тому і кислотні властивості карбонових кислот зв'язані зі здатністю
атома водню карбоксильної групи відщеплюватися у вигляді протона.Сила карбонових кислот залежить від стабкості аніона, утворюється після відриву протона. Стабільність аніона перш за все визначається ступенем делокації негативного заряду: чим вищий ступінь деполяризації. Тим слабший аніон. Завдяки повній делокалізації негативного заряду, карбоксилат-іон володіє достатньо високою стабільністю. Тому карбонові кислоти значно перевищують по кислотності спирти та феноли.
Слайд 14Сила карбонових кислот залежиться від будови вуглеводневих радикалів і замісників
в них. Електронноакцепторні відновники, відтягуючи електронну хмару, сприяють делокалізації негативного
заряду в карбоксилат-іоні та цим самим стабілізує його.Наприклад, при послідовному введенні у вуглеводневий радикал оцтової кислоти атомів хлору кислотність буде збільшуватися за рахунок електронноакцепторних властивостей атома хлору:
Слайд 16Щавлева кислота сильніша оцтової: НООС-СООН > Н3С-СООН.
Дикарбонові кислоти
сильніші, ніж монокарбонові, а ароматичні сильніші, ніж аліфатичні за рахунок
великої системи спряження.Галогенкарбонові кислоти сильніші монокарбонових. Кислотність проявляється в реакціях утворення солей:
С17Н35СООН + NaОН→С17Н35СООNa + Н2О.
стеарат натрію(мило)
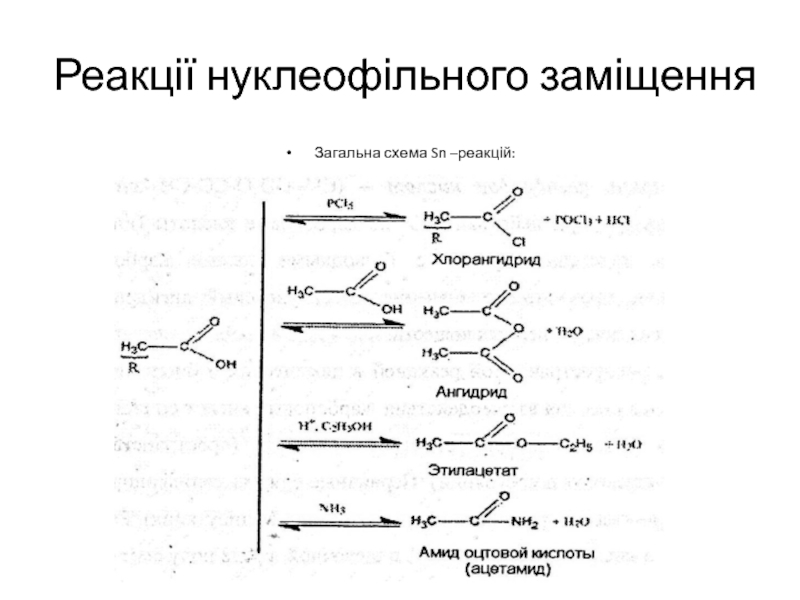
Слайд 18Характерними типами реакцій для карбонових кислот являються реакції нуклеофільного заміщення
з утворенням відповідних функціональних похідних:
1) утворення складних ефірів – (етилацетат
– СН3-СО-О-С2Н5) – реакція етерифікації (ацилування спирту кислотою) і зворотня реакція гідроліз складного ефіру. Гідроліз складних ефірів може здійснитися як в кислому так і в лужному середовищі: в кислому середовищі відбувається утворення карбонової кислоти та спирту, в лужному середовищі утвориться сіль та спирт. Лужний гідроліз ефірів називають також омилення (солі ВЖК, що утворюються при лужному гідролізі, називають милами).2) утворення амінів кислот – (СН3-СО-NH2 - ацетамід), котрі утворюються при ацилюванні аміаку та амінів ангідридами і хлорангідридами кислот, а також складними ефірами. Аміди – це функціональні похідні карбонових кислот, в котрих гідроксильна група замінена на аміногрупу.
3) утворення хлорангідридів – (СН3-СО-СІ хлорангідрид оцтової кислоти) утворюється при дії на карбонові кислоти хлоридом фосфору (ІІІ) та фосфору (V).
4) утворення ангідридів кислот – (СН3-СО-О-СО-СН3 ангідрид оцтової кислоти) – при дії Р2О5 на карбонові кислоти(або при взаємодії галоген гідридів з безводними солями карбонових кислот). Велике практичне значення має оцтовий ангідрид для отримання багатьох лікувальних речовин.
Слайд 19Найбільш поширеною реакцією в хімічних та біологічних системах є реакція
взаємодії карбонових кислот зі спиртами. Швидкість цієї реакції залежить від
будови спирту (просторове затримання в перехідному стані). Первинні спирти етерифікуються легше, рніж вторинні та третинні спирти (правило Маншутніка). Реакція етерифікації в каслому середовищі оборотня, в лужному середовищі утворюється сіль та спирт. Гідроліз складних ефірів – ліпідів в шлунково-кишковому тракті та клітинах живого організму здійснюється при допомозі специфічних ферментів класу гідролаз ліпаза.Слайд 20Ненасичені монокарбонові кислоти по карбоксильній групі ненасичених карбонових кислот вступають у
такі самі, що і насичені. Відмінною їхньою особливістю являються реакції
з участю радикалу.1) якісна реакція на ненасиченість – взаємодія олеїнової кислоти з бромною водою:
9,10-дибромметеаринова кислота
Слайд 212) якісна реакція ненасиченість – реакція Вагнера (окиснення КМnO4 в
слабко лужному або нейтральному середовищі):
9,10-дигідроксостеаринова
кислота
Слайд 223) доказом розташування подвійного зв'язку в олеїновій кислоті – окиснення
в кислому середовищі при нагріванні:
Нонандіова кислота
Слайд 23Дикарбонові кислоти проявляють всі властивості монокарбонових кислот, тільки реакції проходять
у два етапи: утворюють кислі та середні солі, неповні та
повні галогенангідриди, аміди, складні ефіри.Слайд 24Особливими властивостями є їхні відношення до нагрівання.
Перші представники гомологічного ряду
дикарбонових кислот при нагріванні втрачають вуглекислий газ (декарбоксилювання), утворюють монокарбонові
кислоти з меньшою кількістю атомів вуглецю в ланцюгу:Щавлева кислота Мурашина кислота
Малонова кислота Оцтова кислота
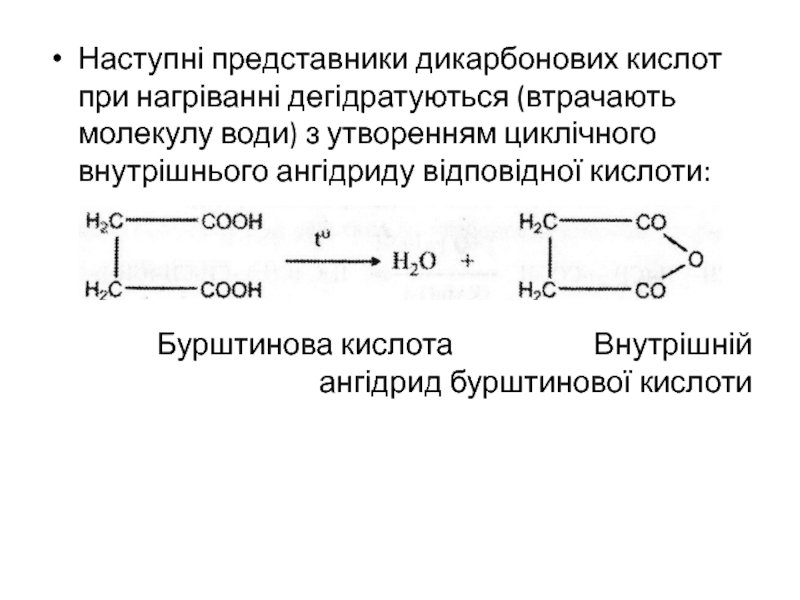
Слайд 25Наступні представники дикарбонових кислот при нагріванні дегідратуються (втрачають молекулу води)
з утворенням циклічного внутрішнього ангідриду відповідної кислоти:
Бурштинова кислота
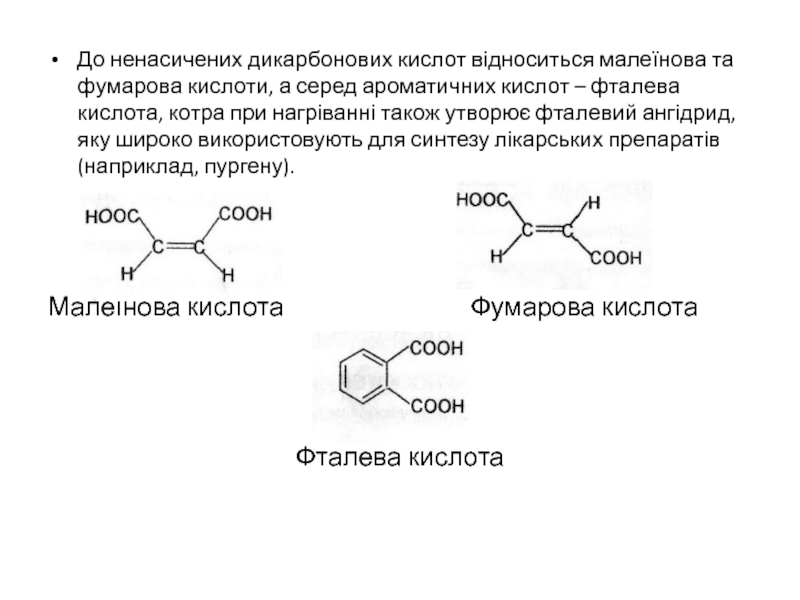
Внутрішній ангідрид бурштинової кислотиСлайд 26До ненасичених дикарбонових кислот відноситься малеїнова та фумарова кислоти, а
серед ароматичних кислот – фталева кислота, котра при нагріванні також
утворює фталевий ангідрид, яку широко використовують для синтезу лікарських препаратів (наприклад, пургену).Малеїнова кислота Фумарова кислота
Фталева кислота
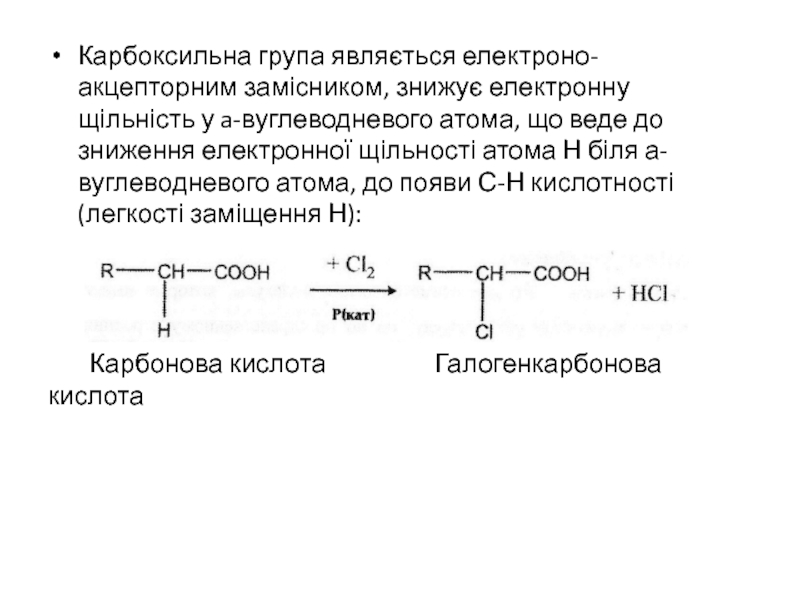
Слайд 27Карбоксильна група являється електроно-акцепторним замісником, знижує електронну щільність у a-вуглеводневого
атома, що веде до зниження електронної щільності атома Н біля
а-вуглеводневого атома, до появи С-Н кислотності (легкості заміщення Н):Карбонова кислота Галогенкарбонова кислота
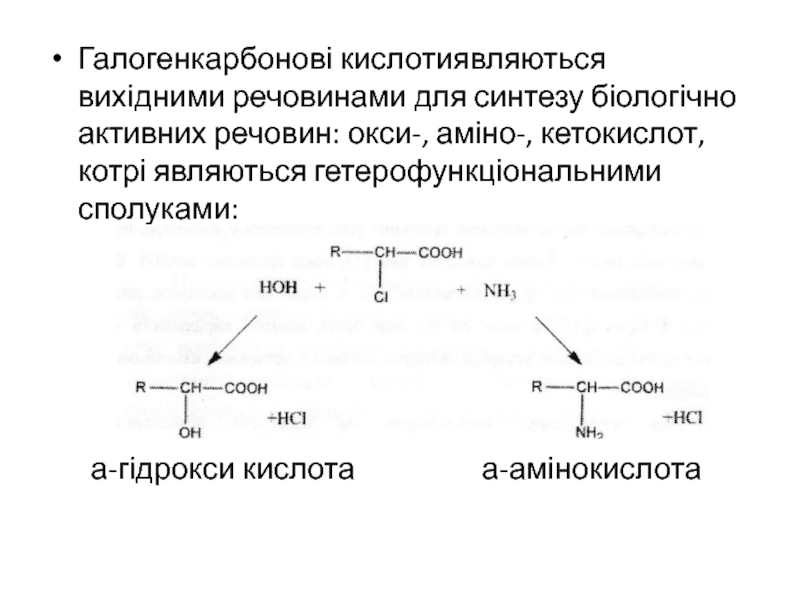
Слайд 28Галогенкарбонові кислотиявляються вихідними речовинами для синтезу біологічно активних речовин: окси-,
аміно-, кетокислот, котрі являються гетерофункціональними сполуками:
а-гідрокси кислота
а-амінокислотаСлайд 29Гетерофункціональні сполуки. Ізомерія.
Багато органічних сполук містять в молекулах одночасно різні
функціональні групи.вони відносяться до гетерофункціональних сполук, котрі трапляються в рослинному
та тваринному світах, а також деякі з них являються лікарськими речовинами. Серед них амінокислоти, аміноспирти, гідроксикислоти, оксикислоти.Ізомерія цих сполук буває структурною та просторова-стереоізомерія, котра пов'язана з відмінностями в просторовому розміщенні атомів в молекулах речовин, що містять однаковий склад та будову. Стереоізомери, або просторові ізомери діляться на конформаційні (зигзагоподібні, розгалужені конформації вуглеводневих ланцюгів) і конфігураційні: енантіомери (дзеркальні ізомери) та діастереомери.
Слайд 30Енантіомери – це дві асиметричні молекули, котрі містять однакову молекулярну
формулу, але згідно просторової будови відносяться один до одного як
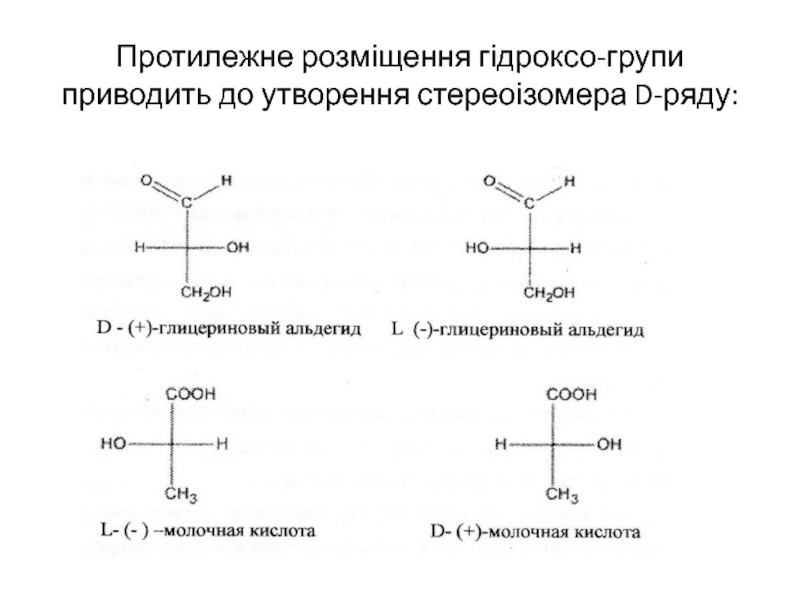
предмет і не сумісне з ним в одній площині дзеркальне зображення. Енантіомери однакові за своїми фізичними та хімічними властивостями, наділені оптичною активністю, але відрізнити їх можна лише з допомогою «хірального» методу дослідження, використовуючи дію на них будь-якого хірального фактору, наприклад поляризованого світла. Значення величини кута повороту однакові, але різного напрямку: правий поворот знак (+), лівий поворот – знак (-).у вигляді енантіомерів можуть існувати лише хіральні молекули, для котрих характерним є наявність одного або кількох центрів хіральності – асиметричних атомів вуглеводню, котрі звязані з чотирма різними замінниками.Слайд 31Для зображення енантіомерів на площині використовують проекційні формули Фішера. Формули
пишуться вертикально. Зверху розташована карбоксильна група. Хіральні атоми вуглеводню переносяться
в точку перенесення горизонтальної та вертикальної лінії і не позначаються символом, зліва та справа від них розташовуються атоми водню і функціональні групи.для позначення конфігурацій оптично активнихсполук використовують еталони – два енантіомери гліцеринового альдегіду D- та L-стереохімічних рядів (для порівняння). Наприклад, у одного з енантіомерів молочної кислоти (1) в проекційній формулі гідрокси група знаходиться зліва, а атом водню – справа, як у L-гліринового ангідриду. Тому енантіомер (1) відносять до L-ряду.
Слайд 33Напрямок відхилення площини поляризації світла (+) або (-) визначається експерментально,
в поляриметрі. Рівномолекулярна суміш двох енантіомерів називається рацематом. Для розділення
рацематів існують кілька способів: хімічні, біохімічні (стереоселективні реакції) та хроматографічні методи.В молекулах багатьох органічних сполук містяться два або більше асиметричних атомів вуглеводню. При цьому зростає кількість конфігураційних стереоізомерів, котрі не являються дзеркальними антиподами. Такі стереоізомери називають діастереоізомери. Їхнє число розраховується за формулою N=2ⁿ, де n- число асиметричних атомів вуглеводню.
Слайд 34Хімічні властивості гетерофункціональних сполук.
Загальні властивості окси- та амінокислот визначаються різними
функціональними групами. По карбоксильнійф групі утворюються солі, складні ефіри, ангідриди,
галогенангідриди, аміди кислот. При декарбоксилюванні оксикислот утворюються спирти, а при декарбоксилюванні амінокислот – аміни. По групі ОН утворюються алкоголяти, прості та складні ефіри, галогенкарбонові кислоти, а в результаті реакції елімінування – ненасичені карбонові кислоти; при окисненні утворюються альдегідо- та кетокислоти. По групі NH2 відбуваються реакції ацилювання, алкілування, дезамінування.Відмінні (специфічні) властивості оксі- та амінокислот спричинені взаємним впливом функцій і проявляються в основному при нагріванні.
Нагрівання сприяє взаємодії гетерофункцій між собою в середині одної молекули (внутрішньомолекулярне), або між двома молекулами (міжмолекулярна взаємодія).
Слайд 35Такі реакції оборотні;оскільки циклічні похідні окси- та амін, кислот легко
гідролізуються з утворенням вихідних продуктів.
При міжмолекулярній взаємодії розмір циклу розширюється
до шестичленного, т.е. найбільш ефективного, на відміну від внутрішньомолекулярної взаємодії функцій у а-похідних, при яких утворюються термодинамічно не стійкі тричленні цикли.Слайд 36Гідроксикислоти – похідні карбонових кислот, в структурі радикалу котрих один
або кілька атомів водню заміщених на гідроксигрупу –ОН.
В залежності від
природи радикалу, гідроксикислоти можуть бути аліфатичними або ароматичними (фенолокислоти). Для гідроксикислот характерна ізомерія структурна та просторова (стереоізомерія).Структурна ізомерія аліфатичних гідроксикислот залежить від взаємодії розташованих карбоксильних та гідроксильних груп:
Розміщення –ОН групи позначається цифрами або буквами грецького алфавіту (α, β, γ, δ і т.д).
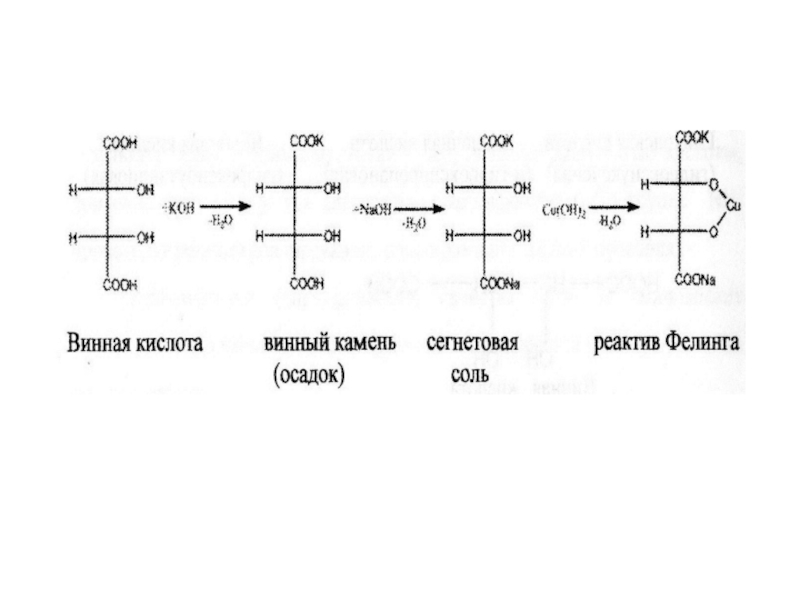
Слайд 38Винна кислота містить два хіральні атоми вуглецю і тому повинно
бути 4 стереоізомери, але відомо лише три: оптичні антиподи D-(+)-винна
кислота, L-(+)-винна кислота, а також їх діастіомер – оптично неактивна мезовинна кислота.Слайд 39Перший та другий стереоізомери являються енантіомерами, дзеркальними антиподами (D- та
L-винні кислоти), мезовинна кислота містить вісь симетрії, тому у неї
немає енентіомера, вона оптично неактивна. По відношенню до D- та L-винної кислоти мезовинна кислота являється діастереомером. Це ізомери що містять протилежно розташоваті атоми груп не у всіх хіральних центрах, відрізняються за своїми фізичними та хімічними властивостями. При дії на сегнетову сіль гідроксиду міді(ІІ) у лужному середовищі утворюється реактив Фелінга (розчин темно-синього кольору), що використовується для визначення альдегідної групи у багатьох важливих органічних речовинах, наприклад, в глюкозі.Слайд 41D-(+)- винна кислота міститься у багатьох рослинах: винограді, горобині. Солі
винної кислоти називають тартратами. Кисла калієва сіль важкорозчинна у воді.
Вона осідаю у винних бочках у вигляді так званого винного каміння. При нейтралізації цієї солі гідроксидом натрію утворюється змішана калієво-натрієва сіль винної кислоти – сегнатова сіль.Гідроксикислоти у вільному вигляді або у складі деяких похідних знаходяться у рослинних та живих обєктах та приймають важливу участь у ряді біохімічних процесів. Яблучна, лимонна, винна кислоти знаходяться у соці багатьох рослин (виноград, горобина, яблука, плоди цитрусових) або продуктах їх переробки. Вони не шкідливі для людини і використовуються в кулінарії, а також при харчовому консервуванні. Саліцилова кислота міститься в корі івових рослин, з давана використовується для лікування запальних процесів.
Більшість природніх гідроксикислот утворюються в організмі при перетворенні вуглеводів, амінокислот, жирних кислот. Являються інтермедіаторами внутрішньоклітинного обміну речовин (яблучна, лимонна, ізолимонна кислоти).
Слайд 42Хімічні властивості гідроксикислот
Хімічні властивості гідроксикислот визначаються наявністю у їхній молекулі
функціональної групи – карбоксильної і гідроксильної. Карбоксильна група визначає кислотні
властивості, а гідроксильна – властивості притаманні спиртам.Слайд 43По карбоксильній групі гідроксикислоти вступають в реакції, характерні для карбонових
кислот: утворюють солі, складні ефіри, аміди, галогенангідриди
1) утворюють солі при
взаємодії з лугами:2) утворюють складні ефіри (реакції етерифікації) при взаємодії зі спиртами:
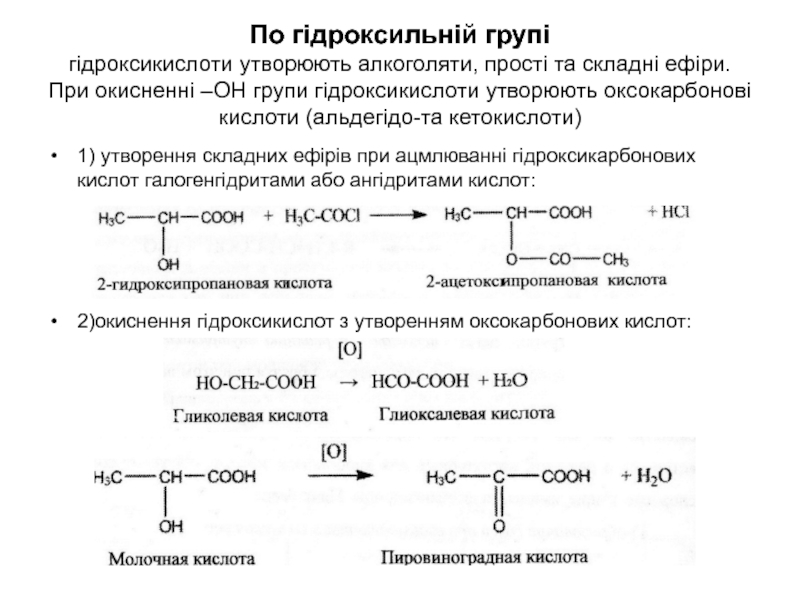
Слайд 44По гідроксильній групі гідроксикислоти утворюють алкоголяти, прості та складні ефіри. При
окисненні –ОН групи гідроксикислоти утворюють оксокарбонові кислоти (альдегідо-та кетокислоти)
1) утворення
складних ефірів при ацмлюванні гідроксикарбонових кислот галогенгідритами або ангідритами кислот:2)окиснення гідроксикислот з утворенням оксокарбонових кислот:
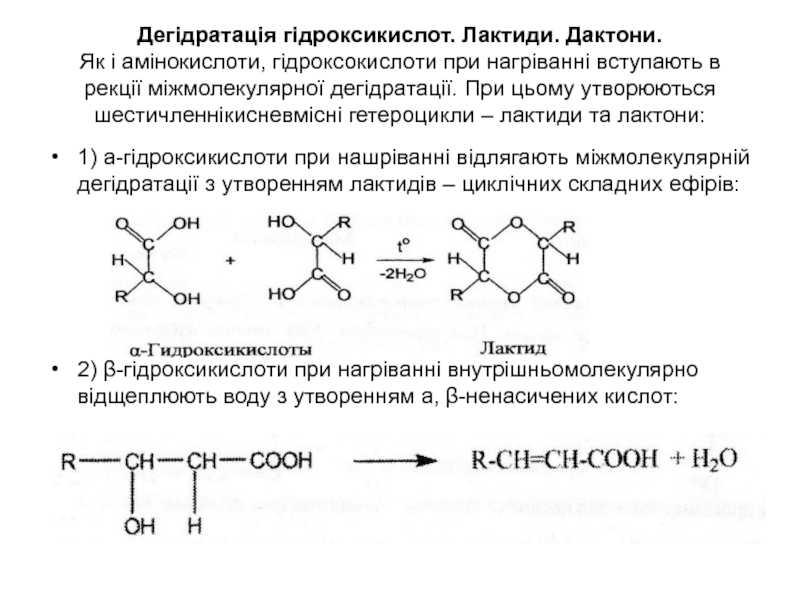
Слайд 45Дегідратація гідроксикислот. Лактиди. Дактони. Як і амінокислоти, гідроксокислоти при нагріванні вступають
в рекції міжмолекулярної дегідратації. При цьому утворюються шестичленнікисневмісні гетероцикли –
лактиди та лактони:1) а-гідроксикислоти при нашріванні відлягають міжмолекулярній дегідратації з утворенням лактидів – циклічних складних ефірів:
2) β-гідроксикислоти при нагріванні внутрішньомолекулярно відщеплюють воду з утворенням а, β-ненасичених кислот:
Слайд 463) γ-, δ-гідроксикислоти з більш віддаленим розташуванням функціональної групи, легко
вступають в реакцію внутрішньомолекулярної дегідратації навіть при кімнатній температурі, утворюючи
при цьому лактони:Слайд 47Оксокислоти
Похідні карбонових кислот, котрі містять у своєму складі поряд
із карбоксильною групою і карбонільну групу. В залежності від її
типу оксокислоти можуть бути альдегідокислотами і кетокислотами. Розташування оксогрупи відносно карбоксильної групи в гідроксокислотах та амінокислотах позначається цифрами або відповідними буквами грецького алфавіту. Напоширенішими в біохімічних системах є такі оксокислоти:Слайд 48Піровиеонрадна кислота – проміжний продукт обміну вуглеводів, гліцеролу, амінокислот.
Гліоксалева
кислота міститься в недозрілих фруктах, але по мірі дозрівання її
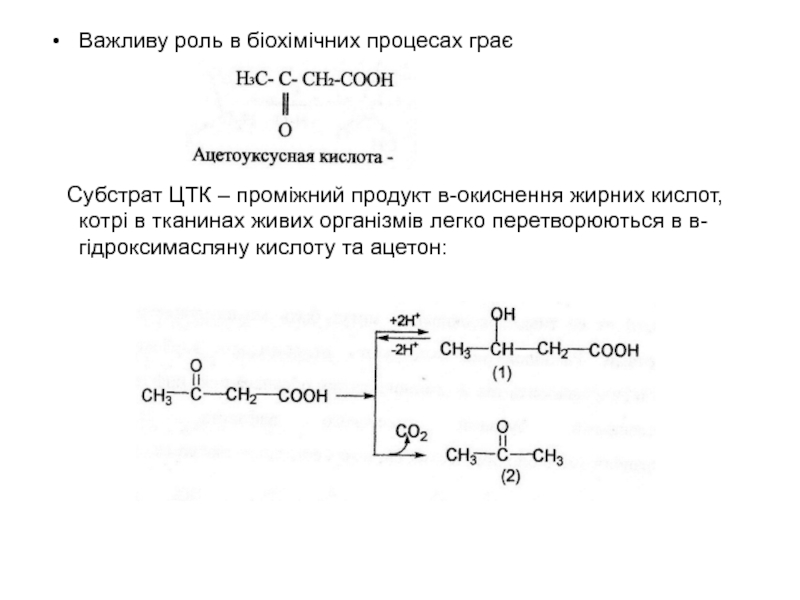
кількість зменшується. Піровиноградна кислота являється ключевою сполукою багатостадійного процесу вуглеводневого обміну. При клітинному диханні в присутності кисню вона “згорає”. При відсутності кисню вона під дією ферментів вона відновлюється в молочу кислоту, котра і накопичується у м'язах при інтенсивних фізичних навантаженнях, пов'язаних з великими затратами кисню. Таке саме явище відбувається і при молочнокислому бродінні.Слайд 49Важливу роль в біохімічних процесах грає
Субстрат ЦТК –
проміжний продукт в-окиснення жирних кислот, котрі в тканинах живих організмів
легко перетворюються в в-гідроксимасляну кислоту та ацетон:Слайд 50 При деяких патологічних станах (цукровий діабет) ацетооцтова кислота,
в-гідроксимасляна кислота та ацетон можуть накопичуватися в організмі людини у
вигляді (кетонових тіл), що приводить до підвищення виведення цих сполук з сечею (кетонурія).Слайд 51Ацетооцтова кислота утворюється в житті в процесі метаьрлізму ВЖК
Котра відноситься
одночасно до а- та в-кетонокислот. Вона утворюється в ЦТК при
окисненні яблучної кислоти.Субстрат ЦТК, попередник важливих амінокислот (глутамінової та гамма-аміномасляної).