Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
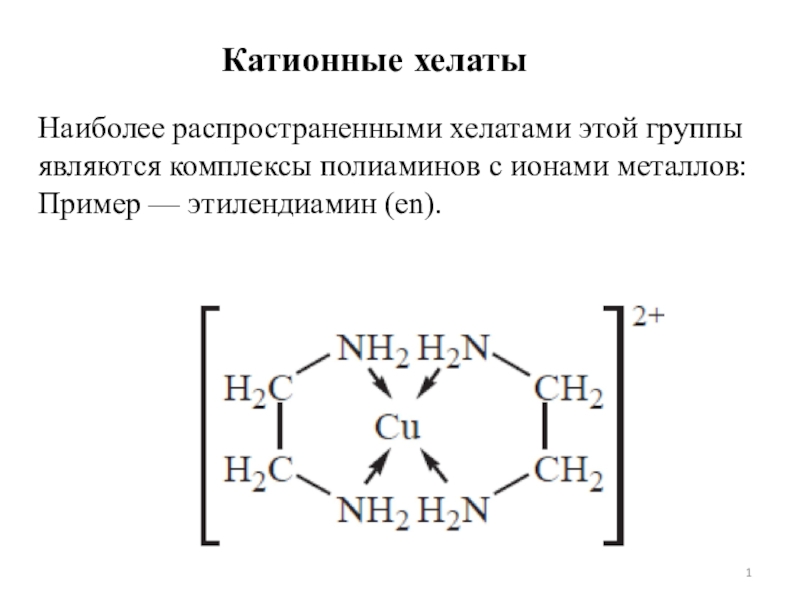
Катионные хелаты
Содержание
- 1. Катионные хелаты
- 2. Анионные хелатыТипичными анионными хелатами являются комплексы ионов
- 3. При рН 8–10 реагент присутствует в растворе
- 4. Нейтральные хелаты(внутрикомплексные соединения)Понятие «внутрикомплексное соединение» введено Леем
- 5. Положительный заряд меди нейтрализуется ацетатными группами хелатообразующего
- 6. Эфирные хелатыПри образовании хелата аквалиганды гидратированного иона
- 7. Хелаты такого типа устойчивы только в сильнокислых
- 8. Образование хелатов в этом случае представляют как
- 9. Различие эфирных и «обычных» хелатов состоит в
- 10. Хелатный эффект Это понятие введено Г. Шварценбахом в
- 11. где βn — общая константа устойчивости комплекса
- 12. Для корректности результата сравниваемые лиганды должны иметь
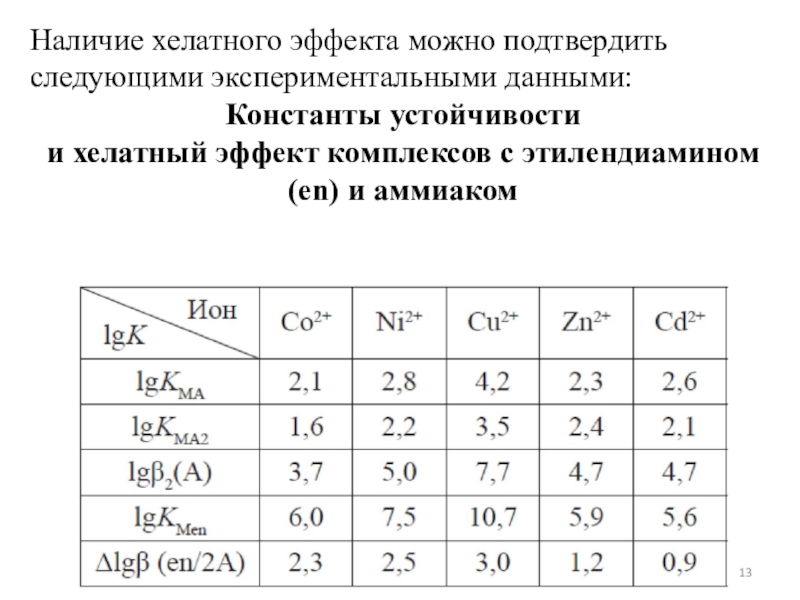
- 13. Наличие хелатного эффекта можно подтвердить следующими экспериментальными
- 14. Природа хелатного эффекта
- 15. Согласно Шварценбаху высокая устойчивостьхелатов связана с увеличением
- 16. Поэтому величина ΔS равна нулю. Если же
- 17. Энтропия реакций комплексообразования зависит не только от
- 18. Лиганды (многоатомные молекулы) находятся в растворах в
- 19. Вклад энтальпийной составляющей хелатного эффекта, -
- 20. Первая составляющая -
- 21. Если монодентатный и полидентатный лиганды близки по
- 22. Термодинамическая выгода комплексообразования с полидентатными лигандами подтверждается экспериментально. Хелатный эффект является общей закономерностью реакций комплексообразования.
- 23. Хелатный эффект различают : энтальпийный и энтропийный.
- 24. Энтропийный вклад в величину хелатного эффекта определяется:1)
- 25. Энтальпийный вклад в величину хелатного эффектаопределяется:1) теплотой
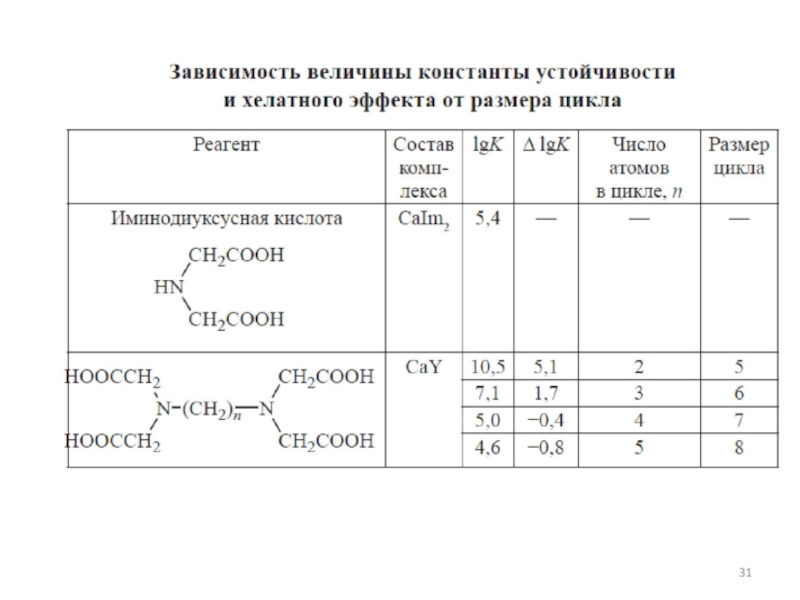
- 26. Влияние размера хелатных цикловна величину хелатного эффектаОбразование
- 27. Искажения структуры лигандов минимальны при образовании пяти-
- 28. А-катионы (или жесткие кислоты) небольшого размера предпочтительно
- 29. Б-катионы (мягкие кислоты), имеющие большие радиусы и
- 30. Константы устойчивости комплексов никеля (II) и меди
- 31. Слайд 31
- 32. Хелатный эффект убывает с увеличением количества метиленовых
- 33. Однако из этого правила существуют исключения. Ag+
- 34. Влияние количества образующихся цикловна величину хелатного эффектаИз
- 35. Устойчивость комплексов возрастает при переходе от бидентатного
- 36. Скачать презентанцию
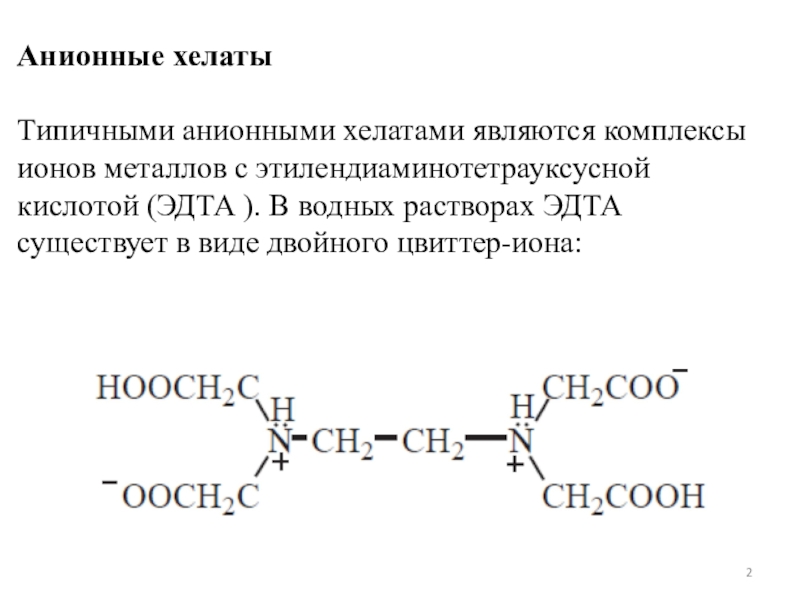
Анионные хелатыТипичными анионными хелатами являются комплексы ионов металлов с этилендиаминотетрауксусной кислотой (ЭДТА ). В водных растворах ЭДТА существует в виде двойного цвиттер-иона:
Слайды и текст этой презентации
Слайд 1Катионные хелаты
Наиболее распространенными хелатами этой группы являются комплексы полиаминов с
ионами металлов:
Слайд 2Анионные хелаты
Типичными анионными хелатами являются комплексы ионов металлов с этилендиаминотетрауксусной
кислотой (ЭДТА ). В водных растворах ЭДТА существует в виде двойного
цвиттер-иона:Слайд 3При рН 8–10 реагент присутствует в растворе в форме иона
H2Y2−, реакция образования комплекса с двухзарядным ионом металла можно записать
следующим образом:H2Y2− + M2+ ↔ MY2− + 2H+
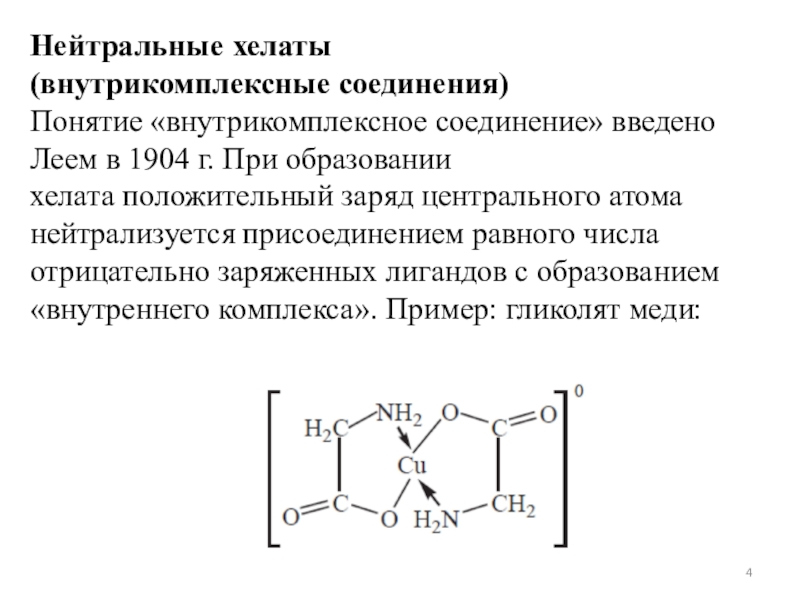
Слайд 4Нейтральные хелаты
(внутрикомплексные соединения)
Понятие «внутрикомплексное соединение» введено Леем в 1904 г.
При образовании
хелата положительный заряд центрального атома нейтрализуется присоединением равного числа
отрицательно заряженных лигандов с образованием «внутреннего комплекса». Пример: гликолят меди:Слайд 5Положительный заряд меди нейтрализуется ацетатными группами хелатообразующего реагента, незаряженные аминогруппы
координационно связаны с медью. В целом частица координационного соединения электронейтральна.
Внутрикомплексные соединения
(ВКС) обычно плохо растворимы в воде, хорошо растворимы в малополярных органических растворителях. Их используют в экстракции, гравиметрии, экстракционной хроматографии.Слайд 6Эфирные хелаты
При образовании хелата аквалиганды гидратированного иона металла вытесняются донорными
атомами лиганда. Однако для высокозарядных катионов небольшого размера,
которые в водных
растворах находятся в виде оксо- и гидроксокомплексы такое поведение не характерно:Слайд 7Хелаты такого типа устойчивы только в сильнокислых растворах, часто образуются
даже в концентрированных кислотах и быстро разрушаются в щелочных растворах.
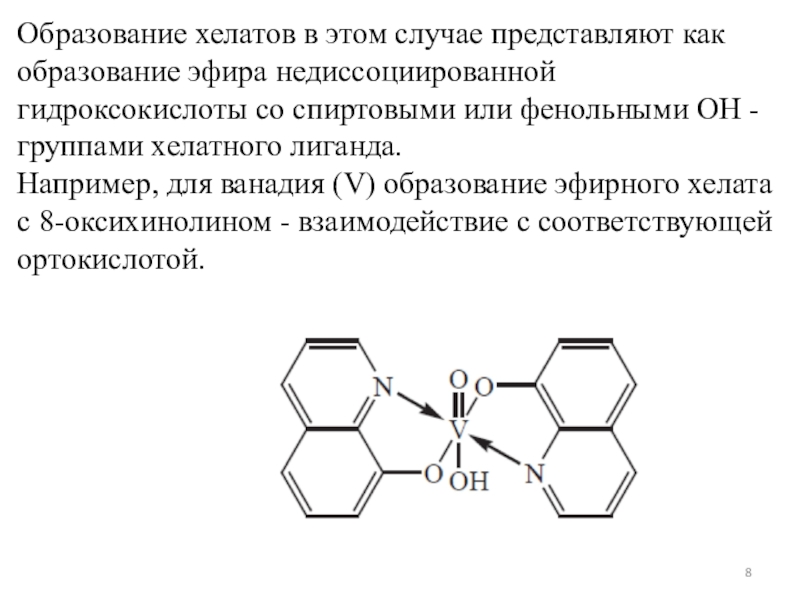
Слайд 8Образование хелатов в этом случае представляют как образование эфира недиссоциированной
гидроксокислоты со спиртовыми или фенольными ОН -группами хелатного лиганда.
Например,
для ванадия (V) образование эфирного хелата с 8-оксихинолином - взаимодействие с соответствующей ортокислотой.Слайд 9Различие эфирных и «обычных» хелатов состоит в том, что устойчивость
обычных хелатов обусловливается конкуренцией между ионами металла и протоном раствора
за анион хелатного лиганда и поэтому возрастает с повышением значения рН раствора. В случае эфирных хелатов устойчивость повышается с уменьшением рН раствора, так как она определяется конкуренцией между гироксо- и оксоанионами и анионом хелатного лиганда за центральный атом.Слайд 10Хелатный эффект
Это понятие введено Г. Шварценбахом в 1952 г. и
отражает устойчивость хелата металла по сравнению с аналогичными комплексами ионов
металлов с монодентатными лигандами или с хелатообразующими реагентами, но с меньшим числом хелатных циклов.Мерой хелатного эффекта служит разность логарифмов общих констант устойчивости хелатного комплекса MLn и его нециклического аналога
Слайд 11где βn — общая константа устойчивости комплекса MLn,
βn/m
— константа устойчивости комплекса и n > m, Сравнивают хелатный
эффект только для таких хелатов, где отношение m/n имеет целочисленные значения.Слайд 12Для корректности результата сравниваемые лиганды должны иметь одинаковые донорные атомы
и близкую структуру (например, L —алифатический полиамин, L′ — аммиак
или алифатический одноатомный амин).Слайд 13Наличие хелатного эффекта можно подтвердить следующими экспериментальными данными:
Константы устойчивости
и хелатный
эффект комплексов с этилендиамином (en) и аммиаком
Слайд 15Согласно Шварценбаху высокая устойчивость
хелатов связана с увеличением энтропийного вклада в
свободную энергию образования комплекса. Изменение энтропии определяется изменением числа частиц.
Увеличение числа частиц (возрастание степени беспорядка) означает увеличение энтропии. Для реакций в растворах необходимо учитывать сольватацию. В случае обмена лигандами между гидратированным ионом и монодентатным лигандом изменения суммарного числа частиц в результате комплексообразования не происходит:Слайд 16Поэтому величина ΔS равна нулю.
Если же в реакции обмена
лигандами участвует полидентатный лиганд, (депротонированный анион ЭДТА), то суммарное число
частиц в ходе реакции увеличивается:Энтропия системы возрастает, ΔS > 0, что приводит к более отрицательной величине изменения свободной энергии системы и возрастанию константы устойчивости комплекса.
Слайд 17Энтропия реакций комплексообразования зависит не только от соотношения количества входящих
и выходящих частиц (молекул) при формировании внутренней сферы комплекса.
Слайд 18Лиганды (многоатомные молекулы) находятся в растворах в нескольких пространственных формах.
Связываясь в комплекс, они теряют часть степеней свободы, т.е. комплексообразование
фиксирует какую-либо одну форму лиганда. При этом происходит в результате реакции комплексообразования уменьшение энтропии в системе.Следовательно, пространственно жесткие лиганды, находящиеся в комплексе в такой же форме, как и в растворе, образуют более устойчивые комплексы.
Слайд 19 Вклад энтальпийной составляющей хелатного эффекта, - изменение стандартной энтальпии
системы ΔН, можно разделить на две составляющие:
Слайд 20Первая составляющая - энергия образования координационных
связей центрального атома с донорными атомами лиганда, ее значение -
меньше нуля, т.к. образование связей металл — лиганд сопровождается выигрышем энергии. Вторая составляющая ( ) обусловлена изменением энергии лигандов за счет стерических факторов (ориентация вокруг центрального атома, взаимное отталкивание, деформация и т. д.).Эта величина положительна, т. е. сопряжена с затратами энергии.
Слайд 21Если монодентатный и полидентатный лиганды близки по своей природе, то
энергия образования связей для нециклического
и хелатного комплексов ( )
равны. Стерические составляющие ( ) заметно различаются.Для ориентации монодентатных лигандов вокруг центрального атома надо затратить больше
энергии, чем для ориентации полидентатных лигандов, т.к. в полидентатном лиганде функциональные группы уже ориентированы относительно друг друга изначально. Выигрыш энергии при переходе от монодентатного лиганда к полидентатному может быть значителен.
Слайд 22Термодинамическая выгода комплексообразования с полидентатными лигандами подтверждается экспериментально. Хелатный эффект
является общей закономерностью реакций комплексообразования.
Слайд 23Хелатный эффект различают :
энтальпийный и энтропийный.
Энтальпийный эффект является
дополнительным по отношению к энтропийному и проявляется при комплексообразовании катионов
группы Б и ионов переходных металлов, образующих очень прочные координационные связиЭнтальпийный эффект не проявляется при комплексообразовании ионов щелочно-земельных металлов (катионы группы А). Характер их связей с лигандами ближе к ионному взаимодействию. В этом случае хелатный эффект практически полностью обусловлен энтропийным фактором.
Слайд 24Энтропийный вклад в величину хелатного эффекта определяется:
1) числом хелатных циклов;
2)
размером хелатных циклов;
3) изменением сольватации частиц при образовании комплекса;
4) расположением
хелатных циклов;5) изменением энтропии некоординированных лигандов;
6) энтропийным вкладом, определяемым степенью свободы лигандов в комплексе.
Слайд 25Энтальпийный вклад в величину хелатного эффекта
определяется:
1) теплотой образования связи иона
металла с лигандом, которая определяется электроотрицательностью иона металла и донорного
атома, эффектом поля лигандов;2) структурой лиганда;
3) стерическим эффектом и электростатическим отталкиванием между донорными группами лигандов в комплексе;
4) кулоновскими силами в комплексе
Слайд 26Влияние размера хелатных циклов
на величину хелатного эффекта
Образование связей между полидентатным
лигандом и ионом металла всегда приводит к изменению углов связей
в молекуле лиганда, т. е. сопряжено с дополнительными энергетическими затратами, которые препятствуют образованию хелатного комплекса.Слайд 27Искажения структуры лигандов минимальны при образовании пяти- и шестичленных циклов.
Правило циклов Чугаева:
Пятичленные циклы наиболее устойчивы в отсутствие кратных связей,
а шестичленные — при наличии двойных связей . Слайд 28А-катионы (или жесткие кислоты) небольшого размера предпочтительно образуют шестичленные хелатные
циклы, содержащие двойные связи.
Это могут быть реагенты, содержащие донорные атомы
O,O; N,О и реже N,N.Слайд 29Б-катионы (мягкие кислоты), имеющие большие радиусы и легко деформируемые электронные
оболочки, образуют стабильные четырехчленные, а также пятичленные хелатные циклы с
S,S- или S,N-реагентами, и реже — с S,O-реагентами.Влияние размера цикла на устойчивость комплексов:
Слайд 30Константы устойчивости комплексов никеля (II) и меди (II) с этилендиамином,
(пятичленные хелатные циклы), выше, чем константы устойчивости комплексов пропилендиамина (C3H6(NH2)2
)(шестичленные хелатные циклы в отсутствие двойных связей).Закономерность изменения устойчивости комплексов от размера образующегося в молекуле комплекса хелатного цикла можно проследить на другом примере.
Слайд 32Хелатный эффект убывает с увеличением количества метиленовых групп в мостике
между атомами азота, хотя общее количество донорных атомов в реагенте
не изменяется.При этом не изменяется и размер цикла с участием карбоксильных групп и донорных атомов азота. При образовании семичленного центрального хелатного цикла хелатный эффект практически равен нулю.
Слайд 33Однако из этого правила существуют исключения. Ag+ (КЧ = 2),
для которого необходимо линейное расположение донорных атомов (sp-гибридизация), образует более
устойчивые комплексы с пропилендиамином по сравнению с этилендиамином.Слайд 34Влияние количества образующихся циклов
на величину хелатного эффекта
Из определения понятия «хелатный
эффект» следует, что устойчивость хелатов должна возрастать при увеличении числа
сопряженных хелатных циклов. Увеличение числа хелатныхциклов приводит к возрастанию устойчивости хелата, только если все донорные атомы объединены в одну молекулу.