Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислород
Содержание
- 1. Кислород
- 2. Кислород - элемент главной подгруппы VI группы, второго периода периодической системы
- 3. Строение атома кислородаКислород относится к элементам р-семейства.
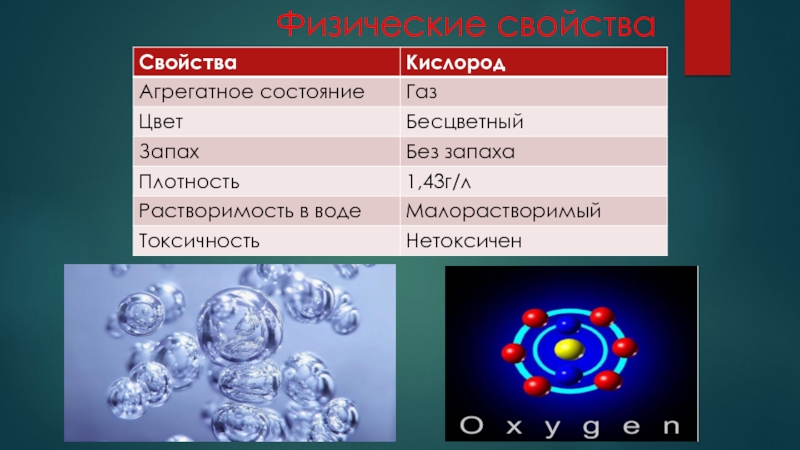
- 4. Физические свойства
- 5. Химические свойства1.Взаимодействие c металлами:В результате реакции образуется оксид
- 6. 3.Взаимодействие с некоторыми сложными веществамиВ этом случае образуются
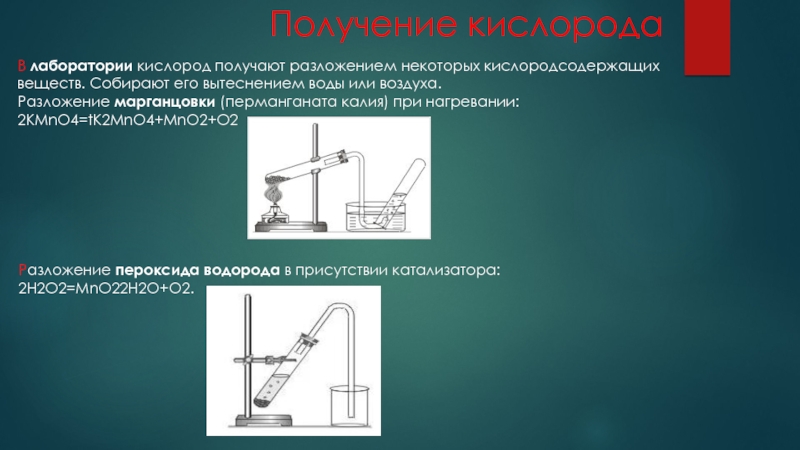
- 7. Получение кислородаВ лаборатории кислород получают разложением некоторых кислородсодержащих веществ.
- 8. Электролиз воды: 2H2O=эл. ток2H2+O2. Можно получить кислород
- 9. Кислород - самый распространенный наЗемле элемент, на
- 10. Применение кислородаВ металлургической промышленности кислород используется при выплавке чугуна
- 11. Спасибо за внимание!
- 12. Скачать презентанцию
Кислород - элемент главной подгруппы VI группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (лат. Oxygenium). Это химически активный неметалл, самый лёгкий элемент из группы халькогенов. При нормальных условиях - газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода
Слайды и текст этой презентации
Слайд 2Кислород - элемент главной подгруппы VI группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным
Слайд 3Строение атома кислорода
Кислород относится к элементам р-семейства. На внешнем энергетическом
уровне шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали.
На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.Относительная атомная масса – 16. Существует три изотопа элемента:
16O;
17O;
18O.
Наиболее распространён 16O
Слайд 5Химические свойства
1.Взаимодействие c металлами:
В результате реакции образуется оксид этого металла.
4Al +
3O2 = 2Al2O3;
3Fe + 2O2 = Fe3O4.
2.Взаимодействие с неметаллами:
При этом образуется оксид этого
неметалла.Сера взаимодействует с кислородом при 250°С:
S + O2 = SO2.
Горение фосфора с образованием оксида фосфора (V) начинается при 60 °С:
4Р + 5О2 = 2Р2О5.
Графит реагирует с кислородом при 700-800 °С:
С + О2 = СО2.
С водородом кислород взаимодействует при 300 °С:
2Н2 + О2 = 2Н2О.
Слайд 63.Взаимодействие с некоторыми сложными веществами
В этом случае образуются оксиды элементов, из
которых состоит молекула сложного вещества.
2CuS + 3O2 = 2CuO + 2SO2;
СН4 +
2О2 = СО2 + 2Н2О.4.Взаимодействие с простыми веществами-металлами
Активные металлы реагируют с кислородом при комнатной температуре:
4Li + O2 = 2Li2O.
2Ca + O2 = 2CaO + Q.
При нагревании реагируют менее активные металлы:
2Cu + O2 =t 2CuO.
Слайд 7Получение кислорода
В лаборатории кислород получают разложением некоторых кислородсодержащих веществ. Собирают его вытеснением
воды или воздуха.
Разложение марганцовки (перманганата калия) при нагревании:
2KMnO4=tK2MnO4+MnO2+O2
Разложение пероксида водорода в присутствии катализатора:
2H2O2=MnO22H2O+О2.
Слайд 8Электролиз воды:
2H2O=эл. ток2H2+O2.
Можно получить кислород и при разложении
некоторых других веществ: бертолетовой соли KClO3, нитратов NaNO3, KNO3 и
т. д.В промышленных масштабах кислород получают из воздуха.
Для этого воздух при повышенном давлении охлаждают и превращают в жидкость. Затем жидкий воздух нагревают. Сначала выделяется азот (температура кипения –196 °С).
Жидкий кислород остаётся, так как его температура кипения выше (–183 °С). Хранят жидкий кислород в стальных баллонах голубого цвета.
Слайд 9Кислород - самый распространенный на
Земле элемент, на его долю (в
составе
различных соединений, главным образом
силикатов), приходится около 47,4% массы
твердой земной коры.
Морские и пресныеводы содержат огромное количество
связанного кислорода — 88,8% (по массе), в
атмосфере содержание свободного кислорода
составляет 20,95 % (по объему). Элемент
кислород входит в состав более 1500
соединений земной коры.
Нахождение в природе
Слайд 10Применение кислорода
В металлургической промышленности кислород используется при выплавке чугуна и стали.
В смеси
с водородом или ацетиленом кислород применяется для резки и варки металлов.
Находит применение кислород в качестве окислителя
ракетного топлива.Используется он для обеспечения жизнедеятельности на подводных лодках и космических кораблях, при работе водолазов.
Находит применение в медицине в лечебных целях.
Играет наиважнейшую роль в жизни человека и животных.