Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислотно-основные свойства органических веществ. Спирты. Фенолы
Содержание
- 1. Кислотно-основные свойства органических веществ. Спирты. Фенолы
- 2. I. Определение понятий «кислота» и «основание» Кислотность
- 3. В общем виде:А-Н +
- 4. II. Кислоты и основания в биологии и
- 5. Пример:Желудок рН = 1Кишечник
- 6. Зная величину рКа биосубстрата можно определить, вкакой
- 7. Типы органических кислотОрганические кислотыOH-кислоты RCOOH AlkOH ArOHSH-кислотыAlkSH ArSHNH-кислотыRNH2CH-кислоты CH4 C2H2 CHCl3CH3NO2
- 8. При оценке кислотности органических соединенийпрогнозируют стабильность аниона,
- 9. 1. Природа атома в кислотном центреа) по
- 10. 2. Делокализация отрицательного заряда: а) за
- 11. Пример 2pKa
- 12. IV. Типы органических основанийОСНОВАНИЯn-Основания (ониевые) (центр
- 13. Сила основания определяется:- доступностью электронной пары гетероатома,
- 14. ЭД заместители повышают основность,ЭА заместители – понижают.Пример
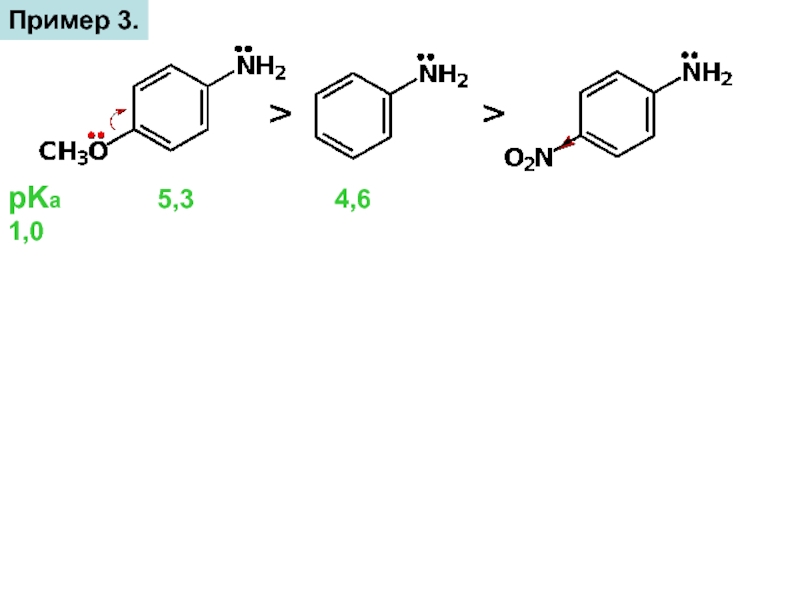
- 15. Пример 3.pKа
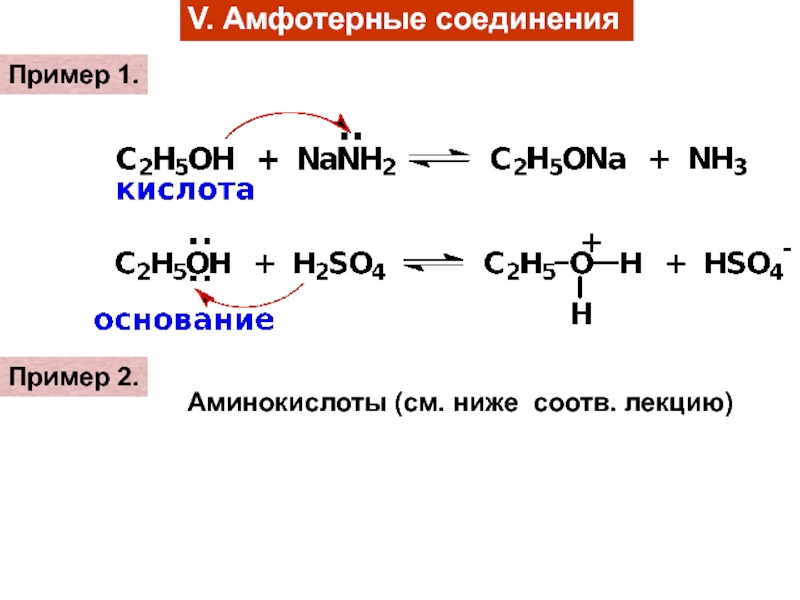
- 16. V. Амфотерные соединенияПример 1.Пример 2.Аминокислоты (см. ниже соотв. лекцию)
- 17. VI. Кислоты и основания Льюиса(более общая теория)Кислоты
- 18. Примерыn-Основание Льюиса+КислотаЛьюисаn-Комплекс R-Br:
- 19. VII. Жесткие и мягкие кислоты и основания
- 20. Жесткие основания Льюиса предпочитают координиро-ваться с жесткими
- 21. ОснованияЖесткиеМягкиеАтомы-доноры эл. пар:
- 22. ОН-кислотный центрНуклеофильный иn-основный центрЭлектрофильный
- 23. Медико-биологическое значение спиртовМетанол – ядЭтанол – экстракты,
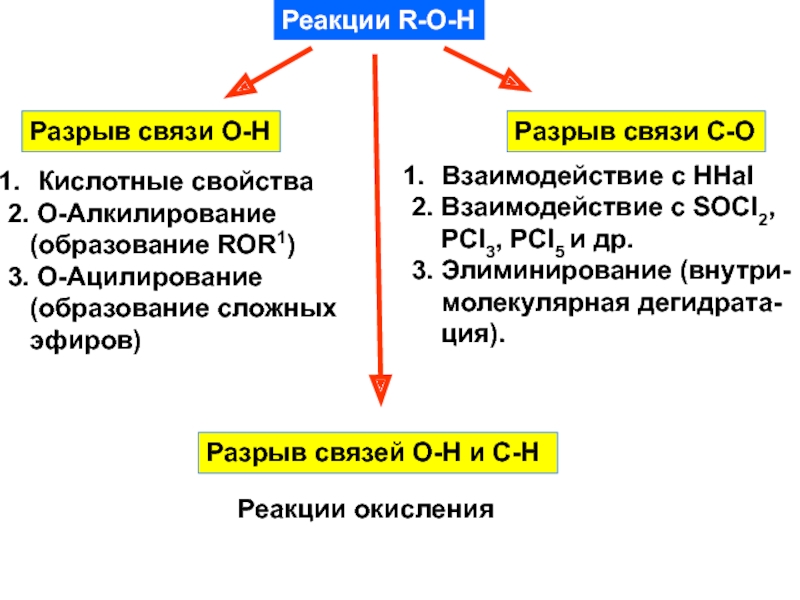
- 24. Реакции R-O-HРазрыв связи О-НРазрыв связи C-OКислотные свойства2.
- 25. I. Реакции с участием нуклеофильного центраО-АлкилированиеROH
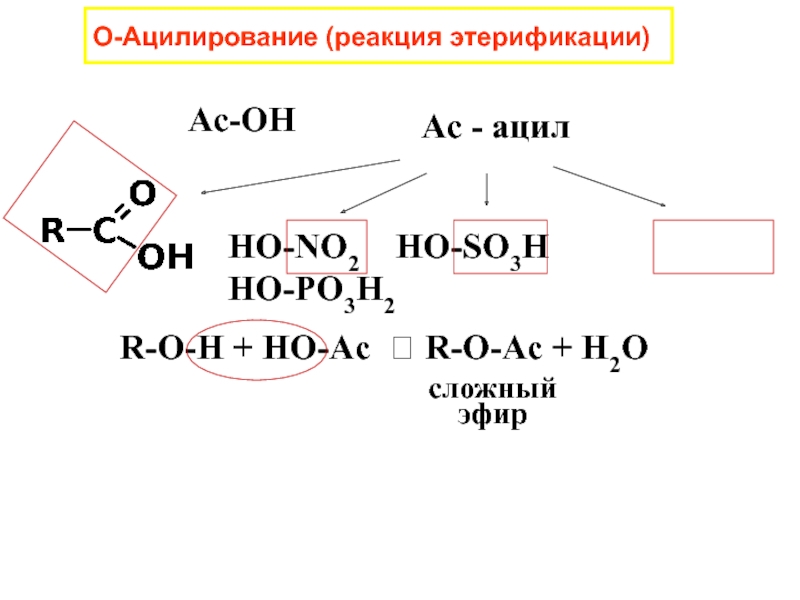
- 26. О-Ацилирование (реакция этерификации) Ac-OHAc - ацилHO-NO2
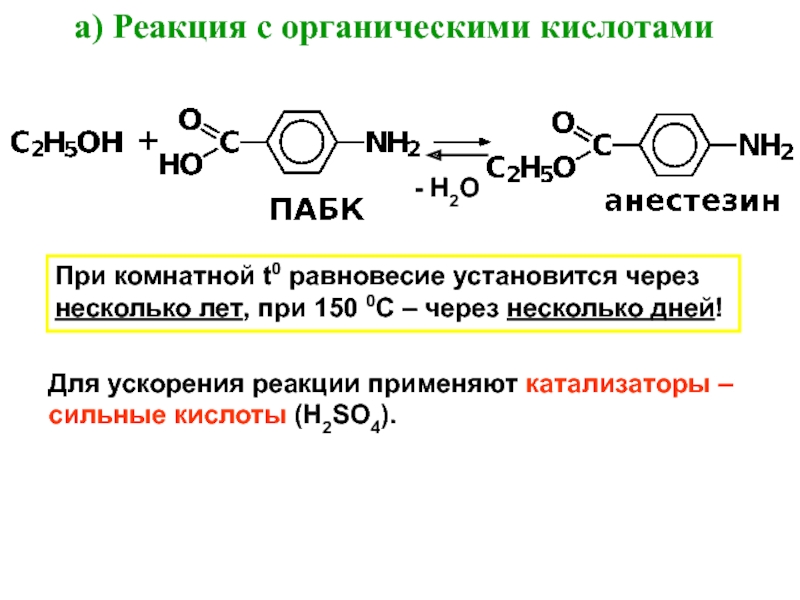
- 27. а) Реакция с органическими кислотами- Н2ОПри комнатной
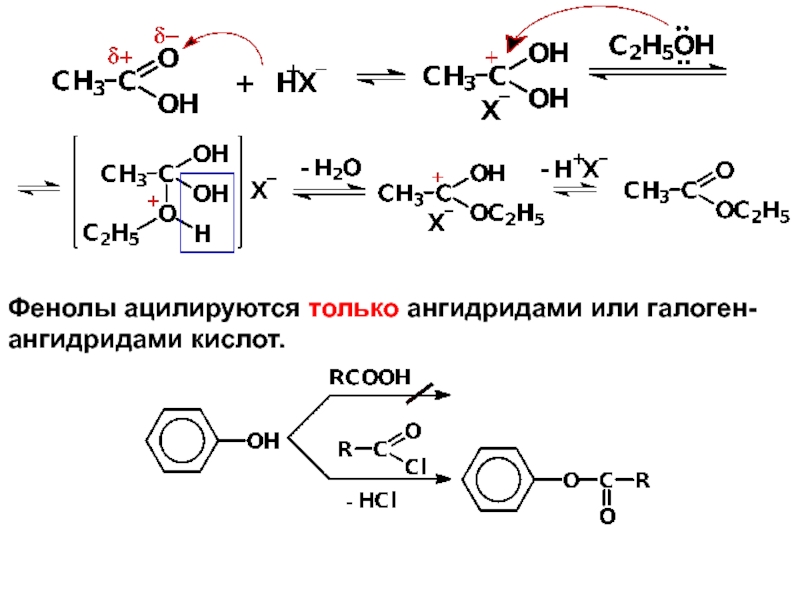
- 28. Фенолы ацилируются только ангидридами или галоген-ангидридами кислот.
- 29. При нагревании (140 0С) реакция (SN) идет
- 30. Нитроглицерин3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O А.Нобель Н.Н. Зинин А.Собрерорасширяет сосудыгемоглобин
- 31. 1846 г. – два взрывчатых нитроэфира:1. Пироксилин
- 32. «Нитроглицерин для взрывчатого дела был
- 33. II. Реакции с участием электрофильного центраа) Реакции
- 34. Два механизма: SN2 и SN1 (см. «Химические
- 35. III. Реакции элиминированияВ растворе: катализаторы – минеральные
- 36. Слайд 36
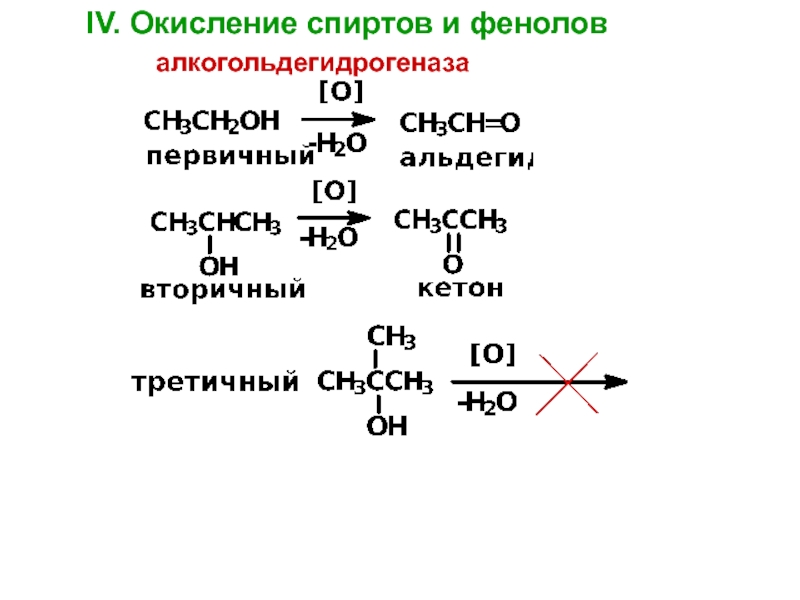
- 37. IV. Окисление спиртов и феноловалкогольдегидрогеназа
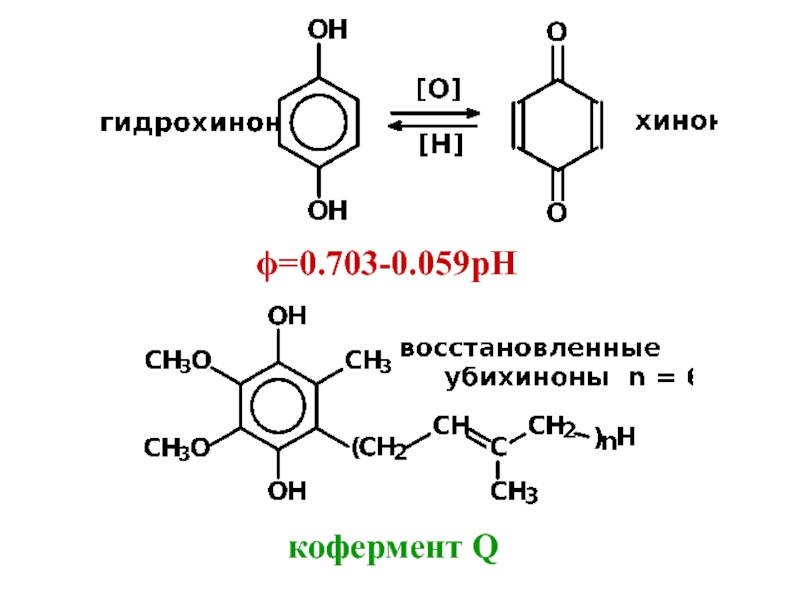
- 38. ϕ=0.703-0.059рНкофермент Q
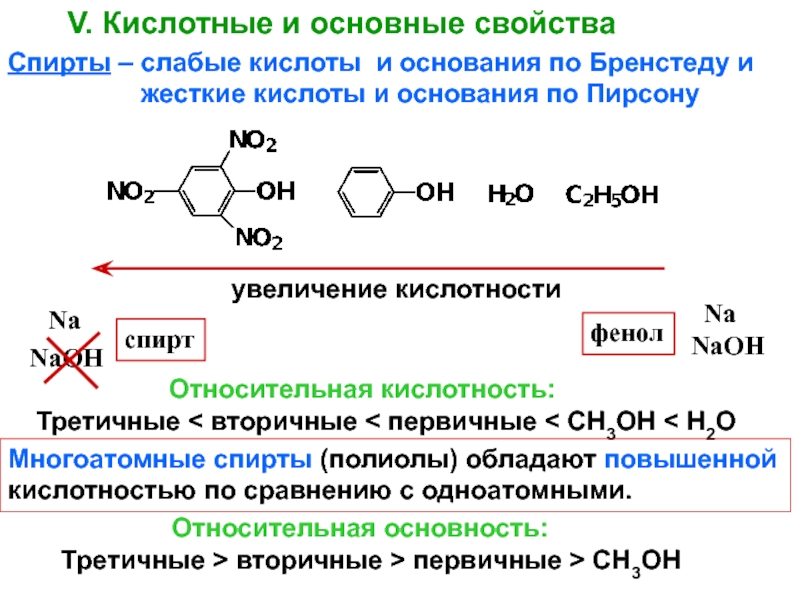
- 39. увеличение кислотностиспиртфенолNaNaOHNaNaOHV. Кислотные и основные свойстваСпирты –
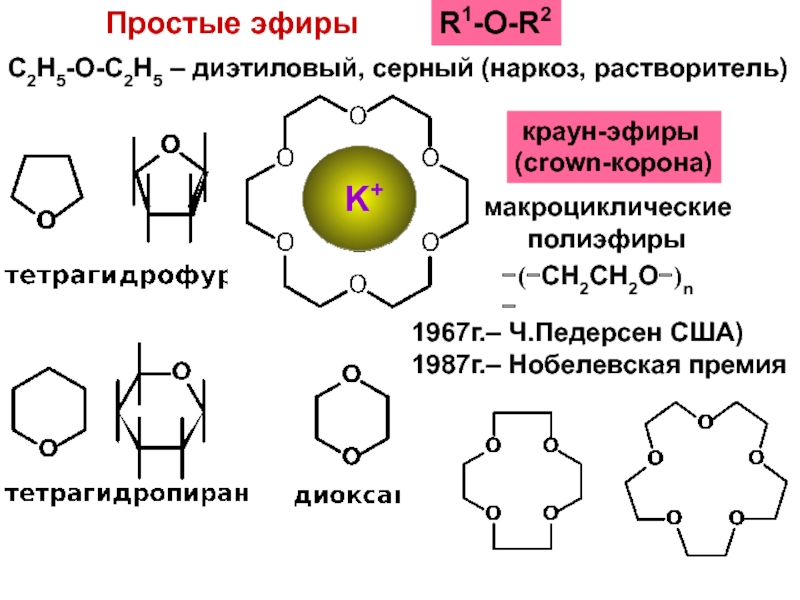
- 40. Простые эфирыR1-O-R2C2H5-O-C2H5 – диэтиловый, серный (наркоз, растворитель) краун-эфиры(crown-корона)−(−СН2СН2О−)n −макроциклические полиэфиры1967г.– Ч.Педерсен США)1987г.– Нобелевская премияK+
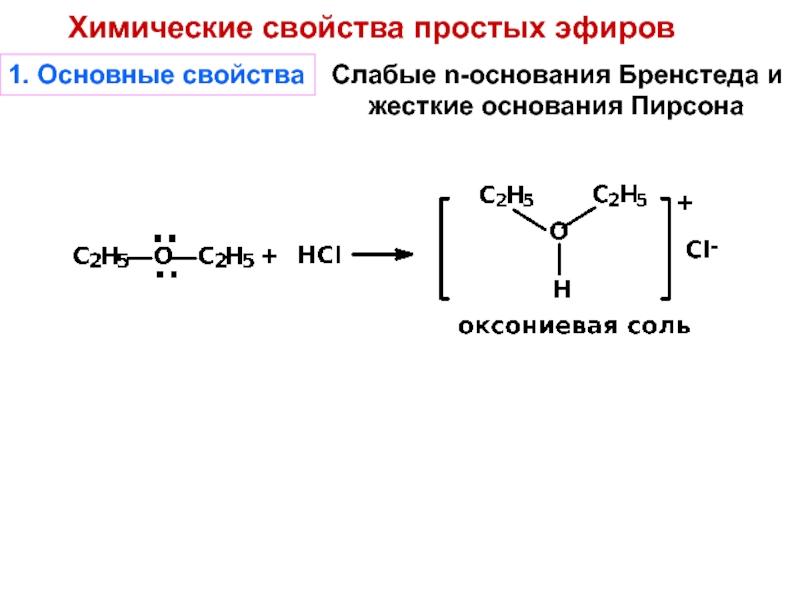
- 41. 1. Основные свойстваСлабые n-основания Бренстеда и жесткие основания ПирсонаХимические свойства простых эфиров
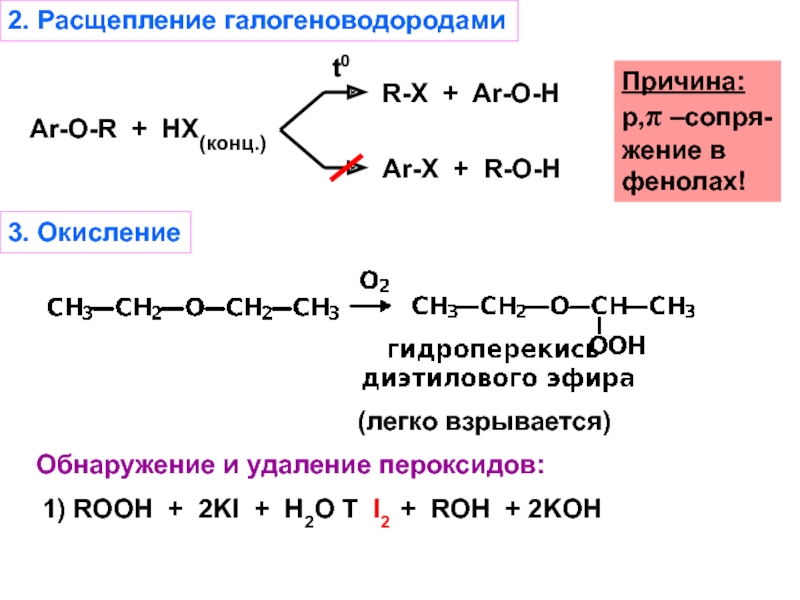
- 42. 3. Окисление(легко взрывается)Обнаружение и удаление пероксидов:1) ROOH
- 43. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Кафедра химии
Тема лекции:
Кислотно-основные свойства
органических веществ
Спирты. Фенолы. Простые эфиры.
Слайд 2I. Определение понятий «кислота» и «основание»
Кислотность и основность по
Бренстеду-Лоури
нейтральные молекулы или ионы, способные присоединять протон Н+Слайд 3В общем виде:
А-Н + : В
А−
+ ВН+
кислота
основание
сопряженное
основание
сопряженная
кислотаПравило: сильной кислоте соответствует слабое основа-
ние, и наоборот.
Удобно выражать силу кислот и оснований в одной
шкале (рКа) подобно тому, как рН одинаково характе-
ризует и кислотность, и основность.
Чем > рКа, тем слабее кислота и сильнее основание.
Для оснований величина рКа обычно отражает силу сопря-
женной кислоты – протонной формы основания рКBH+
Слайд 4II. Кислоты и основания в биологии и медицине
рКа используются:
- для
установления структуры природных и синтетических веществ, т.к. рКа зависят от природы
радикалов;- для установления связи между диссоциацией веществ и
их фармакологическим действием;
незаряженные молекулы и ионы обладают разными био-
логическими свойствами, т.к. у них различная проницае-
мость через липидные мембраны.
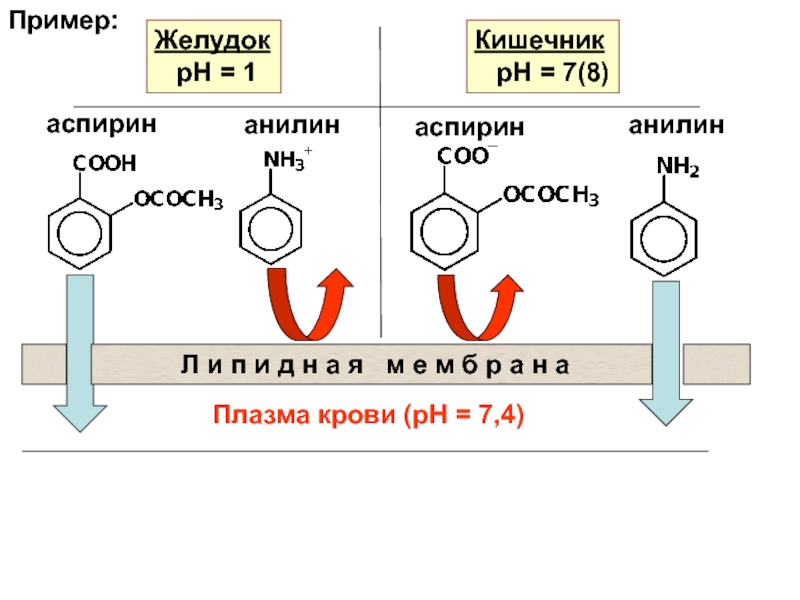
Всасывание лекарств зависит от рКа и растворимости.
Слайд 5Пример:
Желудок
рН = 1
Кишечник
рН = 7(8)
аспирин
аспирин
анилин
анилин
Л и
п и д н а я м е м
б р а н аПлазма крови (рН = 7,4)
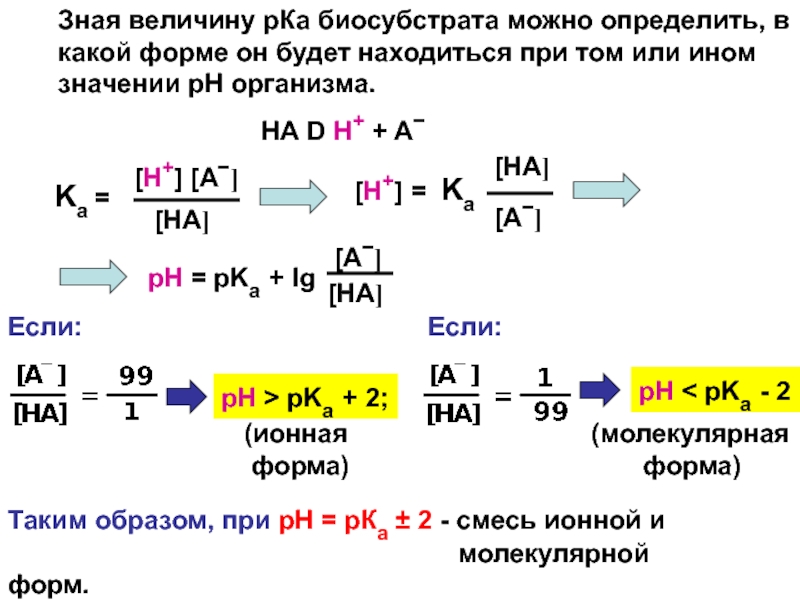
Слайд 6Зная величину рКа биосубстрата можно определить, в
какой форме он будет
находиться при том или ином
значении рН организма.
НА D H+
+ A−Ka =
[H+] [A−]
[HA]
[H+] =
Ka
[HA]
[A−]
pH = pKa + lg
[A−]
[HA]
Если:
pH > pKa + 2;
Если:
pH < pKa - 2
Таким образом, при рН = рКа ± 2 - смесь ионной и
молекулярной форм.
(ионная
форма)
(молекулярная
форма)
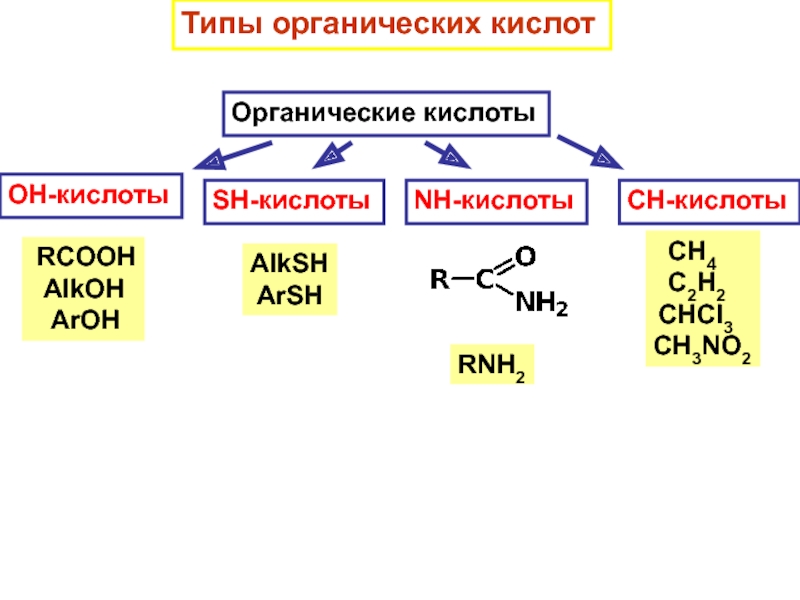
Слайд 7Типы органических кислот
Органические кислоты
OH-кислоты
RCOOH
AlkOH
ArOH
SH-кислоты
AlkSH
ArSH
NH-кислоты
RNH2
CH-кислоты
CH4
C2H2
CHCl3
CH3NO2
Слайд 8При оценке кислотности органических соединений
прогнозируют стабильность аниона, образующегося
при диссоциации
кислоты (А−).
Факторы, влияющие на стабильность аниона:
1. Природа кислотного центра, т.е.
элемента, связанного
с атомом водорода.2. Возможность делокализации заряда:
а) за счет сопряжения;
б) за счет влияния заместителей.
3. Влияние растворителя.
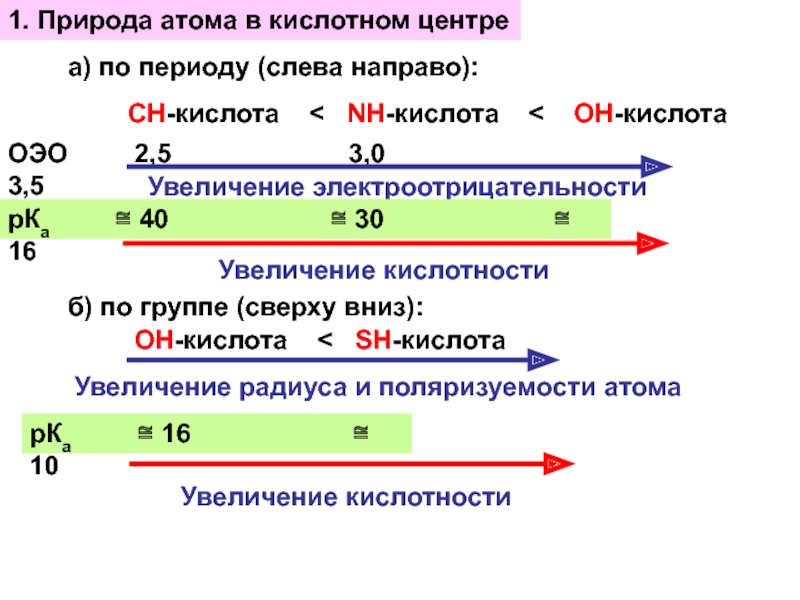
Слайд 91. Природа атома в кислотном центре
а) по периоду (слева направо):
СН-кислота
< NH-кислота < OH-кислота
ОЭО
2,5 3,0 3,5Увеличение электроотрицательности
Увеличение кислотности
рКа ≅ 40 ≅ 30 ≅ 16
б) по группе (сверху вниз):
OН-кислота < SH-кислота
Увеличение радиуса и поляризуемости атома
Увеличение кислотности
рКа ≅ 16 ≅ 10
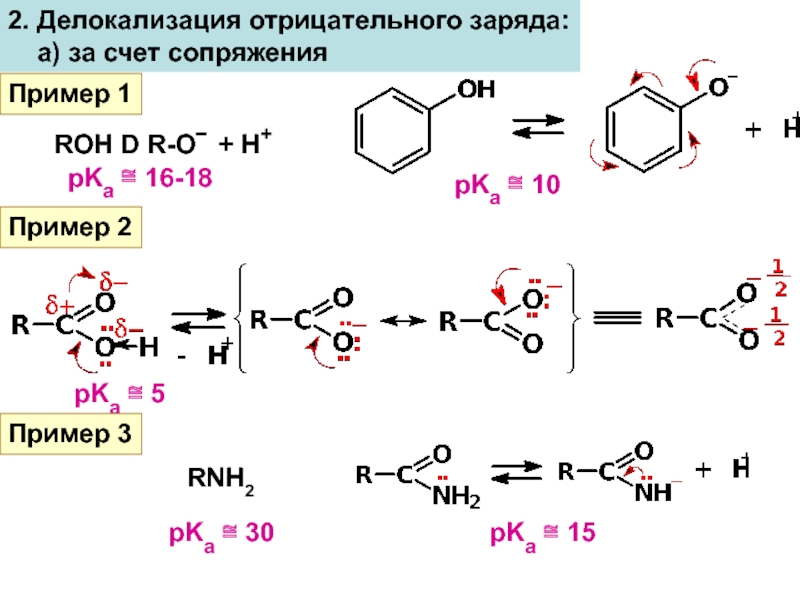
Слайд 102. Делокализация отрицательного заряда:
а) за счет сопряжения
Пример 1
ROH
D R-O− + H+
pKa ≅ 16-18
pKa ≅ 10
Пример 2
pKa ≅
5Пример 3
RNH2
pKa ≅ 30
pKa ≅ 15
Слайд 11Пример 2
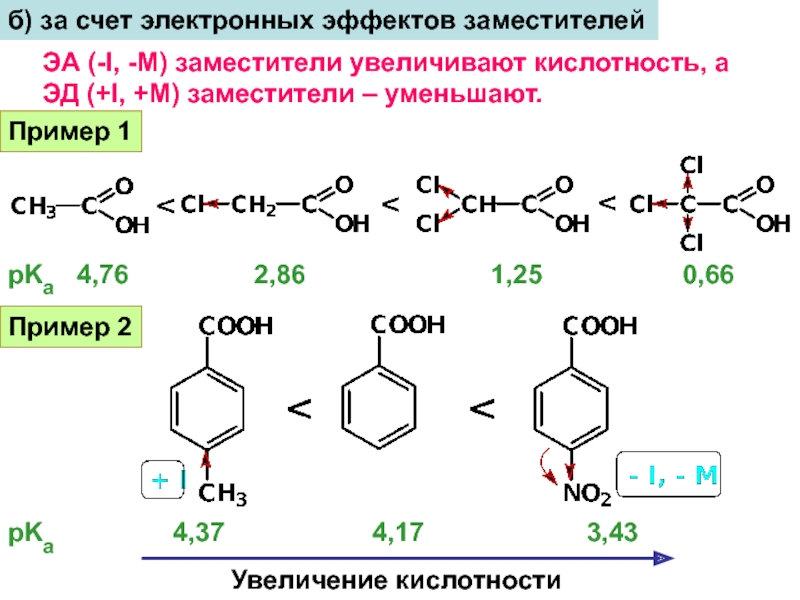
pKa 4,37
4,17
3,43Увеличение кислотности
б) за счет электронных эффектов заместителей
ЭА (-I, -M) заместители увеличивают кислотность, а
ЭД (+I, +M) заместители – уменьшают.
Пример 1
pKa 4,76 2,86 1,25 0,66
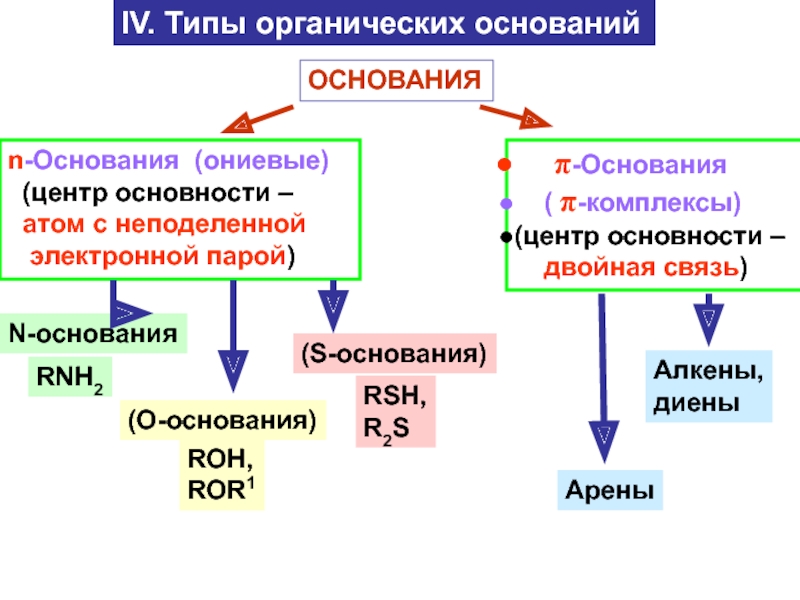
Слайд 12IV. Типы органических оснований
ОСНОВАНИЯ
n-Основания (ониевые)
(центр основности –
атом с
неподеленной
электронной парой)
π-Основания
( π-комплексы)
(центр
основности –
двойная связь)N-основания
(O-основания)
RNH2
ROH,
ROR1
(S-основания)
RSH,
R2S
Алкены,
диены
Арены
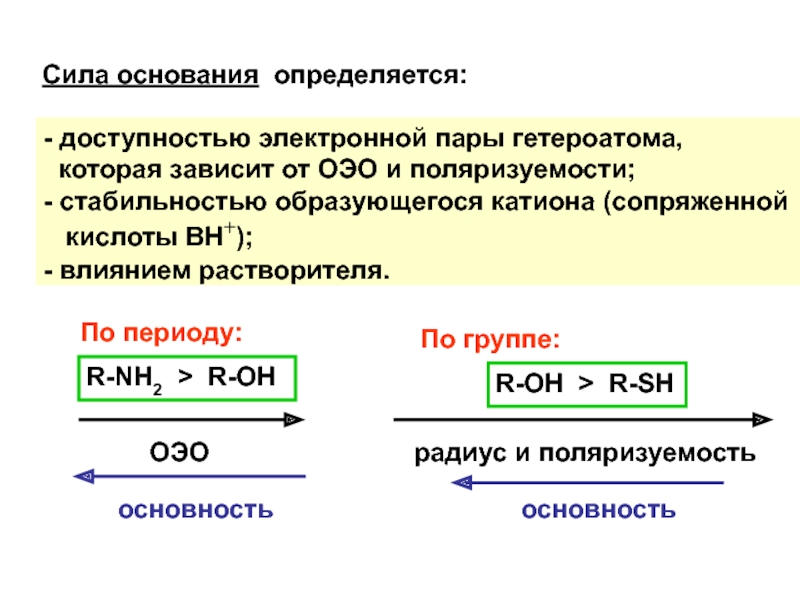
Слайд 13Сила основания определяется:
- доступностью электронной пары гетероатома,
которая зависит
от ОЭО и поляризуемости;
- стабильностью образующегося катиона (сопряженной
кислоты
ВН+);- влиянием растворителя.
R-NH2 > R-OH
R-OH > R-SH
По периоду:
ОЭО
основность
По группе:
радиус и поляризуемость
основность
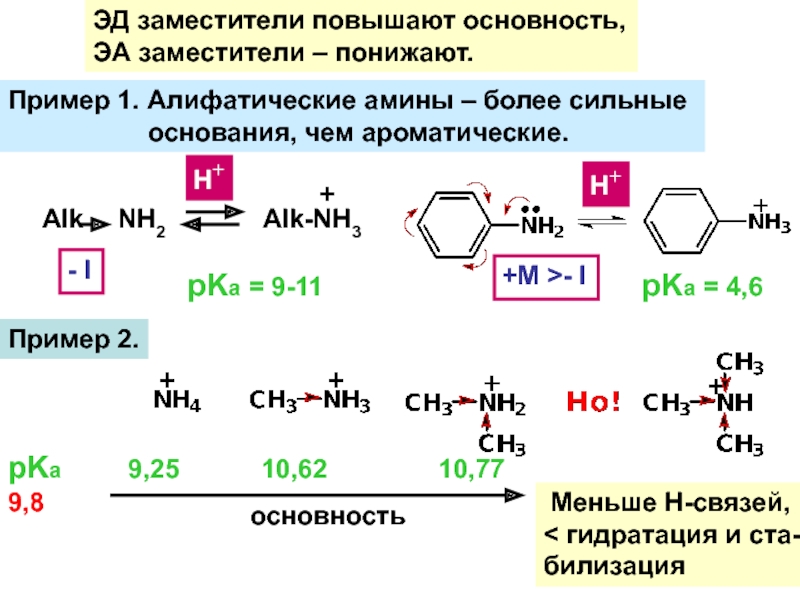
Слайд 14ЭД заместители повышают основность,
ЭА заместители – понижают.
Пример 1. Алифатические амины
– более сильные
основания, чем ароматические.Alk
NH2
H+
Alk-NH3
+
- I
pKа = 9-11
H+
+М >- I
pKа = 4,6
Пример 2.
pKа 9,25 10,62 10,77 9,8
основность
Меньше Н-связей,
< гидратация и ста-
билизация
Слайд 17VI. Кислоты и основания Льюиса
(более общая теория)
Кислоты Льюиса – акцепторы
пары электронов, любые
электронодефицитные соединения (апротонные кислоты),
имеют всегда вакантную орбиталь:
BF3, AlCl3, FeCl3, H+, Na+, Mg2+, (CH3)3C+ и др.Основания Льюиса – доноры пары электронов (как и по
Бренстеду)
В рамках теории Льюиса многие органические реакции
являются кислотно-основными взаимодействиями.
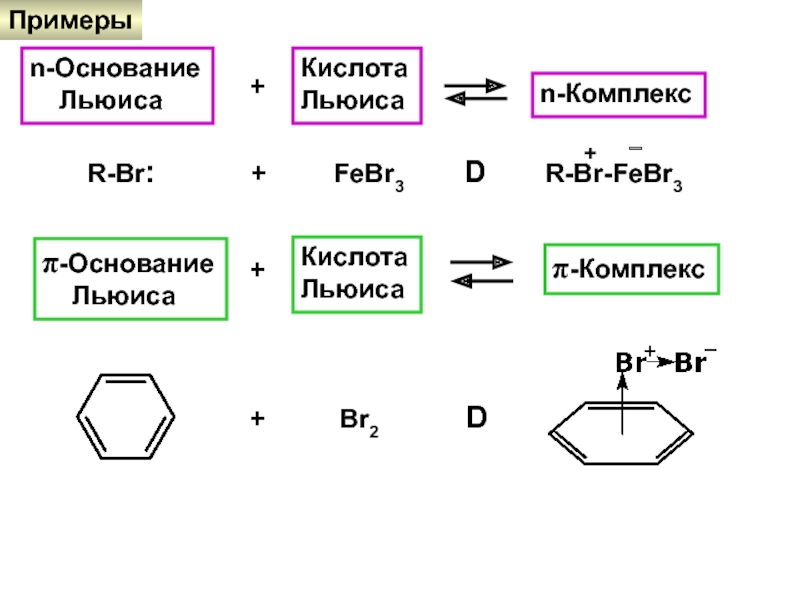
Слайд 18Примеры
n-Основание
Льюиса
+
Кислота
Льюиса
n-Комплекс
R-Br:
+ FeBr3 D
R-Br-FeBr3+
−
π-Основание
Льюиса
Кислота
Льюиса
π-Комплекс
+ Br2 D
+
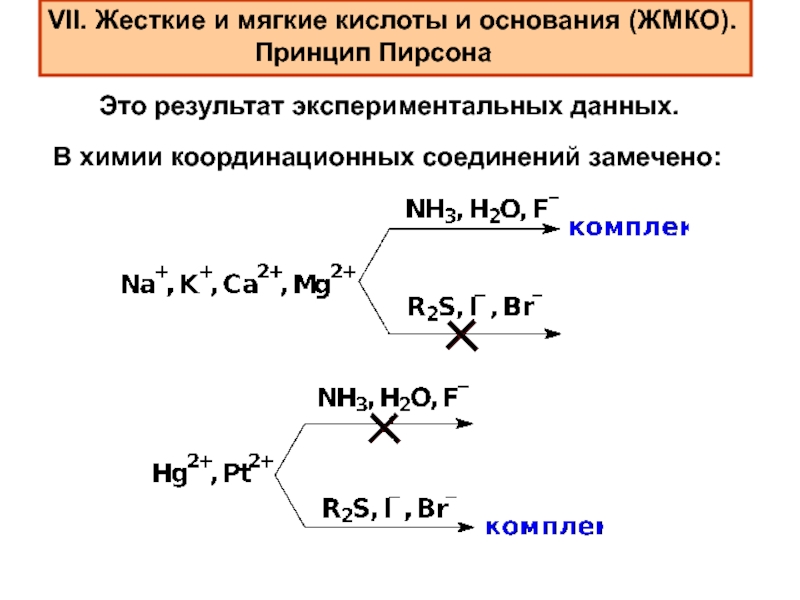
Слайд 19VII. Жесткие и мягкие кислоты и основания (ЖМКО).
Принцип Пирсона
Это результат экспериментальных данных.
В химии координационных соединений замечено:
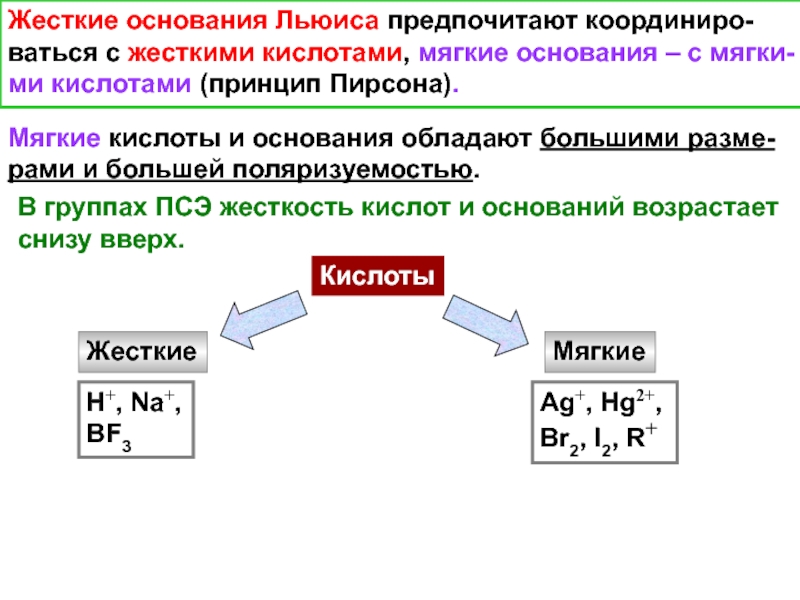
Слайд 20Жесткие основания Льюиса предпочитают координиро-
ваться с жесткими кислотами, мягкие основания
– с мягки-
ми кислотами (принцип Пирсона).
Мягкие кислоты и основания обладают
большими разме-
рами и большей поляризуемостью.Кислоты
Жесткие
Мягкие
H+, Na+,
BF3
Ag+, Hg2+,
Br2, I2, R+
В группах ПСЭ жесткость кислот и оснований возрастает
снизу вверх.
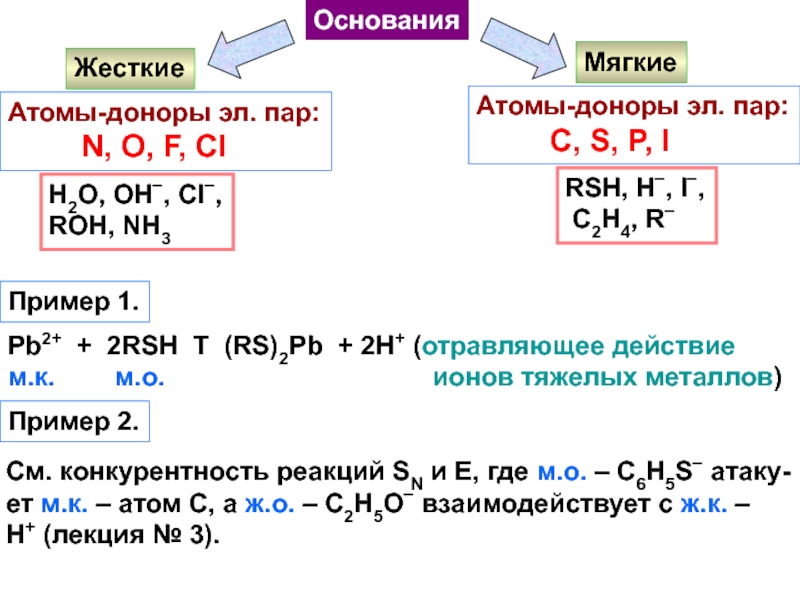
Слайд 21Основания
Жесткие
Мягкие
Атомы-доноры эл. пар:
N, O, F,
Cl
Атомы-доноры эл. пар:
C, S, P,
IH2O, OH−, Cl−,
ROH, NH3
RSH, H−, I−,
C2H4, R−
Пример 1.
Pb2+ + 2RSH T (RS)2Pb + 2H+ (отравляющее действие
м.к. м.о. ионов тяжелых металлов)
Пример 2.
См. конкурентность реакций SN и Е, где м.о. – С6Н5S− атаку-
ет м.к. – атом С, а ж.о. – С2Н5О− взаимодействует с ж.к. –
Н+ (лекция № 3).
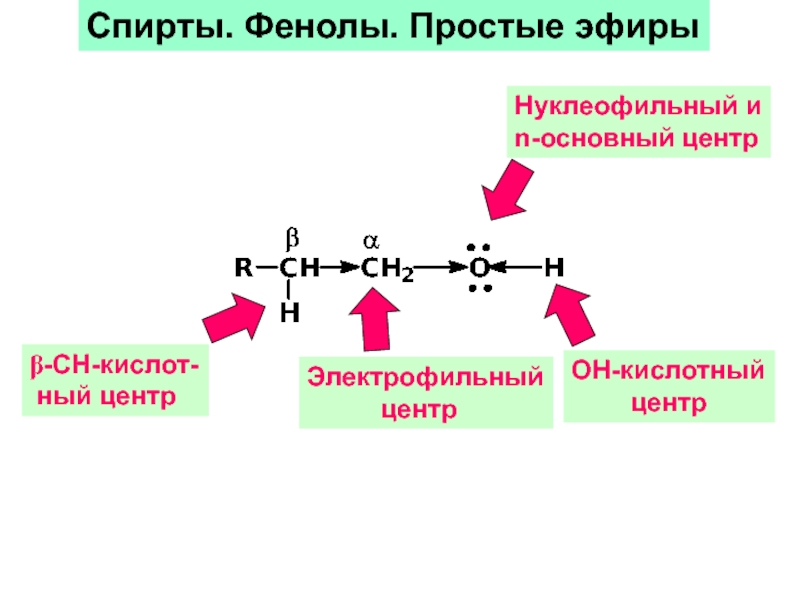
Слайд 22ОН-кислотный
центр
Нуклеофильный и
n-основный центр
Электрофильный
центр
β-CH-кислот-
ный центр
Спирты. Фенолы. Простые эфиры
Слайд 23
Медико-биологическое значение спиртов
Метанол – яд
Этанол – экстракты, настои,
дезинфекция рук,
консервирование препаратовФенол – первый антисептик
ВЖС (цетиловый – С16Н33ОН) – в производстве ПАВ
Слайд 24Реакции R-O-H
Разрыв связи О-Н
Разрыв связи C-O
Кислотные свойства
2. О-Алкилирование
(образование
ROR1)
3. О-Ацилирование
(образование сложных
эфиров)
Взаимодействие с HHal
2. Взаимодействие
с SOCl2,PCl3, PCl5 и др.
3. Элиминирование (внутри-
молекулярная дегидрата-
ция).
Разрыв связей О-Н и С-Н
Реакции окисления
Слайд 25I. Реакции с участием нуклеофильного центра
О-Алкилирование
ROH + R1X
T R-O-R1 + HX
Обычно – в щелочной среде для
образования болеесильного нуклеофила – алкоголят-иона.
нуклеофил
2ROH + 2Na T 2RO−Na+ + H2
Химические свойства спиртов и фенолов
Слайд 26О-Ацилирование (реакция этерификации)
Ac-OH
Ac - ацил
HO-NO2 HO-SO3H
HO-PO3H2
R-O-H + HO-Ac R-O-Ac + H2O
сложный
эфир
Слайд 27а) Реакция с органическими кислотами
- Н2О
При комнатной t0 равновесие установится
через
несколько лет, при 150 0С – через несколько дней!
Для ускорения
реакции применяют катализаторы –
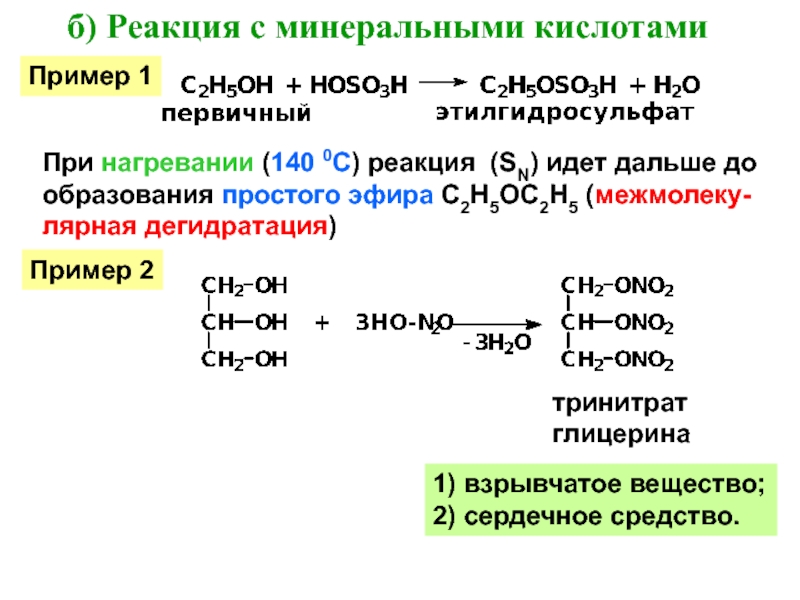
сильные кислоты (Н2SО4).Слайд 29При нагревании (140 0С) реакция (SN) идет дальше до
образования простого
эфира С2Н5ОС2Н5 (межмолеку-
лярная дегидратация)
б) Реакция с минеральными кислотами
тринитрат
глицерина
1) взрывчатое
вещество;2) сердечное средство.
Пример 1
Пример 2
Слайд 30Нитроглицерин
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO +
2H2O
А.Нобель Н.Н. Зинин А.Собреро
расширяет
сосуды
гемоглобин
Слайд 311846 г. – два взрывчатых нитроэфира:
1. Пироксилин (нитроклетчатка), Х. Шенбайн,
2.
Нитроглицерин, А. Собреро.
1854 г. – практическое использование
нитроглицерина Н.Н.Зининым во время
Крымской
войны.1866 г. – полигонные испытания нитроглицерина
под руководством В.Ф.Петрушевского;
Использован стабилизатор – углекислая магнезия
(магнезиальный динамит).
1867 г. – А.Нобель патентует динамит (стабизиза-
тор – кизельгур: инфузорная земля, минерализо-
ванные останки крошечных водорослей)
Слайд 32 «Нитроглицерин для взрывчатого дела был в
первый раз применен
известным химиком
Н.Н.Зининым во время Крымской войны, а
затем В.Ф.Петрушевским
в 60-х годах – ранее изобретения и широкого применения динамита
Нобеля и других препаратов»
Д.И.Менделеев, 1895 г.
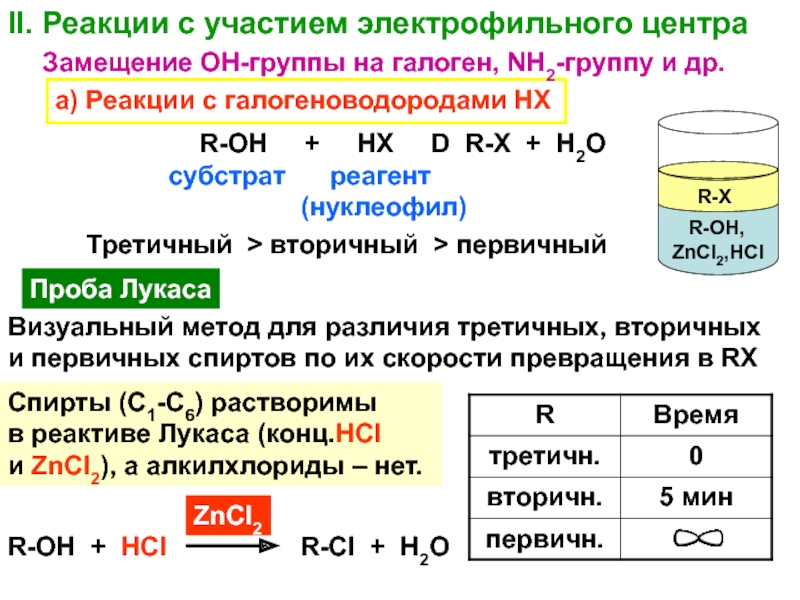
Слайд 33II. Реакции с участием электрофильного центра
а) Реакции с галогеноводородами НХ
Замещение
ОН-группы на галоген, NH2-группу и др.
R-OH +
HX D R-X + H2Oсубстрат
реагент
(нуклеофил)
Третичный > вторичный > первичный
Проба Лукаса
Визуальный метод для различия третичных, вторичных
и первичных спиртов по их скорости превращения в RX
R-OH + HCl
Спирты (С1-С6) растворимы
в реактиве Лукаса (конц.HCl
и ZnCl2), а алкилхлориды – нет.
R-Cl + H2O
ZnCl2
R-OH,
ZnCl2,HCl
R-X
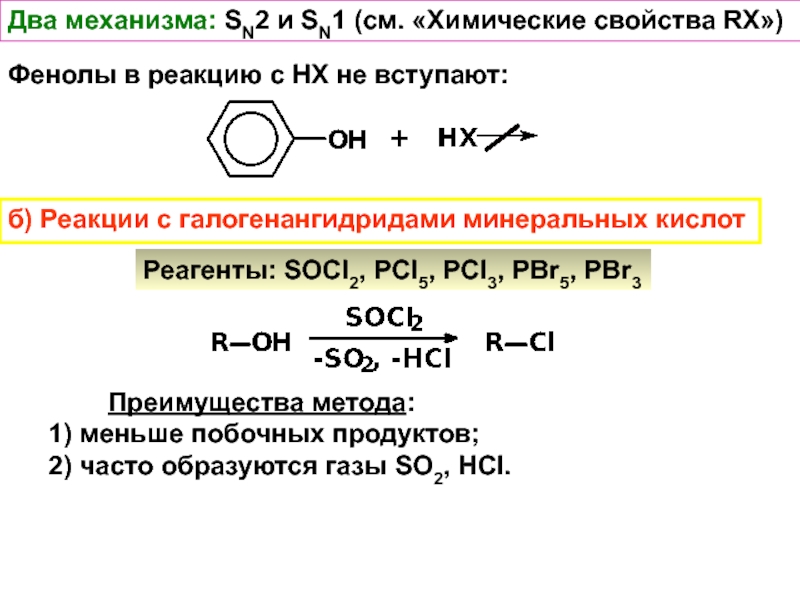
Слайд 34Два механизма: SN2 и SN1 (см. «Химические свойства RX»)
Фенолы
в реакцию с НХ не вступают:
б) Реакции с галогенангидридами минеральных
кислот Преимущества метода:
1) меньше побочных продуктов;
2) часто образуются газы SO2, HCl.
Реагенты: SOCl2, PCl5, PCl3, PBr5, PBr3
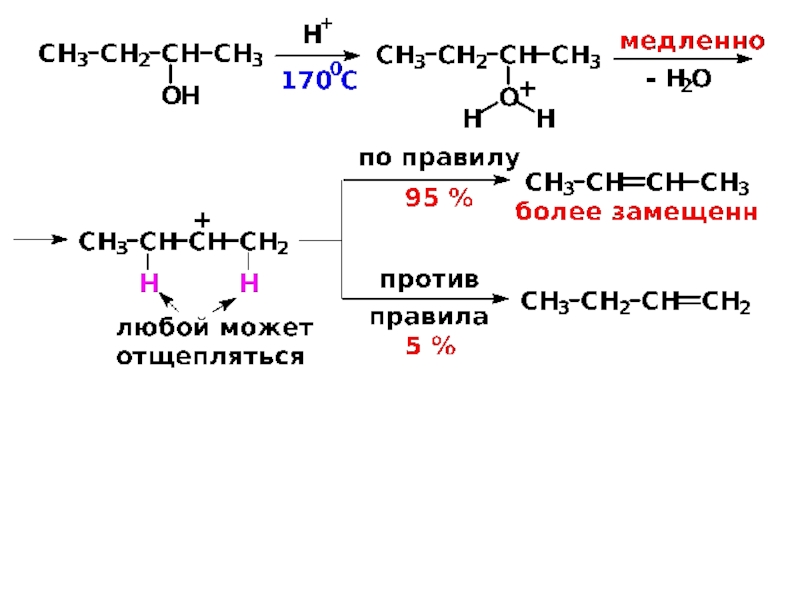
Слайд 35III. Реакции элиминирования
В растворе: катализаторы – минеральные кислоты или
кислоты Льюиса
Реакции с участием СН-кислотного центра
(внутримолекулярная дегидратация)
По правилу Зайцева
Механизм только Е1 (отличие от элиминирования RX),
т.к. для Е2 необходимо сильное основание, что не-
совместимо с кислой средой.
Слайд 39увеличение кислотности
спирт
фенол
Na
NaOH
Na
NaOH
V. Кислотные и основные свойства
Спирты – слабые кислоты и
основания по Бренстеду и
жесткие кислоты и основания по Пирсону Относительная кислотность:
Третичные < вторичные < первичные < СН3ОН < Н2О
Многоатомные спирты (полиолы) обладают повышенной
кислотностью по сравнению с одноатомными.
Относительная основность:
Третичные > вторичные > первичные > СН3ОН
Слайд 40Простые эфиры
R1-O-R2
C2H5-O-C2H5 – диэтиловый, серный (наркоз, растворитель)
краун-эфиры
(crown-корона)
−(−СН2СН2О−)n −
макроциклические
полиэфиры
1967г.– Ч.Педерсен США)
1987г.– Нобелевская премия
K+
Слайд 411. Основные свойства
Слабые n-основания Бренстеда и
жесткие
основания Пирсона
Химические свойства простых эфиров
Слайд 423. Окисление
(легко взрывается)
Обнаружение и удаление пероксидов:
1) ROOH + 2KI +
H2O T I2 + ROH + 2KOH
2. Расщепление галогеноводородами
Ar-O-R +
HX(конц.)t0
R-X + Ar-O-H
Ar-X + R-O-H
Причина:
р,π –сопря-
жение в
фенолах!