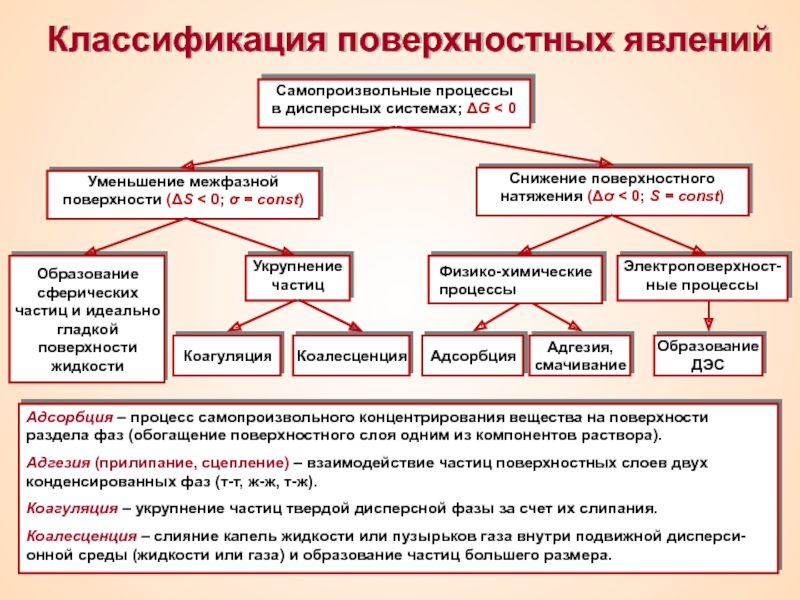
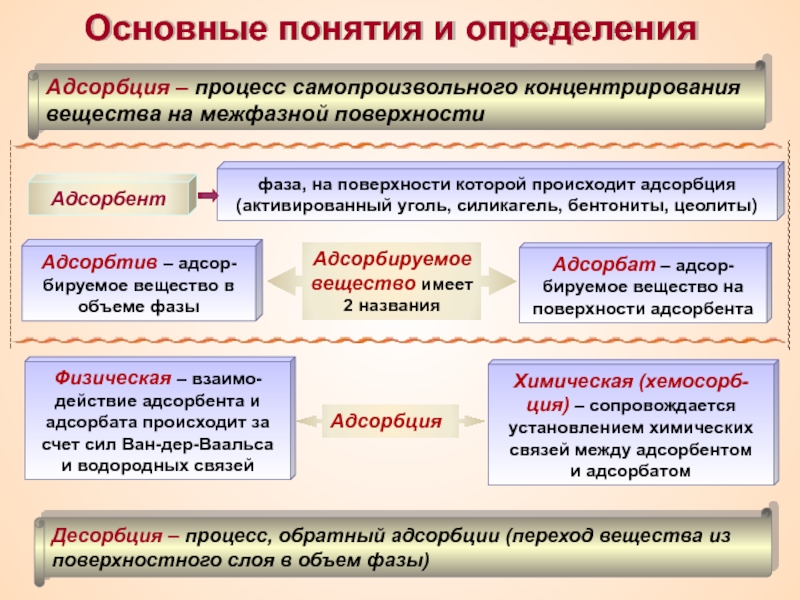
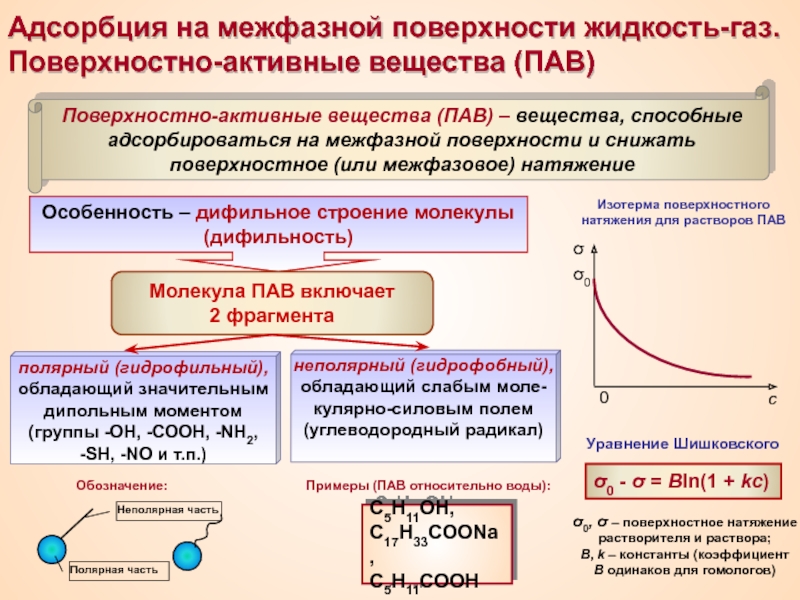
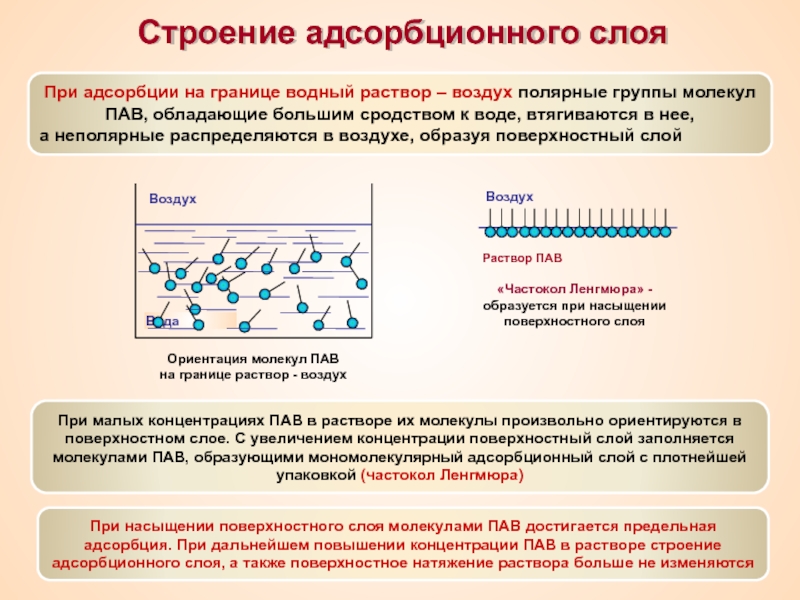
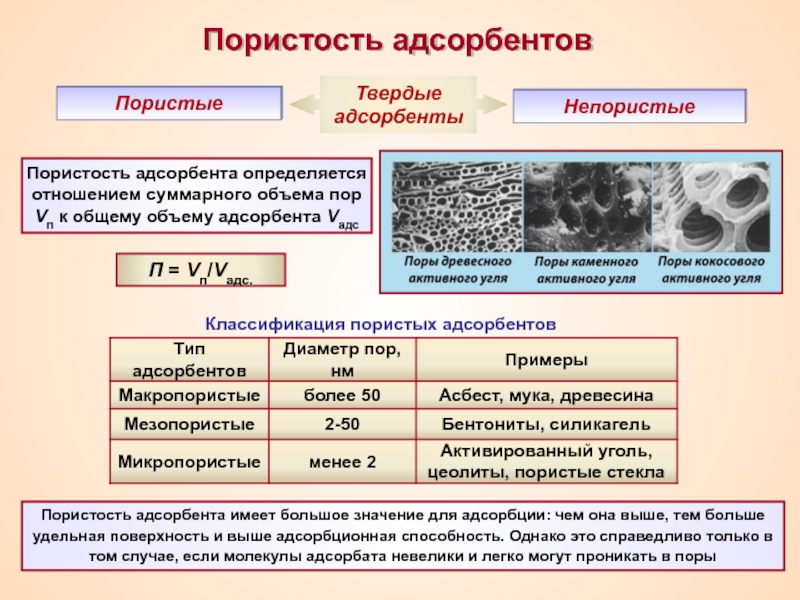
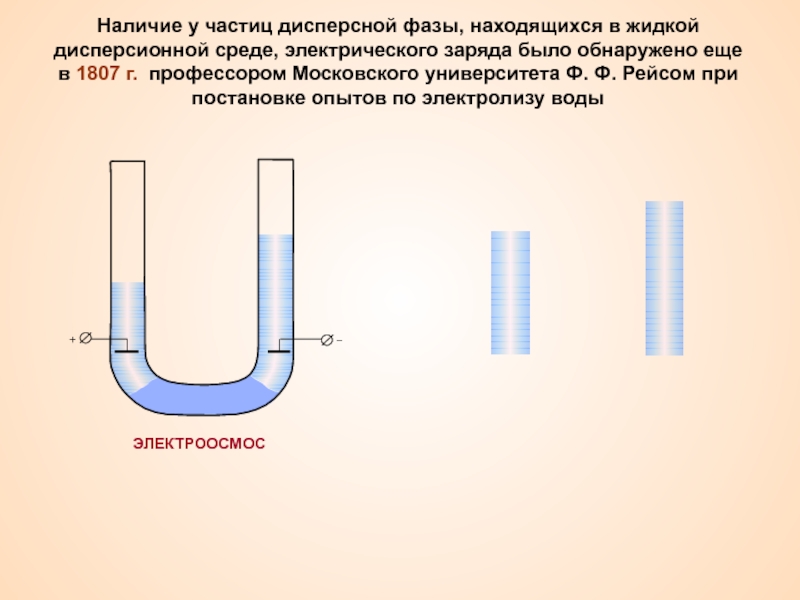
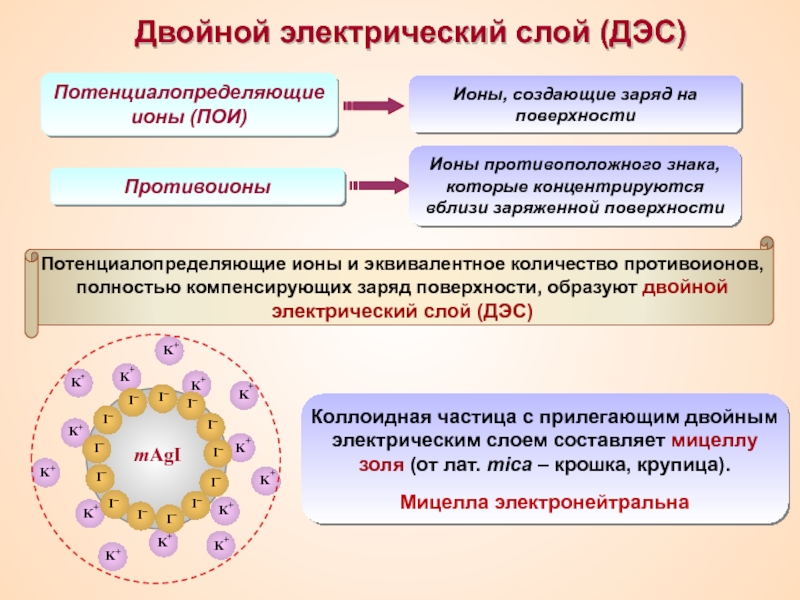
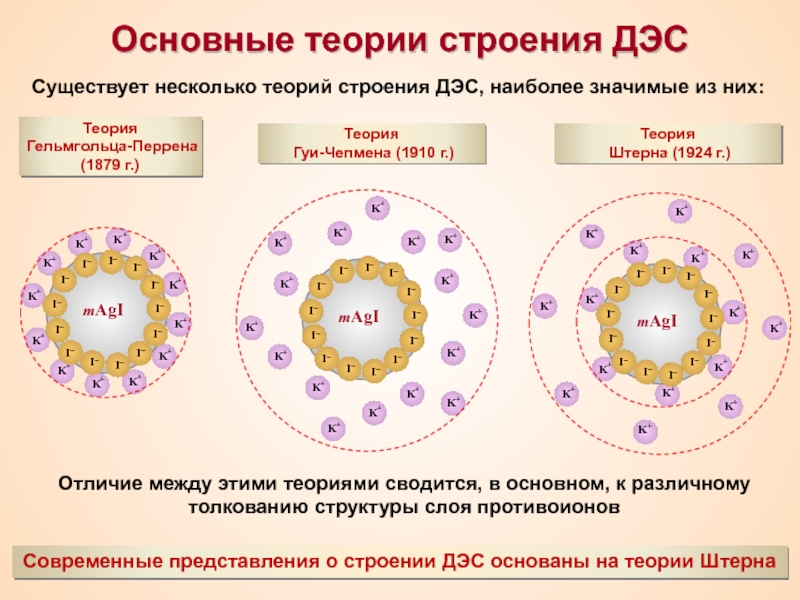
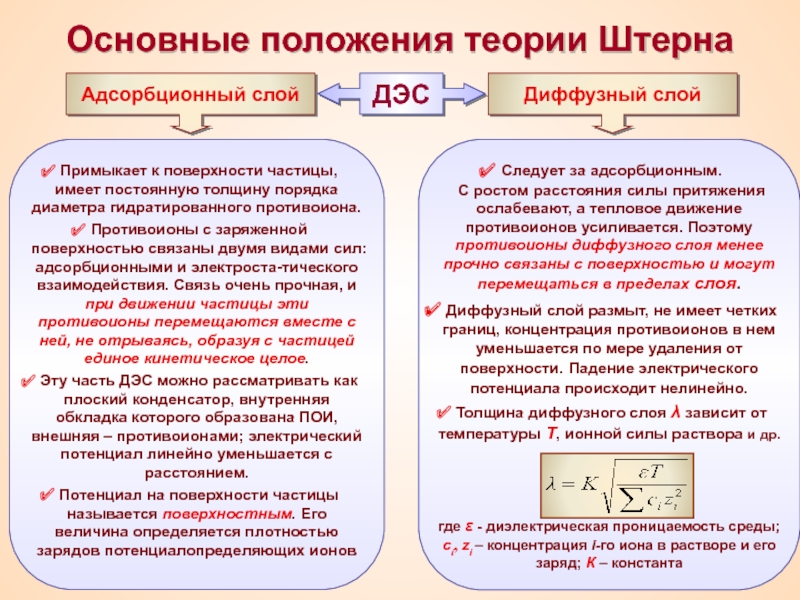
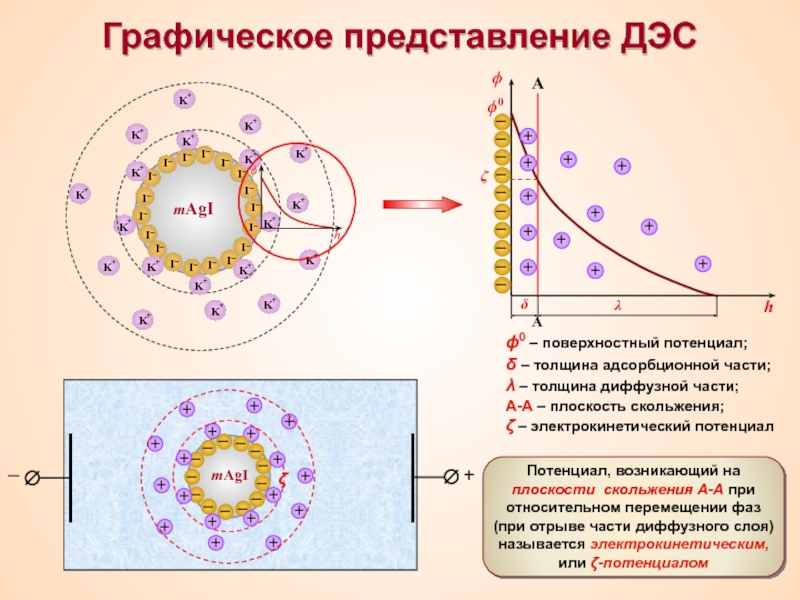
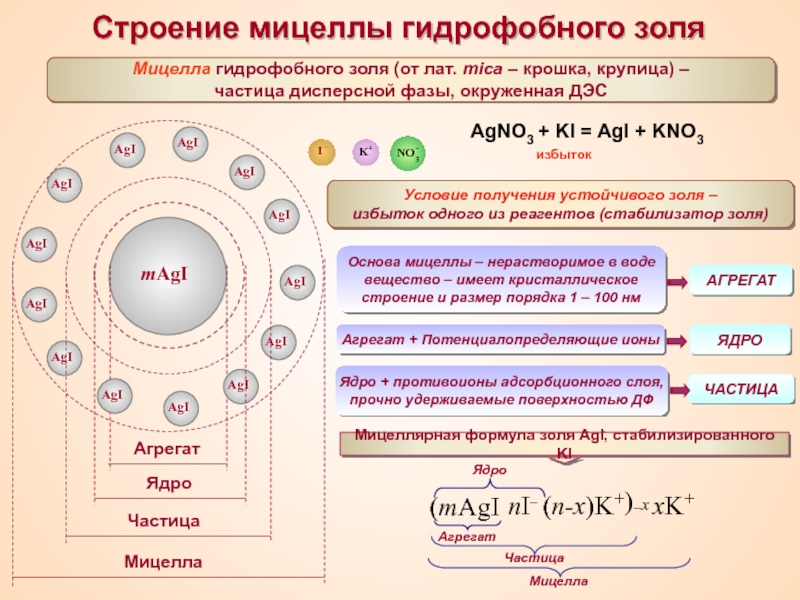
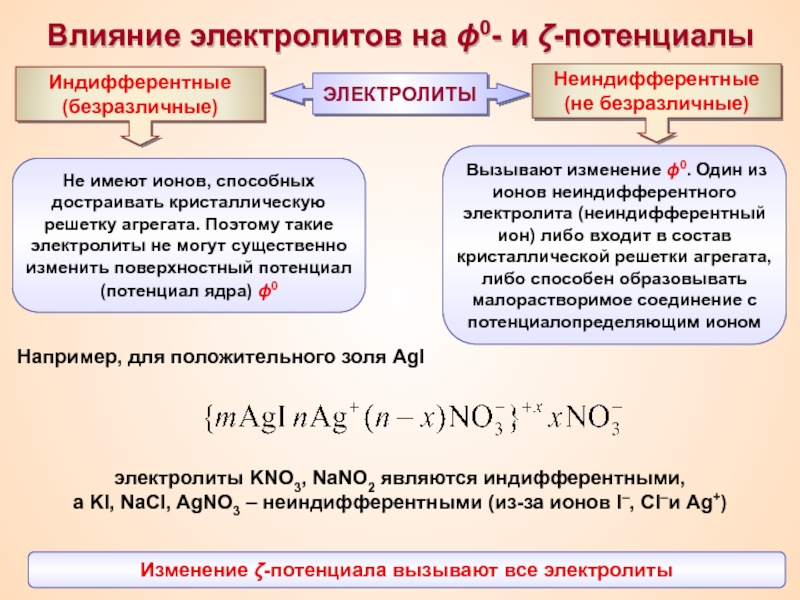
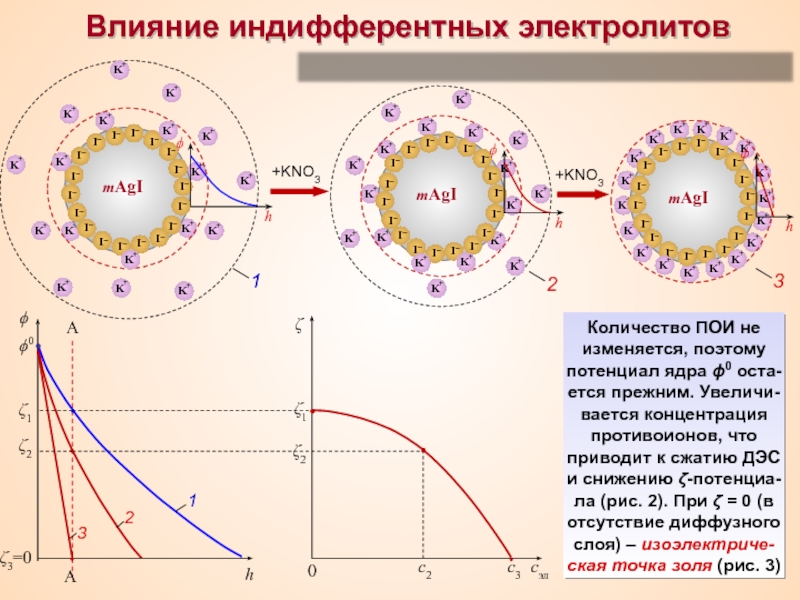
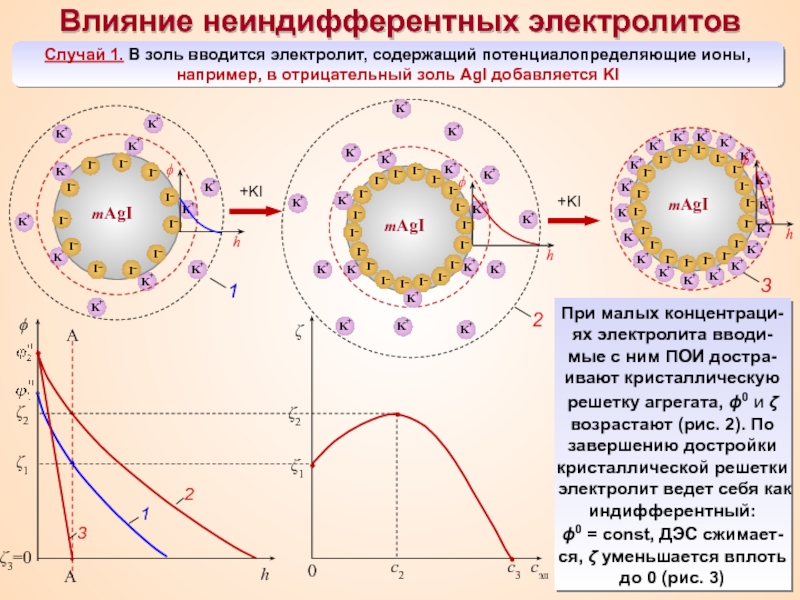
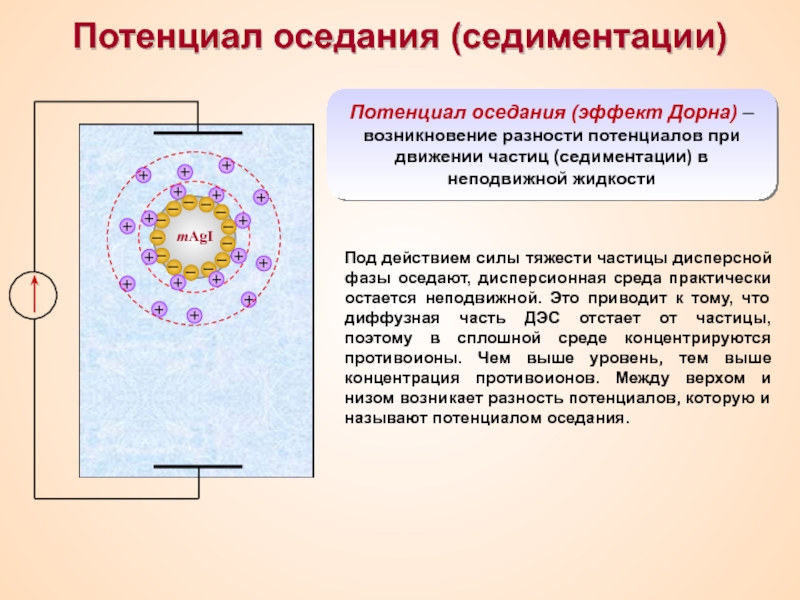
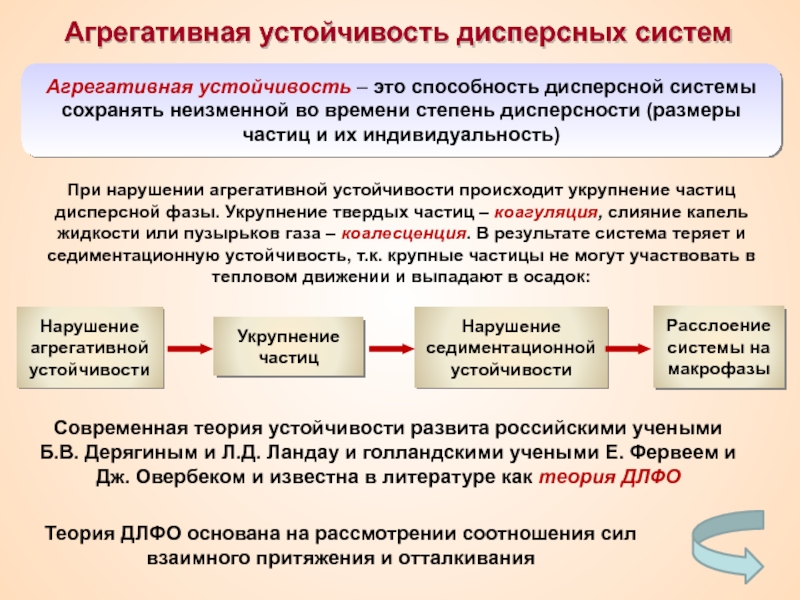
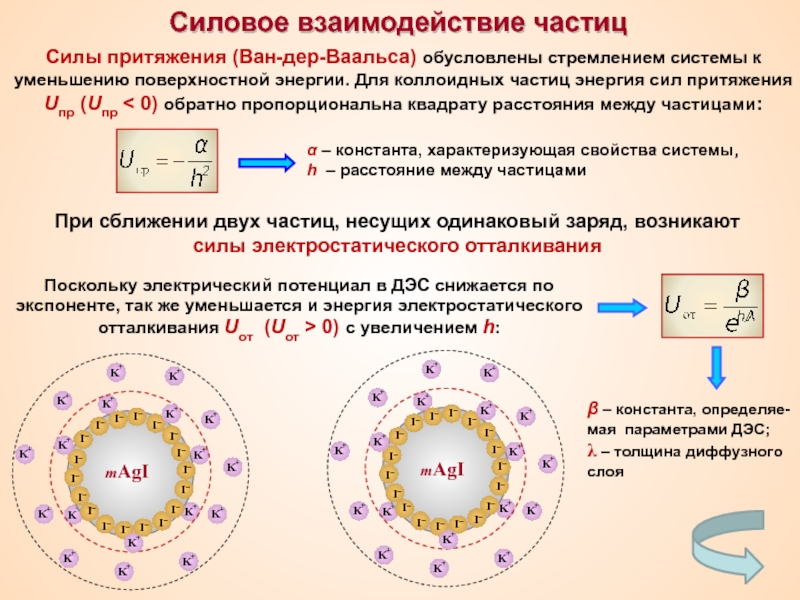
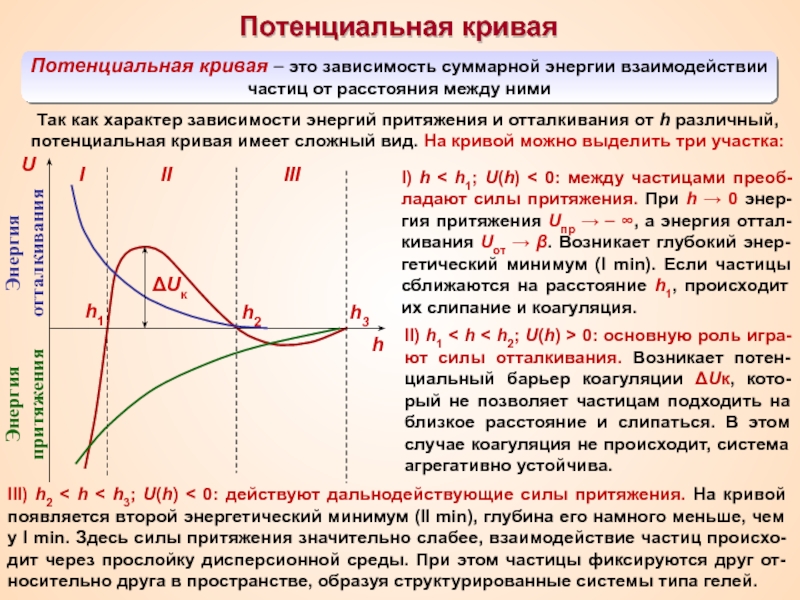
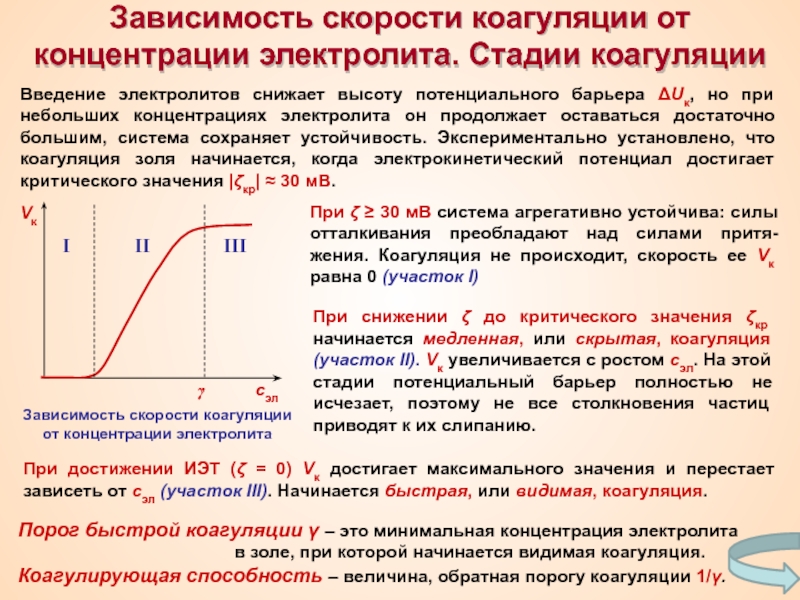
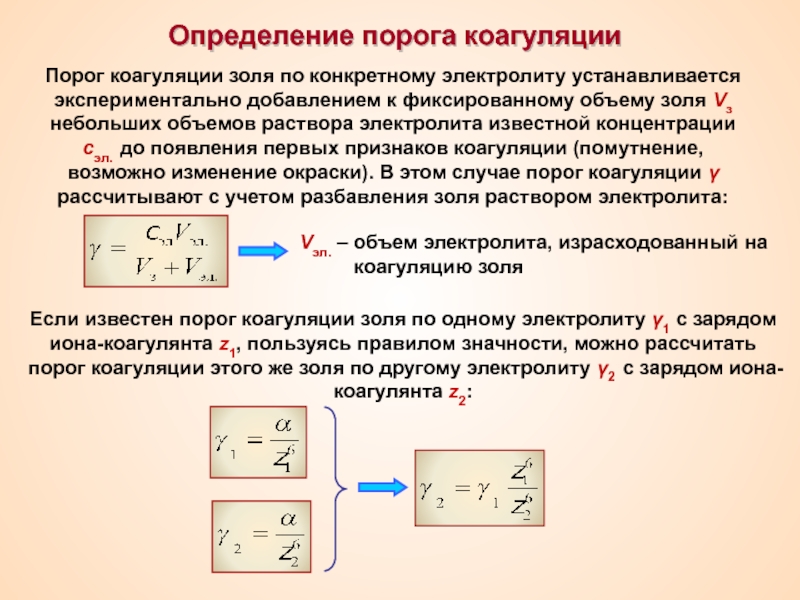
Термин «коллоид» ввел шотландский химик Томас Грэм в 1861 г.
Он обнаружил, что некоторые вещества, например, желатина, агар-агар, кремниевая кислота, при выпаривании водного раствора не кристаллизуются, а образуют студенистые осадки. Кроме того, скорость их диффузии через мембрану очень мала. Некоторые из этих веществ обладают клеющим действием. Подобные вещества и были названы Грэмом «коллоидами».Историческая справка
«Так как желатина представляет собой особый тип веществ,
предложено обозначать вещества этого типа названием
«коллоиды» и трактовать о такой форме агрегации, как о
коллоидном состоянии материи. Противоположным коллоидному
является кристаллическое состояние материи. Вещества,
принадлежащие к данной форме состояния материи, следует
обозначать названием «кристаллоиды».
(Томас Грэм)