Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комунальний заклад Бердянський медичний коледж Запорізької обласної ради
Содержание
- 1. Комунальний заклад Бердянський медичний коледж Запорізької обласної ради
- 2. З елементів шостої групи періодичної системи
- 3. Вода очищенаAqua purificataH2O
- 4. Вода очищена — це вода для приготування
- 5. Випробування на чистотуВизначення рН води: до
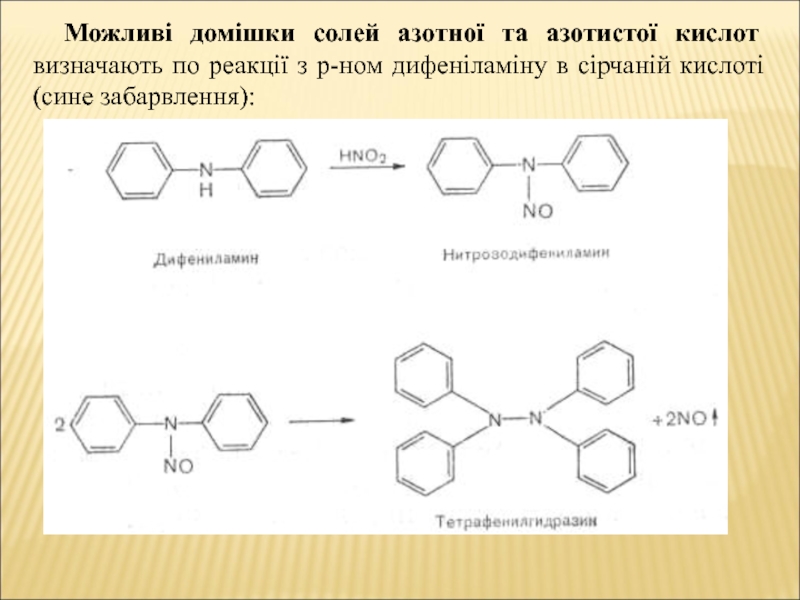
- 6. Можливі домішки солей азотної та азотистої кислот
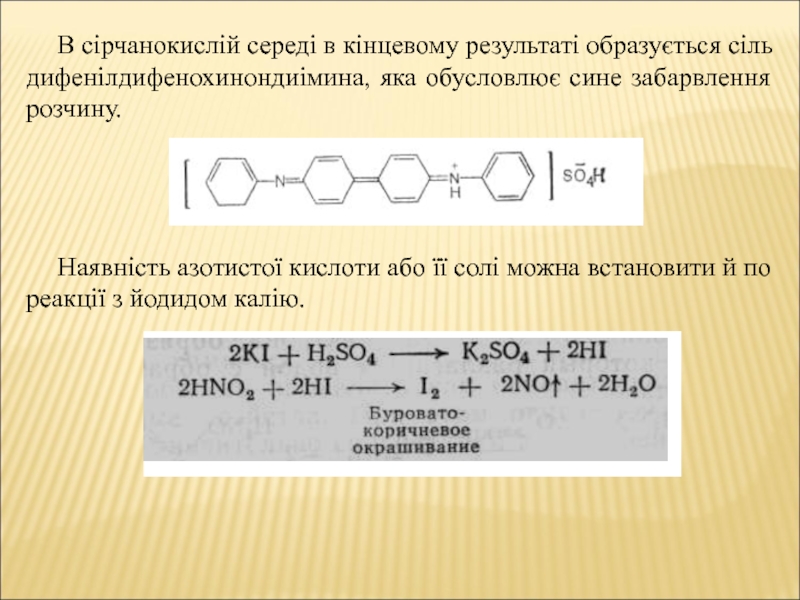
- 7. В сірчанокислій середі в кінцевому результаті образується
- 8. Органічні (відновні) домішки у воді создають умови
- 9. Зберігання. Зберігати воду очищену треба в
- 10. Вода для ін'єкцій — вода, яка використовується
- 11. Сульфур — елемент, відомий людині з найдавніших
- 12. Добування. Окисненням полісульфідів:Властивості. Безбарвні прозорі кристали без
- 13. Ідентифікація. При додаванні до натрію тіосульфату хлороводневої
- 14. 3. Субстанція знебарвлює розчин калію йодиду йодований:4.
- 15. в) сіль натрію, змочена кислотою хлористоводневою розведеною
- 16. Кількісне визначення. Йодометрія, пряме титрування, індикатор —
- 17. Дякую за увагу !
- 18. Скачать презентанцию
З елементів шостої групи періодичної системи цікавість для медицини представляють кисень та сіра, які вже самі собою являються фармацевтичними засобами, мають значення також й їх різноманітні сполучення.Хімічні властивості елементів підгрупи
Слайды и текст этой презентации
Слайд 1Комунальний заклад «Бердянський медичний коледж» Запорізької обласної ради лекція з ФАРМАЦЕВТИЧНОЇ
Слайд 2
З елементів шостої групи періодичної системи цікавість для медицини
представляють кисень та сіра, які вже самі собою являються фармацевтичними
засобами, мають значення також й їх різноманітні сполучення.Хімічні властивості елементів підгрупи кисню свідчать про різко виявлений неметалічний характер цих елементів.
У сполученнях елементи підгрупи кисню проявляють як негативну, так і позитивну ступінь окислення. У сполученнях з металами та гідрогеном їх ступень окислення, як правило, дорівнює ─2. У сполученнях з не металами вона може бути +4 і +6. Виключення має сам кисень. У сполученнях з фтором його ступень окислення дорівнює +2, у сполученнях зо всіма іншими елементами вона негативна і дорівнює ─2.
Слайд 4
Вода очищена — це вода для приготування лікарських засобів.
Виробництво.
Воду очищену одержують із води питної дистиляцією або іонним обміном.
Властивості.
Повинна бути прозора, безбарвна, без запаху та смаку; рН повинен бути у межах 5,0-6,8; густина при 40С дорівнює 1,000; температура кипіння 100 0С при тиску 760 мм рт. ст. Ці властивості визначають ідентифікацію і в той же час доброякісність води очищеної.Слайд 5
Випробування на чистоту
Визначення рН води: до невеликій кількості свіжої
кип’яченої води додають 2-3 краплі метилового червоного ─ жовте забарвлення,
якщо вода нейтральна. При додаванні краплі 0,01 н р-ну НCl повинне з’явитися рожеве забарвлення.Випробування на домішки солей: невелику кількість води випаровують. Після випаровування 100 мл води очищеної сухого залишку не повинно бути більше 1 мг (0,001 %).
Вода очищена не повинна давати позитивних реакцій на хлориди, сульфати, солі кальцію та тяжкі метали, диоксид вуглецю.
Слайд 6Можливі домішки солей азотної та азотистої кислот визначають по реакції
з р-ном дифеніламіну в сірчаній кислоті (сине забарвлення):
Слайд 7В сірчанокислій середі в кінцевому результаті образується сіль дифенілдифенохинондиімина, яка
обусловлює сине забарвлення розчину.
Наявність азотистої кислоти або її солі
можна встановити й по реакції з йодидом калію.Слайд 8Органічні (відновні) домішки у воді создають умови для розвитку в
неї різноманітних пліснявих грибків, бактерій, сапрофитів та ін. Тому випробування
на органічі домішки є обов’язковим для води очищеної. Для цього до 100 мл води додають 1 мл 0,01 н. р-ну перманганату калію, підкисленого розведеною сірчаною кислотою, й доводять воду до кипіння. Рожеве забарвлення води повинне зберігатися (відсутність відновнихречовин). Якщо у воді присутні органічні домішки, р-н перманганату калію знебарвлюється.Випробування на амоніак, солі амонію (не повинно бути). Амоніак відкривається звичайно реактивом Несслера по жовтому або бурому забарвленню осаду або рідини.
Допускається домішка амоніаку у воді очищеній у кількості не більше 0,00002%.
Слайд 9 Зберігання. Зберігати воду очищену треба в добре закупорених бутилях,
наповнених доверху. Пробки, якими закупорюють бутилі, повинні забезпечуватися хлоркальцієвою трубкою,
заповненою натронним вапном та ватою для запобігання потрапляння у воду диоксиду вуглецю. Тривале зберігання в стекляній тарі навіть з хімічно стійкого скла завжди приводить до забруднення продуктами вилужнювання. Тому воду очищену допускається зберігати не довше 3 діб.Вода для ін'єкцій
Aqua purificata pro injectionibus
H2O М.м. 18.02
Слайд 10Вода для ін'єкцій — вода, яка використовується як розчинник при
приготуванні лікарських засобів для парентерального застосування (вода для ін'єкцій) або
для розчинення, або для розведення субстанцій або лікарських засобів для парентерального застосування перед використанням (вода для ін'єкцій стерильна).Виробництво. Воду для ін'єкцій одержують із води питної або води очищеної шляхом дистиляції на обладнанні, частини якого, що контактують із водою, виготовлені з нейтрального скла, кварцу або підхожого металу. Першу порцію води, одержану на початку роботи, відкидають, потім дистилят збирають.
Властивості, ідентифікація ─ див. «Вода очищена»
Випробовування на чистоту. Ті ж самі, що й для води очищеної, а також проводять випробування на бактеріальні ендотоксини.
Слайд 11Сульфур — елемент, відомий людині з найдавніших часів. У медичній
практиці застосовується як елементарна сірка, так і різноманітні сполуки сульфуру,
серед них натрію тіосульфат.Натрію тіосульфат
(Natrii thiosulfas)
М.м. 248,2
Слайд 12
Добування. Окисненням полісульфідів:
Властивості. Безбарвні прозорі кристали без запаху, солонкуватого смаку.
В сухому повітрі вивітрюється, у вологому — злегка розпливається. Дуже
легкорозчинний у воді, практично нерозчинний у спирті. Собою являє сіль тіосірчаної кислоти.Слайд 13Ідентифікація.
При додаванні до натрію тіосульфату хлороводневої кислоти відбувається помутніння
через виділення газу, який забарвлює йодкрохмальний папір у синій колір:
При
додаванні до лікарської речовини надлишку арґентуму нітрату утворюється білий осад, який повільно жовтіє, буріє, чорніє:Слайд 143. Субстанція знебарвлює розчин калію йодиду йодований:
4. Реакції на іони
Na+:
а) з розчином калію піроантимонату (калію гексагід-роксостибіату (V)) - утворюється
білий осадб) з розчином реактиву метоксифенілоцтової кислоти – ут-ворюється об'ємний білий кристалічний осад:
Осад розчиняється при додаванні розчину амоніаку розведеного і не випадає знову при наступному додаванні розчину амонію карбонату.
Слайд 15в) сіль натрію, змочена кислотою хлористоводневою розведеною і внесена в
безбарвне полум'я, забарвлює його у жовтий колір.
Випробування на чистоту.
У препараті не допускається наявність домішок миш’яку, селену, карбонатів, сульфатів, сульфідів, сульфітів, солей кальцію.Специфічну домішку сульфідів визначають з натрію нітропрусидом:
Не повинно з'являтися фіолетове забарвлення.
ДФУ допускає наявність домішок хлоридів, солей тяжких металів у межах еталону.