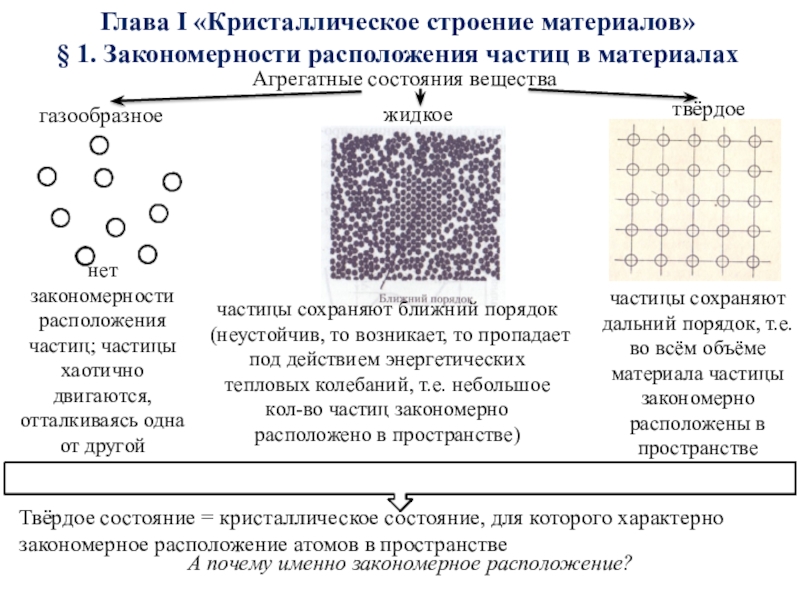
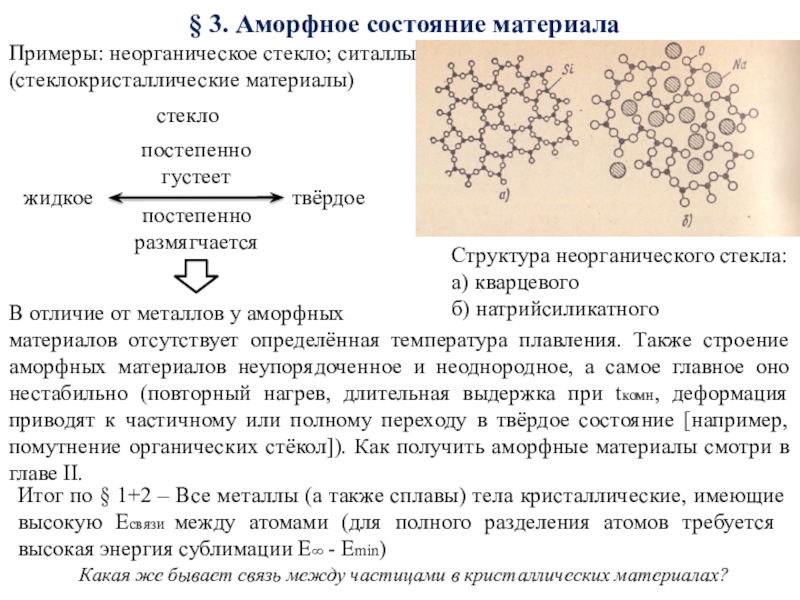
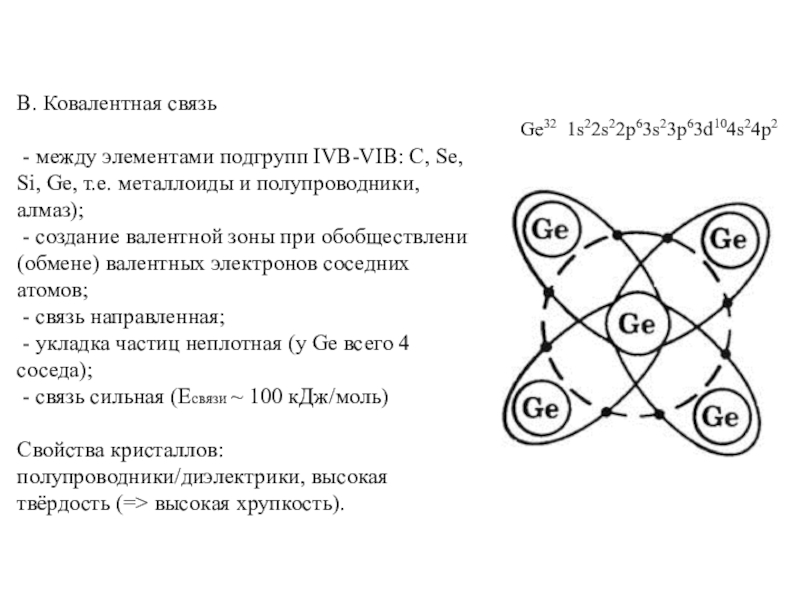
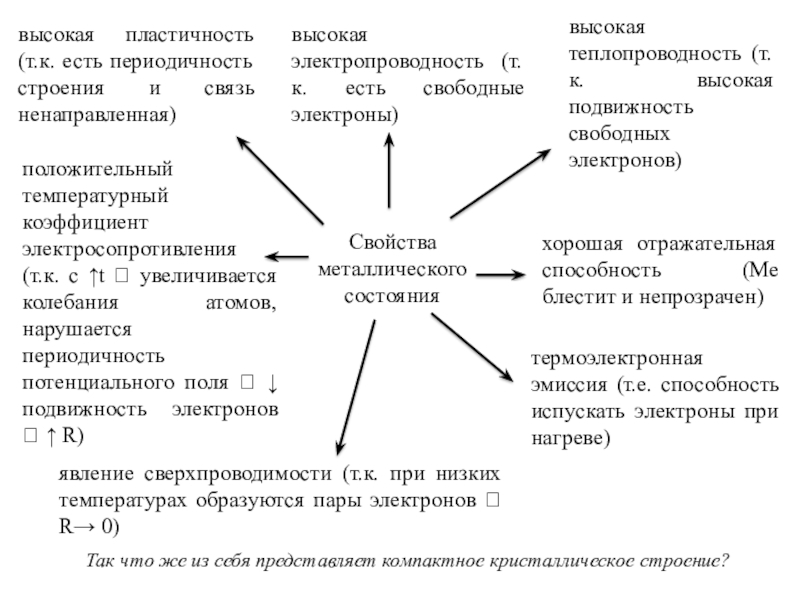
= Оц1 =Оц2
(0-14 –
«2»; 15-17 – «3»; 18-20 – «4»; 21-25 – «5»)
Если:
«2» – незачёт+данные модули выносятся на экзамен;
от «3» до «5» – зачёт+данные модули не выносятся на экзамен.
Лабораторный практикум
4 раза х 2 л/р = 8 л/р (выполнение+защита)
Домашнее задание (выполнение+защита)
0...20 баллов
<12 баллов – незачёт по лаб-му практикуму+недопуск до экзамена
(0-11 – «2»; 12-13 – «3»; 14-16 – «4»; 17-20 – «5»)
Экзамен
по II части курса
0...30 баллов
0...20 + 0...30 = 0...50 баллов = Оц3
(0-29 – «2»; 30-33 – «3»; 34-41 – «4»; 42-50 – «5»)
Если:
«2» – незачёт по II части курса => экзамен на пересдачу;
от «3» до «5» – зачёт по II части курса.
Итог по экзамену (при успешной сдаче всего перечисленного)
Оценка за экзамен = ( Оц1 + Оц2 + Оц3 ) / 3
(0-17 – «2»; 18-20– «3»; 21-25 – «4»; 26-30 – «5»)