Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лабораторная №3
Содержание
- 1. Лабораторная №3
- 2. ЦельСформировать представления о гомологическом ряде алкановЗадачиПознакомиться с
- 3. Алканыявляются насыщенными углеводородами и содержат максимально возможное
- 4. Теоретическая часть
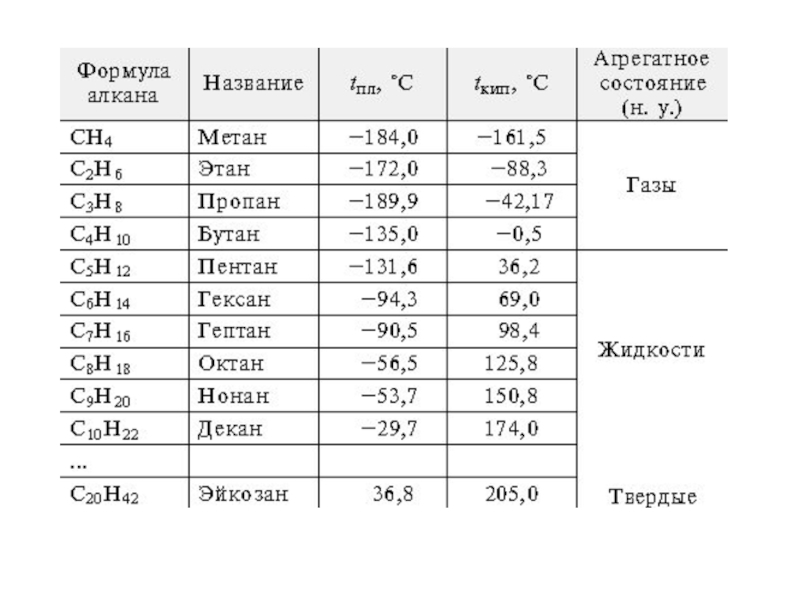
- 5. Слайд 5
- 6. Задание 1Изобразите приведенные выше вещества, обозначая черточкой связь углерода с водородом.
- 7. Задание 2Изобразите сокращенные формулы гомологического ряда алканов, (до С=15)
- 8. Алканы имеют низкую химическую активность. Это объясняется
- 9. Галогенирование алкановпротекает по радикальному механизму. Для инициирования реакции необходимо
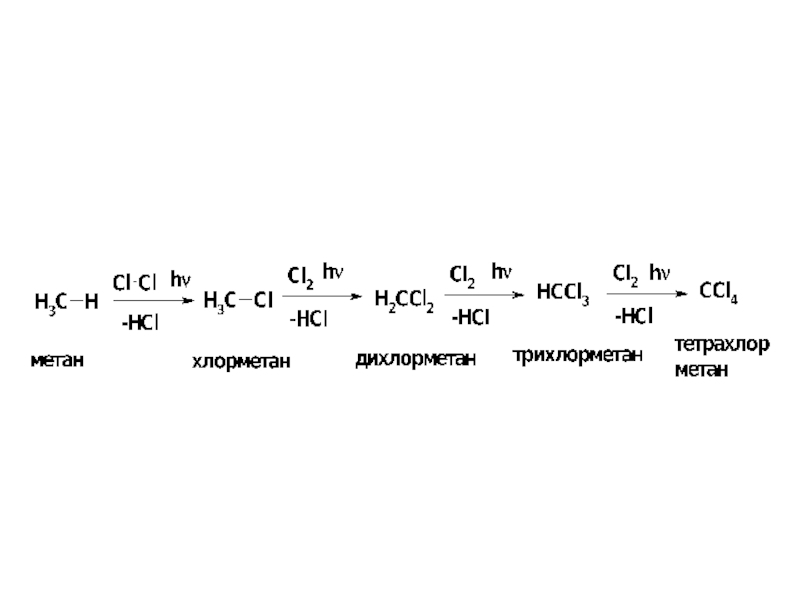
- 10. Слайд 10
- 11. Задание 3Используя образец химической реакции, напишите уравнение
- 12. Изомерия насыщенных углеводородов вывод формул строения
- 13. Углеродный атом, обозначенный буквой , затратил на
- 14. при отнятии атома водорода от молекулы пропана
- 15. При замещении одного атома водорода в молекуле
- 16. Один образуется при соединении метила с первичным
- 17. На холоду серная кислота (олеум) почти не
- 18. Образующиеся вещества называют сульфокислотоми. Реакция сульфирования имеет
- 19. Окисление предельных углеводородов Практическая часть
- 20. ЦельИзучение химических свойств предельных углеводородов
- 21. Реактивы и материалыжидкие алканыперманганат калия (1 н. раствор) углекислый натрий (1 н. раствор) пипеткипробирки
- 22. Ход работыВ пробирку помещают 1 каплю исследуемого
- 23. ВыводФиолетовая окраска водного слоя не изменяется, так как алканы в этих условиях не окисляются.
- 24. Вопросы для самоподготовкиСульфохлорирование (реакция Рида)Реакции окисления алкановАлканы,
- 25. Скачать презентанцию
ЦельСформировать представления о гомологическом ряде алкановЗадачиПознакомиться с взаимосвязью между молекулярной массой и свойствами веществаИзучить основные вещества гомологического ряда алканов
Слайды и текст этой презентации
Слайд 2Цель
Сформировать представления о гомологическом ряде алканов
Задачи
Познакомиться с взаимосвязью между молекулярной
массой и свойствами вещества
Слайд 3Алканы
являются насыщенными углеводородами и содержат максимально возможное число атомов водорода.
Каждый
атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные
орбитали атома С идентичны по форме и энергии,Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью..
Простейшим представителем класса является метан (CH4).
Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Билл и М. К. Уайтин
Слайд 6Задание 1
Изобразите приведенные выше вещества, обозначая черточкой связь углерода с
водородом.
Слайд 8Алканы имеют низкую химическую активность. Это объясняется тем, что единичные
связи C—H и C—C относительно прочны, и их сложно разрушить.
Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.Слайд 9Галогенирование алканов
протекает по радикальному механизму.
Для инициирования реакции необходимо смесь алкана и
галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида
(если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры.
Слайд 11Задание 3
Используя образец химической реакции, напишите уравнение реакции для образование
хлорпроизводных для алканов до С = 5
Слайд 12Изомерия насыщенных углеводородов
вывод формул строения более сложных предельных углеводородов
- путем последовательного замещения атома водорода в молекуле более простого
углеводорода на радикал метил.Из этана С2Н6 таким образом может быть выведен пропан – углеводород состава С3Н8, которому соответствует одновалентный радикал пропил состава С3Н7—.
Напишем еще раз упрощенную структурную формулу пропана, обозначив в ней атомы углерода:
СН3— СН2— СН3.
Из этой формулы видно, что в пропане не все углеродные атомы одинаковы по своему положению в молекуле.
Каждый из двух атомов углерода, обозначенных буквой , затратил только по одной валентной связи на соединение с другим углеродным атомом. Такие атомы углерода называют первичными углеродными атомами.
Слайд 13Углеродный атом, обозначенный буквой , затратил на соединение с другими
углеродными атомами две валентные связи и поэтому называется вторичным углеродным
атомом.Первичные углеродные атомы входят в состав метильных групп, вторичный – в состав группы СН2 , которую называют метиленовой группой.
Первичные углеродные атомы в молекуле пропана равноценны между собой, так как они связаны с одним и тем же вторичным углеродным атомом.
Следовательно, равноценны и все атомы водорода, связанные с обоими первичными углеродными атомами
Слайд 14при отнятии атома водорода от молекулы пропана могут образоваться два
остатка состава С3Н7
один при отнятии водорода от каждого из
первичных углеродных атомов; его называют первичным пропилом, или просто пропиломвторой – при отнятии водорода от вторичного углеродного атома; его называют вторичным пропилом, или изопропилом:
СН3—СН2—СН2 СН3—СН—СН3
Слайд 15При замещении одного атома водорода в молекуле пропана на остаток
метил или, что то же самое, при соединении пропильного остатка
С3Н7 с метильным остатком - СН3 образуется следующий в ряду гомолог С4Н10 углеводород, получивший название бутан.следует сделать вывод, что бутанов может быть два.
Слайд 16Один образуется при соединении метила с первичным пропильным остатком
Второй углерод
состава С4Н10 образуется при соединении метила с вторичным пропильным остатком,
и его строение может быть выражено формуламиСлайд 17На холоду серная кислота (олеум) почти не действует на предельные
углеводороды
при высокой температуре она может их окислять.
При умеренном нагревании
углеводороды, преимущественно изостроения, с третичным углеродом в молекуле, вступают во взаимодействие с дымящейся серной кислотой. В результате выделяется вода и образуется продукт замещения водород при третичном углероде на остаток серной кислоты – SO2OH (сульфогруппу)























![Звуки [ p] и [ р’ ]
БУКВА Р
Подготовительная
группа](/img/tmb/6/585963/56560ced688c38d77a33d5a7dfeaec1c-800x.jpg)