Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
lekcija_14.ppt
Содержание
- 1. lekcija_14.ppt
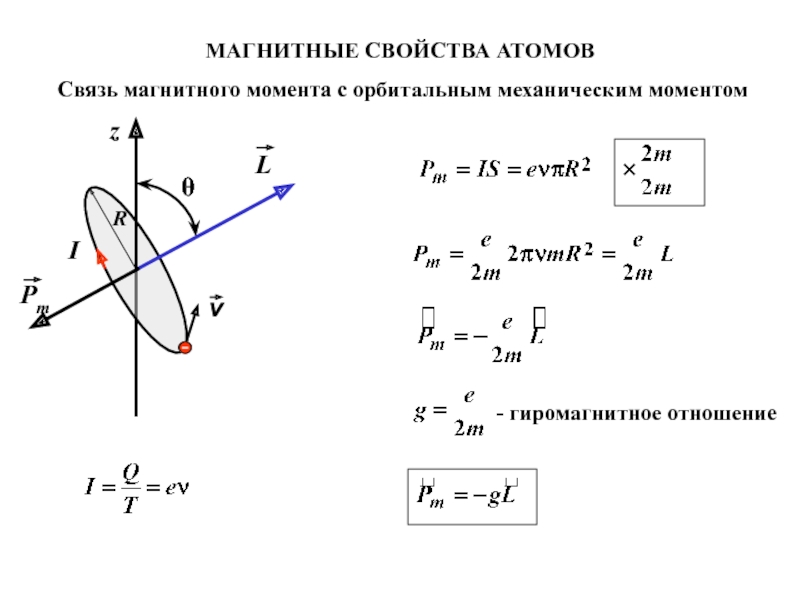
- 2. МАГНИТНЫЕ СВОЙСТВА АТОМОВСвязь магнитного момента с орбитальным механическим моментом- гиромагнитное отношение
- 3. Слайд 3
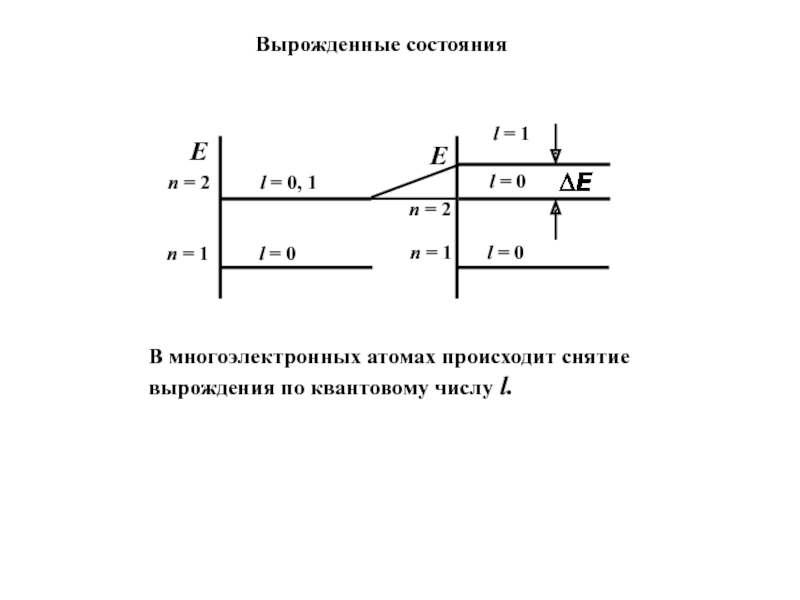
- 4. Вырожденные состоянияВ многоэлектронных атомах происходит снятие вырождения по квантовому числу l.
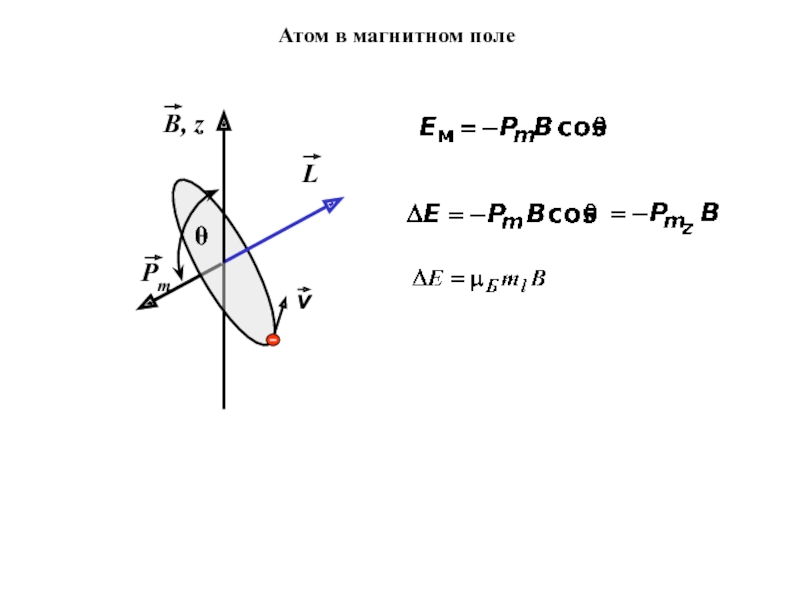
- 5. Атом в магнитном поле
- 6. ЭФФЕКТ ЗЕЕМАНАB = 0B ≈ 1 ТлТриплет
- 7. n = 2n = 1Eml = 0
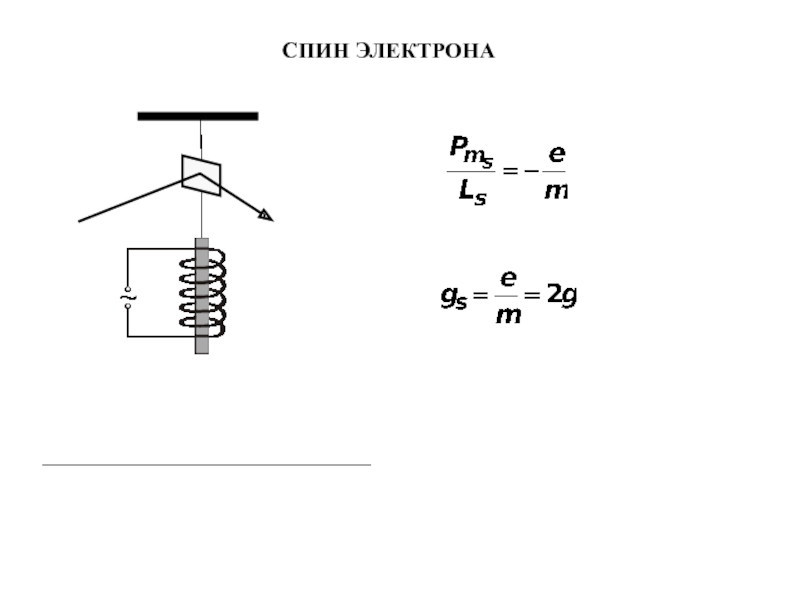
- 8. СПИН ЭЛЕКТРОНА
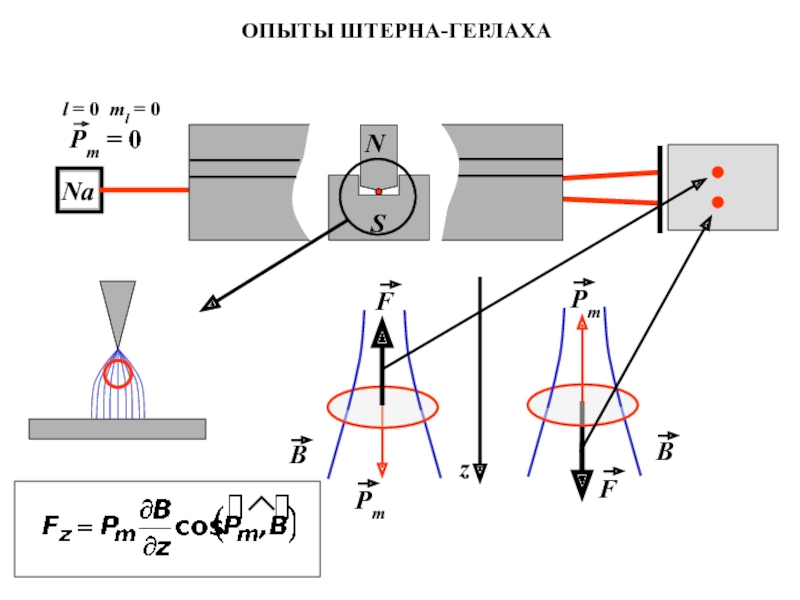
- 9. ОПЫТЫ ШТЕРНА-ГЕРЛАХАl = 0 ml = 0Na
- 10. s - спиновое квантовое число
- 11. − кратность вырожденияn = 1, 2, 3,
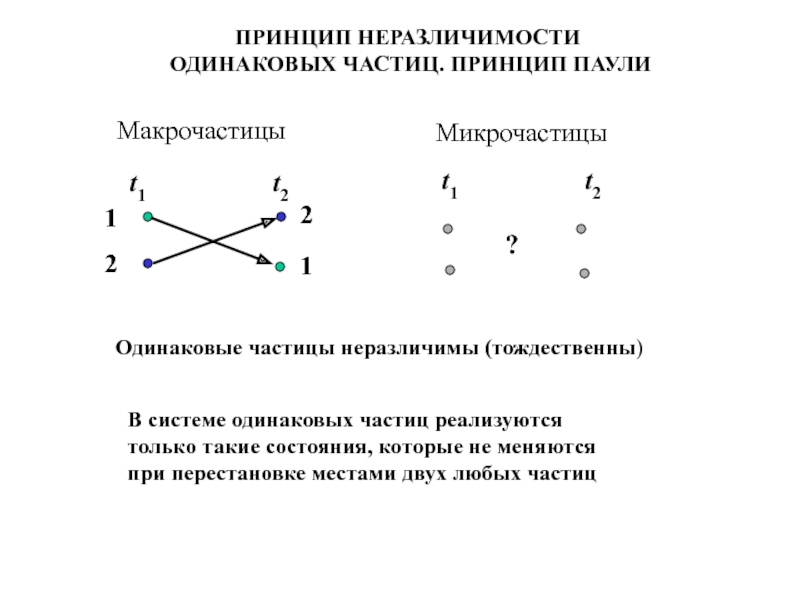
- 12. ПРИНЦИП НЕРАЗЛИЧИМОСТИ ОДИНАКОВЫХ ЧАСТИЦ. ПРИНЦИП
- 13. Если переставить частицы местами, состояние не изменится Отсюда две возможности:- симметричная волновая функция- антисимметричная волновая функция
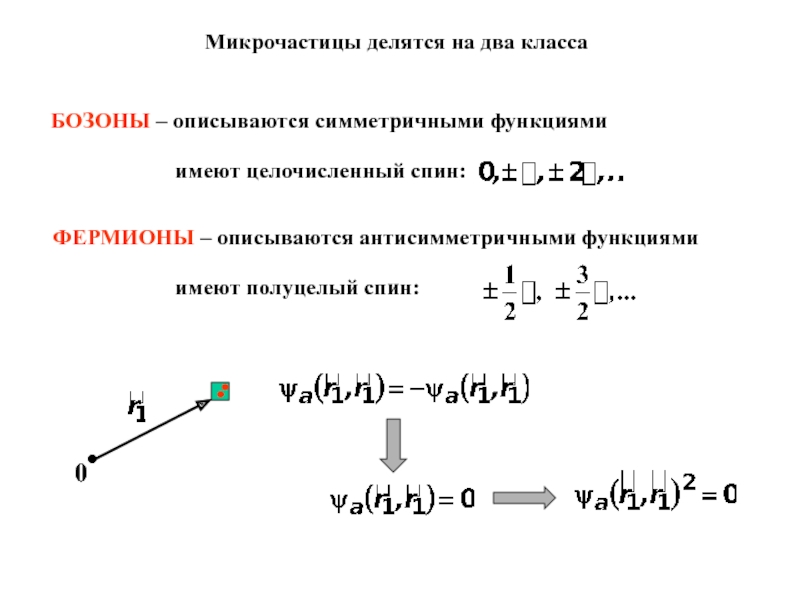
- 14. Микрочастицы делятся на два классаБОЗОНЫ – описываются
- 15. ПРИНЦИП ПАУЛИВ системе тождественных фермионов не может
- 16. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ ПО ЭНЕРГЕТИЧЕСКИМ УРОВНЯМ АТОМА1. Принцип
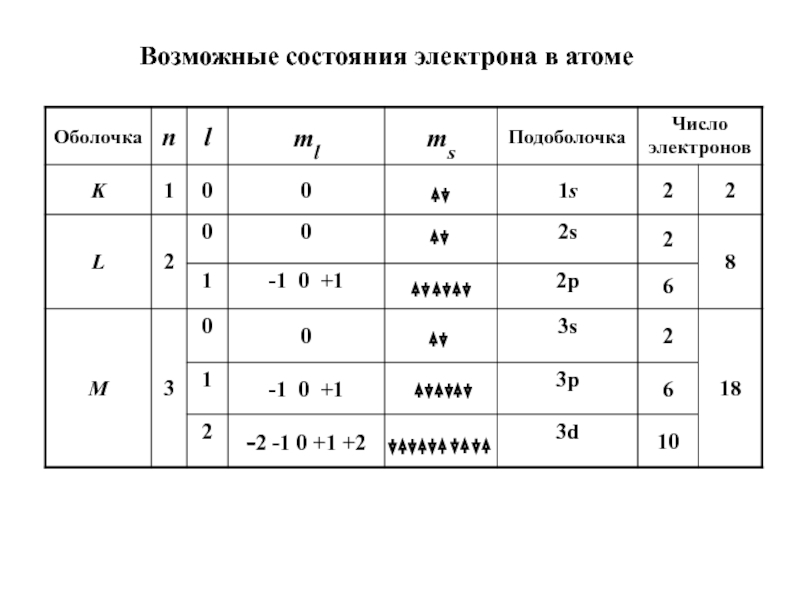
- 17. Возможные состояния электрона в атоме
- 18. Z = 1 H n = 1, l =
- 19. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
Спин электрона
Принцип тождественности одинаковых частиц
Опыты Штерна и Герлаха
Распределение электронов по
энергетическим уровням атома
Слайд 2МАГНИТНЫЕ СВОЙСТВА АТОМОВ
Связь магнитного момента с орбитальным механическим моментом
- гиромагнитное
отношение
Слайд 4Вырожденные состояния
В многоэлектронных атомах происходит снятие вырождения по квантовому числу
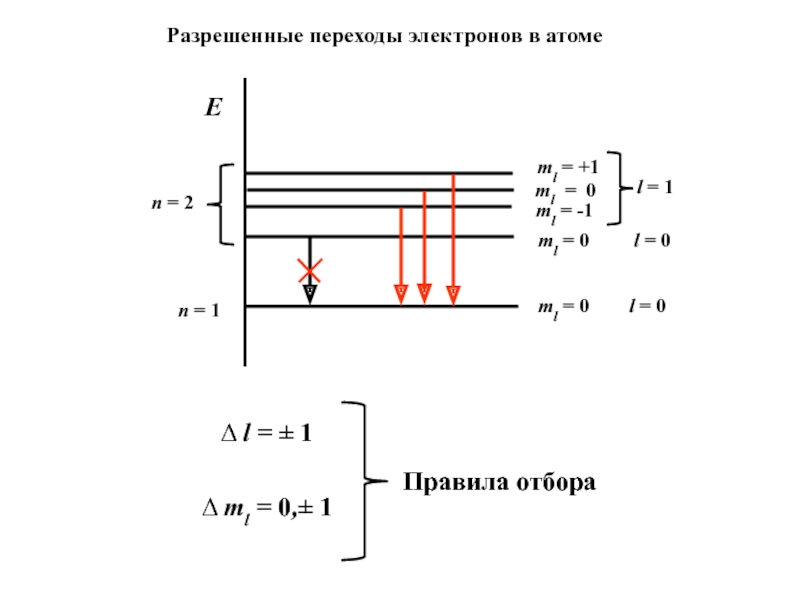
Слайд 7n = 2
n = 1
E
ml = 0
l = 0
ml = 0 l
= 0Δ l = ± 1
Δ ml = 0,± 1
Разрешенные переходы электронов в атоме
Слайд 11− кратность вырождения
n = 1, 2, 3, ….…
– главное квантовое число
l =
0, 1, 2…., n −1 – азимутальноеml = 0, ± 1, ± 2, …, ± l – магнитное
Правила отбора
Δ n = 1, 2, 3, ….
Δ l = ± 1
Δ ml = 0, ± 1
Δ ms = 0
Квантовые числа
Слайд 12ПРИНЦИП НЕРАЗЛИЧИМОСТИ
ОДИНАКОВЫХ ЧАСТИЦ. ПРИНЦИП ПАУЛИ
Макрочастицы
Микрочастицы
t1
t2
t1
t21
2
2
1
?
Одинаковые частицы неразличимы (тождественны)
В системе одинаковых частиц реализуются только такие состояния, которые не меняются при перестановке местами двух любых частиц
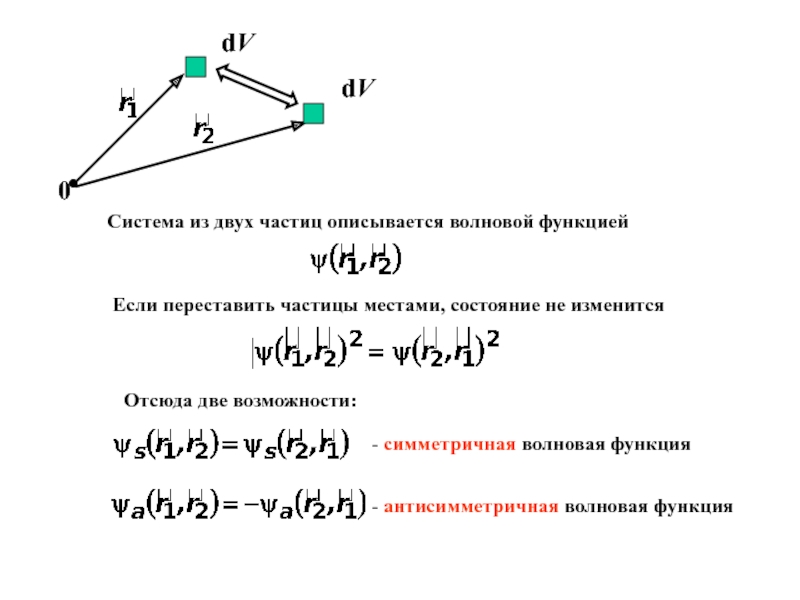
Слайд 13
Если переставить частицы местами, состояние не изменится
Отсюда две возможности:
-
симметричная волновая функция
- антисимметричная волновая функция
Слайд 14Микрочастицы делятся на два класса
БОЗОНЫ – описываются симметричными функциями
имеют целочисленный
спин:
ФЕРМИОНЫ – описываются антисимметричными функциями
имеют полуцелый спин:
Слайд 15
ПРИНЦИП ПАУЛИ
В системе тождественных фермионов не может быть двух частиц,
находящихся в одном и том же состоянии
В атоме не
может быть двух электронов, характеризующихся одинаковой четверкой квантовых чиселСлайд 16РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ ПО ЭНЕРГЕТИЧЕСКИМ УРОВНЯМ АТОМА
1. Принцип запрета Паули
ms =
±1/2
в квантовом состоянии (n, l, ml) может находиться не более
двух электронов2. Принцип наименьшей энергии
n 1 2 3 4 5
оболочка K L M N O
l 0 1 2 3 4
подоболочка s p d f g
Слайд 18Z = 1 H n = 1, l = 0, ml =
0 1s1
Z = 2 He 1s2
Z = 3 Li 1s2 2s1
Z = 4 Be 1s2
2s2Z = 10 Ne 1s2 2s22p6
Структура электронных оболочек атомов