Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 6
Содержание
- 1. Лекция 6
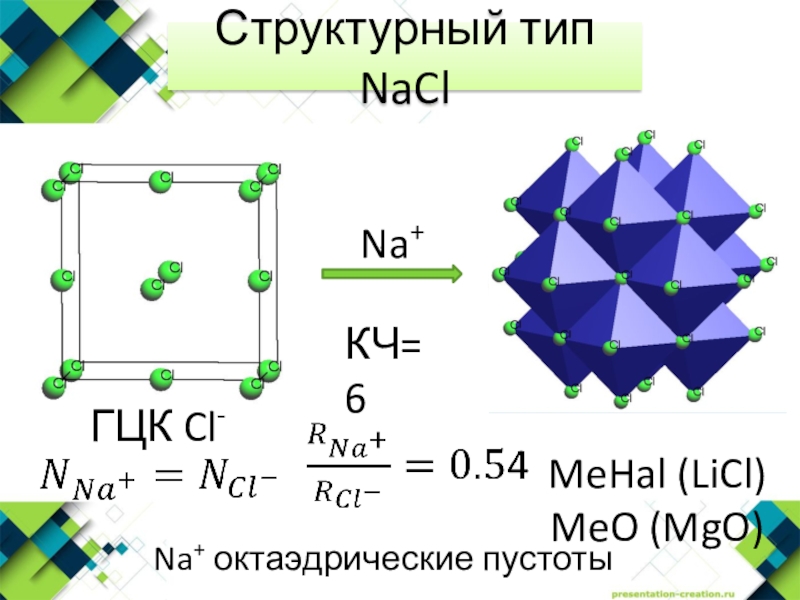
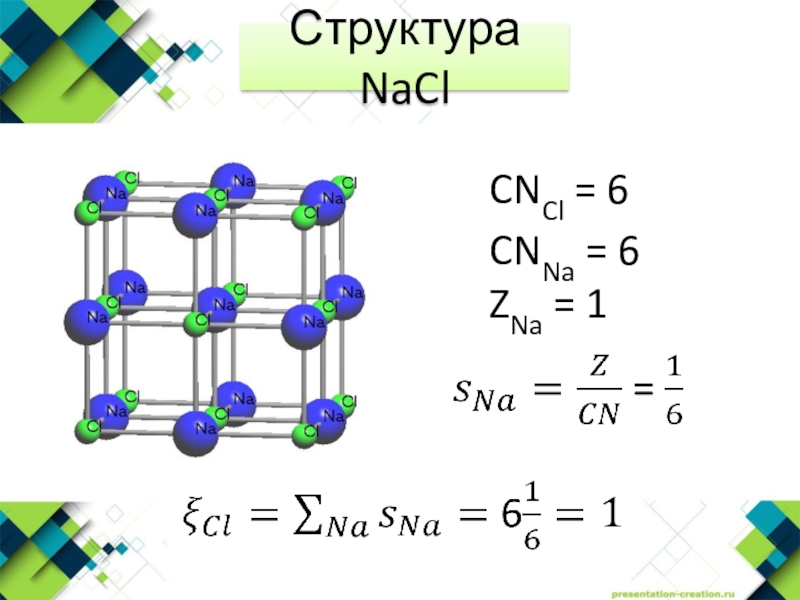
- 2. Структурный тип NaClNa+ октаэдрические пустотыГЦК Cl- КЧ=6MeHal (LiCl)MeO (MgO)
- 3. Слайд 3
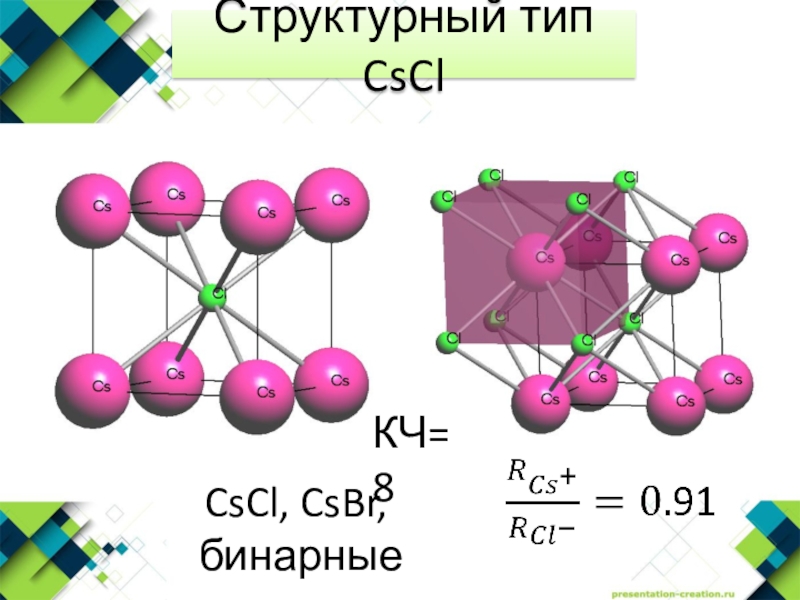
- 4. Структурный тип CsClCsCl, CsBr, бинарные сплавыКЧ=8
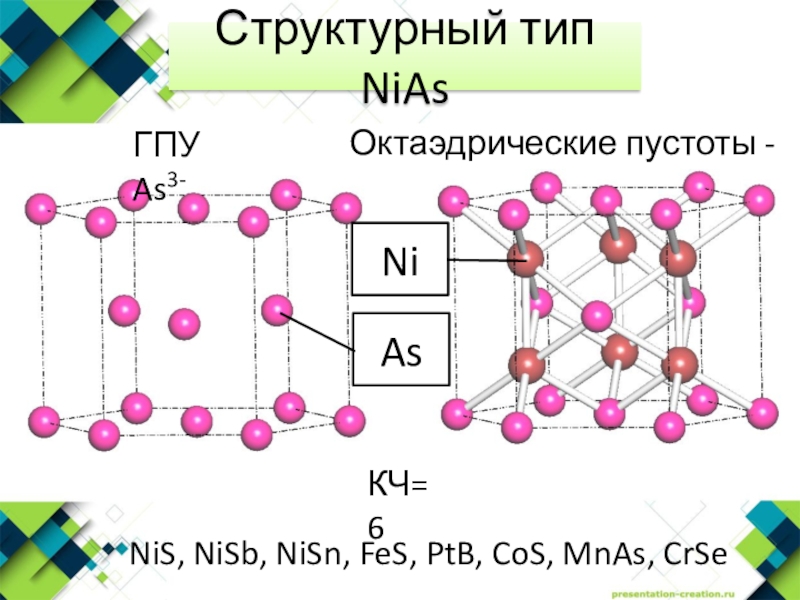
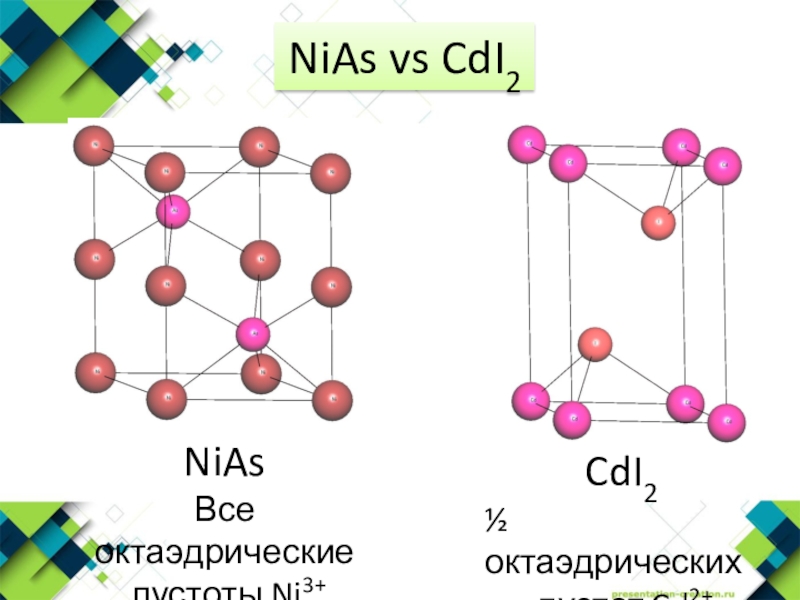
- 5. Структурный тип NiAsNiS, NiSb, NiSn, FeS, PtB, CoS, MnAs, CrSeКЧ=6
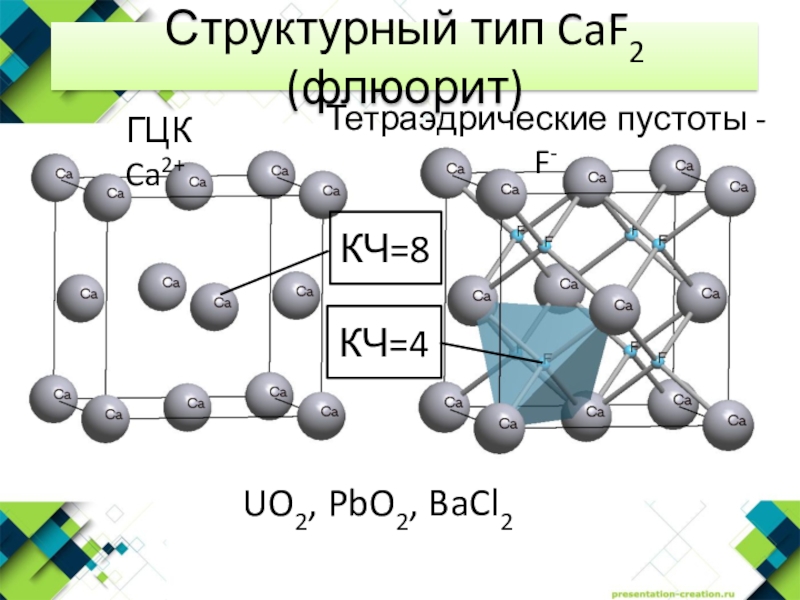
- 6. Структурный тип CaF2 (флюорит)КЧ=8КЧ=4UO2, PbO2, BaCl2 Тетраэдрические пустоты - F-ГЦК Ca2+
- 7. Структурный тип Li2O (антифлюорит)ГЦК O2-Тетраэдрические пустоты Li+КЧ=8КЧ=4Li2O, Rb2O, K2O,Li2S, Li2Se
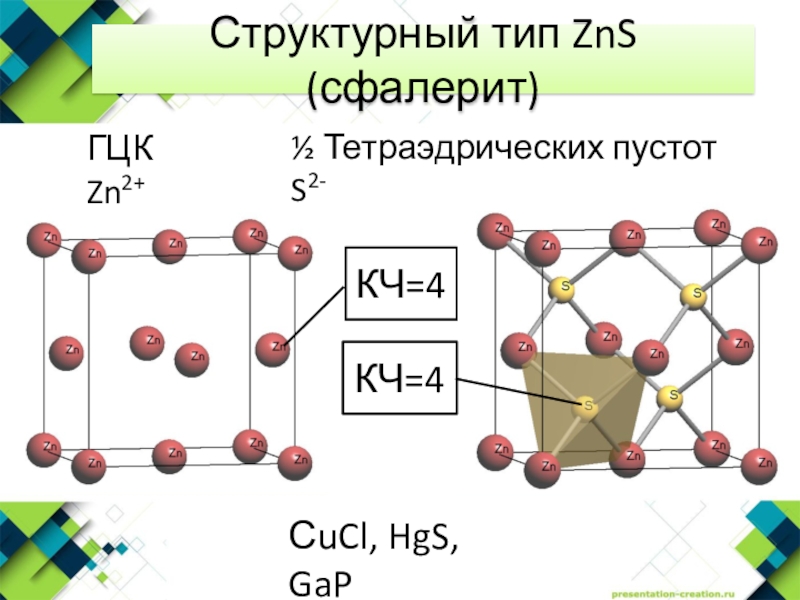
- 8. Структурный тип ZnS (сфалерит)ГЦК Zn2+½ Тетраэдрических пустот S2-КЧ=4СuCl, HgS, GaPКЧ=4
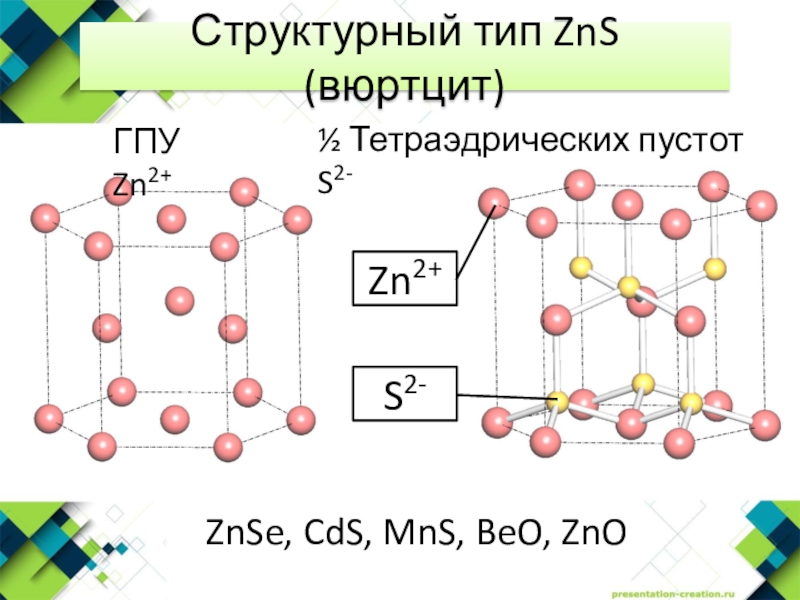
- 9. Структурный тип ZnS (вюртцит)ГПУ Zn2+½ Тетраэдрических пустот S2-ZnSe, CdS, MnS, BeO, ZnO
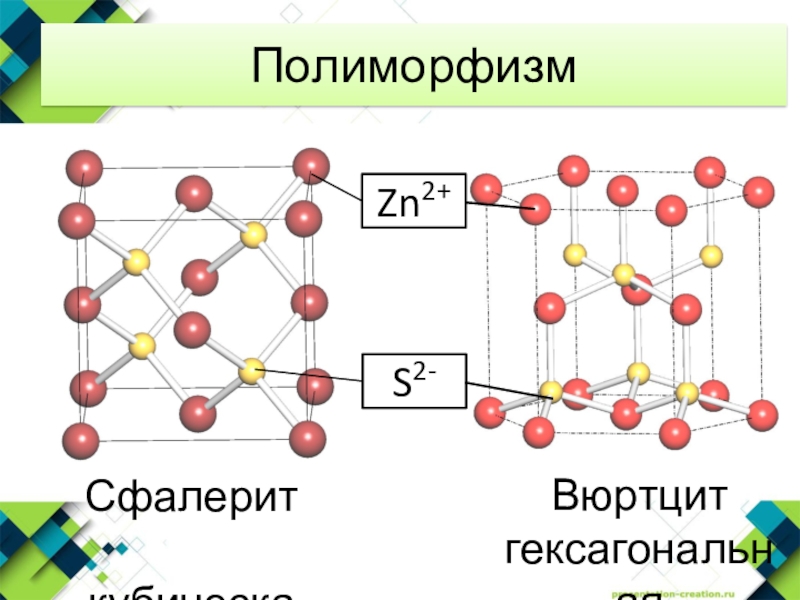
- 10. Полиморфизм
- 11. Структурный тип CdI2ГПУ I-½ октаэдрических пустот Cd2+CdCl2, GeI2
- 12. NiAs vs CdI2
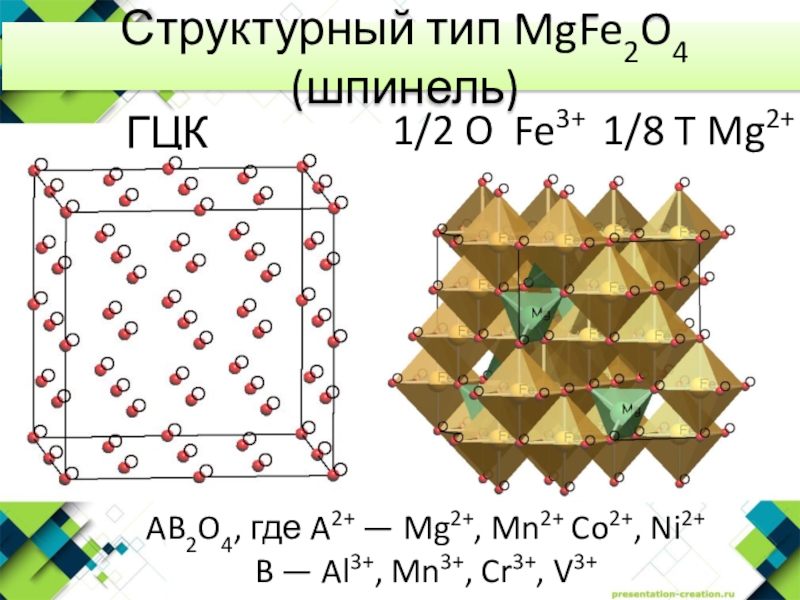
- 13. Структурный тип MgFe2O4 (шпинель)ГЦК O2-1/2 O Fe3+
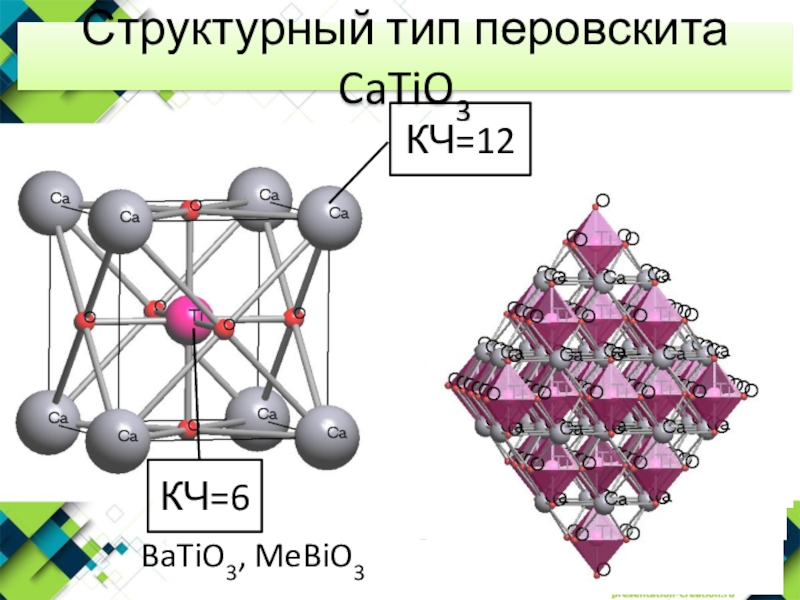
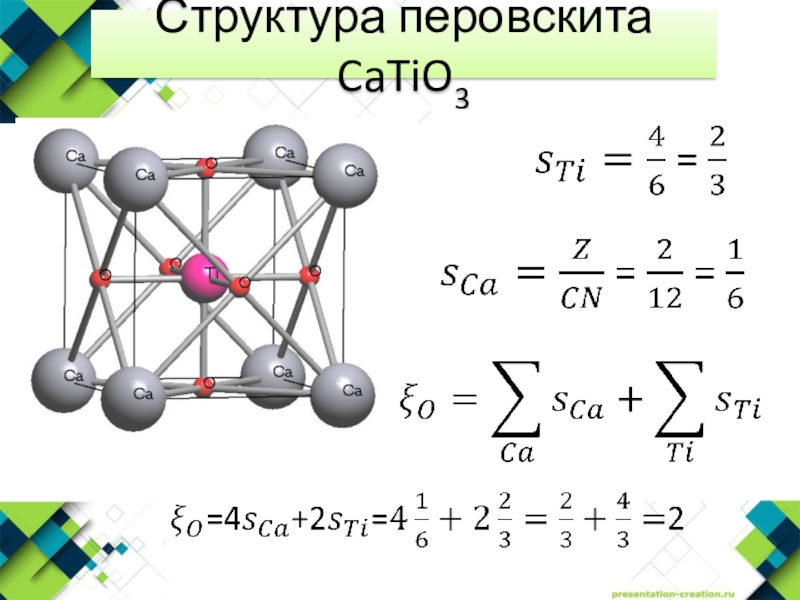
- 14. Структурный тип перовскита CaTiO3КЧ=12КЧ=6BaTiO3, MeBiO3
- 15. Структурный тип ReO3КЧ=6
- 16. Правила ПолингаЛайнус Полинг1901-1994Нобелевская премия по химии 1954Нобелевская премия мира 1962
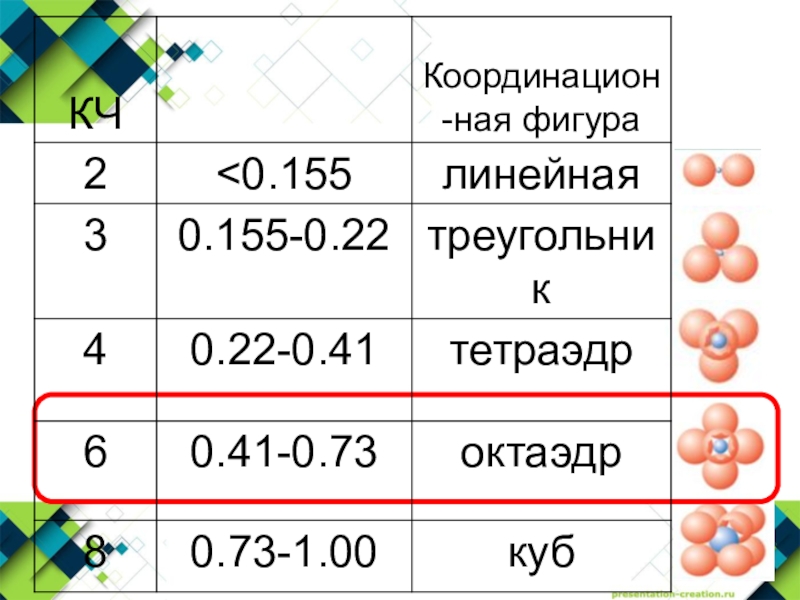
- 17. Первое правило: соотношение радиусовСумма ионных радиусов определяет
- 18. Слайд 18
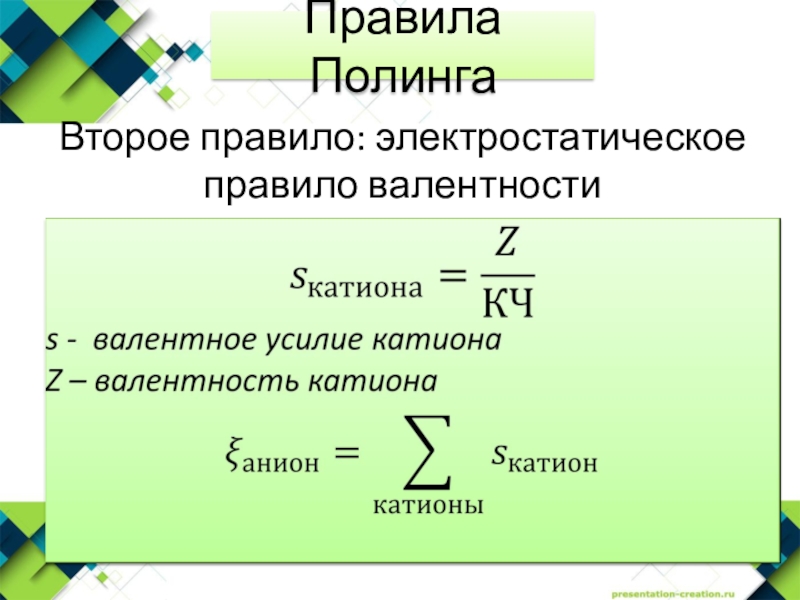
- 19. Второе правило: электростатическое правило валентностиПравила Полинга
- 20. В устойчивой ионной структуре валентность каждого аниона,
- 21. Структура NaClCNCl = 6 CNNa = 6ZNa = 1
- 22. Структура перовскита CaTiO3
- 23. Наличие в структуре общих ребер и особенно
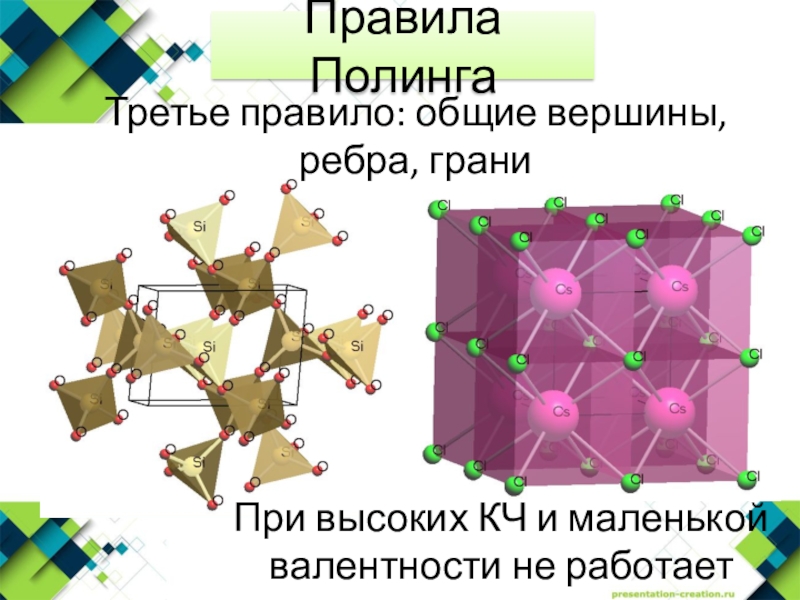
- 24. Третье правило: общие вершины, ребра, граниПравила ПолингаПри высоких КЧ и маленькой валентности не работает
- 25. Спасибо за внимание
- 26. Скачать презентанцию
Структурный тип NaClNa+ октаэдрические пустотыГЦК Cl- КЧ=6MeHal (LiCl)MeO (MgO)
Слайды и текст этой презентации
Слайд 7Структурный тип Li2O (антифлюорит)
ГЦК O2-
Тетраэдрические пустоты Li+
КЧ=8
КЧ=4
Li2O, Rb2O, K2O,Li2S, Li2Se
Слайд 13Структурный тип MgFe2O4 (шпинель)
ГЦК O2-
1/2 O Fe3+ 1/8 T Mg2+
AB2O4,
где A2+ — Mg2+, Mn2+ Co2+, Ni2+
B — Al3+, Mn3+,
Cr3+, V3+Слайд 16Правила Полинга
Лайнус Полинг
1901-1994
Нобелевская премия по химии 1954
Нобелевская премия мира 1962
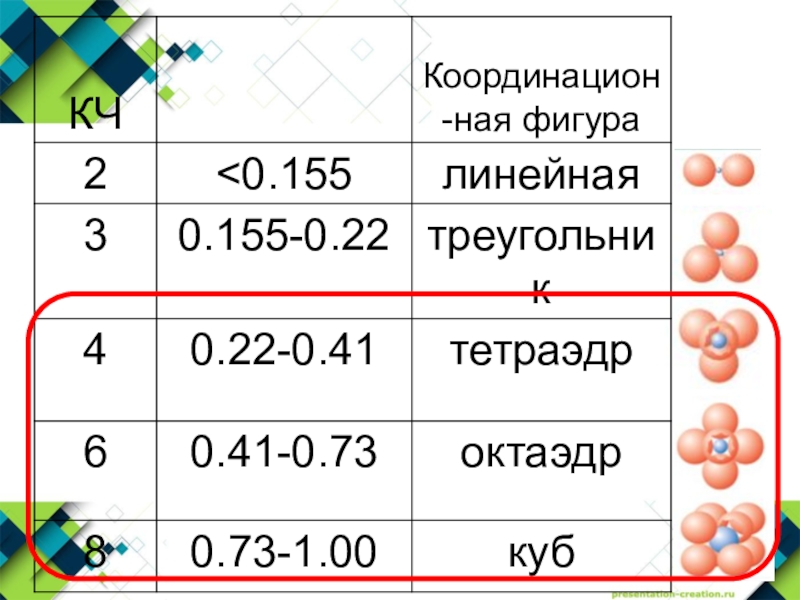
Слайд 17Первое правило: соотношение радиусов
Сумма ионных радиусов определяет расстояние катион-анион
Соотношение
радиусов катиона и аниона определяет КЧ катиона и форму его
координационного полиэдраПравила Полинга
Слайд 20В устойчивой ионной структуре валентность каждого аниона, взятая с обратным
знаком, точно или приближённо равна сумме валентных усилий всех соседних
с ним катионов.Второе правило: электростатическое правило валентности
Правила Полинга
Слайд 23Наличие в структуре общих ребер и особенно общих граней у
соседних координационных полиэдров катионов снижает устойчивость структуры.
Третье правило: Наличие
общих ребер и гранейПравила Полинга