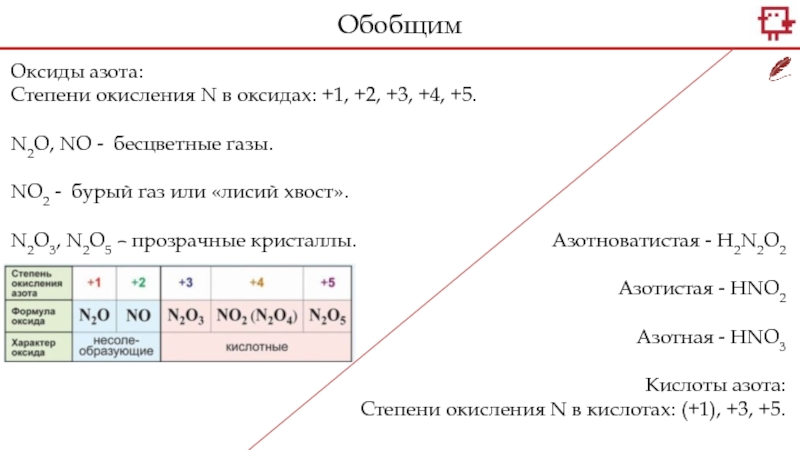
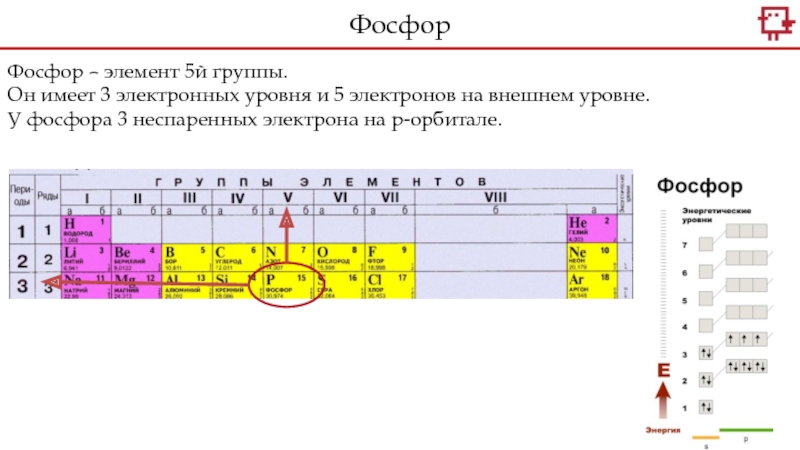
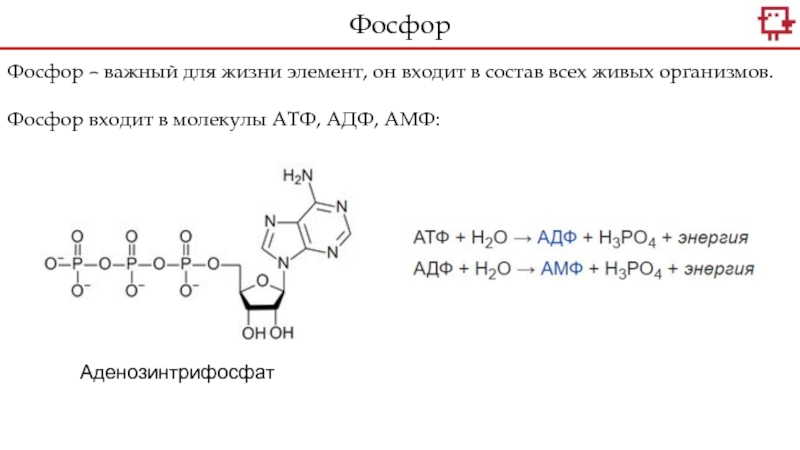
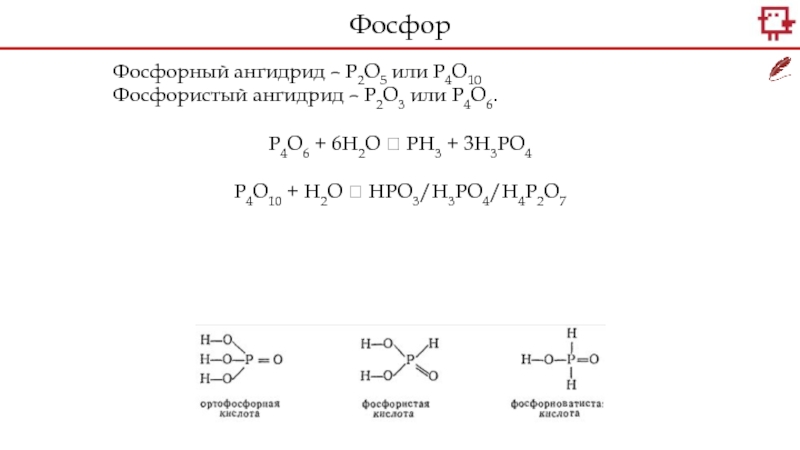
+5.
N2O, NO - бесцветные газы.
NO2 - бурый газ или «лисий
хвост».N2O3, N2O5 – прозрачные кристаллы.
Обобщим
Азотноватистая - H2N2O2
Азотистая - HNO2
Азотная - HNO3
Кислоты азота:
Степени окисления N в кислотах: (+1), +3, +5.