Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Метаболизм
Содержание
- 1. Метаболизм
- 2. Основные этапы окисления глюкозы
- 3. Окисление глюкозыСуммарное уравнениеС6Н12О6 + 6О2 → 6СО2
- 4. Дихотомический путь распада глюкозы. Гликолиз
- 5. сложный ферментативный процесс превращения глюкозы, протекающий в
- 6. 1. ФосфорилированиеG° = –16,74 кДж/мольГексокиназа не обладает
- 7. 2. Изомеризация Г-6-Ф во Ф-6-Ф G° = 1,67 кДж/моль Гексозофосфатизомераза (Г-6-Ф-изомераза)Гексозофосфатизомераза активируется субстратом
- 8. 3. Фосфорилирование Ф-6-Ф G° = –14,23 кДж/моль
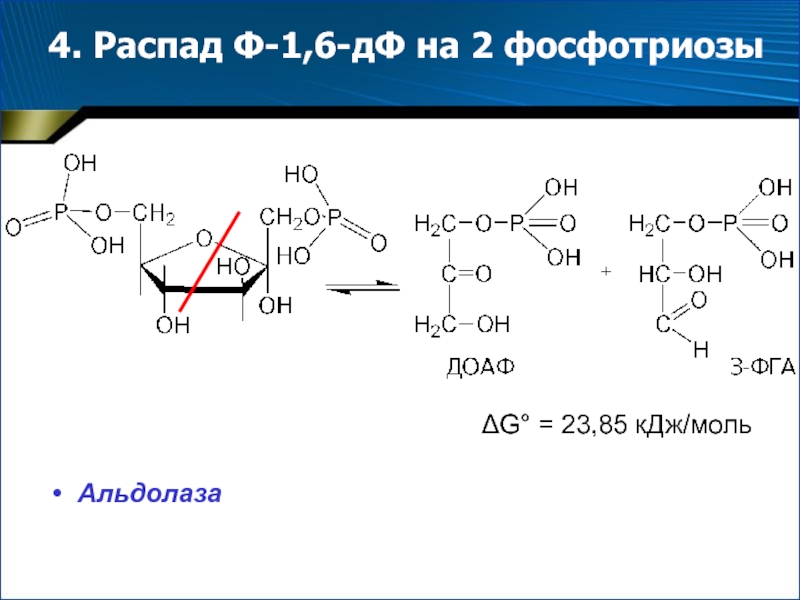
- 9. 4. Распад Ф-1,6-дФ на 2 фосфотриозы G° = 23,85 кДж/моль Альдолаза
- 10. 5. Изомеризация триозофосфатов G° = 7,53 кДж/мольТриозофосфатизомеразаРавновесие
- 11. Биологическое окисление – … совокупность окислительных реакций, происходящих в
- 12. Свободное окислениеОкисление, сопряженное с фосфорилированием АДФсубстратноеокислительноеТипы биологического окисленияфосфорилирование
- 13. Субстратное фосфорилирование – …вид биологического окисления, при
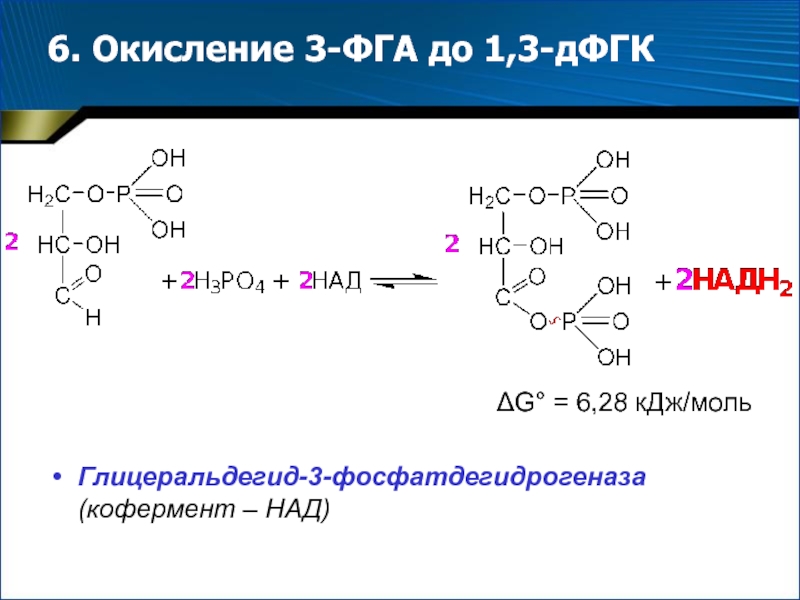
- 14. 6. Окисление 3-ФГА до 1,3-дФГК G° = 6,28 кДж/моль Глицеральдегид-3-фосфатдегидрогеназа (кофермент – НАД)
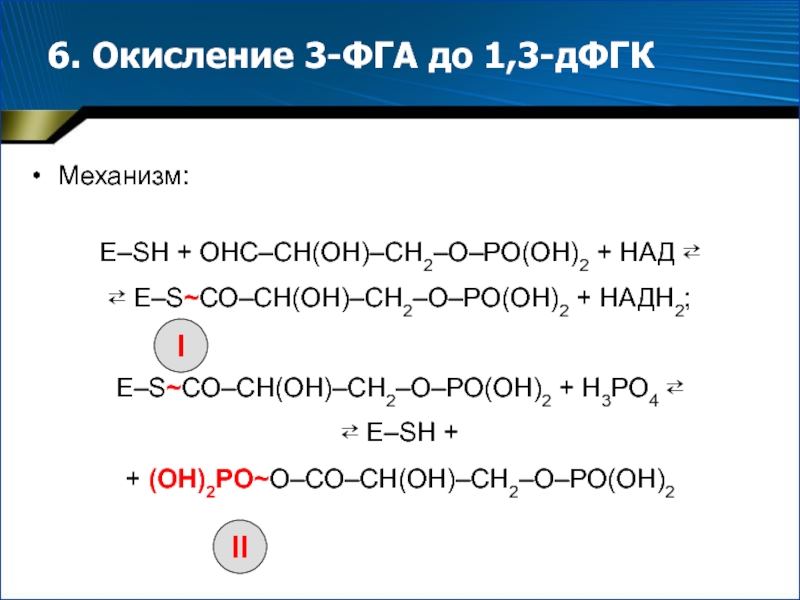
- 15. 6. Окисление 3-ФГА до 1,3-дФГКМеханизм:Е–SН + ОНС–СН(ОН)–СН2–О–РО(ОН)2
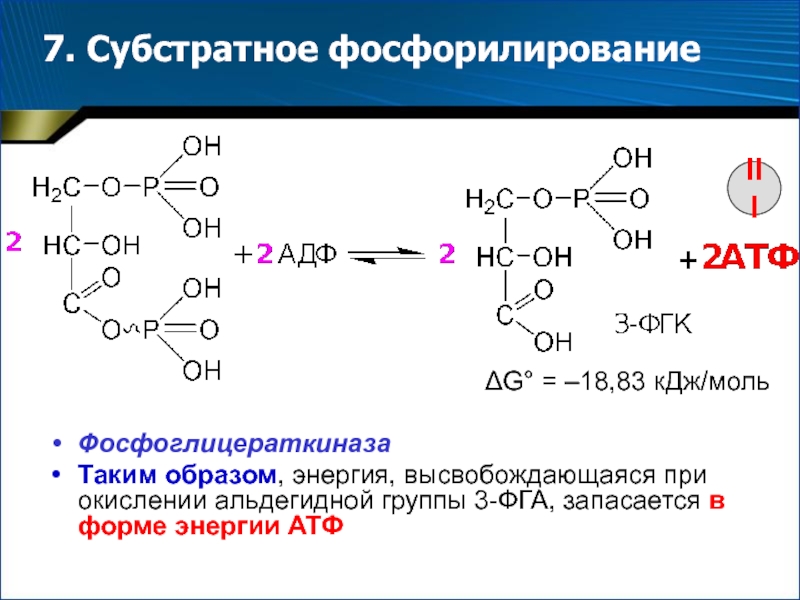
- 16. 7. Субстратное фосфорилирование G° = –18,83 кДж/мольФосфоглицераткиназаТаким
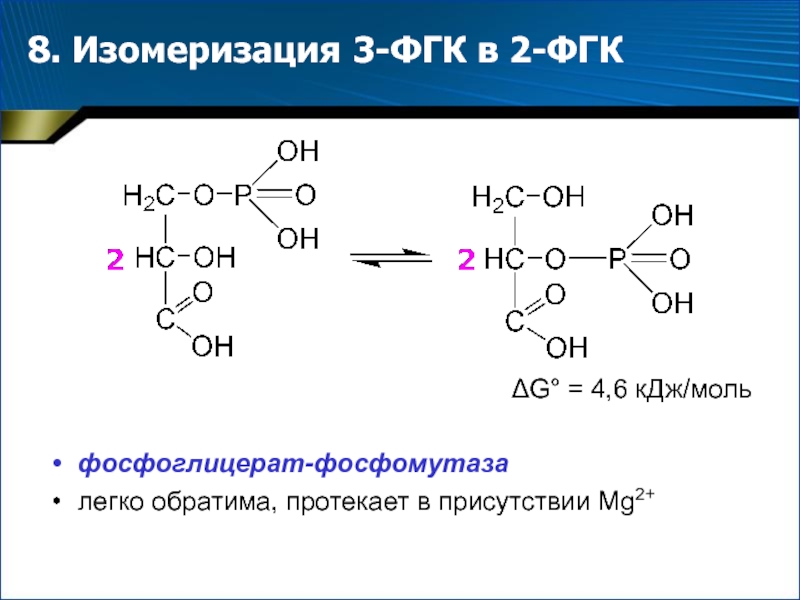
- 17. 8. Изомеризация 3-ФГК в 2-ФГК G° = 4,6 кДж/мольфосфоглицерат-фосфомутазалегко обратима, протекает в присутствии Mg2+
- 18. 9. Дегидратация 2-ФГК G° = 1,67 кДж/мольЕнолаза, активируется Mg2+ или Mn2+ и ингибируется F–
- 19. 10. Субстратное фосфорилирование G° = –31,38 кДж/мольпируваткиназа;
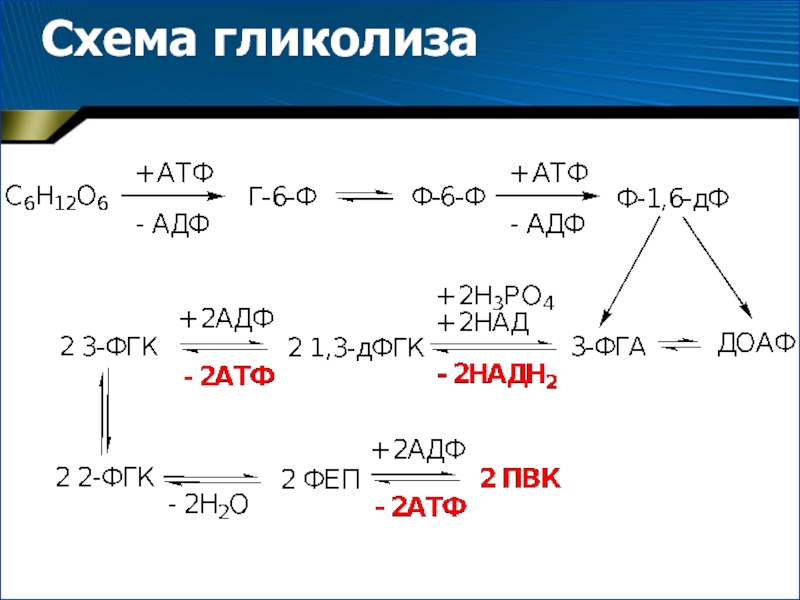
- 20. Схема гликолиза
- 21. Суммарное уравнение гликолиза С6Н12О6 + 2НАД +
- 22. образование макроэргических соединенийЭнергетическая эффективность гликолиза –2 молекулы
- 23. Обмен пировиноградной кислоты
- 24. 1. В анаэробных условиях – восстановление до
- 25. Молочная кислота накапливается при активной мышечной работе
- 26. 2. В анаэробных условиях – спиртовое брожение
- 27. Анаэробные условиявосстановление до молочной кислоты (молочнокислое брожение, окончание гликолиза)спиртовое брожениедругие виды брожения
- 28. 3. В аэробных условиях – окислительное декарбокислирование
- 29. Модель дегидрогеназного полиферментного комплекса12 димерных молекул пируватдекарбоксилазы6 димерных молекул дигидролипоилдегидро-геназы24 молекулылипоат-ацетилтрансферазы
- 30. Механизм окислительного декарбоксилирования ПВК
- 31. Слайд 31
- 32. (HS)2–липоат + ФАД → S2–липоат + ФАДН2;ФАДН2 + НАД → НАДН2 + ФАД
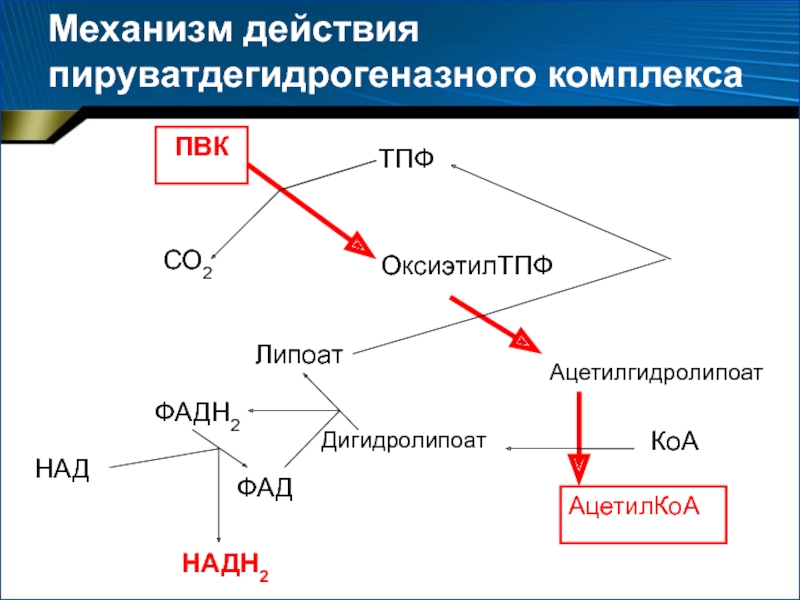
- 33. Механизм действия пируватдегидрогеназного комплекса
- 34. Цикл три- и дикарбоновых кислот (цикл Кребса)
- 35. Х. А. Кребс, 1937 г. впервые постулировал
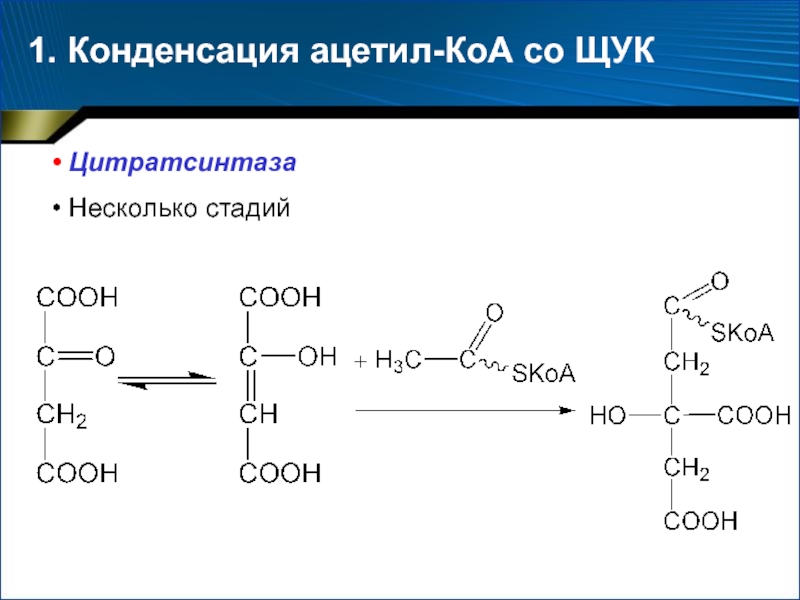
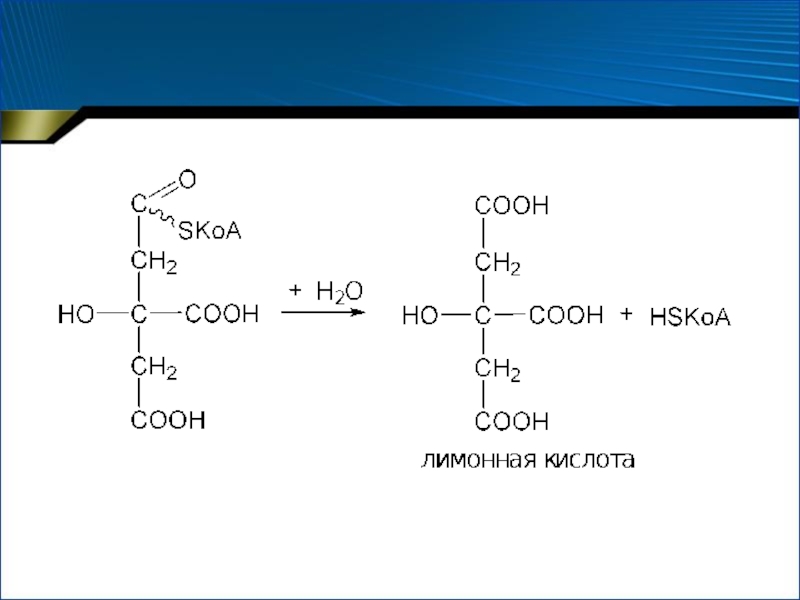
- 36. 1. Конденсация ацетил-КоА со ЩУК Цитратсинтаза Несколько стадий
- 37. Слайд 37
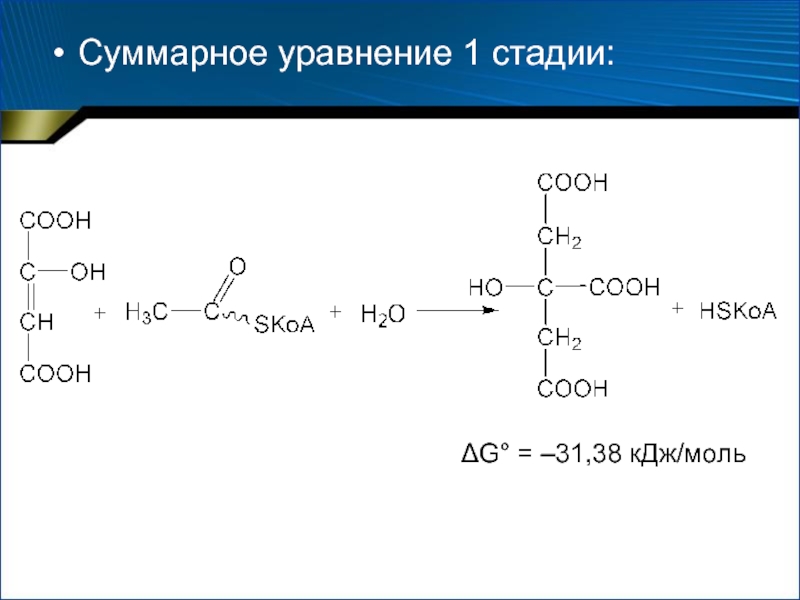
- 38. Суммарное уравнение 1 стадии:G° = –31,38 кДж/моль
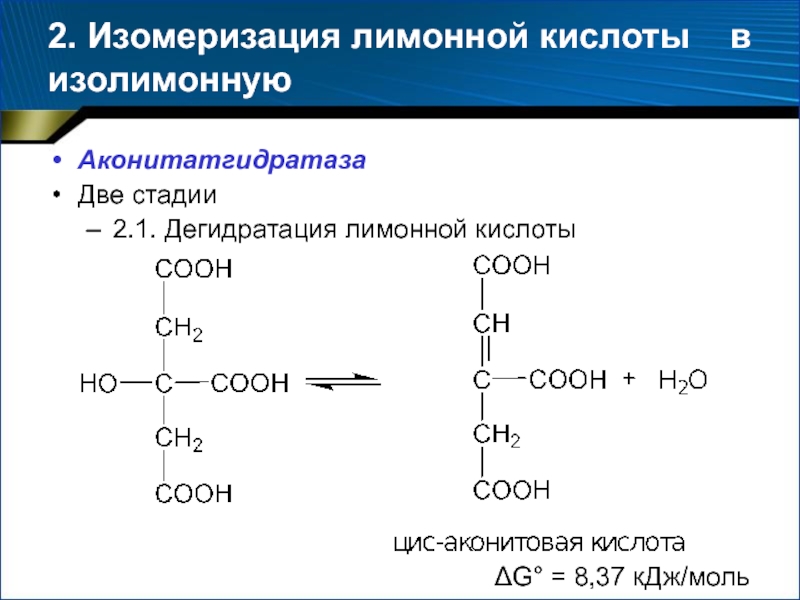
- 39. 2. Изомеризация лимонной кислоты в изолимоннуюАконитатгидратазаДве стадии2.1. Дегидратация лимонной кислотыG° = 8,37 кДж/моль
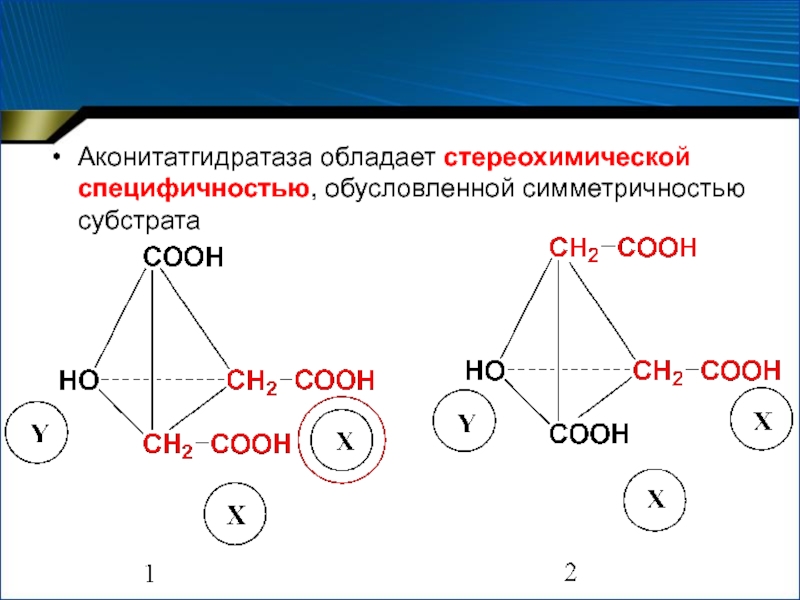
- 40. Аконитатгидратаза обладает стереохимической специфичностью, обусловленной симметричностью субстрата
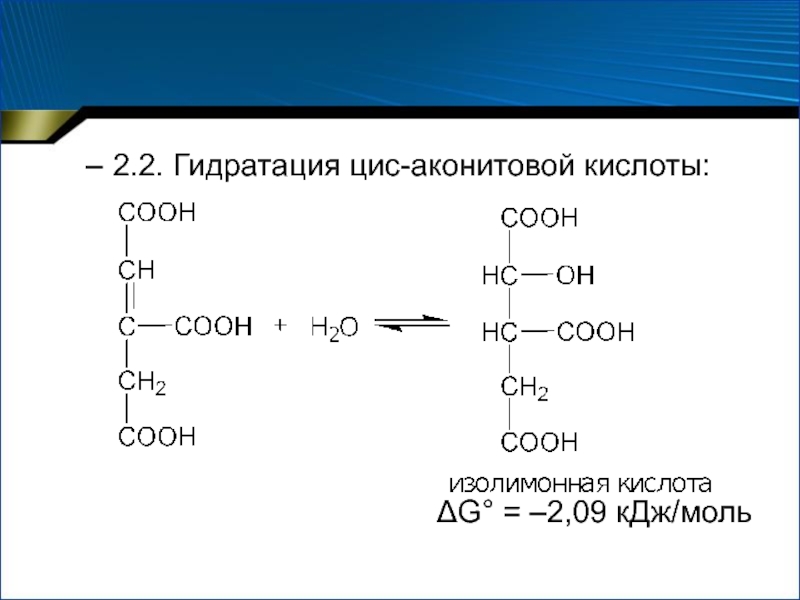
- 41. 2.2. Гидратация цис-аконитовой кислоты:G° = –2,09 кДж/моль
- 42. 3. Окисление изолимонной кислоты, сопровождающееся декарбоксилированием Изоцитратдегидрогеназа (кофермент – НАД)G° = –8,37 кДж/моль
- 43. 4. Окислительное декарбоксилирование -кетоглутаровой кислоты -Кетоглутаратдегидрогеназа
- 44. 5. Субстратное фосфорилирование Сукцинат: КоА-лигаза G° =
- 45. 6. Превращение янтарной кислоты в фумаровую (дегидрирование) Сукцинатдегидрогеназа (кофермент – ФАД):G° = 0
- 46. 7. Гидратация фумаровой кислоты с образованием яблочной кислоты ФумаратгидратазаG° = –3,77 кДж/моль
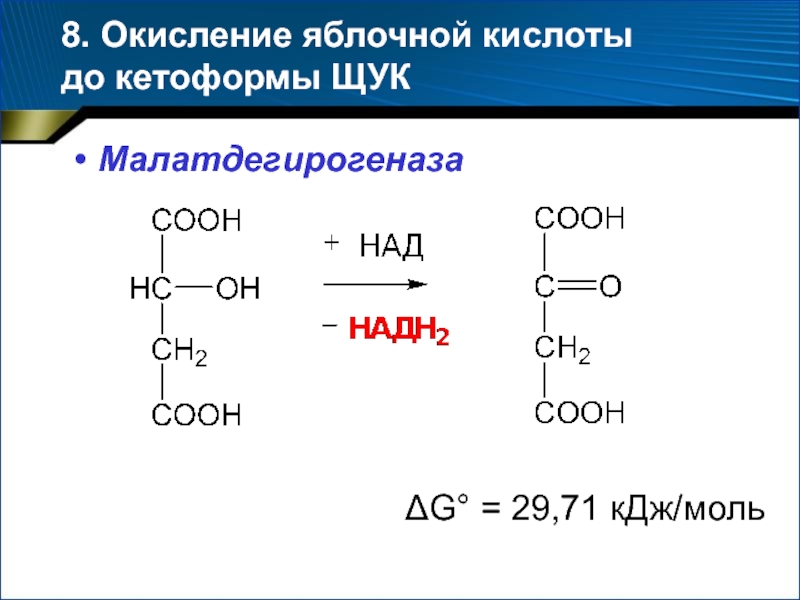
- 47. 8. Окисление яблочной кислоты до кетоформы ЩУКМалатдегирогеназаG° = 29,71 кДж/моль
- 48. Суммарное уравнение цикла КребсаСН3–СОSКоА + 3НАД +
- 49. За 1 оборот цикла Кребса – полное
- 50. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ. Дыхательная цепь
- 51. Окислительное фосфорилирование…сопряжение окисления с синтезом АТФ, когда
- 52. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ФЕРМЕНТЫ (повторение)
- 53. Пиридиновые дегидрогеназы Коферменты – НАД и НАДФУниверсальный
- 54. Флавиновые дегидрогеназыКоферменты – ФМН и ФАДявляются акцепторами
- 55. Слайд 55
- 56. Кофермент Q (убихинон)
- 57. ЦитохромыДальнейший перенос электронов от КоQ на О2
- 58. Схема дыхательной цепи
- 59. Самая примечательная особенность дыхательной цепи – наличие
- 60. Хемиосмотическая гипотеза Питер Митчелл, Владимир Петрович СкулачевРеакции,
- 61. Энергетический эффект гликолитического расщепления 1 молекулы глюкозы
- 62. На самом деле – 36 АТФ т.
- 63. Скачать презентанцию
Основные этапы окисления глюкозы
Слайды и текст этой презентации
Слайд 3Окисление глюкозы
Суммарное уравнение
С6Н12О6 + 6О2 → 6СО2 + 6Н2О
G =
–2820 кДж/моль
внутренней мембране митохондрий)Слайд 5сложный ферментативный процесс превращения глюкозы, протекающий в тканях человека и
животных без потребления кислорода
На промежуточных стадиях образуются трехуглеродные фрагменты, используемые
для биосинтеза ряда веществУ ряда микроорганизмов процессами, аналогичными гликолизу, являются различные виды брожения
11 ферментов
В гиалоплазме клеток
Гликолиз…
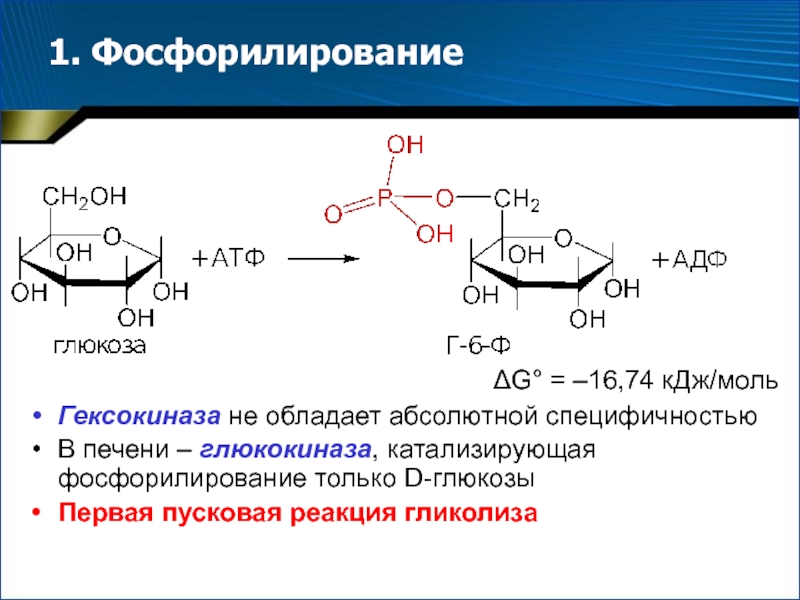
Слайд 61. Фосфорилирование
G° = –16,74 кДж/моль
Гексокиназа не обладает абсолютной специфичностью
В печени
– глюкокиназа, катализирующая фосфорилирование только D-глюкозы
Первая пусковая реакция гликолиза
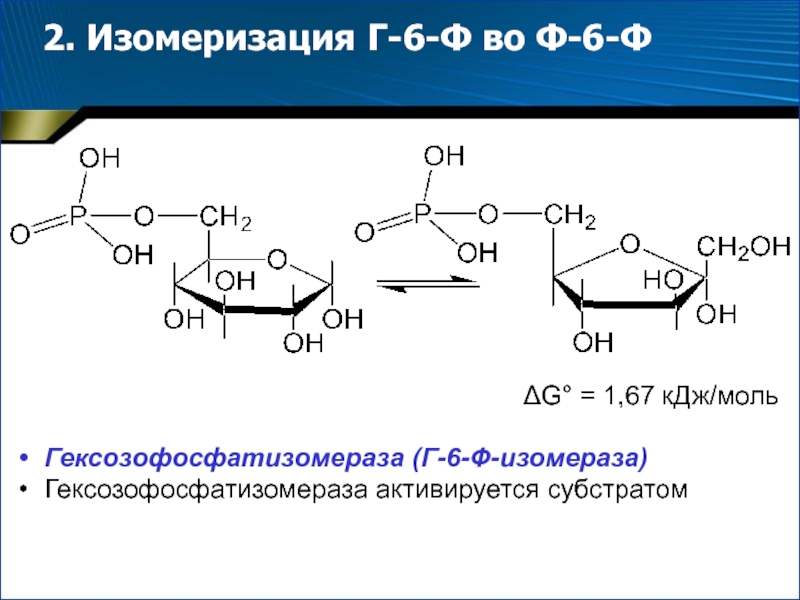
Слайд 72. Изомеризация Г-6-Ф во Ф-6-Ф
G° = 1,67 кДж/моль
Гексозофосфатизомераза
(Г-6-Ф-изомераза)
Гексозофосфатизомераза активируется субстратом
Слайд 83. Фосфорилирование Ф-6-Ф
G° = –14,23 кДж/моль
6-фосфофруктокиназа
Вторая пусковая
реакция гликолиза
Лимитирующая стадия
Фосфофруктокиназа ингибируется АТФ и стимулируется АДФ и
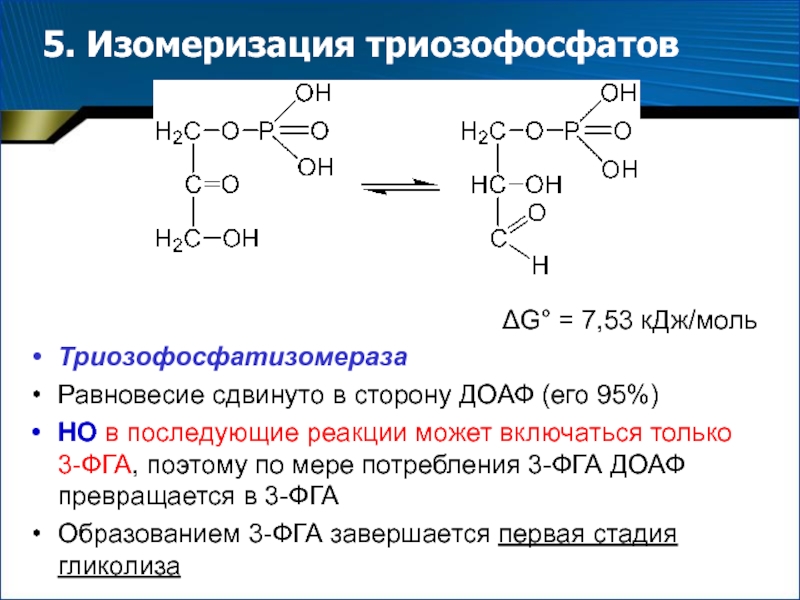
АМФСлайд 105. Изомеризация триозофосфатов
G° = 7,53 кДж/моль
Триозофосфатизомераза
Равновесие сдвинуто в сторону
ДОАФ (его 95%)
НО в последующие реакции может включаться только 3-ФГА,
поэтому по мере потребления 3-ФГА ДОАФ превращается в 3-ФГАОбразованием 3-ФГА завершается первая стадия гликолиза
Слайд 11Биологическое окисление – …
совокупность окислительных реакций,
происходящих в биологических объектах
и обеспечивающих
их энергией и метаболитами
для осуществления процессов жизнедеятельности
Слайд 12Свободное окисление
Окисление, сопряженное с фосфорилированием АДФ
субстратное
окислительное
Типы биологического окисления
фосфорилирование
Слайд 13Субстратное фосфорилирование – …
вид биологического окисления, при котором:
макроэргическая связь
возникает в момент непосредственного окисления субстрата
затем передается на фосфатный
остаток,который используется для фосфорилирования АДФ – синтеза АТФ
Окисление, сопряженное с фосфорилированием АДФ на уровне субстрата
Слайд 146. Окисление 3-ФГА до 1,3-дФГК
G° = 6,28 кДж/моль
Глицеральдегид-3-фосфатдегидрогеназа
(кофермент – НАД)
Слайд 156. Окисление 3-ФГА до 1,3-дФГК
Механизм:
Е–SН + ОНС–СН(ОН)–СН2–О–РО(ОН)2 + НАД ⇄
⇄ Е–SСО–СН(ОН)–СН2–О–РО(ОН)2 + НАДН2;
Е–SСО–СН(ОН)–СН2–О–РО(ОН)2 + Н3РО4 ⇄
⇄ Е–SН +
+ (ОН)2РОО–СО–СН(ОН)–СН2–О–РО(ОН)2
I
II
Слайд 167. Субстратное фосфорилирование
G° = –18,83 кДж/моль
Фосфоглицераткиназа
Таким образом, энергия, высвобождающаяся
при окислении альдегидной группы 3-ФГА, запасается в форме энергии АТФ
III
Слайд 178. Изомеризация 3-ФГК в 2-ФГК
G° = 4,6 кДж/моль
фосфоглицерат-фосфомутаза
легко обратима,
протекает в присутствии Mg2+
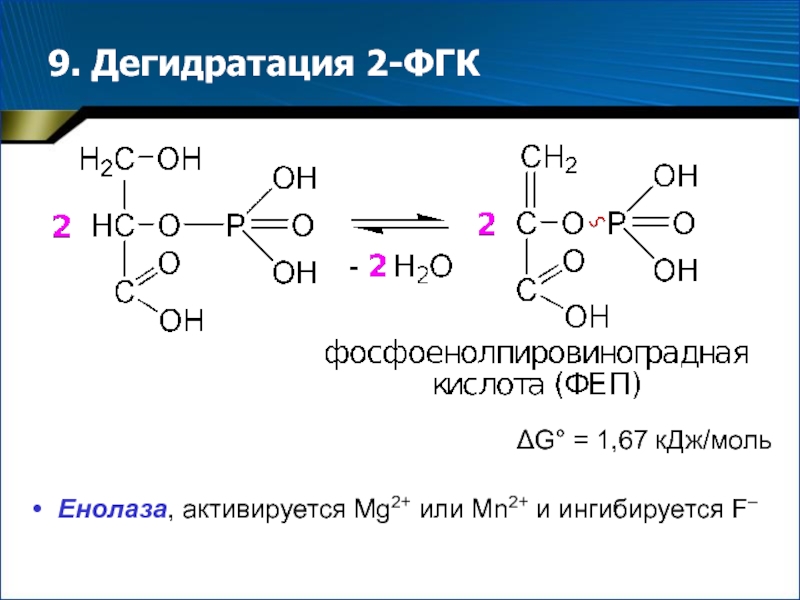
Слайд 189. Дегидратация 2-ФГК
G° = 1,67 кДж/моль
Енолаза, активируется Mg2+ или
Mn2+ и ингибируется F–
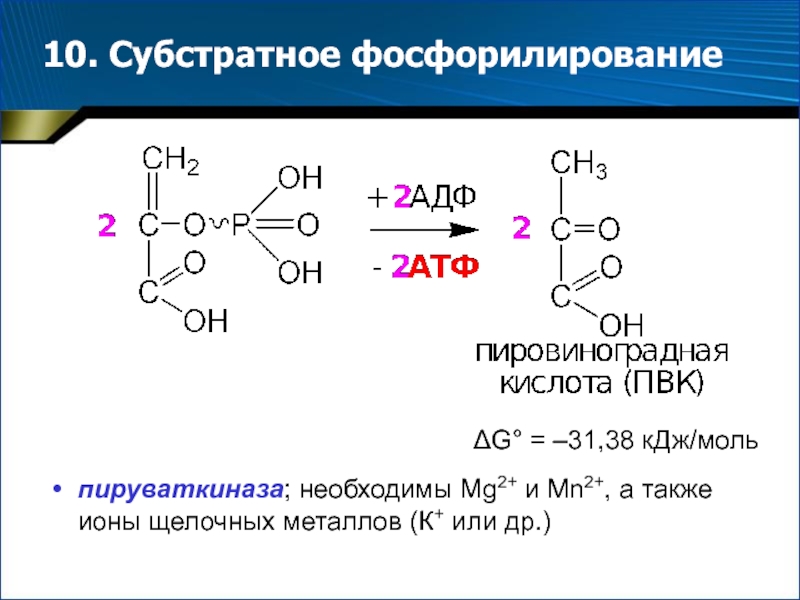
Слайд 1910. Субстратное фосфорилирование
G° = –31,38 кДж/моль
пируваткиназа; необходимы Mg2+ и
Mn2+, а также ионы щелочных металлов (К+ или др.)
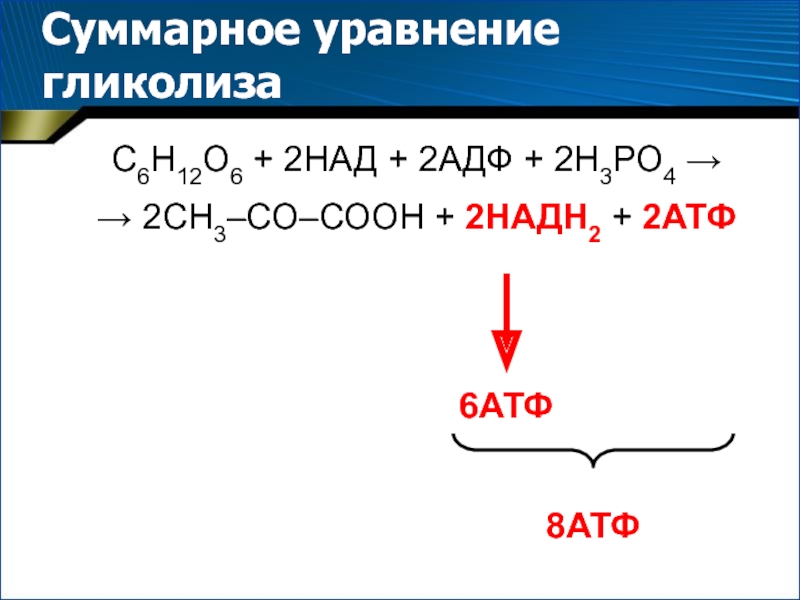
Слайд 21Суммарное уравнение гликолиза
С6Н12О6 + 2НАД + 2АДФ + 2Н3РО4
→
→ 2СН3–СО–СООН + 2НАДН2 + 2АТФ
6АТФ
8АТФ
Слайд 22образование макроэргических соединений
Энергетическая эффективность гликолиза –
2 молекулы АТФ на 1
молекулу глюкозы
Если гликолиз начинается не с глюкозы, а с гликогена
или крахмала (гликогенолиз), то накапливаются не 2, а 3 молекулы АТФ (?)Однако в энергетическом плане гликолиз и гликогенолиз практически равноценны, т. к. на синтез гликогена в тканях расходуется АТФ
Биологическое значение гликолиза
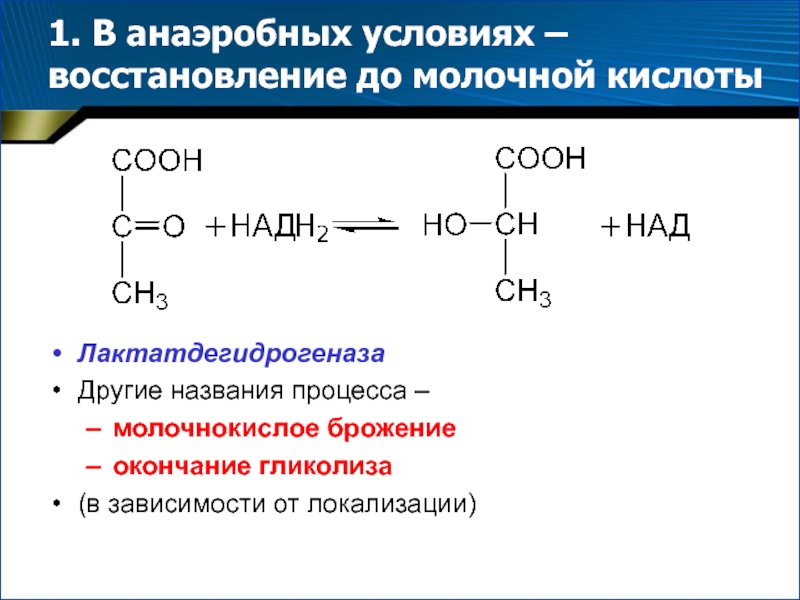
Слайд 241. В анаэробных условиях – восстановление до молочной кислоты
Лактатдегидрогеназа
Другие названия
процесса –
молочнокислое брожение
окончание гликолиза
(в зависимости от локализации)
Слайд 25Молочная кислота накапливается при активной мышечной работе и вызывает утомление
мышц
Часть ее (1/5 – 1/6) в аэробных условиях окисляется до
СО2 и Н2О или идет на ресинтез гликогенаG°310 расщепления глюкозы до молочной кислоты ~210 кДж/моль
~126 кДж – в виде тепла, а ~84 кДж – в форме АТФ
Концевая макроэргическая связь АТФ соответствует ~33,6–42,0 кДж/моль
Таким образом, КПД гликолиза (до молочной кислоты) составляет около 0,4
Слайд 262. В анаэробных условиях – спиртовое брожение
Дрожжеподобные организмы и
некоторые плесневые грибы
С6Н12О6 → 2СО2 + 2С2Н5ОН
По механизму близко к
гликолизупируватдекарбоксилаза (Mg2+ и кофермент тиаминпирофосфат)
СН3–СО–СООН → СН3–СНО + СО2
алкогольдегидрогеназа
СН3–СНО + НАДН2 → СН3–СН2–ОН + НАД
Другие виды брожения отличаются конечными продуктами
Слайд 27Анаэробные условия
восстановление до молочной кислоты (молочнокислое брожение, окончание гликолиза)
спиртовое брожение
другие
виды брожения
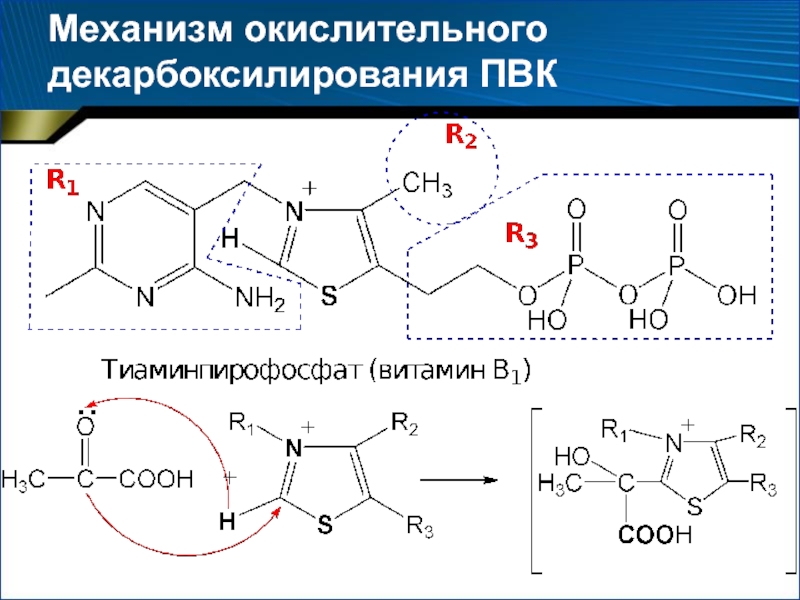
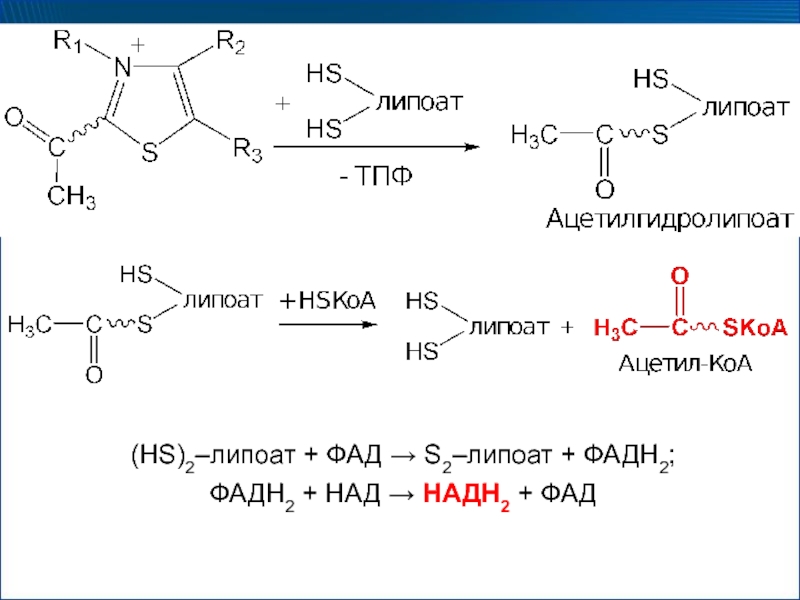
Слайд 283. В аэробных условиях – окислительное декарбокислирование (дыхание)
Окислительное декарбоксилирование
с образованием ацетил-КоА, который затем может окисляться до СО2 и
Н2ОСН3–СО–СООН + НАД + НSКоА →
→ СО2 + СН3–СОSКоА + НАДН2
Пируватдегидрогеназный комплекс
мультиэнзимный комплекс
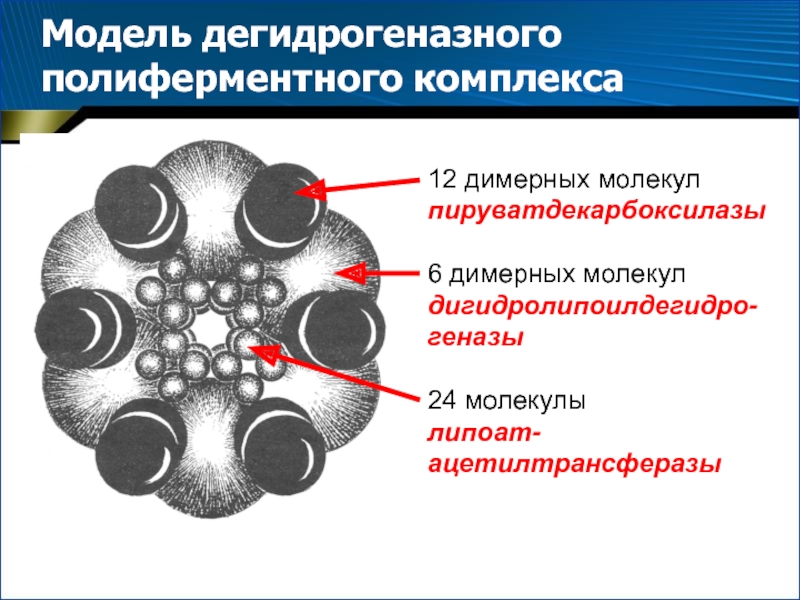
Слайд 29Модель дегидрогеназного полиферментного комплекса
12 димерных молекул пируватдекарбоксилазы
6 димерных молекул
дигидролипоилдегидро-геназы
24 молекулы
липоат-ацетилтрансферазы
Слайд 35Х. А. Кребс, 1937 г.
впервые постулировал значение цикла для
полного «сгорания» ПВК, главным источником которой является гликолиз
В дальнейшем
было показано, что цикл Кребса – «фокус», в котором сходятся практически все метаболические пути8 последовательных реакций
Ферменты цикла собраны в метаболон, локализованный в кристах митохондрий
Рядом с метаболоном цикла Кребса располагаются пируватдегидрогеназный комплекс и, вероятно, метаболон -окисления жирных кислот, поставляющие ему ацетил-КоА
Ханс Адольф Кребс
(1900–1981)
Слайд 392. Изомеризация лимонной кислоты в изолимонную
Аконитатгидратаза
Две стадии
2.1. Дегидратация лимонной
кислоты
G° = 8,37 кДж/моль
Слайд 40Аконитатгидратаза обладает стереохимической специфичностью, обусловленной симметричностью субстрата
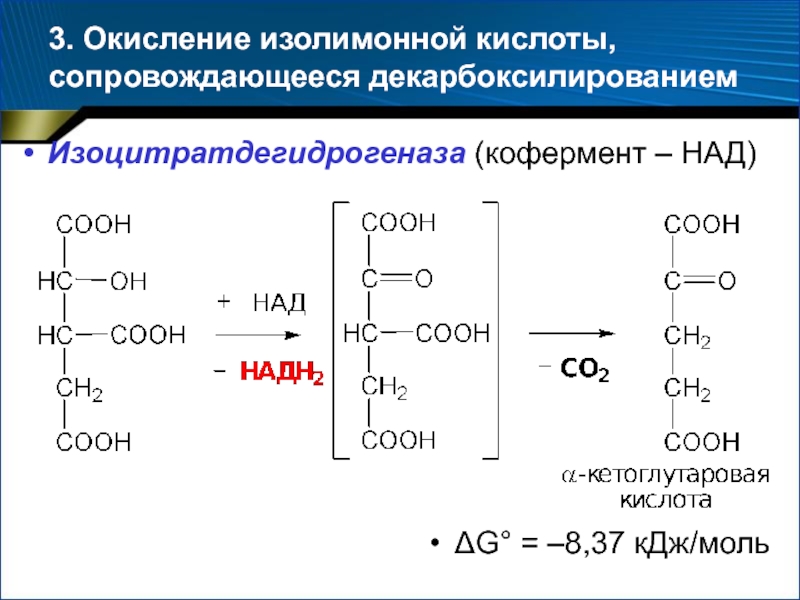
Слайд 423. Окисление изолимонной кислоты, сопровождающееся декарбоксилированием
Изоцитратдегидрогеназа (кофермент – НАД)
G°
= –8,37 кДж/моль
Слайд 434. Окислительное декарбоксилирование -кетоглутаровой кислоты
-Кетоглутаратдегидрогеназа
Сукцинил-КоА
G° =
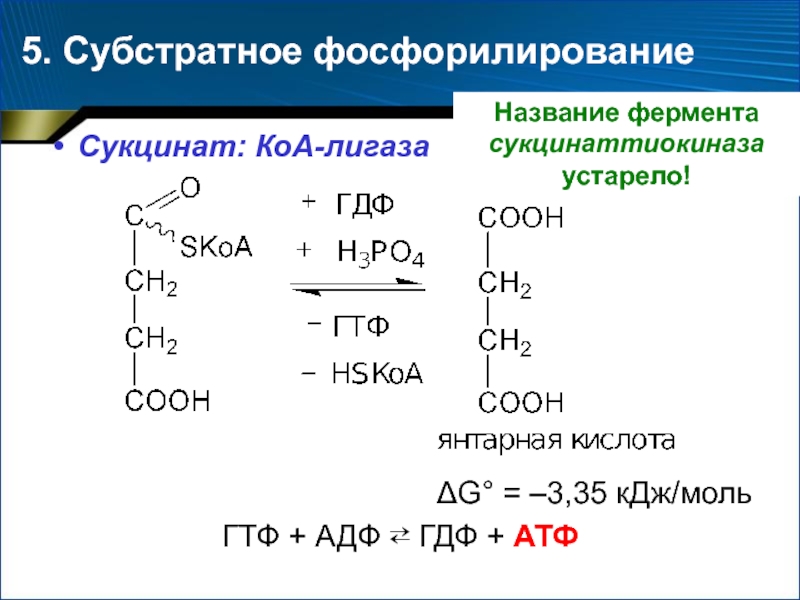
–30,12 кДж/моль Слайд 445. Субстратное фосфорилирование
Сукцинат: КоА-лигаза
G° = –3,35 кДж/моль
ГТФ +
АДФ ⇄ ГДФ + АТФ
Название фермента сукцинаттиокиназа устарело!
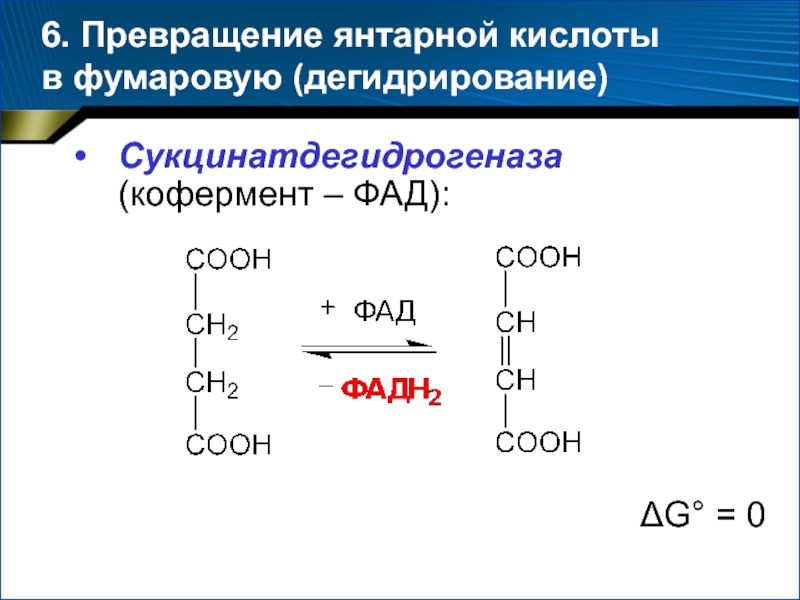
Слайд 456. Превращение янтарной кислоты в фумаровую (дегидрирование)
Сукцинатдегидрогеназа (кофермент – ФАД):
G° = 0
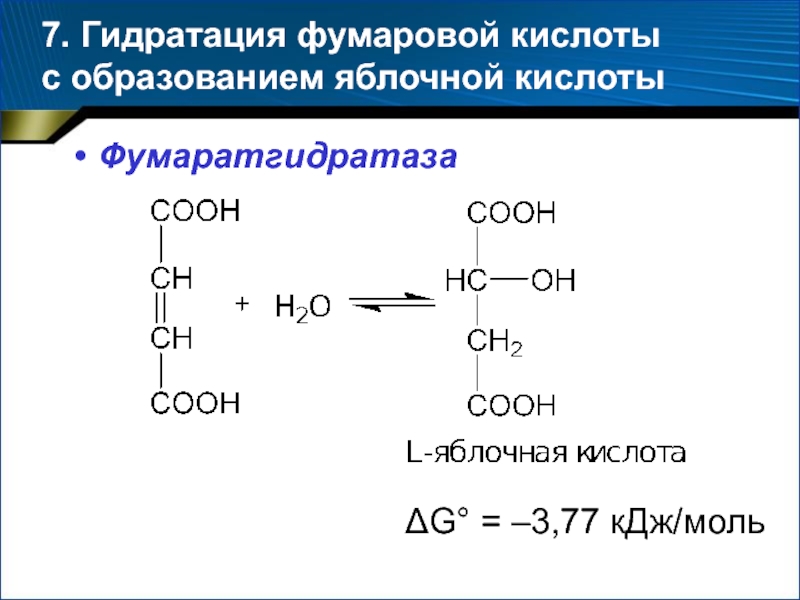
Слайд 467. Гидратация фумаровой кислоты с образованием яблочной кислоты
Фумаратгидратаза
G° =
–3,77 кДж/моль
Слайд 48Суммарное уравнение цикла Кребса
СН3–СОSКоА + 3НАД + ФАД + АДФ
+ Н3РО4 →
→ НSКоА + 3НАДН2 + ФАДН2 +
АТФ + 2СО2Слайд 49За 1 оборот цикла Кребса – полное окисление 1 молекулы
ацетил-КоА
Для непрерывной работы цикла необходимо
постоянное поступление в систему ацетил-КоА
НАДН2
и ФАДН2 должны снова и снова окисляться в дыхательной цепиОсвобождающаяся энергия в значительной мере сосредоточивается в макроэргических связях АТФ
При окислении 1 молекулы ацетил-КоА в цикле Кребса – 12 молекул АТФ
Слайд 51Окислительное фосфорилирование…
сопряжение окисления с синтезом АТФ,
когда атомы водорода с
коферментов дегидрогеназ, принимающих участие в окислении субстратов, передаются в оксидоредуктазную
цепь,где сопряженно с переносом ионов Н+ и электронов на молекулярный кислород происходит активирование неорганического фосфата и при его посредстве – фосфорилирование АДФ с образованием АТФ
Окисляемый субстрат непосредственного участия в активировании неорганического фосфата не принимает
Сопряжение окисления с фосфорилированием идет главным образом на внутренних мембранах митохондрий
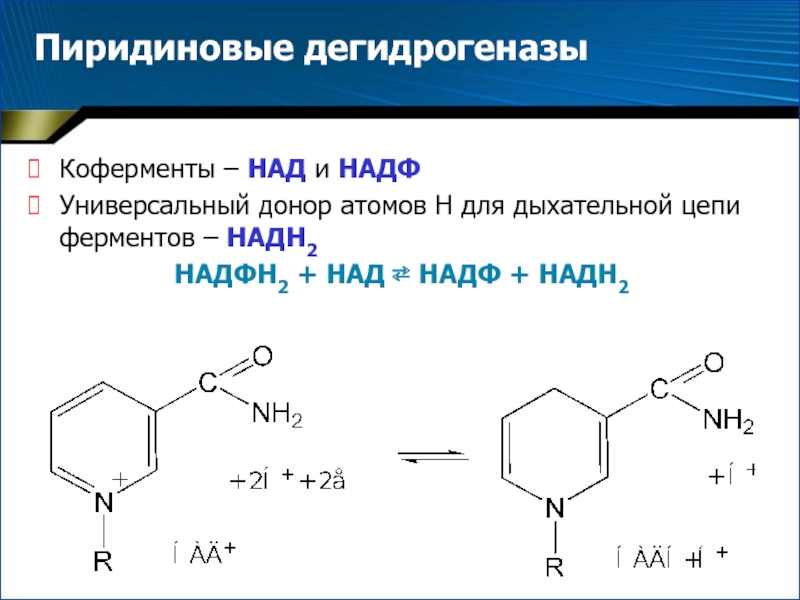
Слайд 53Пиридиновые дегидрогеназы
Коферменты – НАД и НАДФ
Универсальный донор атомов Н
для дыхательной цепи ферментов – НАДН2
НАДФН2 + НАД ⇄
НАДФ + НАДН2Слайд 54Флавиновые дегидрогеназы
Коферменты – ФМН и ФАД
являются акцепторами атомов Н и
осуществляют перенос их от НАДН2
НАДН2 + ФАД ⇄ НАД +
ФАДН2В некоторых случаях (?) могут играть роль первичных дегидрогеназ
Слайд 57Цитохромы
Дальнейший перенос электронов от КоQ на О2 осуществляет система цитохромов
– ряд гемопротеидов, расположенных в порядке возрастания ОВП (?)
Цит а
и а3 содержат в своем составе атомы CuПри транспорте электронов в направлении увеличения ОВП происходят процессы:
Fe2+ ⇄ Fe3+ (в цит. b, c1, с)
Cu+ ⇄ Cu2+ (в цит. а, а3)
Слайд 59Самая примечательная особенность дыхательной цепи – наличие участков, где соседние
компоненты резко отличаются значениями ОВП
Именно здесь происходит сопряжение окисления
с фосфорилированием АДФСлайд 60Хемиосмотическая гипотеза
Питер Митчелл, Владимир Петрович Скулачев
Реакции, сопровождающиеся расходованием или
образованием Н+, протекают на внутренней мембране митохондрий так , что
Н+ переносятся с внутренней мембраны на внешнюю, т. е. перенос электронов сопровождается возникновением трансмембранного градиента концентрации Н+ – совершением осмотической работыЭтот градиент, создающий разность химических () и электрических () потенциалов, – источник энергии образования АТФ
АТФаза – фермент, способный использовать градиент концентрации ионов Н+ для обращения процесса гидролиза АТФ
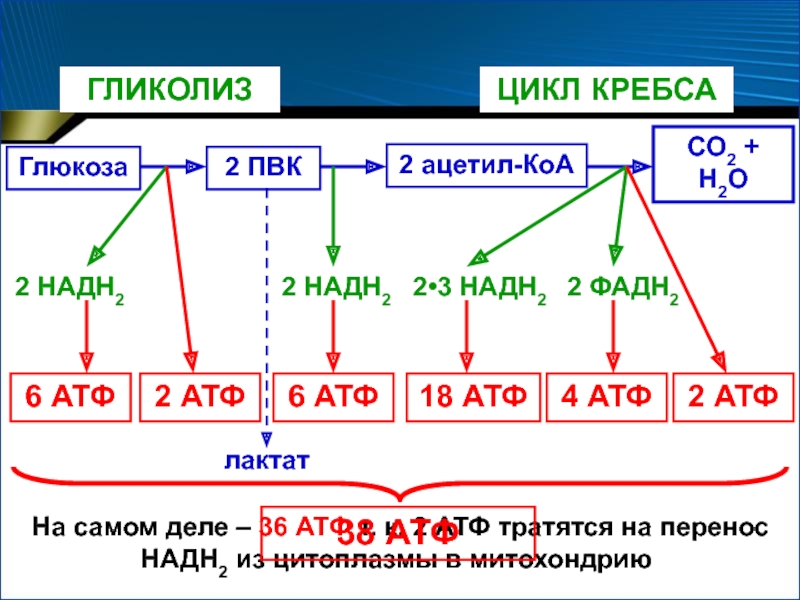
Слайд 61Энергетический эффект гликолитического расщепления 1 молекулы глюкозы и последующего окисления
ПВК
до СО2 и Н2О
Слайд 62На самом деле – 36 АТФ т. к. 2 АТФ
тратятся на перенос НАДН2 из цитоплазмы в митохондрию
Глюкоза
2 ПВК
ГЛИКОЛИЗ
лактат
2 ацетил-КоА
СО2
+ Н2ОЦИКЛ КРЕБСА
2 АТФ
6 АТФ
2 НАДН2
2 НАДН2
2•3 НАДН2
2 ФАДН2
6 АТФ
18 АТФ
4 АТФ
2 АТФ
38 АТФ