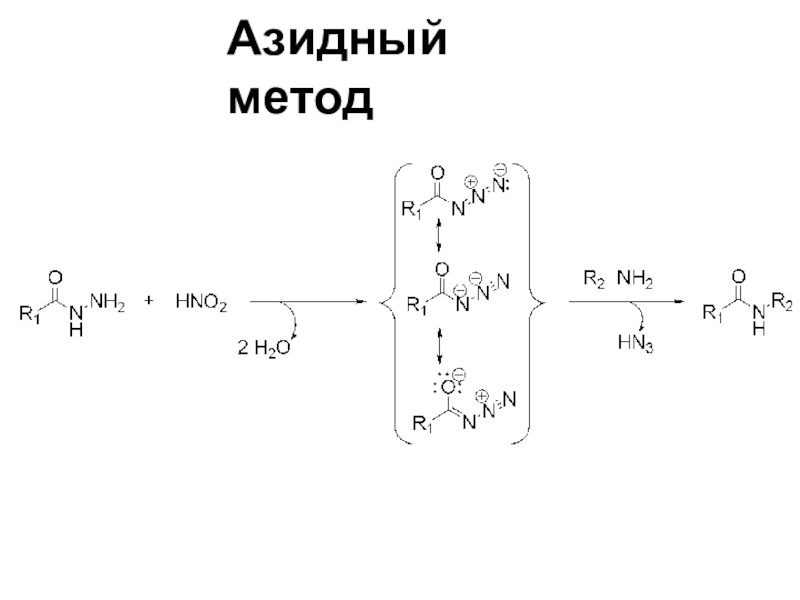
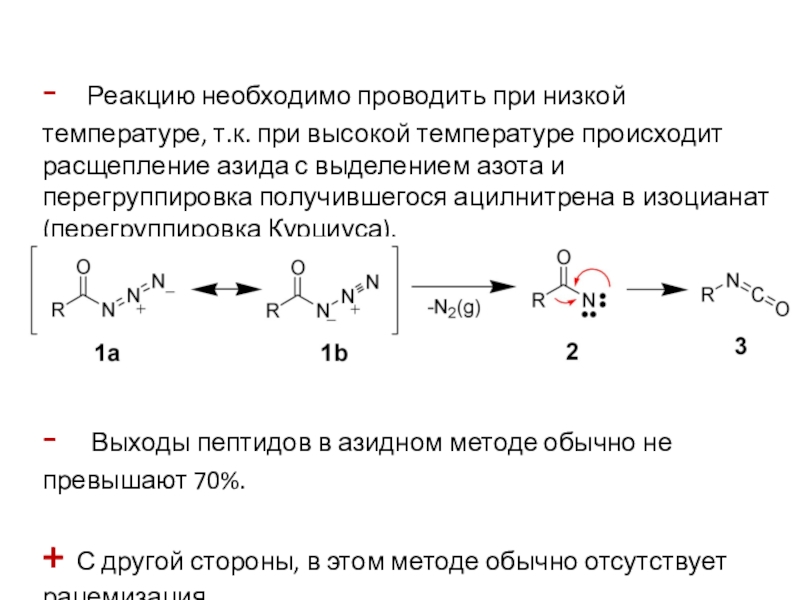
Слайд 3- Реакцию необходимо проводить при низкой температуре, т.к.
при высокой температуре происходит расщепление азида с выделением азота и
перегруппировка получившегося ацилнитрена в изоцианат (перегруппировка Курциуса).
- Выходы пептидов в азидном методе обычно не превышают 70%.
+ С другой стороны, в этом методе обычно отсутствует рацемизация.
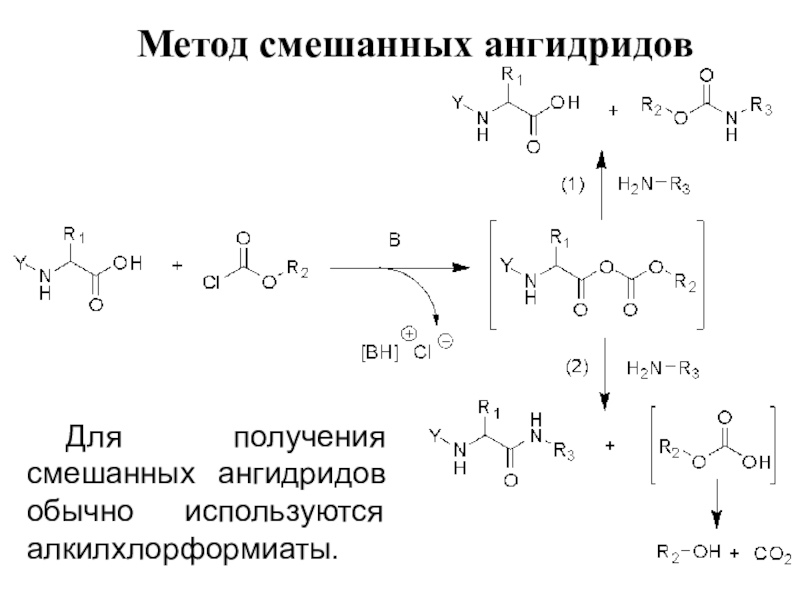
Слайд 4Метод смешанных ангидридов
Для получения смешанных ангидридов обычно используются алкилхлорформиаты.
Слайд 5+ Региоселективность реакции аминолиза смешанного ангидрида – удовлетворительная.
В случае
смешанных ангидридов, образованных с использованием алкилхлорформиатов, аминогруппа преимущественно атакует аминокислотный
карбоксил, давая в результате желаемый пептид и соответствующую кислоту (в случае с алкилхлорформиатом – моноэфир угольной кислоты, который тут же распадается на углекислый газ и спирт).
Однако иногда атакуется противоположный карбоксил, и образуется смесь исходного карбоксикомпонента с уретаном, что может существенно снизить выход конденсации.
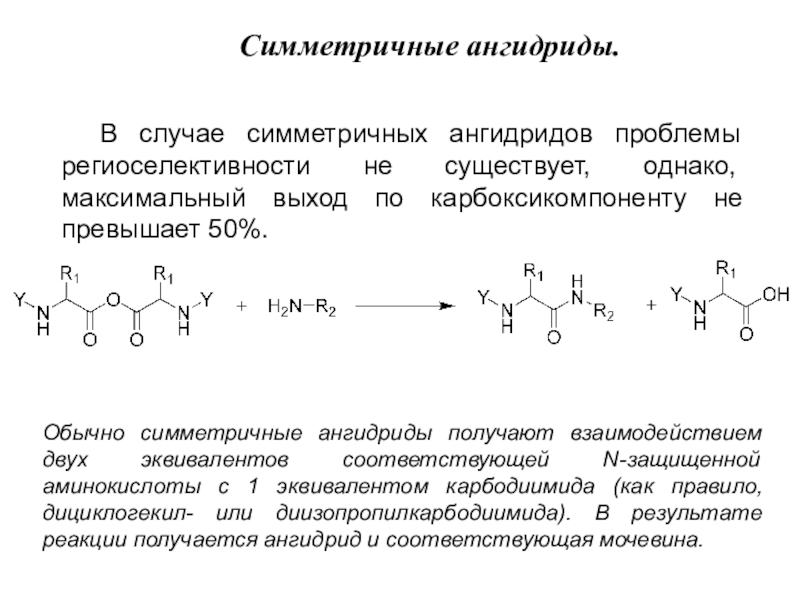
Слайд 6В случае симметричных ангидридов проблемы региоселективности не существует, однако, максимальный
выход по карбоксикомпоненту не превышает 50%.
Симметричные ангидриды.
Обычно симметричные ангидриды получают
взаимодействием двух эквивалентов соответствующей N-защищенной аминокислоты с 1 эквивалентом карбодиимида (как правило, дициклогекил- или диизопропилкарбодиимида). В результате реакции получается ангидрид и соответствующая мочевина.
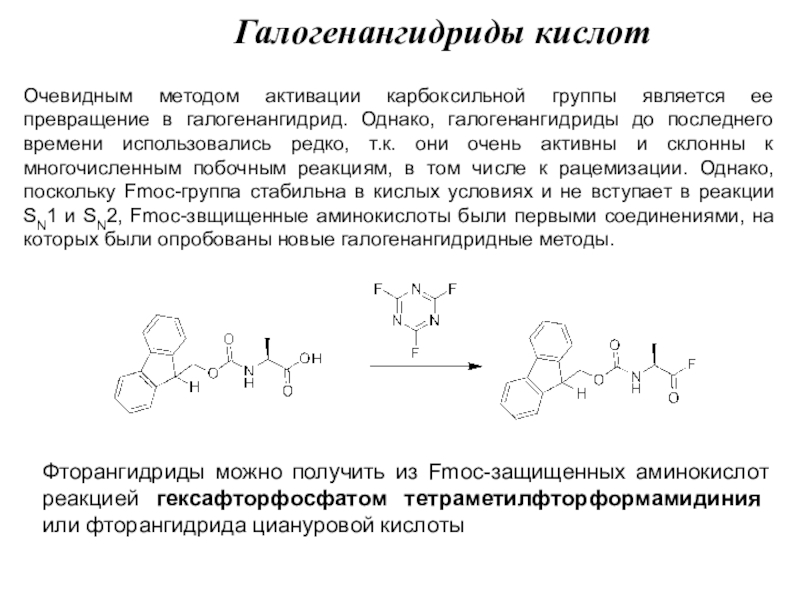
Слайд 7Очевидным методом активации карбоксильной группы является ее превращение в галогенангидрид.
Однако, галогенангидриды до последнего времени использовались редко, т.к. они очень
активны и склонны к многочисленным побочным реакциям, в том числе к рацемизации. Однако, поскольку Fmoc-группа стабильна в кислых условиях и не вступает в реакции SN1 и SN2, Fmoc-звщищенные аминокислоты были первыми соединениями, на которых были опробованы новые галогенангидридные методы.
Галогенангидриды кислот
Фторангидриды можно получить из Fmoc-защищенных аминокислот реакцией гексафторфосфатом тетраметилфторформамидиния или фторангидрида циануровой кислоты
Слайд 8Чаще хлорангидридов в настоящий момент используют фторангидриды, т.к. они:
- более
стабильны,
- хуже разлагаются водой,
- менее склонны к образованию
оксазолонов при обработке третичными основаниями.
Фторангидриды Fmoc-защищенных аминокислот оказались эффективны при синтезе пептидов, как в растворе, так и на твердой фазе.
Реакции с фторангидридами не требуют присутствия основания, что позволяет минимизировать рацемизацию.
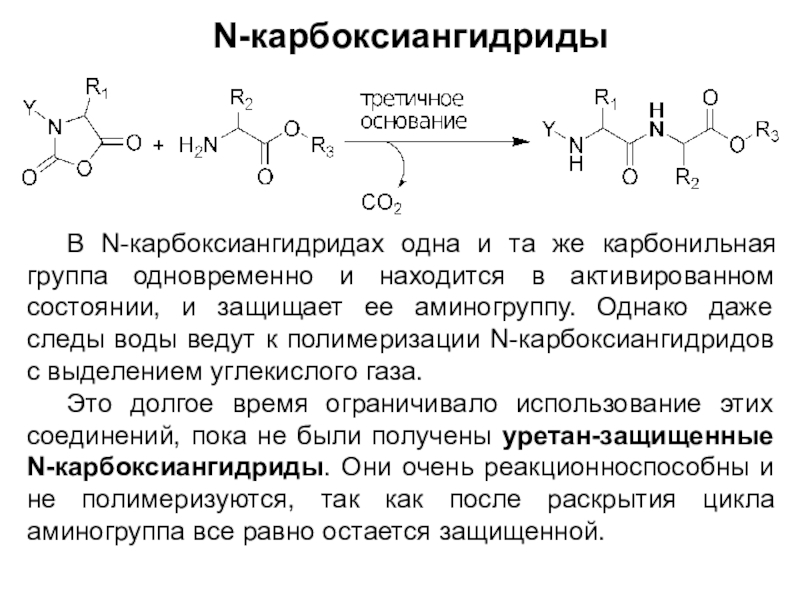
Слайд 9N-карбоксиангидриды
В N-карбоксиангидридах одна и та же карбонильная группа одновременно и
находится в активированном состоянии, и защищает ее аминогруппу. Однако даже
следы воды ведут к полимеризации N-карбоксиангидридов с выделением углекислого газа.
Это долгое время ограничивало использование этих соединений, пока не были получены уретан-защищенные N-карбоксиангидриды. Они очень реакционноспособны и не полимеризуются, так как после раскрытия цикла аминогруппа все равно остается защищенной.
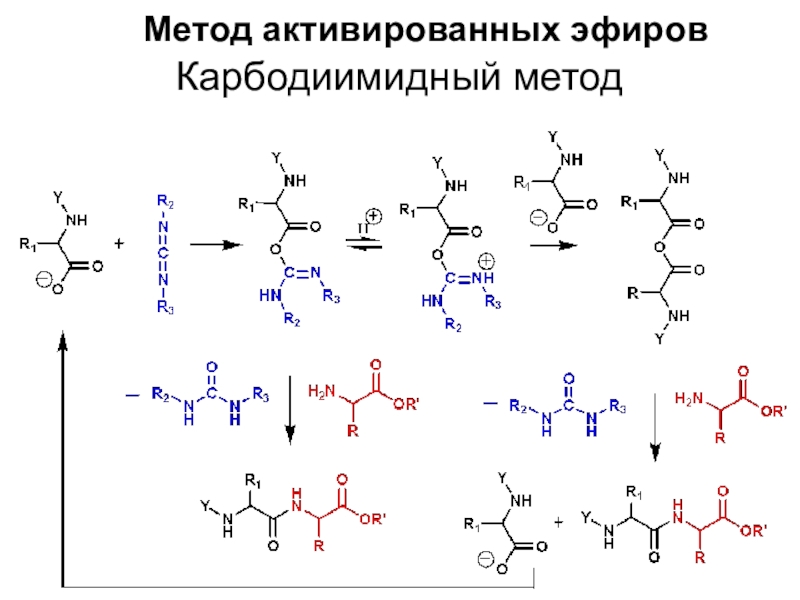
Слайд 10Метод активированных эфиров
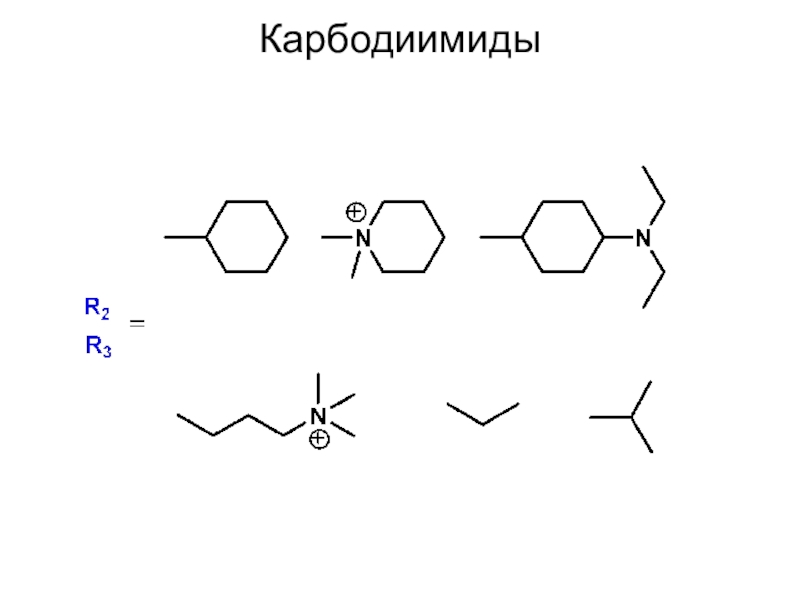
Карбодиимидный метод
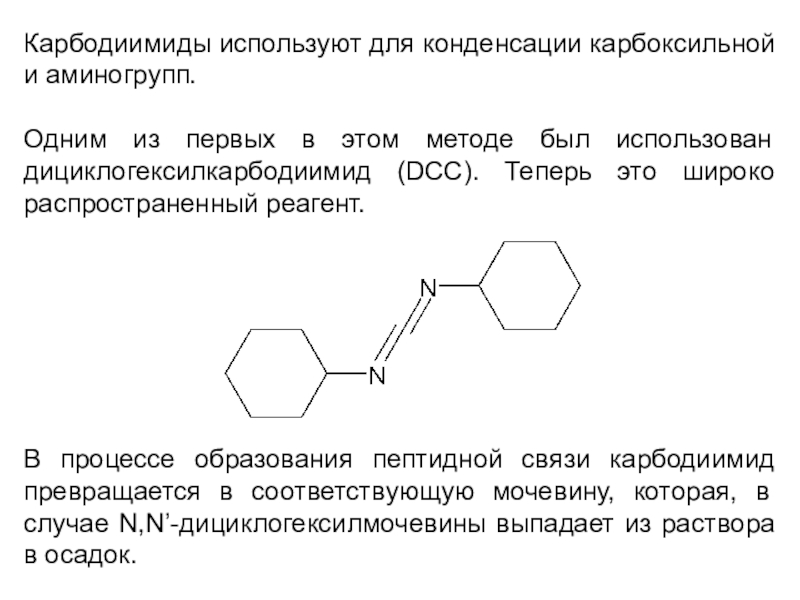
Слайд 11Карбодиимиды используют для конденсации карбоксильной и аминогрупп.
Одним из первых
в этом методе был использован дициклогексилкарбодиимид (DCC). Теперь это широко
распространенный реагент.
В процессе образования пептидной связи карбодиимид превращается в соответствующую мочевину, которая, в случае N,N’-дициклогексилмочевины выпадает из раствора в осадок.
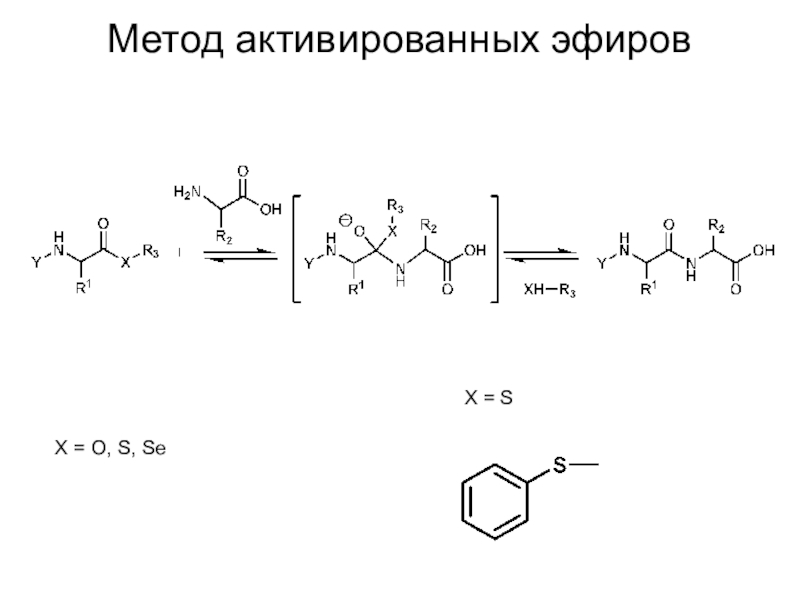
Слайд 13Метод активированных эфиров
X = O, S, Se
X = S
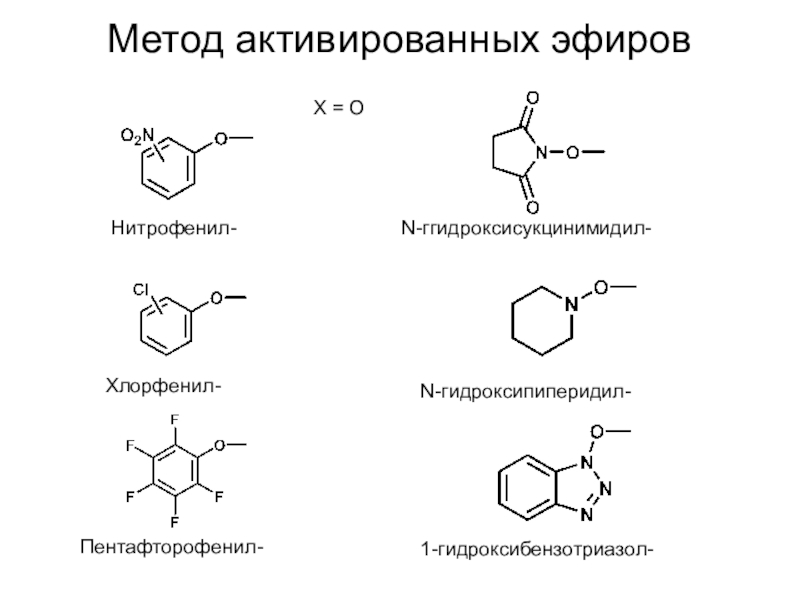
Слайд 14Метод активированных эфиров
X = O
Нитрофенил-
Хлорфенил-
Пентафторофенил-
N-гидроксипиперидил-
N-ггидроксисукцинимидил-
1-гидроксибензотриазол-
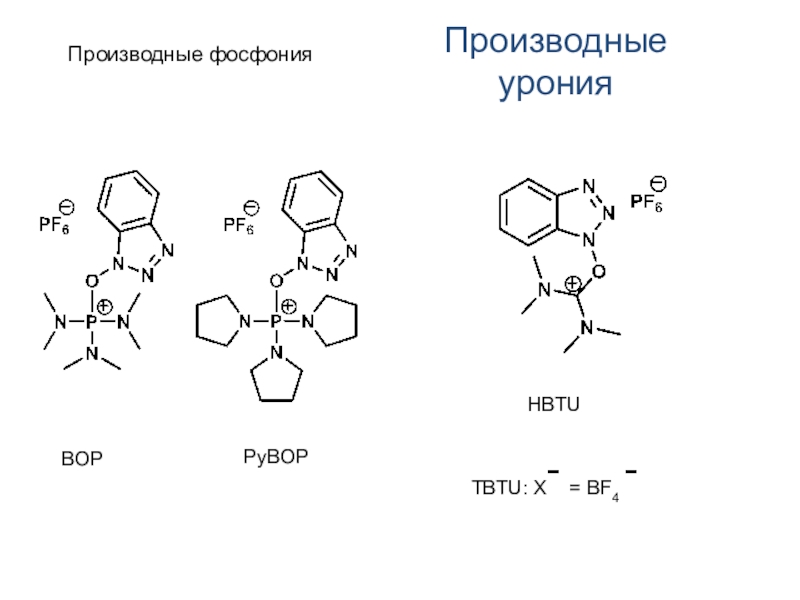
Слайд 15Производные фосфония
Производные урония
BOP
PyBOP
HBTU
TBTU: Xˉ = BF4 ˉ
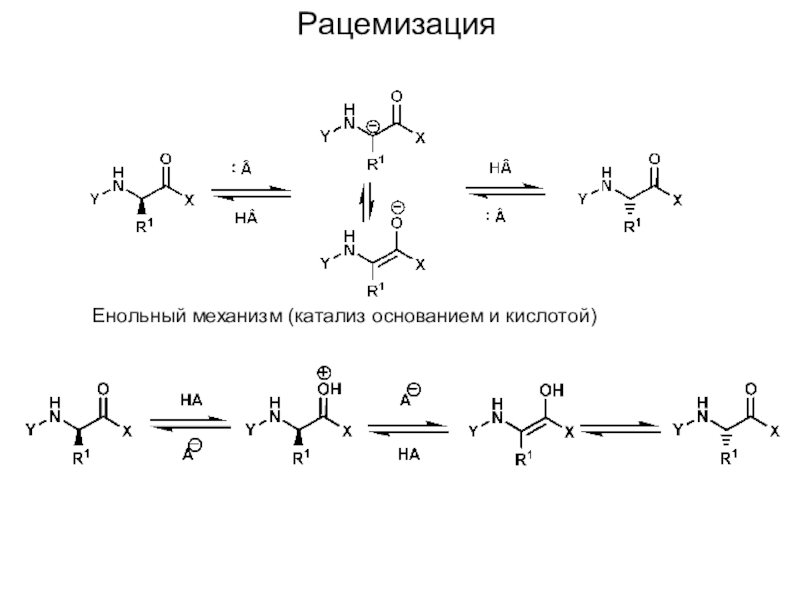
Слайд 16Рацемизация
Енольный механизм (катализ основанием и кислотой)
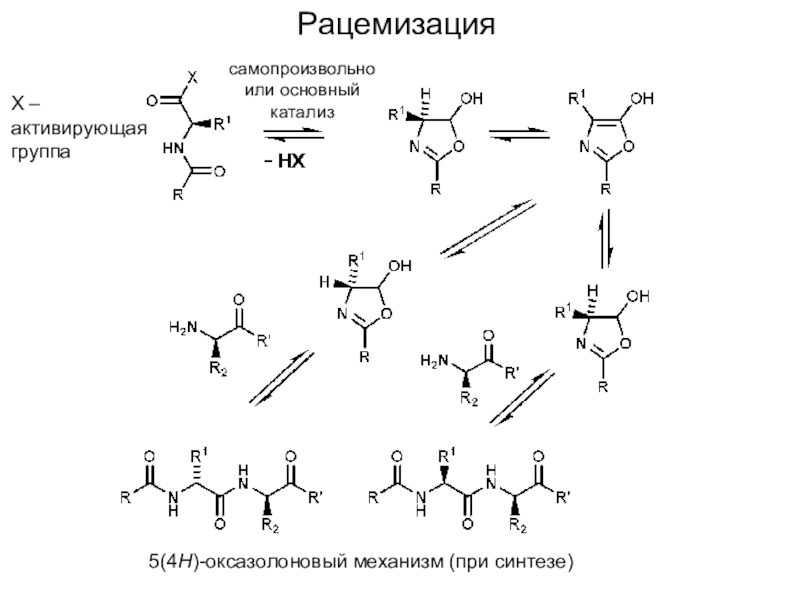
Слайд 17Рацемизация
5(4H)-оксазолоновый механизм (при синтезе)
X – активирующая группа
самопроизвольно или основный катализ
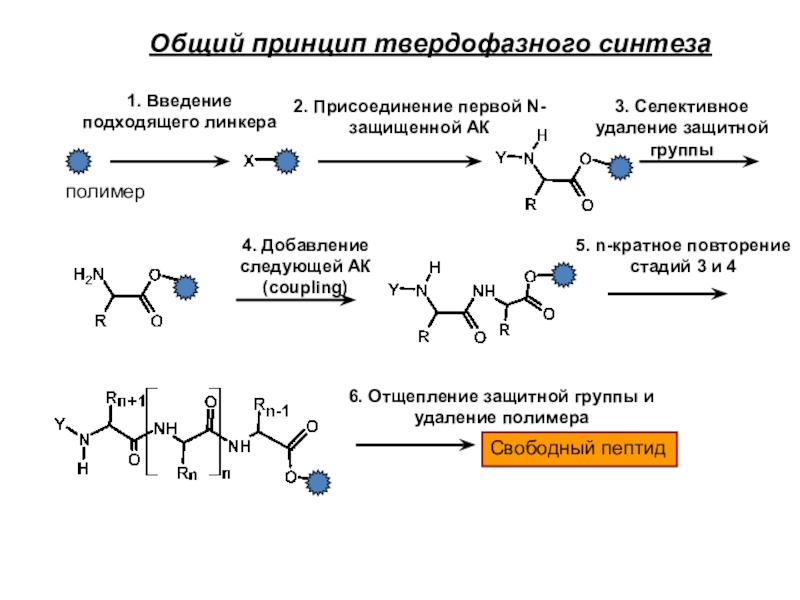
Слайд 18Общий принцип твердофазного синтеза
Свободный пептид
полимер
1. Введение подходящего линкера
2. Присоединение первой
N-защищенной АК
3. Селективное удаление защитной группы
4. Добавление следующей АК (coupling)
5.
n-кратное повторение стадий 3 и 4
6. Отщепление защитной группы и удаление полимера
Слайд 19Требования к носителям
химическая инертность
механическая стабильность
нерастворимость в используемом
растворителе
легкое удаление путем фильтрации
достаточное количество реакционных центров
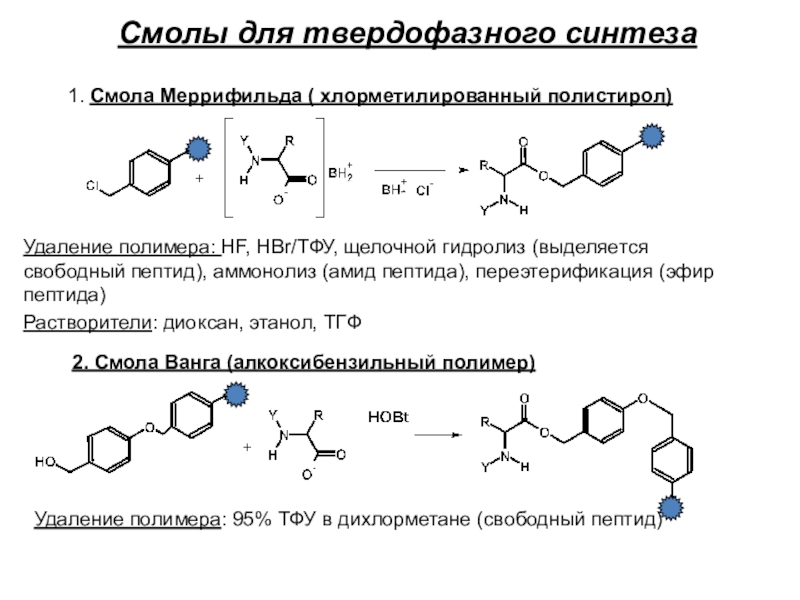
Слайд 20Смолы для твердофазного синтеза
1. Смола Меррифильда ( хлорметилированный полистирол)
Удаление полимера:
HF, HBr/ТФУ, щелочной гидролиз (выделяется свободный пептид), аммонолиз (амид пептида),
переэтерификация (эфир пептида)
Растворители: диоксан, этанол, ТГФ
2. Смола Ванга (алкоксибензильный полимер)
Удаление полимера: 95% ТФУ в дихлорметане (свободный пептид)
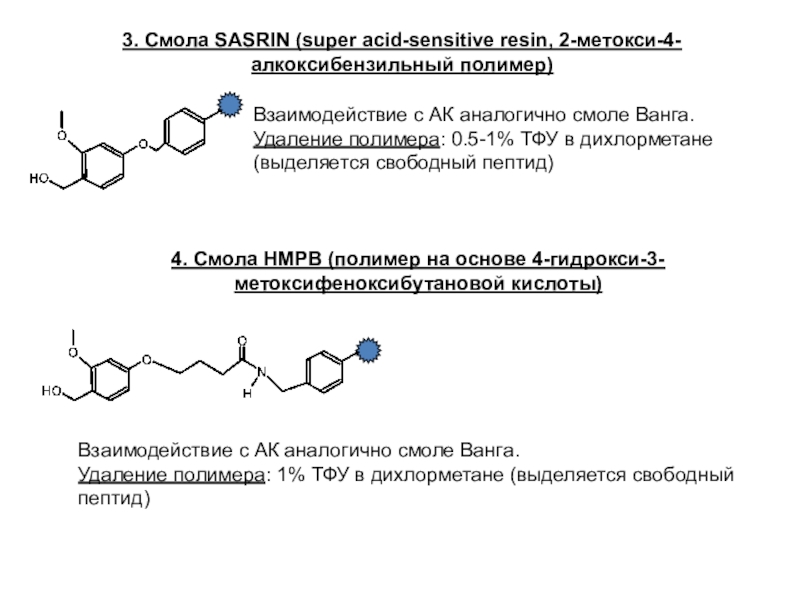
Слайд 213. Смола SASRIN (super acid-sensitive resin, 2-метокси-4-алкоксибензильный полимер)
Взаимодействие с АК
аналогично смоле Ванга.
Удаление полимера: 0.5-1% ТФУ в дихлорметане (выделяется свободный
пептид)
4. Смола HMPB (полимер на основе 4-гидрокси-3-метоксифеноксибутановой кислоты)
Взаимодействие с АК аналогично смоле Ванга.
Удаление полимера: 1% ТФУ в дихлорметане (выделяется свободный пептид)
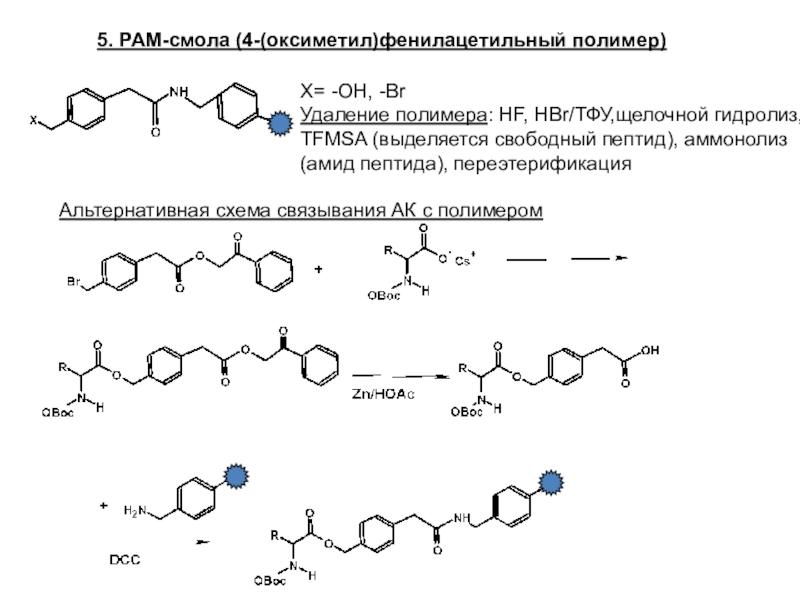
Слайд 225. PAM-смола (4-(оксиметил)фенилацетильный полимер)
X= -OH, -Br
Удаление полимера: HF, HBr/ТФУ,щелочной гидролиз,
TFMSA (выделяется свободный пептид), аммонолиз (амид пептида), переэтерификация
Альтернативная схема связывания
АК с полимером
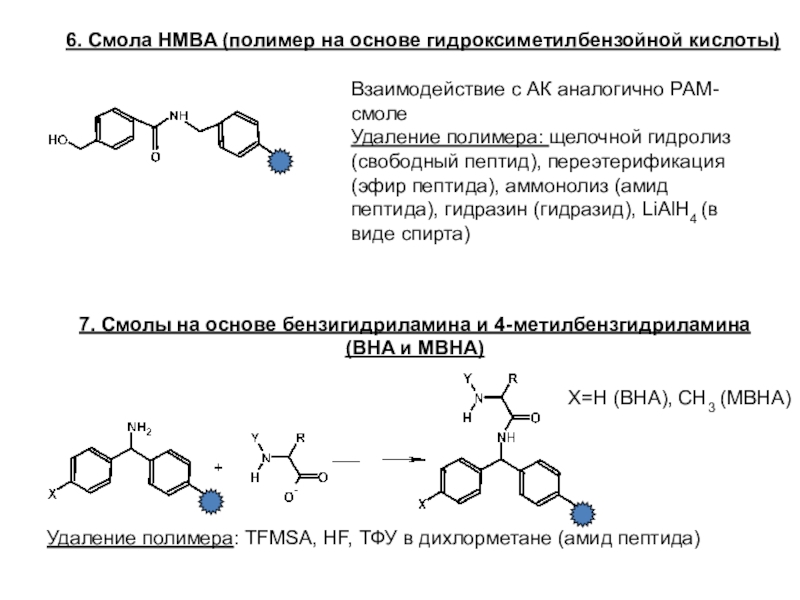
Слайд 236. Смола HMBA (полимер на основе гидроксиметилбензойной кислоты)
Взаимодействие с АК
аналогично РАМ-смоле
Удаление полимера: щелочной гидролиз (свободный пептид), переэтерификация (эфир пептида),
аммонолиз (амид пептида), гидразин (гидразид), LiAlH4 (в виде спирта)
7. Смолы на основе бензигидриламина и 4-метилбензгидриламина (BHA и МВНА)
X=H (BHA), CH3 (MBHA)
Удаление полимера: TFMSA, HF, ТФУ в дихлорметане (амид пептида)
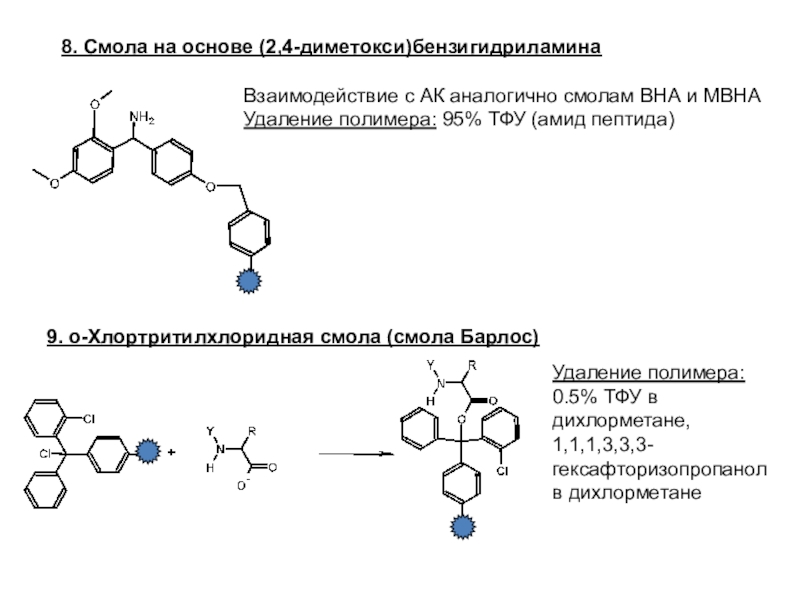
Слайд 248. Смола на основе (2,4-диметокси)бензигидриламина
Взаимодействие с АК аналогично смолам ВНА
и МВНА
Удаление полимера: 95% ТФУ (амид пептида)
9. о-Хлортритилхлоридная смола (смола
Барлос)
Удаление полимера:
0.5% ТФУ в дихлорметане,
1,1,1,3,3,3-гексафторизопропанол
в дихлорметане
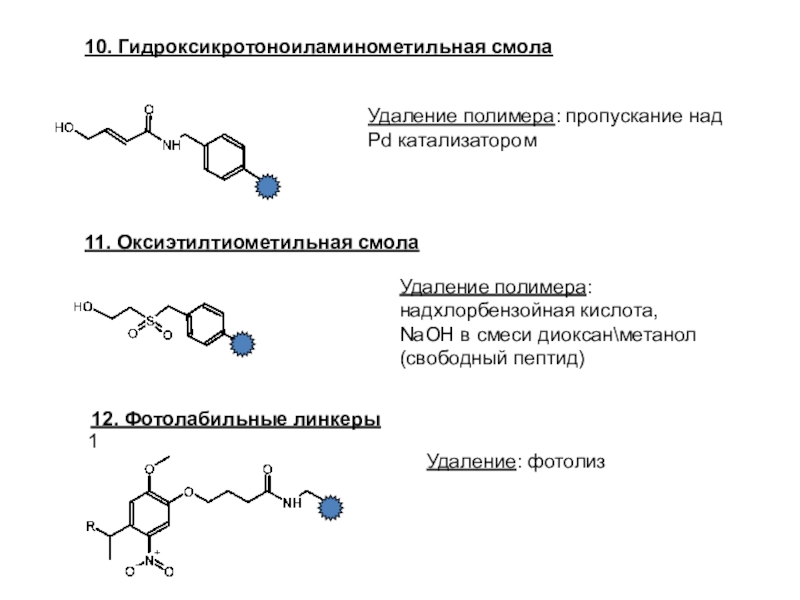
Слайд 2510. Гидроксикротоноиламинометильная смола
Удаление полимера: пропускание над Pd катализатором
11. Оксиэтилтиометильная смола
Удаление
полимера: надхлорбензойная кислота,
NaOH в смеси диоксан\метанол (свободный пептид)
1
12. Фотолабильные линкеры
Удаление:
фотолиз
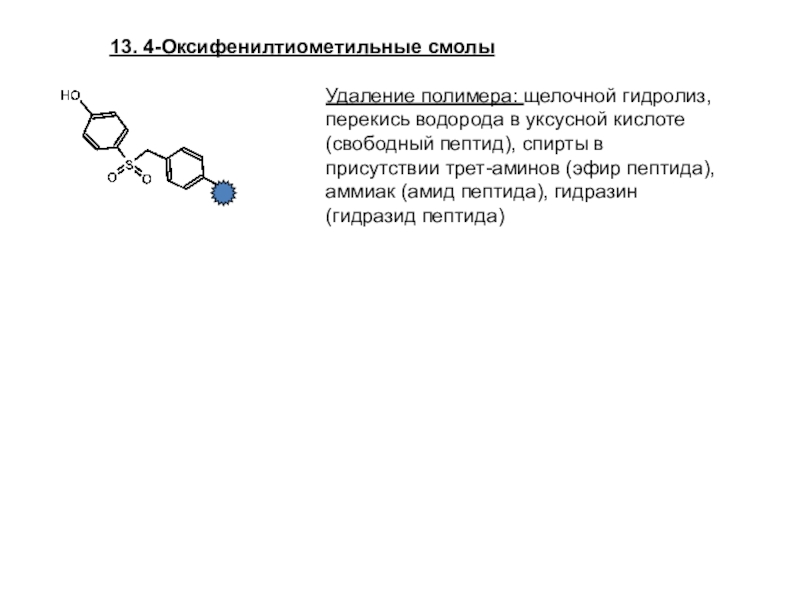
Слайд 2613. 4-Оксифенилтиометильные смолы
Удаление полимера: щелочной гидролиз, перекись водорода в уксусной
кислоте (свободный пептид), спирты в присутствии трет-аминов (эфир пептида), аммиак
(амид пептида), гидразин (гидразид пептида)
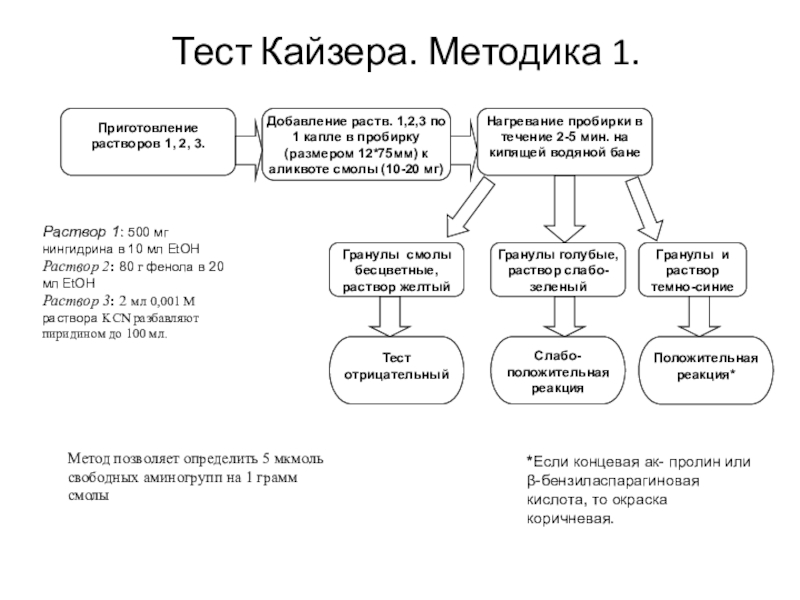
Слайд 27Нингидриновый тест Кайзера - метод
контроля реакции пептидообразования
Слайд 28 Ключевым подходом твердофазного синтеза является стремление довести
выход реакций до 100%. Разработаны разнообразные количественные и качественные методы,
чтобы удостовериться в этом. Наиболее распространенным является нингидриновый тест Кайзера.
Слайд 29Приготовление растворов 1, 2, 3.
Добавление раств. 1,2,3 по 1 капле
в пробирку (размером 12*75мм) к аликвоте смолы (10-20 мг)
Нагревание пробирки
в течение 2-5 мин. на кипящей водяной бане
Тест отрицательный
Слабо-положительная реакция
Гранулы смолы бесцветные, раствор желтый
Гранулы голубые, раствор слабо-зеленый
Раствор 1: 500 мг нингидрина в 10 мл EtOH
Раствор 2: 80 г фенола в 20 мл EtOH
Раствор 3: 2 мл 0,001 М раствора KCN разбавляют пиридином до 100 мл.
Гранулы и раствор темно-синие
Положительная реакция*
*Если концевая ак- пролин или β-бензиласпарагиновая кислота, то окраска коричневая.
Метод позволяет определить 5 мкмоль свободных аминогрупп на 1 грамм смолы
Тест Кайзера. Методика 1.
Слайд 30Количественный тест Кайзера.
Методика 2.
Готовят следующие реагенты:
Раствор1: В 10 мл абсолютного этанола при нагревании растворяют 40
г фенола, добавляют 4г смолы Амберлит МВ-3, перемешивают 45 мин и отфильтровывают.
Растворяют 65 мг KCN в 100 мл воды. 2 мл этого раствора разбавляют до 100 мл водой, добавляют 4 г Амберлит МВ-3, размешивают и смолу удаляют. К фильтрату прибавляют предыдущий раствор фенола.
Раствор 2: В 50 мл абсолютного этанола растворяют 2,5 г нингидрина, склянку хранят в темноте над азотом. Пробу анализируемой смолы промывают 2 раза 5% раствором диизопропилэтиламина в хлористом метилене, трижды – хлористым метиленом и сушат в вакууме при комнатной температуре.
Слайд 31Процедуры определения свободных аминогрупп (АГ)
При низком их содержании
(до 0,1 мкмоль)
К
навеске (2-5мг) пептидил-полимера прибавляют 100 мкл раствора 1 и 25 мкл раствора 2. В пробирку сравнения добавляют лишь эти растворы. Пробирки выдерживают при 100 ◦С 10 мин, охлаждают. К смеси добавляют 1 мл 60% этанола, перемешивают. Пробирки двукратно ополаскивают 0,20 мл раствора хлористого тетраэтиламмония в хлористом метилене. Содержимое разбавляют 60% этанолом до 2 мл и измеряют поглощение на 570 нм против контрольного раствора.
При высоком содержании
(0,1-2 мкмоль)
Чувствительность метода - 0,3 мкмоль АГ на 1 г смолы. Можно определить свободные АГ при блокировании их на 99,9%. Навеску пептидил- полимера (2-5 мг) обрабатывают как и при низком содержании АГ. Но добавляют 2 мл этанола и пробирки ополаскивают 0,5 мл раствора хлористого тетраэтиламмония.Содержимое разбавляют 60% этанолом до 25 мл. Количество свободных АГ вычисляют по формуле:
Где A- поглощение света при 570 нм;
V - объем пробы, мл; ε' - коэффициент экстинкции, 1,5*104 М*см-1; W -навеска, мг.
Слайд 32 Нингидриновый тест используют при исследовании явления
агрегации в твердофазном синтезе пептидов. Он является самым простым и
доступным методом (хотя и неспецифическим).
Надежные критерии агрегации в рамках данного подхода:
устойчиво положительные результаты теста нескольких подряд аминоацилирований
тест остается положительным после повторной посадки АК.
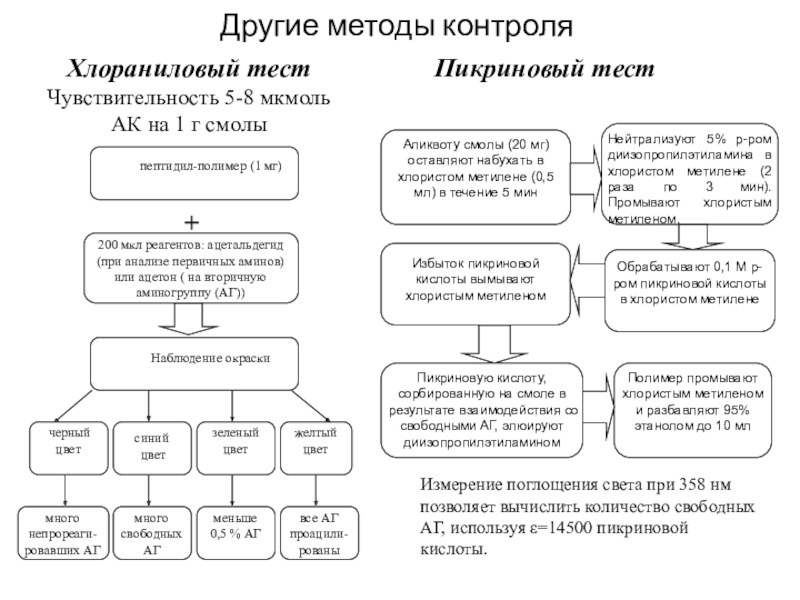
Слайд 33Другие методы контроля
Хлораниловый тест
Чувствительность 5-8 мкмоль АК на 1 г
смолы
Пикриновый тест
Нейтрализуют 5% р-ром диизопропилэтиламина в хлористом метилене
(2 раза по 3 мин). Промывают хлористым метиленом.
Обрабатывают 0,1 М р-ром пикриновой кислоты в хлористом метилене
Избыток пикриновой кислоты вымывают хлористым метиленом
Пикриновую кислоту, сорбированную на смоле в результате взаимодействия со свободными АГ, элюируют диизопропилэтиламином
Полимер промывают хлористым метиленом и разбавляют 95% этанолом до 10 мл
Аликвоту смолы (20 мг) оставляют набухать в хлористом метилене (0,5 мл) в течение 5 мин
Измерение поглощения света при 358 нм позволяет вычислить количество свободных АГ, используя ε=14500 пикриновой кислоты.
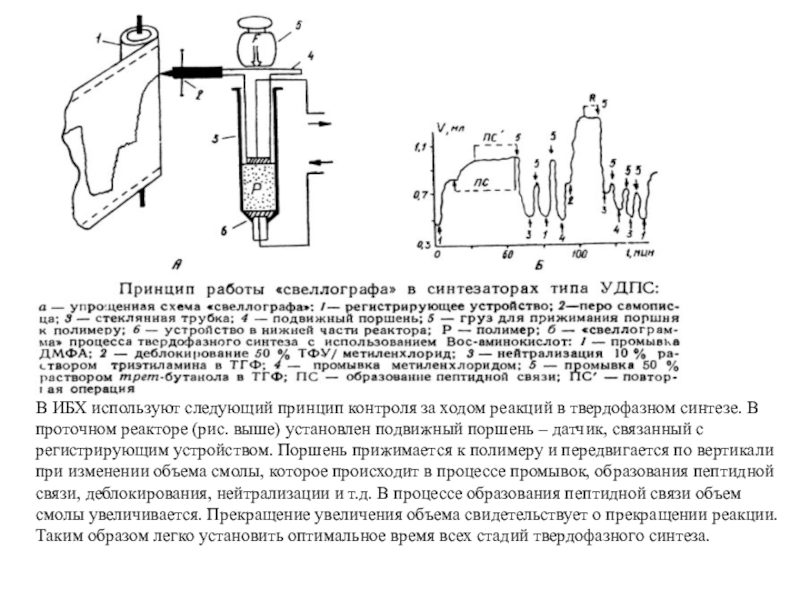
Слайд 34В ИБХ используют следующий принцип контроля за ходом реакций в
твердофазном синтезе. В проточном реакторе (рис. выше) установлен подвижный поршень
– датчик, связанный с регистрирующим устройством. Поршень прижимается к полимеру и передвигается по вертикали при изменении объема смолы, которое происходит в процессе промывок, образования пептидной связи, деблокирования, нейтрализации и т.д. В процессе образования пептидной связи объем смолы увеличивается. Прекращение увеличения объема свидетельствует о прекращении реакции. Таким образом легко установить оптимальное время всех стадий твердофазного синтеза.
Слайд 35Применение пептидов в медицине
Источники
Эндогенные фармацевтические белки
Разработка терапевтических белков
Вакцины
Антитела
Перспективы
Промышленный синтез пептидов
Фармацевтические пептидные препараты
Способы введения пептидных
препаратов
Пептиды – инструменты в поиске лекарств
Слайд 36Источники
Белки – основная фракция биополимеров во всех организмах.
До конца 70-х
г.г. человеческое тело - основной источник эндогенных белков типа фактора
роста и фактора коагуляции VIII, используемых для заместительной терапии.
Критерии выбора источника:
Легкость получения ткани в достаточных количествах
Высокое содержание белка в ткани
Свойства помогающие стабилизировать и извлечь белок
Основные источники:
Домашние животные
Микроорганизмы
Растения
Трансгенные организмы
Слайд 37Эндогенные фармацевтические белки
Фармацевтическое приложение эндогенных белков:
Открытие и синтез белков с
терапевтическим потенциалом,
используя генные технологии
Выяснение их биологического действия in vitro
и in vivo
Создание лекарственного препарата на основе первичной лидерной белковой молекулы.
Применяют при:
Рак Генетические заболевания
Болезни крови Болезни органов пищеварения Инфекционные болезни Астма
Аутоиммунные нарушения Бесплодие
Трансплентации Нарушение роста
Диабет Нарушение покровного слоя
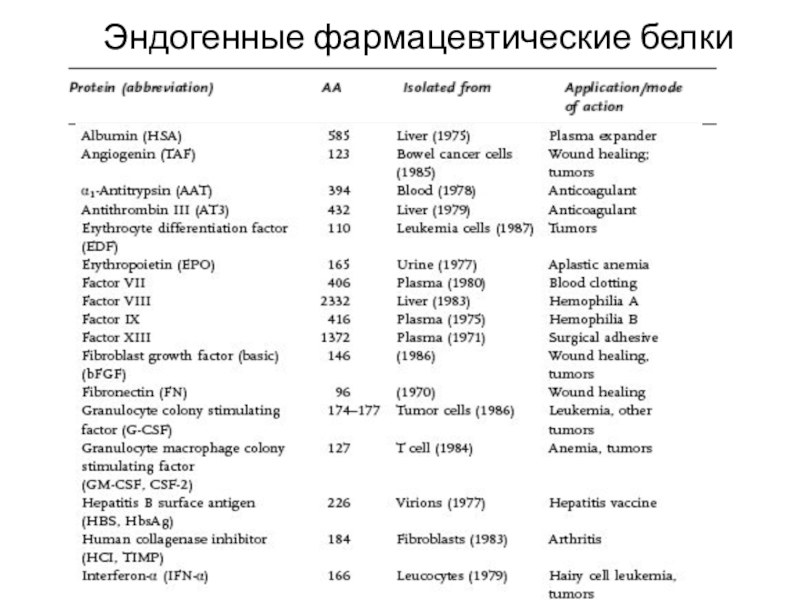
Слайд 38Эндогенные фармацевтические белки
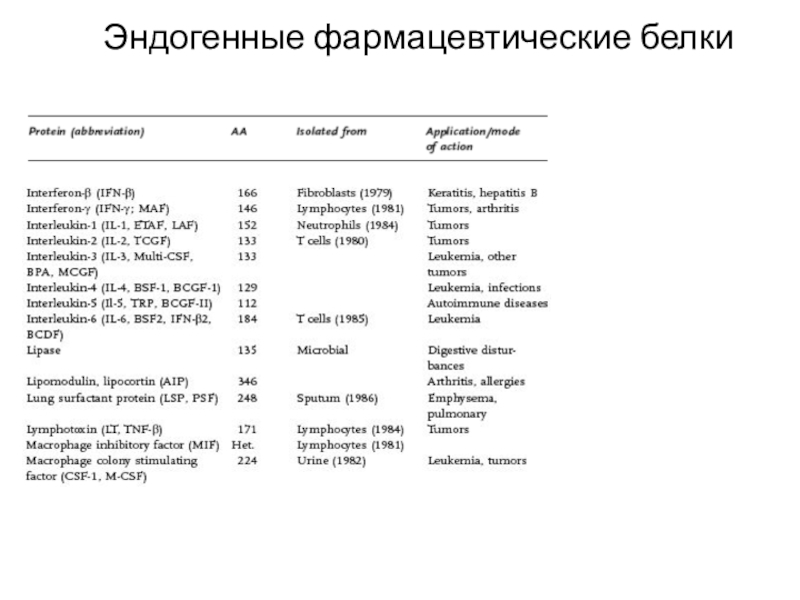
Слайд 39Эндогенные фармацевтические белки
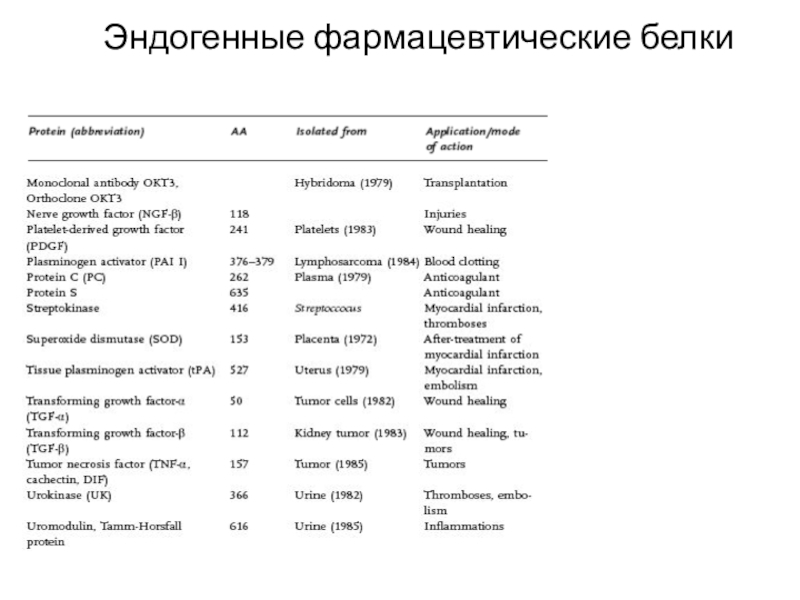
Слайд 40Эндогенные фармацевтические белки
Слайд 41Цели:
Минимизация иммуногенности белка
Улучшение фармакокинетики
Улучшение эффекторных свойств
Увеличение аффинности
Вакцины, основанные на пептидах:
Выделение
из антигена пептидов, содержащих эпитоп
Естественные иммуногенные пептиды
Синтетические пептиды, соответствующие консервативным
областям антигена
Болезнь: Вакцина:
Гепатит В пептиды вирусного капсида
Вирус гриппа иммунный усилитель Pam3Cys-Ser-Ser
ВИЧ на основе 4-х эпитопов проверена in vitro
Разработка терапевтических белков
Эффективная иммунная реакция без потенциального риска
Слайд 43Разработка терапевтических белков
Моноклональные антитела
Химерные (гумманизированные) антитела – вариабельные домены мышиных
АТ, константные домены человеческих АТ
АТ и их производные – 25%
всех производимых фармацевтических белков
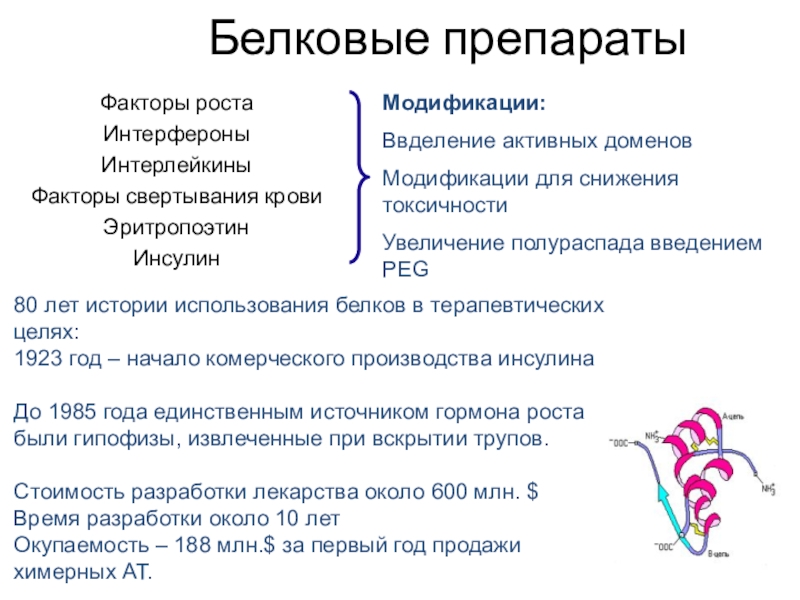
Слайд 44Белковые препараты
Факторы роста
Интерфероны
Интерлейкины
Факторы свертывания крови
Эритропоэтин
Инсулин
Модификации:
Ввделение активных доменов
Модификации для снижения токсичности
Увеличение
полураспада введением PEG
80 лет истории использования белков в терапевтических целях:
1923
год – начало комерческого производства инсулина
До 1985 года единственным источником гормона роста были гипофизы, извлеченные при вскрытии трупов.
Стоимость разработки лекарства около 600 млн. $
Время разработки около 10 лет
Окупаемость – 188 млн.$ за первый год продажи химерных АТ.
Слайд 45Перспективы
Протеом – набор белков, экспрессируемых клеткой в
определенное время в известных условиях.
Число белков в организме превышает
число генов за счет посттраннсляционная модификация
Протеом динамически отражает изменение состояния клетки
Фундаментальная задача – понимание структуры, функциональных и молекулярных взаимодействий, регулирования белков в различных типах клеток.
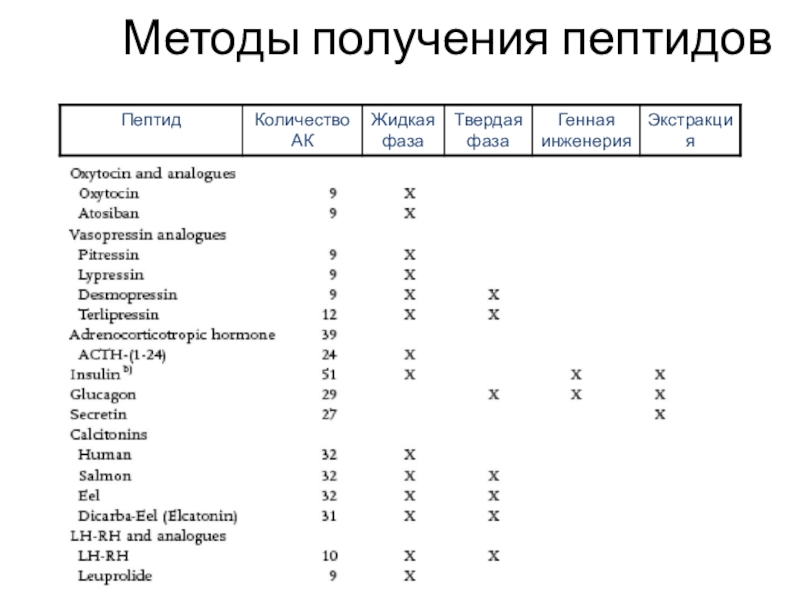
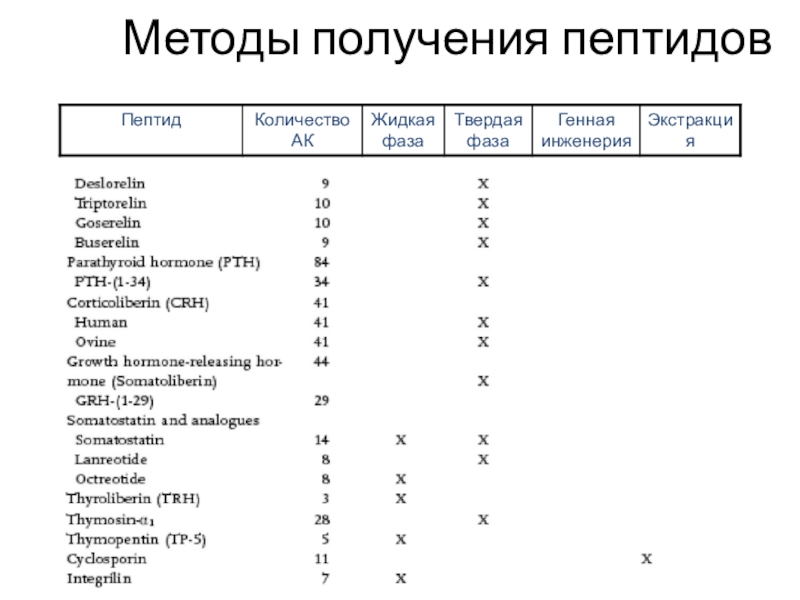
Слайд 46Методы получения пептидов
Прибор для твердофазного синтеза
Биотехнологическое производство
Установка для жидкофазного синтеза
Слайд 49Пептидные фармацевтические препараты
Пептидные препараты содержат < 40 аминокислот
Пептиды – 0,0025%
массы всех производимых лекарств
Продажи циклосприна – 1 млрд.$/год.
Циклоспорин применяют при
трансплантации органов
Создание пептидных ингибиторов белок-белковых взаимодействий
Конечные цели при создании пептидных лекарств:
Высокая эффективность в естественных условиях
Сродство к целевому белку
Отсутствие побочных действий и высокая биодоступность
Основной недостаток – метаболическая неустойчивость
Слайд 50Способы введения пептидов
Пероральное применение приводит к низкой биодоступности
Другие способы введения: Применение
аналогов per os:
Подкожное Вазопрессин - десмопрессин
Сублингвальное Аналоги соматостатина
Интраназальное и др.
Присоединение PEG к
пептидам:
Увеличение биодоступности при пероральном применении
Увеличение времени циркуляции в кровотоке
Пептиды не способны к транспортировке из крови в мозг ГЭБ!
Присоединение к пептиду лигандов рецептор опосредованного трансцитоза решает эту проблему
Радиоакивно меченные (125I) пептиды – диагностические и терапевтические препараты для опухолевых клеток
Слайд 51Пептиды в открытии лекарств
Идентификация и выделение рецептора нейромедиатора или гормона
Количество
потенциальных белковых мишеней для лекарств от 2000 до 5000
Все существующие
лекарства направлены на 500 целевых белков
Использование пептидов для изучения структуры функциональных областей целевого белка
Пептиды – как агонисты или антогонисты рецепторов
Конструирование пептидомиметиков
Пептиды для целевой проверки данных
Выяснение функций целевого белка в биохимическом пути
Пептиды как идентификаторы лигандов для HTS
HTS (высокопроизводительный скрининг) технология основана на конформационном взаимодействии пептида и рецептора