Слайд 1Министерство образования и науки РФ
Федеральное государственное автономное образовательное учреждение
высшего
профессионального образования
БАЛТИЙСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
ИМЕНИ ИММАНУИЛА КАНТА
Доклад
по дисциплине
«Современные проблемы биологии»
на тему:
«ВТОРИЧНЫЕ
МЕТАБОЛИТЫ ПРЕДСТАВИТЕЛЕЙ СЕМЕЙСТВА BORAGINACEAE JUSS. В СВЯЗИ С ТАКСОНОМИЕЙ И БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ»
Выполнил: студент 1 года обучения
магистратуры «Биология» направления «Экология»
факультета биоэкологии Шмаров В.А.
Руководитель: к.б.н., доцент кафедры
медицинской экологии Скрыпник Л.Н.
Калининград, 2011 г.
Слайд 2 Вторичный метаболизм растений
Растения отличаются поразительным многообразием синтетических процессов, конечные продукты
которых представлены соединениями самого разного химического строения. Вторичный метаболизм растений
- это особенность дифференцированных растительных клеток и тканей, он присущ только специализированным органам, приурочен к определённым фазам жизненного цикла. К основным классам вторичных метаболитов относятся алкалоиды, изопреноиды и фенольные соединения. В растениях также синтезируются цианогенные гликозиды, поликетиды, витамины. Из 30 известных витаминов около 20 поступает в организм человека с растительной пищей.
Слайд 3
Актуальность темы
Многие представители семейства Boraginaceae, особенно виды рода Myosotis, характеризуются
полиморфизмом и широтой ареала, что обусловливает сложность систематики и делает
это семейство перспективным объектом для хемотаксономических исследований. Сведения о химическом составе вносят в систематику растений дополнительные материалы о сходстве и различии таксонов, способствуя формированию естественной системы. Наиболее часто для этих целей используют данные о составе флавоноидов (Harborne, 1977; Пименов, Борисова, 1987; Высочина, 2004). Кроме того, исследование химического состава выявляет растения, перспективные для дальнейшего детального химического и фармакологического изучения.
Интерес к фитотерапии, значительно возросший в последние годы, а также необходимость выявления новых источников биологически активных веществ, способствуют исследованию ранее не востребованных объектов. Начальным этапом фитохимических исследований являются скрининговые работы. Они не предполагают детального изучения соединений, выявляя общие закономерности накопления различных групп веществ.
Слайд 4Цель работы: изучить возможности применения данных о составе и содержании
вторичных метаболитов в таксономии семейства Boraginaceae.
Для достижения цели были поставлены
следующие задачи:
1) на основании морфологических и эколого-географических характеристик представителей семейства Boraginaceae, произрастающих на территории Сибири, определить основные объекты биохимических исследований;
2) изучить фенольные соединения видов рода Myosotis, произрастающих на территории Сибири;
3) проанализировать возможности использования полученных данных для уточнения системы рода и выявления родственных отношений изученных видов.
Слайд 5ОБЪЕКТЫ ИССЛЕДОВАНИЯ
На основании изучения морфологических и эколого–географических особенностей видов семейства
Boraginaceae по литературным данным было отобрано для исследования вторичных метаболитов
17 видов из различных родов и триб. Из них наиболее широко распространены виды: Lithospermum officinale, Onosma simplicissima L., Buglossoides arvensis L., Myosotis palustris L., M. arvensis (L.) Hill, Echium vulgare, Nonea rossica Stev., Eritrichium pectinatum, E. subrupestre, Lappula consanguinea, L. squarrosa (Retz.) Dumort., Cynoglossum officinale; виды, часто встречающиеся на территории Сибири: L. intermedia (Ledeb.) M.Pop., Amblynotus rupestris, M. imitata Serg., M. krylovii Serg., Brunnera sibirica Stev. Приведена морфологическая характеристика 15 исследованных видов секций Myosotis, Sylvaticae и Alpestres рода Myosotis.
Слайд 6МАТЕРИАЛЫ И МЕТОДЫ
Исследовано 156 образцов 33 видов из 12 родов
семейства Boraginaceae. Кроме собственных сборов, использовали материалы, предоставленные сотрудниками лаборатории
систематики высших растений и флорогенетики ЦСБС СО РАН. Наиболее подробно исследован состав флавоноидов и фенолкарбоновых кислот в видах рода Myosotis (122 образца 15 видов).
Изучали наличие вторичных метаболитов 17 видов семейства.
Содержание флавоноидов определяли спектрофотометрическими методами (Государственная фармакопея СССР, 1990; Высочина, 1998). Состав флавоноидов и фенолкарбоновых кислот исследовали хроматографией на бумаге FN5 и FN15 (Хроматография, 1986; Высочина, 1998) и методами ВЭЖХ, УФ-спектроскопии и масс-спектрометрии (МСД). Наличие катехинов, кумаринов, алкалоидов, сапонинов и карденолидов устанавливали общепринятыми методами.
При определении таксономического значения фенолкарбоновых кислот использовали методы парных коэффициентов сходства и полигональных фигур (Ellison et all., 1962). Статистическую обработку количественных показателей осуществляли по Г.Н. Зайцеву (1984) и С.А. Мамаеву (1973).

Слайд 7Высокоэффективная жидкостная хроматография
Основой хроматографического разделения является участие компонентов разделяемой
смеси в сложной системе межмолекулярных взаимодействий на границе раздела фаз.
Принцип жидкостной хроматографии состоит в разделении компонентов смеси, основанном на различии в равновесном распределении их между двумя несмешивающимися фазами, одна из которых неподвижна, а другая подвижна. Отличительной особенностью ВЭЖХ является использование высокого давления и мелкозернистых сорбентов.
Бумажная хроматография
При распределительной БХ носителем неподвижной фазы является целлюлоза в виде листов бумаги, которая даже в высушенном виде содержит значительное количество связанной воды. Распределение происходит между связанной водой и растворителем, хотя присутствуют и адсорбционные эффекты.
В бумажной хроматографии вещества различаются по их относительному положению на бумаге после того, как растворитель пройдёт определённое расстояние. В бумажной хроматографии вещества различаются по их относительному положению на бумаге после того, как растворитель пройдёт определённое расстояние. Небольшое количество раствора смеси, которую нужно разделить, наносят в отмеченную точку на бумаге и высушивают. Полученное пятно называют стартовым. Затем бумагу помещают в герметичную камеру и один её конец погружают в растворитель, который является подвижной фазой. Под действием капиллярных сил растворитель движется по бумаге, растворяя и увлекая за собой компоненты образца. После того, как растворитель пройдёт определённое расстояние, лист вынимают и сушат. Затем образовавшиеся пятна, которые могут быть как видимые, так и невидимые, обнаруживают и отмечают. Отношение расстояния, пройденного пятном, к расстоянию, пройденному растворителем стандартно обозначается Rf. Пятна на хроматограммах могут быть обнаружены по цвету, флуоресценции, с помощью химических реакций, для чего бумагу опрыскивают или погружают в различные реагенты, или же по радиоактивности. Идентификацию проводят обычно путём сравнения с образцами с известными величинами Rf.

Слайд 8Спектрофотометрия
Метод исследования и анализа веществ, основанный на измерении спектров поглощения
в оптической области электромагнитного излучения. Различают спектрофотометрию в ИК, видимой
и УФ областях спектра.
Применение спектрофотометрии в УФ и видимой областях спектра основано на поглощении электромагнитного излучения соединениями, содержащими хромофорные (напр., С = С, С=С, С=О) и ауксохромные (ОСН3, ОН, NH2 и др.) группы.
Изолированные, не взаимодействующие между собой хромофоры в молекуле поглощают независимо. В случае какого-либо взаимодействия между ними аддитивность спектров нарушается. По отклонениям от аддитивности можно судить о характере и величине взаимодействия.
Ультрафиолетовая спектроскопия (УФ спектроскопия, УФС), раздел оптич. спектроскопии, включающий получение, исследование и применение спектров испускания, поглощения и отражения в ультрафиолетовой области, т. е. в диапазоне длин волн 10-400 нм (волновых чисел 2,5 · 104 - 106 см-1).
УФ спектры поглощения и отражения получают в основном с использованием таких источников излучения, как дейтериевые (водородные), ртутные, ксеноновые и др. газоразрядные лампы.
Как правило, при облучении УФ излучением вещество не разрушается и не изменяется, что позволяет получать данные о его химическом составе и структуре. В УФ области проявляются электронные спектры. т. е. положение полос и линий определяется разностью энергий различных электронных состояний атомов и молекул.

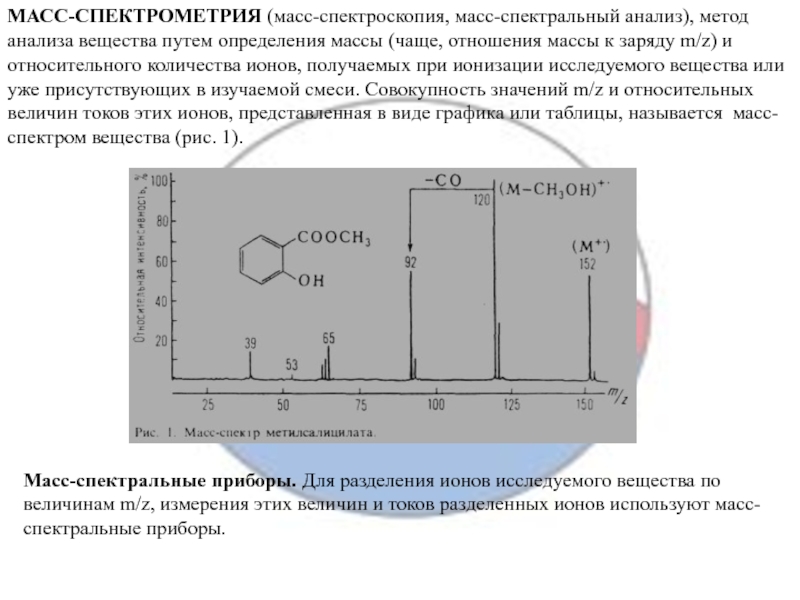
Слайд 9МАСС-СПЕКТРОМЕТРИЯ (масс-спектроскопия, масс-спектральный анализ), метод анализа вещества путем определения массы
(чаще, отношения массы к заряду m/z) и относительного количества ионов,
получаемых при ионизации исследуемого вещества или уже присутствующих в изучаемой смеси. Совокупность значений m/z и относительных величин токов этих ионов, представленная в виде графика или таблицы, называется масс-спектром вещества (рис. 1).
Macс-спектральные приборы. Для разделения ионов исследуемого вещества по величинам m/z, измерения этих величин и токов разделенных ионов используют масс-спектральные приборы.
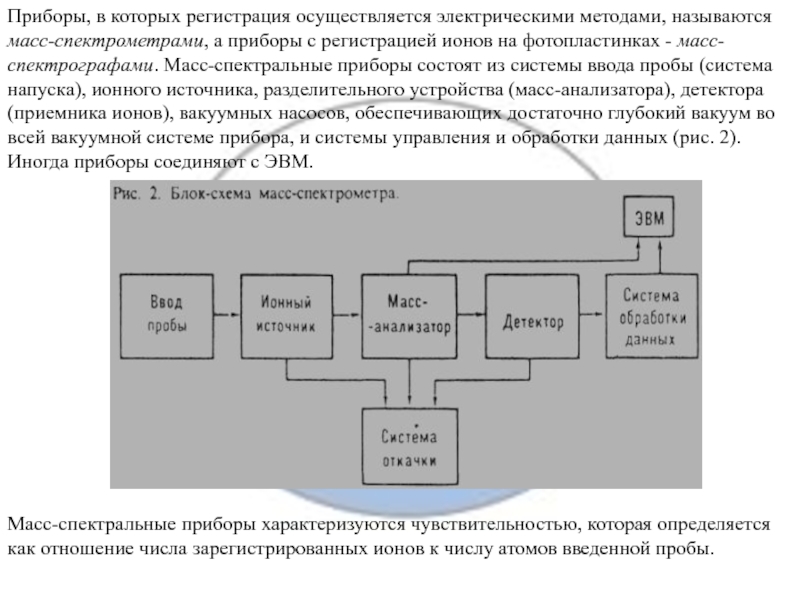
Слайд 10Приборы, в которых регистрация осуществляется электрическими методами, называются масс-спектрометрами, а
приборы с регистрацией ионов на фотопластинках - масс-спектрографами. Масс-спектральные приборы
состоят из системы ввода пробы (система напуска), ионного источника, разделительного устройства (масс-анализатора), детектора (приемника ионов), вакуумных насосов, обеспечивающих достаточно глубокий вакуум во всей вакуумной системе прибора, и системы управления и обработки данных (рис. 2). Иногда приборы соединяют с ЭВМ.
Масс-спектральные приборы характеризуются чувствительностью, которая определяется как отношение числа зарегистрированных ионов к числу атомов введенной пробы.
Слайд 11
Возможности применения данных о составе фенольных соединений в таксономии рода
Myosotis L.
Рассмотрен состав флавоноидов видов рода Myosotis и вида родственного
рода Strophiostoma – S. sparsiflorum.
На основании данных высокоэффективной жидкостной хроматографии, УФ-спектроскопии и масс-спектрометрии установлено, что обнаруженные компоненты являются гликозидами флавонолов – кверцетина и кемпферола.
Флавоноидные профили исследованных нами видов рода Myosotis характеризуются значительным сходством. На хроматограммах обнаружено 7 флавоноловых компонентов (рис. 1).
Слайд 12Рис. 1. Схема расположения флавоноловых гликозидов на хроматограммах экстрактов листьев видов
Myosotis L.
Примечание: желтый, желто-зеленый; Rf1 –
в системе изопропиловый спирт– муравьиная кислота – вода (2:5:5); Rf2 – в системе бутанол – уксусная кислота –вода (40:12:28).
Слайд 13 Гликозиды Ф1, Ф3 и Ф4 присутствуют во всех исследованных образцах.
В большинстве видов секции Sylvaticae, за исключением M. austrobaicalensis и
M. sajanensis, присутствует компонент Ф6. В видах секции Alpestres − M. imitata, M. baicalensis, M.°popovii, M. asiatica и M. austrosibirica − найден гликозид Ф7. Флавоноидный состав видов секции Myosotis – M. palustris и M. caespitosa – оказался более сходен с видами других секций, чем между собой. Профиль Strophiostoma sparsiflorum не отличается от профилей видов рода Myosotis
Нами установлено, что компонентный состав флавоноидов у видов рода Myosotis беден, чёткая специфичность для видов и секций рода по этому признаку отсутствует. Полученные данные о составе флавоноидов свидетельствуют о близости изученных видов по этому признаку и подтверждают точку зрения О.Д. Никифоровой (2003) о сравнительно недавней дифференциации рода Myosotis.
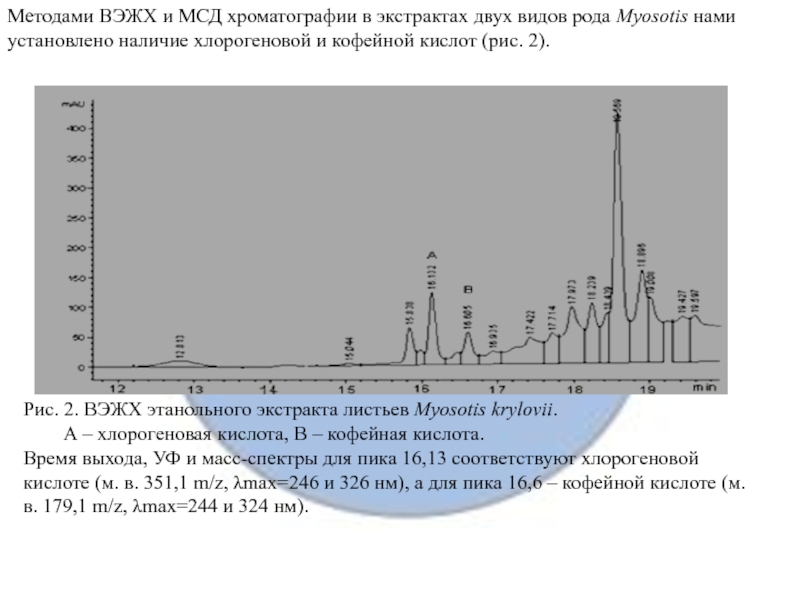
Слайд 14Методами ВЭЖХ и МСД хроматографии в экстрактах двух видов рода
Myosotis нами установлено наличие хлорогеновой и кофейной кислот (рис. 2).
Рис. 2. ВЭЖХ этанольного экстракта листьев Myosotis krylovii.
А – хлорогеновая кислота, В – кофейная кислота.
Время выхода, УФ и масс-спектры для пика 16,13 соответствуют хлорогеновой кислоте (м. в. 351,1 m/z, λmax=246 и 326 нм), а для пика 16,6 – кофейной кислоте (м. в. 179,1 m/z, λmax=244 и 324 нм).
Слайд 15 На двумерных хроматограммах помимо флавонолов обнаружено 11 компонентов с фиолетовой
и голубой флуоресценцией в УФ-свете, которые определили как фенолкарбоновые кислоты
(рис. 3). Вещества К1 и К2 найдены во всех изученных видах. Виды секций Myosotis и Sylvaticae, за исключением M. sajanensis, характеризует наличие К4 и К6. Только в двух видах секции Sylvaticae – M. arvensis и M. decumbens – не обнаружен К3, компонент К7 встречается только у видов данной секции – M. arvensis, M. decumbens и M. sylvatica. Во всех видах секции Alpestres присутствует К8. Изученные виды данной секции принадлежат к сериям Alpestres и Imitatae и отличаются друг от друга компонентом К5 в видах серии Imitatae
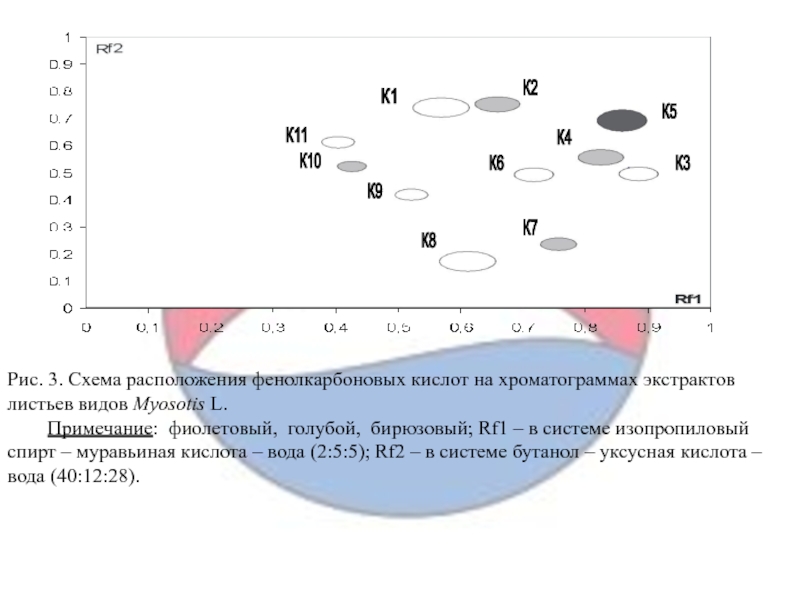
Слайд 16Рис. 3. Схема расположения фенолкарбоновых кислот на хроматограммах экстрактов листьев
видов Myosotis L.
Примечание: фиолетовый, голубой, бирюзовый; Rf1 – в системе
изопропиловый спирт – муравьиная кислота – вода (2:5:5); Rf2 – в системе бутанол – уксусная кислота – вода (40:12:28).
Слайд 17Фенольные соединения представителей различных родов семейства Boraginaceae
Для выявления таксономической значимости
флавоноидов и фенолкарбоновых кислот изучали состав этих соединений в листьях
13 видов растений из триб Lithospermeae, Echieae, Anchuseae, Eritrichieae, Cynoglosseae.
Флавоноидные профили видов различных триб и родов семейства Boraginaceae значительно различаются как между собой, так и с видами рода Myosotis.
Фенолкарбоновые кислоты К1 и К2, присутствующие во всех видах трибы Myosotidae, встречаются у представителей трибы Lithospermeae и у Cynoglossum officinale; вероятно, они являются таксономическими маркерами на уровне триб.
ВЫВОДЫ
Содержание флавоноидов в образцах видов рода Myosotis из различных регионов характеризуется достаточно высокой вариабельностью. Вариабельность содержания флавоноидов в пределах одной ценопопуляции низкая или средняя.
2. Качественный состав флавоноловых гликозидов у видов рода Myosotis характеризуется значительным сходством, что затрудняет их применение как таксономических маркеров.
3. Состав фенолкарбоновых кислот является для рода Myosotis таксономическим признаком на уровне секций и подсекций. Наиболее сходны между собой виды подсекции Sylvaticae секции Sylvaticae. Myosotis krylovii и M. austrobaicalensis наиболее близки, а M. sylvatica обособлен от видов этой группы. Виды Strophiostoma sparsiflorum и Myosotis arvensis по составу фенолкарбоновых кислот сходны.