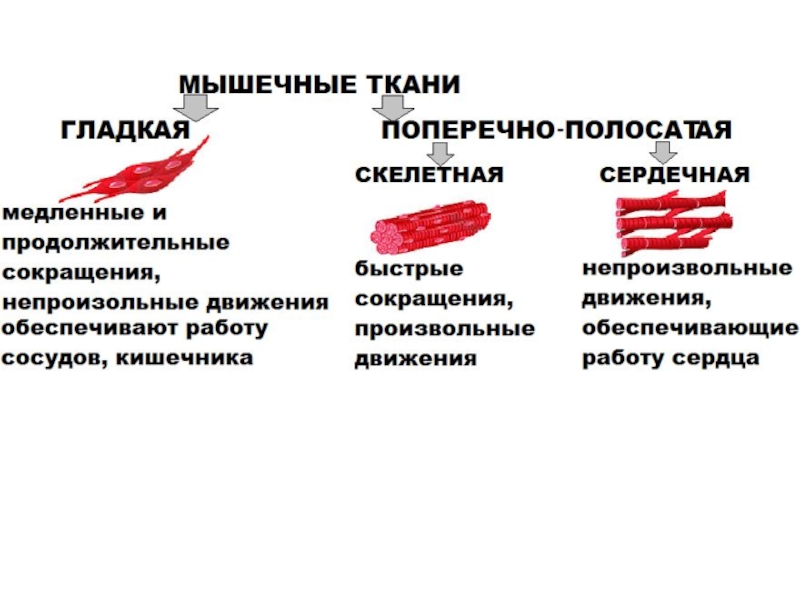
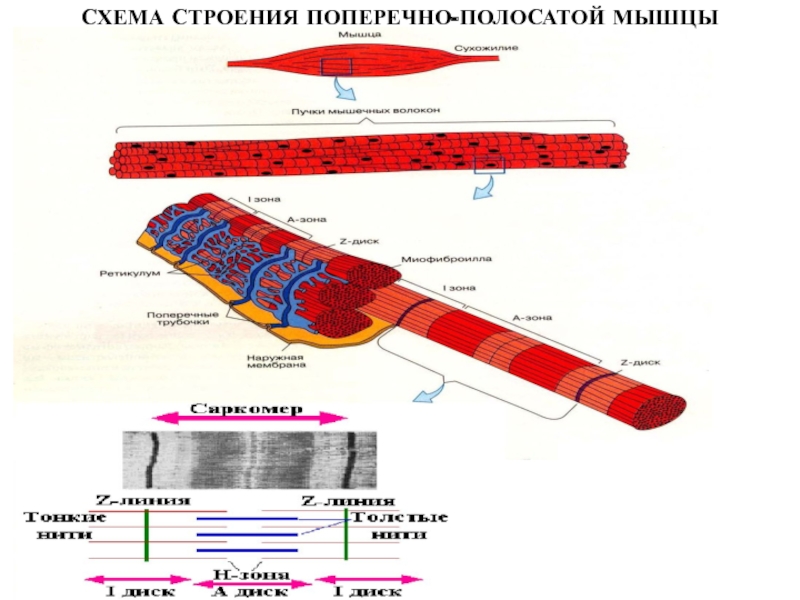
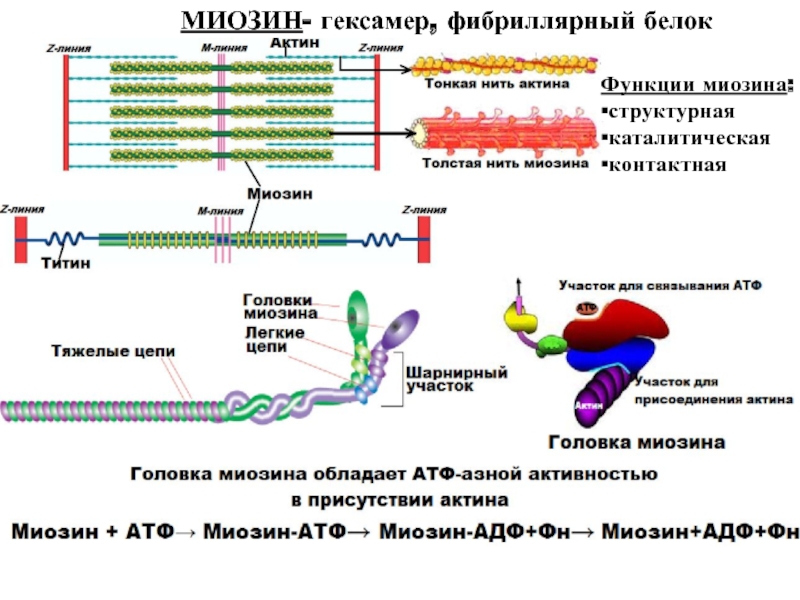
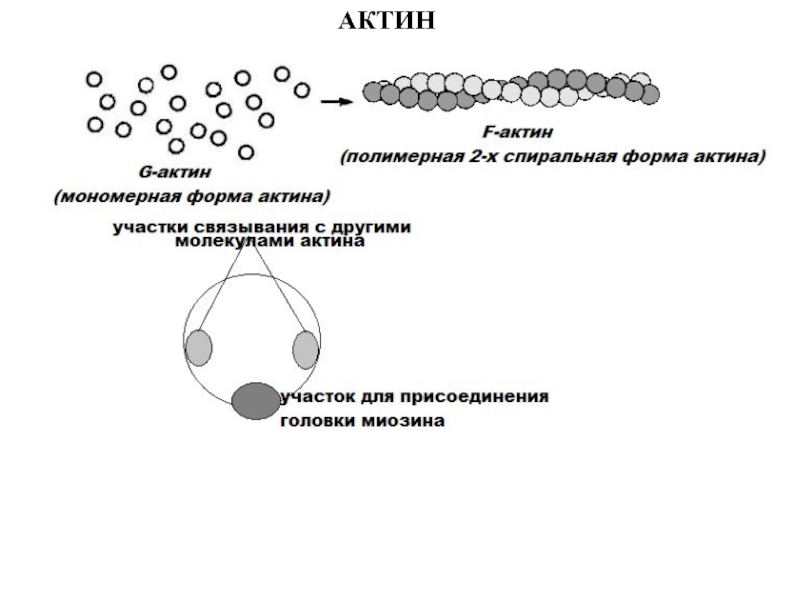
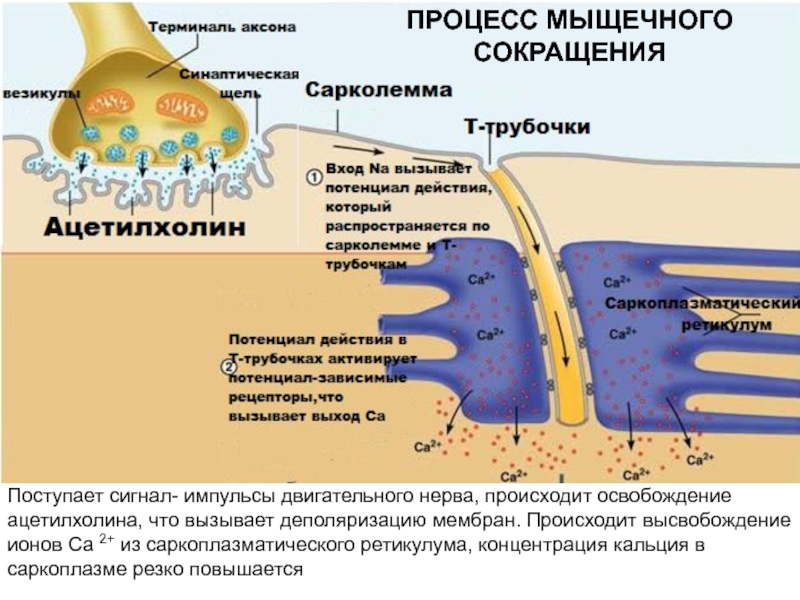
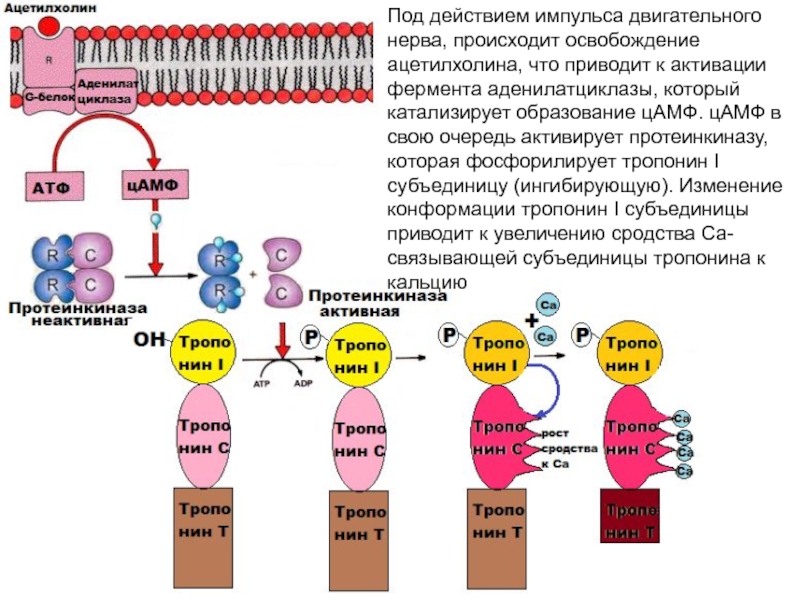
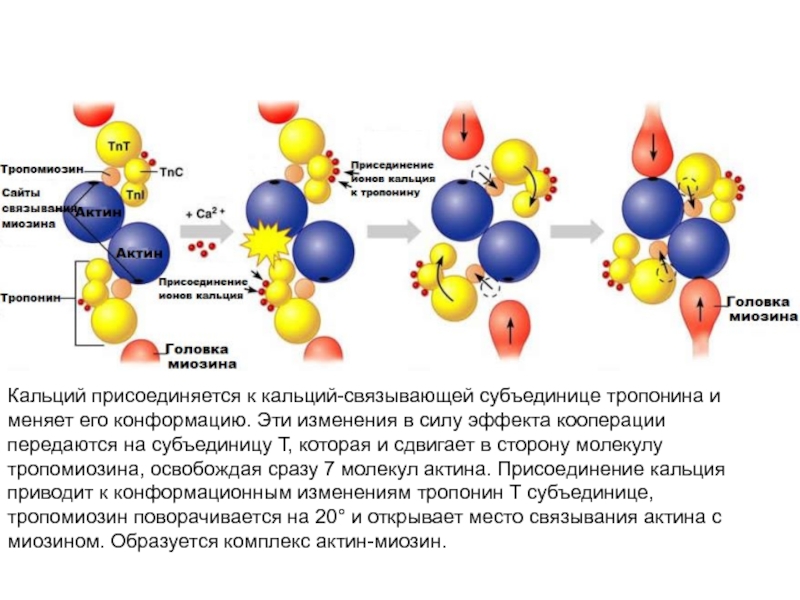
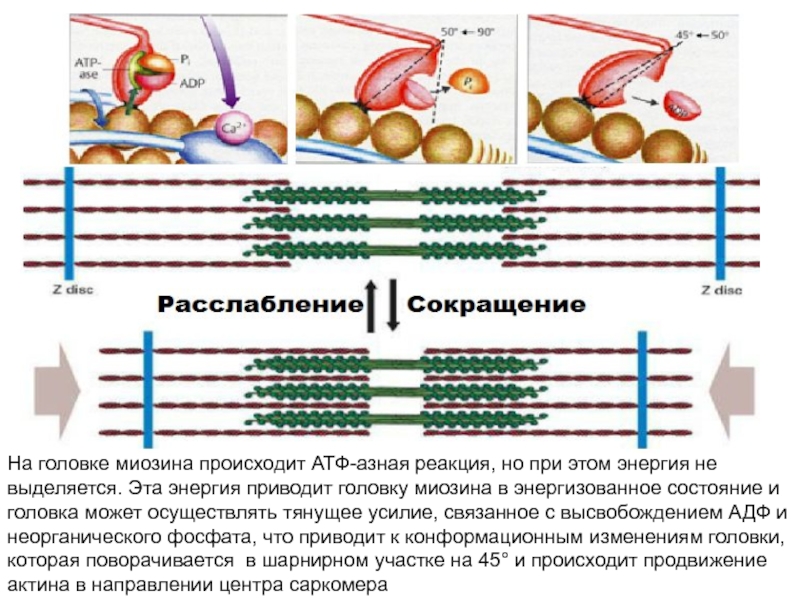
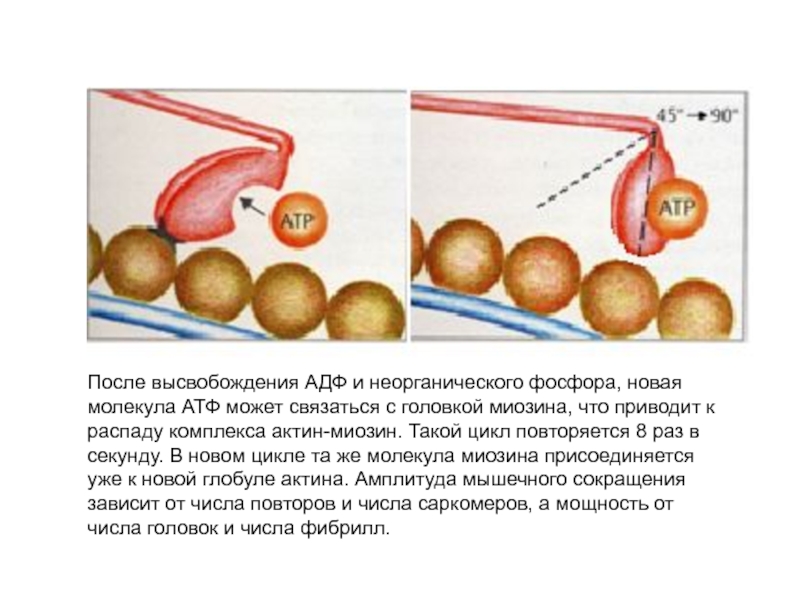
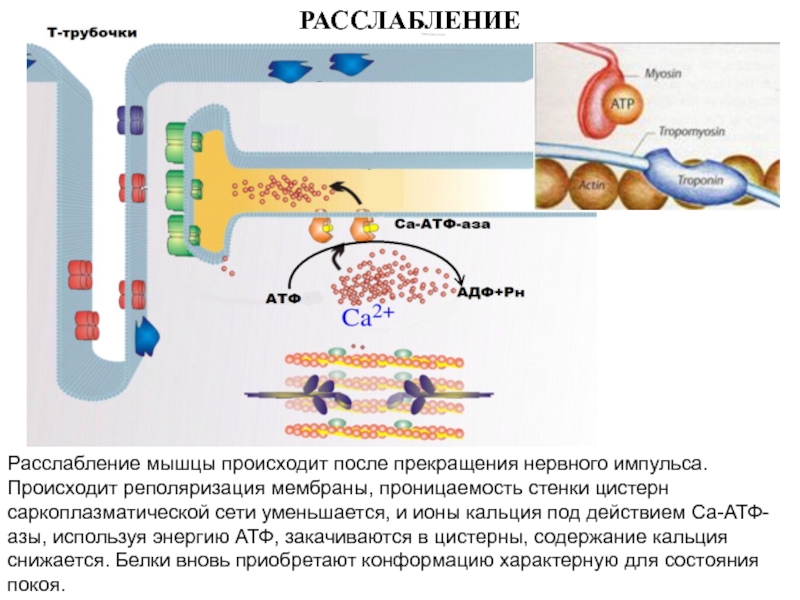
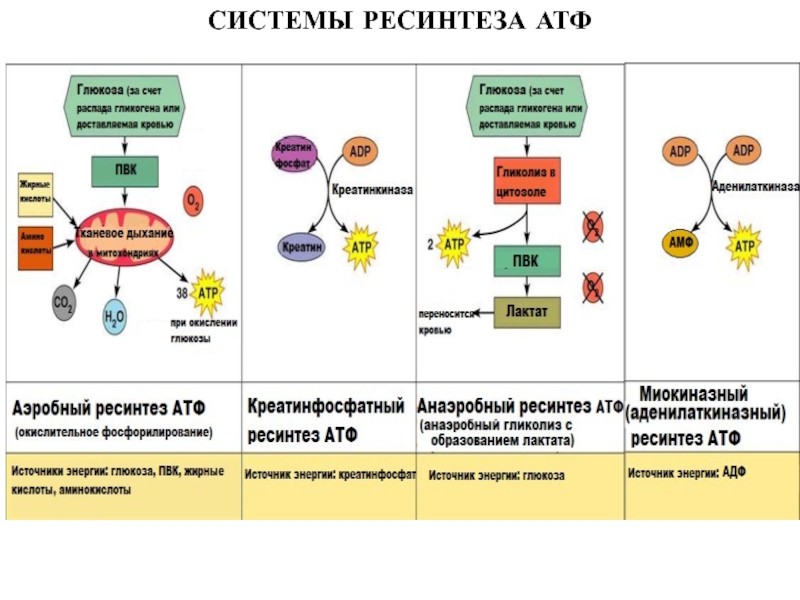
больше митохондрий, чем в скелетной мускулатуре- активнее идет окислительное фосфорилирование
3.
Основной субстрат окисления - жирные кислоты
4. Содержание АТФ /на 1 г ткани в 3 раза меньше, чем в скелетных мышцах, но скорость обмена АТФ в миокарде в 20 раз выше.
5. Запасов креатинфосфата в 5 раз меньше, чем в скелетной мышце
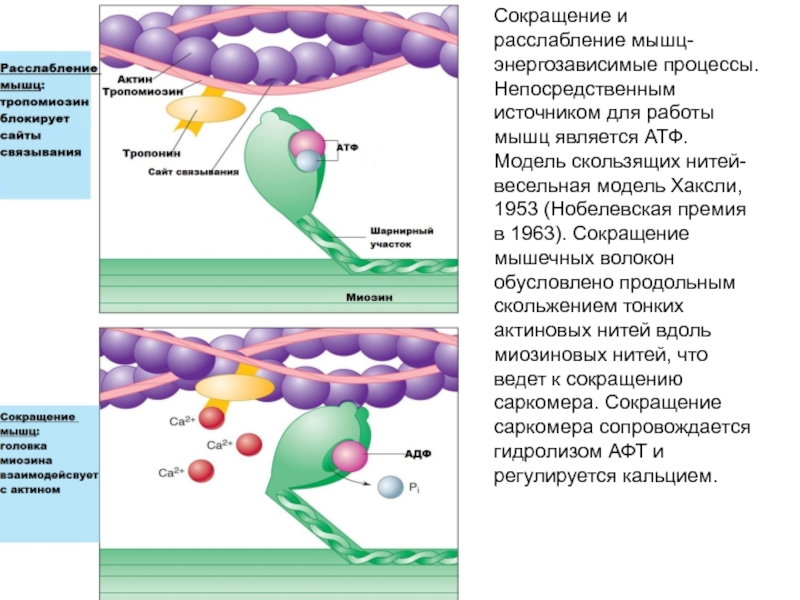
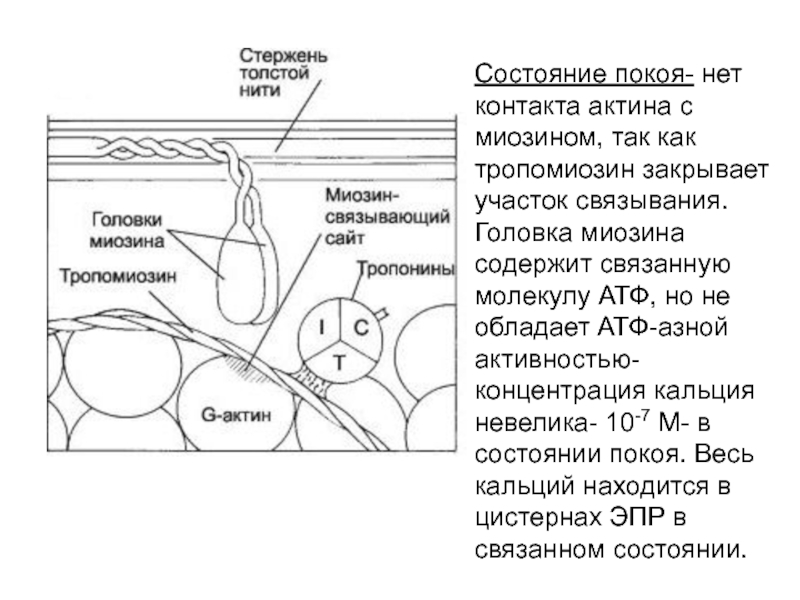
6. Выше активность Ca –АТФ-азы
7. По содержанию гликогена сердечная мышца занимает промежуточное положение между скелетной и гладкой мускулатурой
8. Отличия в концентрации белков по сравнению со скелетной мускулатурой:
-ниже содержание миофибриллярных белков,
-выше концентрация белков стромы
-больше миоальбумина в саркоплазме миокарда
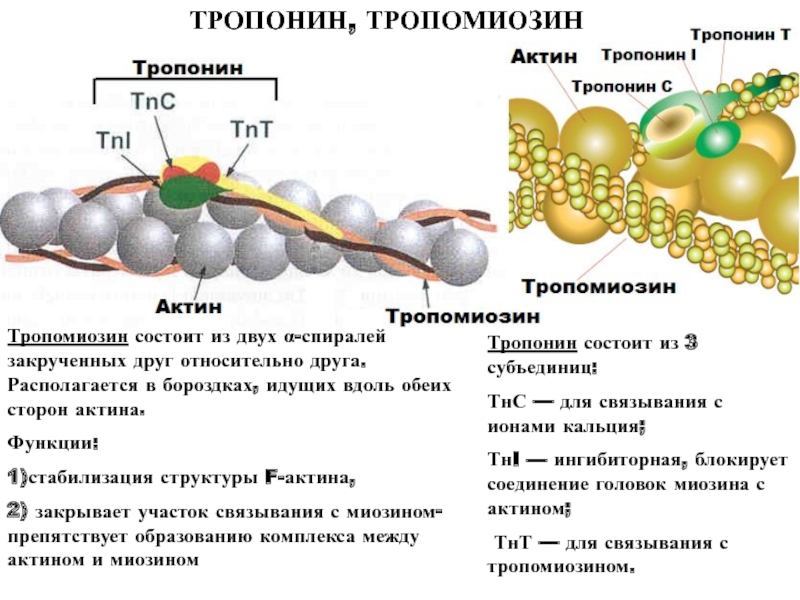
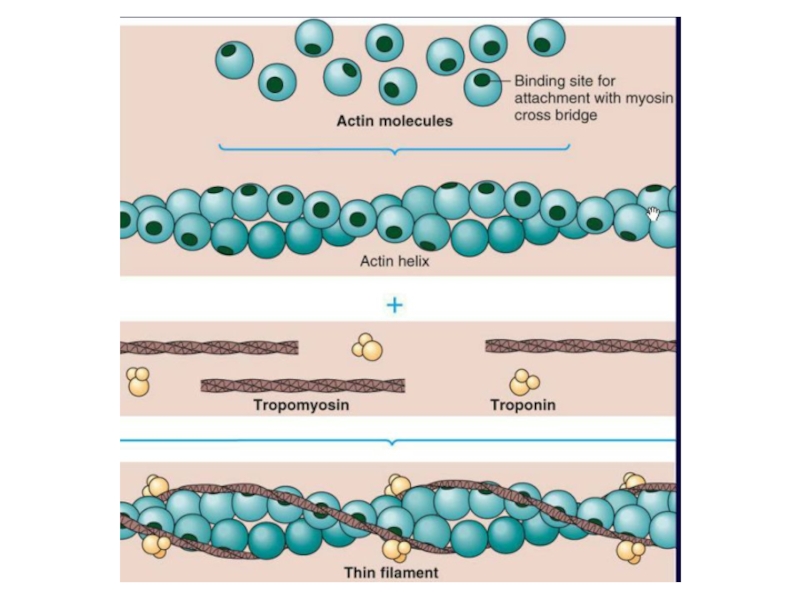
Основные ферменты, которые являются маркерами ткани миокарда: АсАт, креатинкиназа (МВ-форма), лактатдегидрогеназа (1,2). Очень чувствительный маркер инфаркта миокарда- тропонин Т (повышается до 300 раз).
МИОКАРД