Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
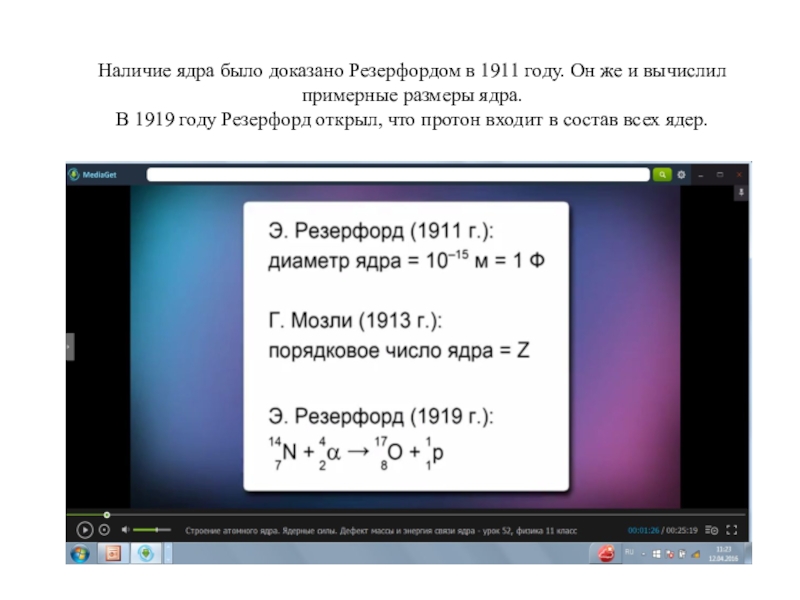
Наличие ядра было доказано Резерфордом в 1911 году. Он же и вычислил примерные
Содержание
- 1. Наличие ядра было доказано Резерфордом в 1911 году. Он же и вычислил примерные
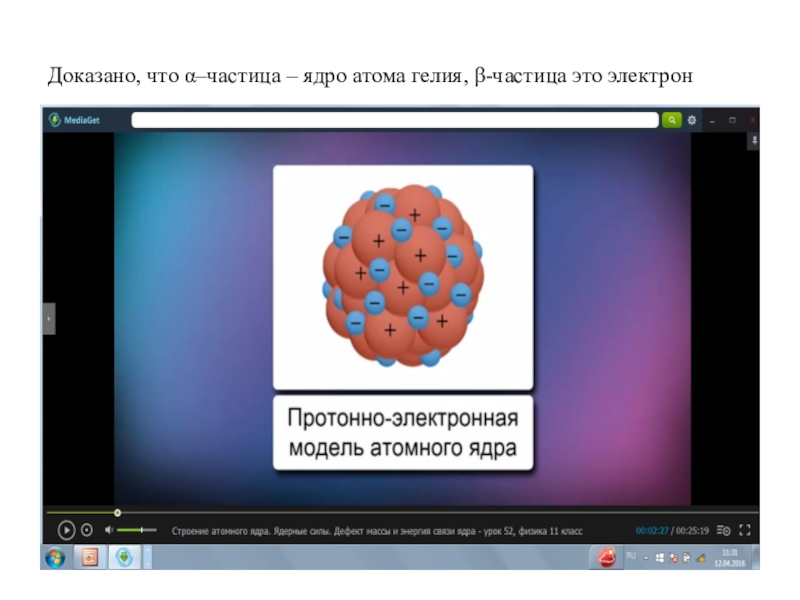
- 2. Доказано, что α–частица – ядро атома гелия, β-частица это электрон
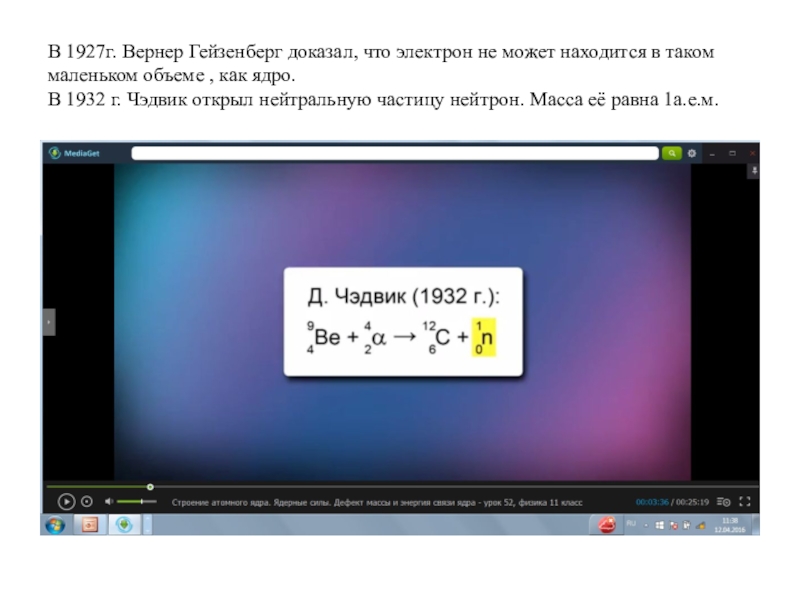
- 3. В 1927г. Вернер Гейзенберг доказал, что электрон
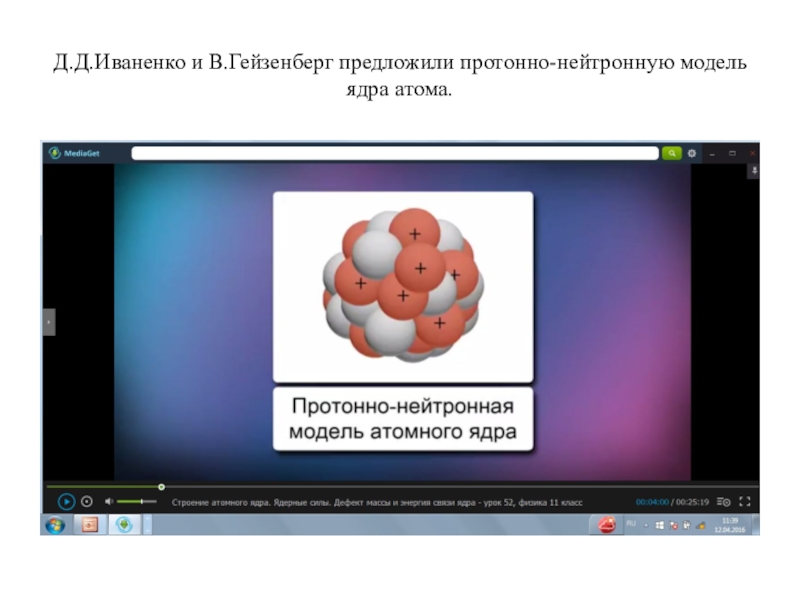
- 4. Д.Д.Иваненко и В.Гейзенберг предложили протонно-нейтронную модель ядра атома.
- 5. Они вычислили массу протона и нейтрона. Протон
- 6. Ядра всех атомов состоят из положительно заряженных
- 7. Изотопы – химические элементы, имеющие одинаковое число
- 8. Ядерные силы. Удержать в очень малом ядре
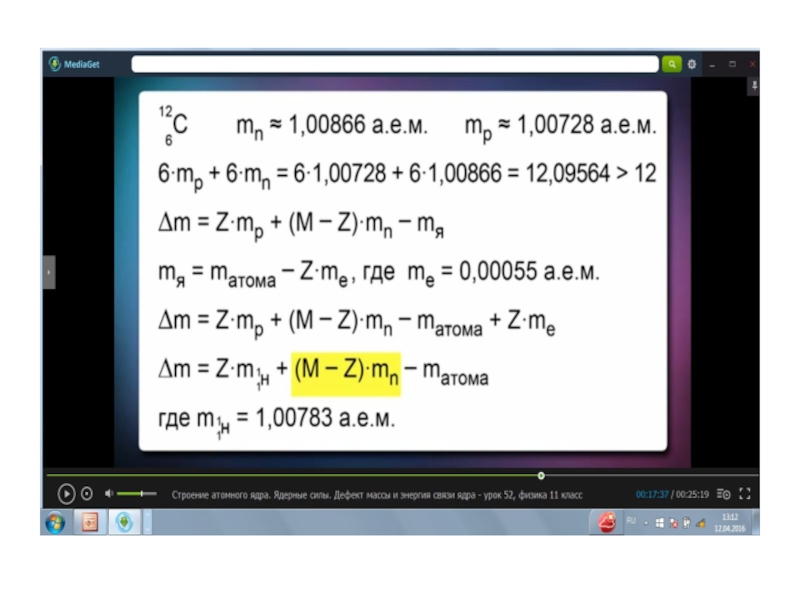
- 9. Энергия связи и дефект масс.Из-за наличия энергии
- 10. Слайд 10
- 11. Слайд 11
- 12. Удельная энергия связи: это энергия, рассчитанная на один нуклон
- 13. Скачать презентанцию
Доказано, что α–частица – ядро атома гелия, β-частица это электрон
Слайды и текст этой презентации
Слайд 3В 1927г. Вернер Гейзенберг доказал, что электрон не может находится
в таком маленьком объеме , как ядро. В 1932 г. Чэдвик
открыл нейтральную частицу нейтрон. Масса её равна 1а.е.м.Слайд 5Они вычислили массу протона и нейтрона. Протон и нейтрон являются двумя
состояниями одной и той же частицы: нуклон.
Слайд 6Ядра всех атомов состоят из положительно заряженных протонов и нейтральных
нейтронов, которые получили общее название – нуклоны.
Z – количество протонов
в ядре называют зарядовым числом.Каждый протон имеет заряд e (равный по модулю заряду электрона), заряд ядра равен Ze.
Зарядовое число равно номеру химического элемента в Периодической системе Менделеева.
Число нейтронов в ядре обозначают – N.
Величина А(М) = Z + N называют массовым числом.
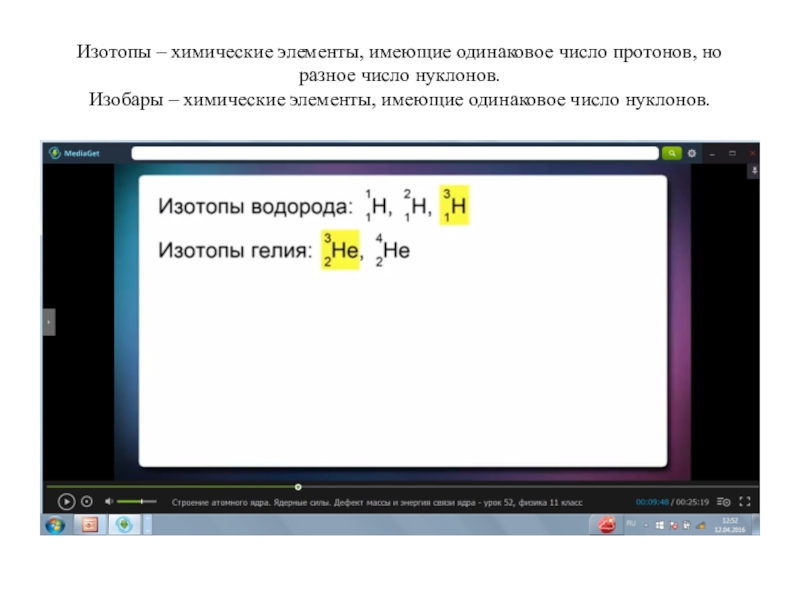
Слайд 7Изотопы – химические элементы, имеющие одинаковое число протонов, но разное
число нуклонов.
Изобары – химические элементы, имеющие одинаковое число нуклонов.
Слайд 8Ядерные силы.
Удержать в очень малом ядре одноименно заряженные и
потому отталкивающиеся протоны могут только очень большие силы притяжения между
нуклонами. Эти силы назвали ядерными.Свойства ядерных сил:
я.с. очень велики (в 100 раз больше электрических).
Являются короткодействующими (очень малый радиус действия).
Зарядовая независимость.