Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неорганическая химия, ч. II Основные разделы: физико-химический
Содержание
- 1. Неорганическая химия, ч. II Основные разделы: физико-химический
- 2. Что такое химия? Тезис: химия – наука
- 3. Основная задача химии – изучить возможности и
- 4. Пространственная организация вещества – т.е., его строение
- 5. Физико-химический анализ (ФХА)ФХА основан на построении и
- 6. Обратимая реакция создает между компонентами взаимную зависимость
- 7. Вопрос на призовую метку Имеется известная реакция
- 8. Фаза – совокупность таких гомогенных тел системы,
- 9. Пространство состояний в однокомпонентной системе
- 10. Наглядная аналогия с “состояниями” человека при наложении
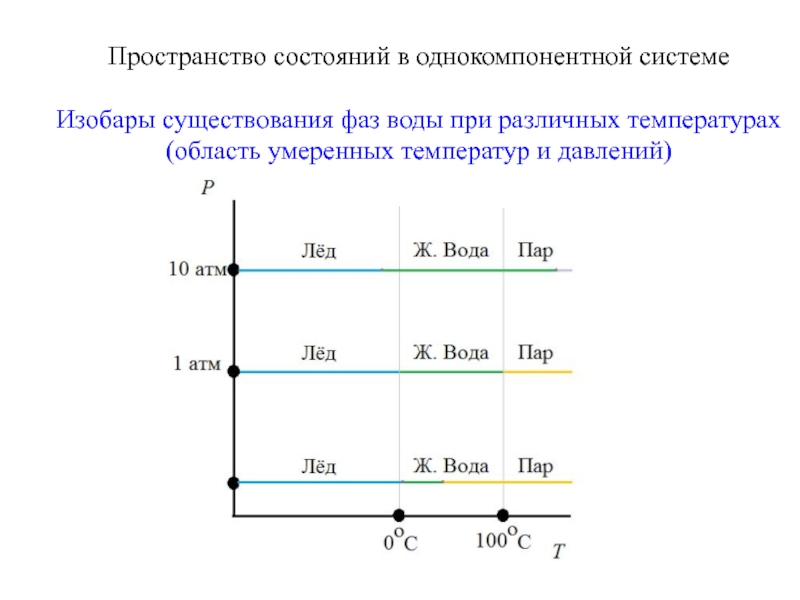
- 11. Пространство состояний в однокомпонентной системеИзобары существования фаз воды при различных температурах(область умеренных температур и давлений)
- 12. Пространство состояний в однокомпонентной системеИзобары существования фаз воды при различных температурах(область умеренных температур и давлений)
- 13. Фазовая диаграмма воды (умеренные температуры и давления)На
- 14. Фазовые диаграммы воды и серы (умеренные P
- 15. .Еще вопрос: 3) – отрицательный наклон линии
- 16. Фазовая диаграмма серы (твердых фаз может быть
- 17. Хочу алмаз! →Кимберлитовые трубки – результат
- 18. Для сравнения: неравновесные способы синтеза алмаза через
- 19. Вернёмся к ФХА...Фазовая диаграмма воды (с областями
- 20. Фрагмент структуры обычного льда Ih (сверху) и
- 21. Фазовая диаграмма церия (область пара не обозначена)Диаграмма
- 22. Фазовая диаграмма органического соединения с участием нескольких (!) жидких фаз на одной диаграмме (жидкие кристаллы)
- 23. Квазиоднокомпонентная система: AsSФазовая диаграмма неорганического соединения с
- 24. “Смерть” Периодического Закона (ПЗ) при высоких давлениях…Мольные
- 25. … и “Жизнь после смерти” ПЗ при
- 26. “жизнь после смерти” ПЗ при сверхвысоких давлениях
- 27. “Жизнь после смерти” ПЗ при сверхвысоких давлениях
- 28. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Неорганическая химия, ч. II
Основные разделы:
физико-химический анализ;
комплексные (координационные) соединения;
ПЗ
и ПС Д.И. Менделеева (включая химию элементов)
Слайд 2Что такое химия?
Тезис: химия – наука о превращениях вообще.
Ab
ovo
Это так? Давайте превратим во что-нибудь некое тело, например свинцовое.
Например, расплющим его. Это химия?Вероятное определение химии в будущем: “Химия – в самом широком смысле – это наука о таких превращениях которые, протекают по основному стехиометрическому закону.
“Количества вступивших в реакцию веществ относятся друг к другу, а также к образовавшимся количествам продуктов как стехиометрические коэффициенты реакции”
Эти отношения могут сводится к отношениям целых чисел
120 С + 8 K2[PtF6] → 2C60 + 8K2[PtF6] → C60C60F16 + 8K2[PtF4] (коэффициенты м.б. большими!)
Слайд 3Основная задача химии – изучить возможности и закономерности таких превращений
веществ, которые сопровождаются перераспределением электронной плотности в веществе, т.е –
образованием или изменением химических связей.Эти новые химические связи, которые являются однотипными для большого (макроскопического) числа частиц, приводят к определенной пространственной организации вещества. Такая пространственная организация называется строением вещества.
Вопросы:
I. Есть реакция: Bi209 + p → Po209 + n Это химическая реакция?
II. 2YCl3 (3CaCl2) → 6ClCl + 2YCa + VCa Это химическая реакция?
IV. H2O(лёд) → H2O(вода) Это химическая реакция?
III. Cалмаз→Сграфит или С60 →60Сграфит Это химические реакции?
Слайд 4Пространственная организация вещества – т.е., его строение – определяет все
свойства этого вещества. Таким образом, возникает связь
химическая связь строение свойства вещества
Зададимся
вопросом: “Варьированием каких внешних величин и как можно добиться изменения характера химического взаимодействия веществ в равновесном состоянии (область термодинамики)?”Задача физико-химического анализа (ФХА) состоит в установлении зависимости свойств равновесной системы, а значит, – и строения, и химических связей в веществе – от параметров состояния.
ФХА – совокупность методов, позволяющих установить взаимосвязь между условиями и свойствами. Свойства отражают характер физико-химического взаимодействия вещества.
Слайд 5Физико-химический анализ (ФХА)
ФХА основан на построении и геометрическом анализе диаграмм состояния и диаграмм
состав-свойство.
О понятиях ФХА:
Система – совокупность тел, находящихся во взаимодействии между
собой и отделенных от окружающей среды. Компонентом системы (в широком смысле слова) называют макроскопическую совокупность частиц вещества, которые могут быть экспериментально зафиксированы и однозначно охарактеризованы как самостоятельные частицы определенного состава и строения. Все частицы этой совокупности имеют одинаковые свойства и одинаково проявляют себя в различных экспериментальных ситуациях.
Слайд 6Обратимая реакция создает между компонентами взаимную зависимость – стехиометрическую связь.
Пусть
есть r независимых реакций и набор компонентов No. Тогда можно
ввести число независимых компонентов NN = No - r
Независимые компоненты
Независимые компоненты – такие, выбрав которые в минимальном количестве (из общего набора компонентов) можно получить – благодаря стехиометрическим связям – все компоненты данной системы при любом ее составе. Пример.
2NO + O2 2NO2 (1)
2NO N2O2 (2)
N2O2 + O2 N2O4 (3)
N2O4 2NO2 (4)
NO + NO2 N2O3 (5)
Компоненты: No = 6: NO, N2O2, N2O3, NO2, N2O4, O2
Независимые компоненты: например, NO и O2 (но не NO и N2O2!)
Получаем r = 4. А перечислено 5 реакций. Одна из них – зависимая, т.е. получается как линейная комбинация двух других. Так, 1 есть сумма 2, 3 и 4.
Компонентность системы определяется числом независимых компонентов N.
Слайд 7Вопрос на призовую метку
Имеется известная реакция “A”:
A: 2HMnO4
+ 5H2O2 + 2H2SO4 = 2MnSO4 + 5O2 + 8H2O
Известны
также самопроизвольные реакции “B” и “C”B: 4HMnO4 + 4H2SO4 = 4MnSO4 + 5O2 + 6H2O
C: H2O2 = H2O + 1/2O2
Тогда “A” можно представить как линейную комбинацию “В” и “С”: A = (B + 10C)1/2
Но если “A” не независимая реакция, то коэффициенты в этой комбинации могут быть любыми. Тогда нельзя утверждать, что соотношение количеств реагирующих HMnO4 и H2O2 равно 2:5?
(!). Помимо прочего: это означает, что реакция “A” может быть уравнена бесконечным количеством способов – вопреки электронному балансу.
Предложить разрешение вопроса
Слайд 8Фаза – совокупность таких гомогенных тел системы, которые характеризуются одинаковыми
свойствами и находятся в состоянии равновесия. При этом требуется, чтобы
объемные свойства доминировали над поверхностными.Фазовые равновесия в однокомпонентной системе
В качестве переменных величин, которые определяют состояние термодинамической системы (переменных состояния) при отсутствии силовых полей, чаще всего выбирают температуру, давление и состав. Разумеется, что для системы, содержащей один компонент, состав остается постоянным, поэтому каждое ее состояние можно описать, задавая пару величин (Т, р). Если температура отсчитана по термодинамической шкале, то обе переменные состояния принимают положительные значения. Тогда каждому состоянию можно поставить в соответствие точку, лежащую в положительном квадранте плоскости, на которой (на плоскости) введена декартова система координат с осями Т и р. Этот квадрант плоскости назовем пространством состояний однокомпонентной системы. В пространстве состояний каждой фазе соответствует область, то есть множество точек, изображающих равновесные состояния, при которых существует данная фаза.
Слайд 10Наглядная аналогия с “состояниями” человека при наложении определенных температур и
давлений
Пресс для коррекции формы человека и “область существования человека” под
таким прессом (фактически – диаграмма состояний человека)Слайд 11Пространство состояний в однокомпонентной системе
Изобары существования фаз воды при различных
температурах
(область умеренных температур и давлений)
Слайд 12Пространство состояний в однокомпонентной системе
Изобары существования фаз воды при различных
температурах
(область умеренных температур и давлений)
Слайд 13Фазовая диаграмма воды (умеренные температуры и давления)
На любой фазовой диаграмме
имеются:
состояния существования фаз и области существования фаз (синоним:
область гомогенности) – области, помеченные зеленой, пурпурной и желтой заливками на рис.),Фазовая диаграмма (ФД) или диаграмма состояний – графическое отображение равновесного состояния системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме (эта точка носит название фигуративной точки).
Обычно координатами ФД являются термодинамические параметры (корректнее – переменные): температура, давление и – для многокомпонентных систем – состав системы.
- состояния сосуществования фаз и области сосуществования фаз (для одно-компонентной системы вырождаются в линии для равновесия двух фаз и в точки для сосуществования трех фаз), кривая AB отражает температурную зависимость давления над льдом, BC – аналогичную зависимость давления над жидкой H2O, BD – линию плавления/кристаллизации воды под давлением;
тройные и критические точки.
Кроме того, м.б. отображены линии метастабильного равновесия (это – на семинарах).
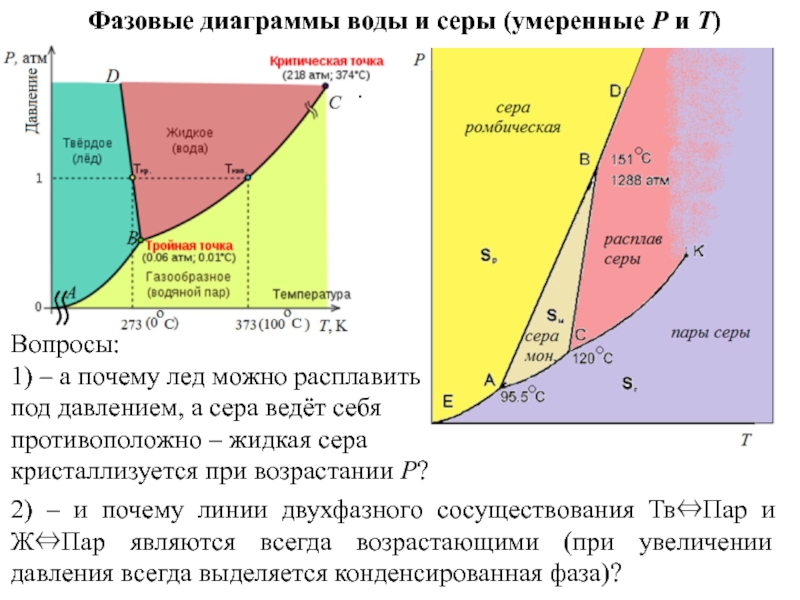
Слайд 14Фазовые диаграммы воды и серы (умеренные P и T)
.
Вопросы:
1)
– а почему лед можно расплавить под давлением, а сера
ведёт себя противоположно – жидкая сера кристаллизуется при возрастании P?2) – и почему линии двухфазного сосуществования ТвПар и ЖПар являются всегда возрастающими (при увеличении давления всегда выделяется конденсированная фаза)?
Слайд 15.
Еще вопрос:
3) – отрицательный наклон линии ТвЖ (здесь –
BD) всегда коррелирует с тем, что твердое тело всплывает на
жидкости (как лёд на воде), а при положительном наклоне твердое тело тонет. Почему?Для ответа проведём т/д анализ. При сосуществовании двух фаз однокомпонентной системы их величины энергии Гиббса совпадают. Далее, из термодинамики, известно, что
dG = –SdT + VdP. Или для фазы “” dG = –SdT + VdP и для фазы “” dG = –S dT + V dP
В этих выражениях S и V – мольные величины! При равновесии этих фаз dG = dG . Тогда
(S – S)dT = (V-V)dP. (1)
Обозначим S = S – S и V = V-V. Подставляя S и V в (1) получаем
dP/dT = S/V = H/(TV) (2)
Выражение (2) есть уравнение Клапейрона – Клаузиуса в дифференциальной форме.
При переходе Тв→Ж для некоторых систем V<0 (например, для воды). Для кривых AB и BC (р-сия ТвПар и ЖПар) уравнения температурной зависимости могут быть получены в явном виде (см. вывод в приложении). При этом вводятся упрощения: (a) - пар идеален, тогда Vпара = RT/P; (б) - V = V пара ; (в) - H слабо зависит от T. Тогда подставляя Vпара = RT/P получаем (3), где B – постоянная интегрирования
ln(P) = -H/(RT) + B (3)
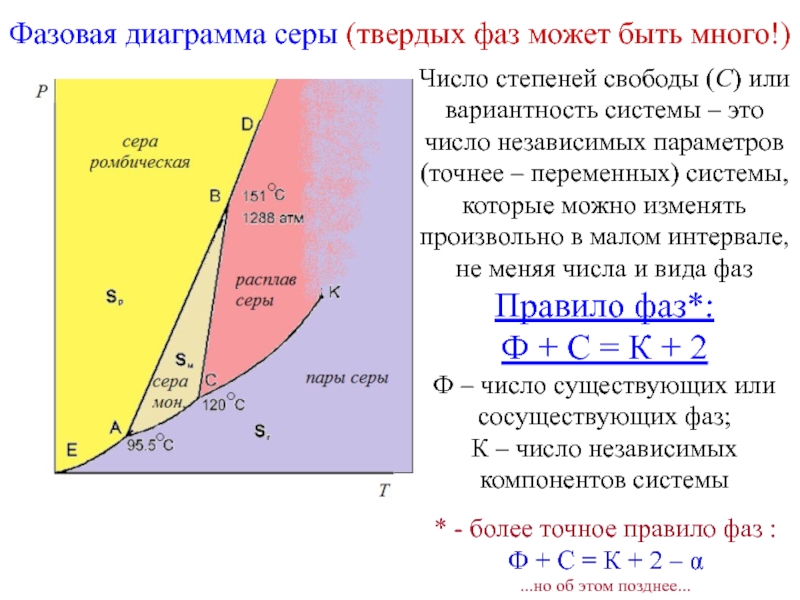
Слайд 16Фазовая диаграмма серы (твердых фаз может быть много!)
Число степеней
свободы (С) или вариантность системы – это число независимых параметров
(точнее – переменных) системы, которые можно изменять произвольно в малом интервале, не меняя числа и вида фазПравило фаз*:
Ф + С = К + 2
Ф – число существующих или сосуществующих фаз;
К – число независимых компонентов системы
* - более точное правило фаз :
Ф + С = К + 2 –
...но об этом позднее...
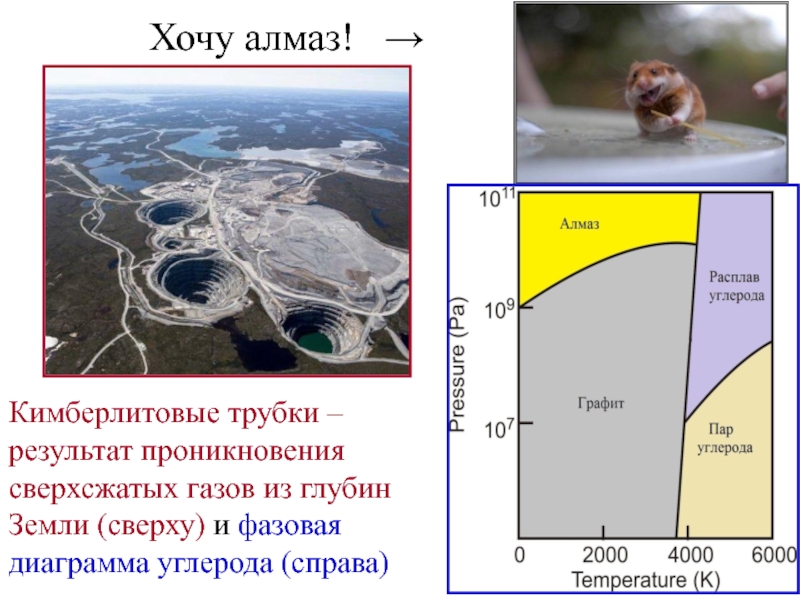
Слайд 17Хочу алмаз! →
Кимберлитовые трубки – результат проникновения сверхсжатых газов
из глубин Земли (сверху) и фазовая диаграмма углерода (справа)
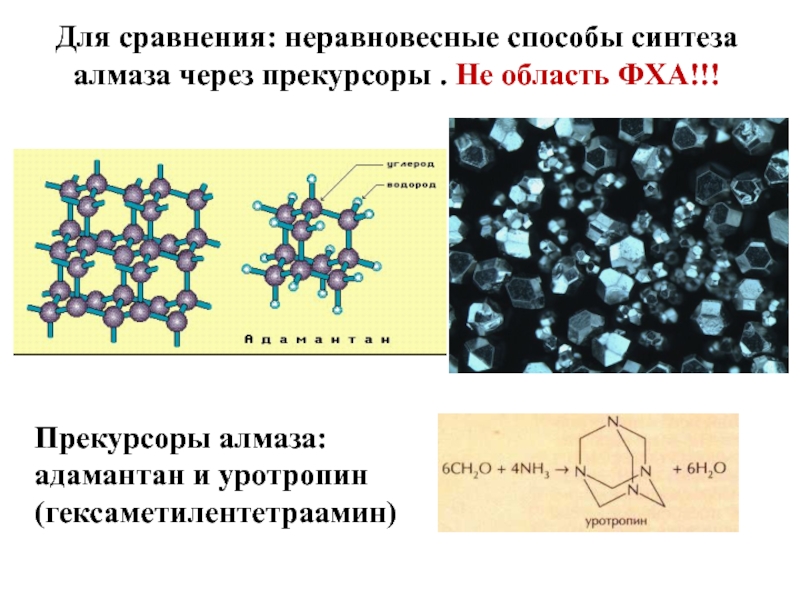
Слайд 18Для сравнения: неравновесные способы синтеза алмаза через прекурсоры . Не
область ФХА!!!
Прекурсоры алмаза: адамантан и уротропин (гексаметилентетраамин)
Слайд 19Вернёмся к ФХА...
Фазовая диаграмма воды (с областями высоких давлений)
Римскими цифрами
обозначены разные льды. В правой части рисунка приведены линии одинаковой
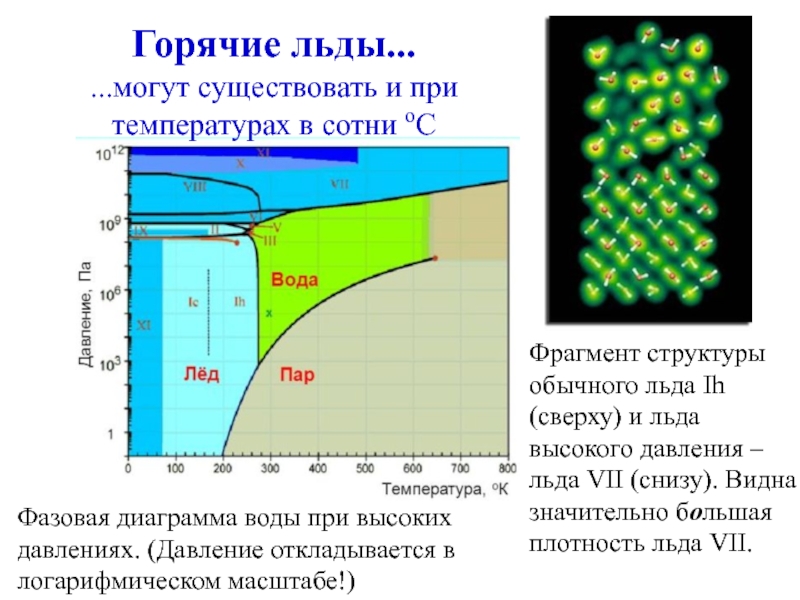
плотности жидкости - изопикныСлайд 20Фрагмент структуры обычного льда Ih (сверху) и льда высокого давления
– льда VII (снизу). Видна значительно большая плотность льда VII.
Горячие льды...
...могут существовать и при температурах в сотни оС
Фазовая диаграмма воды при высоких давлениях. (Давление откладывается в логарифмическом масштабе!)
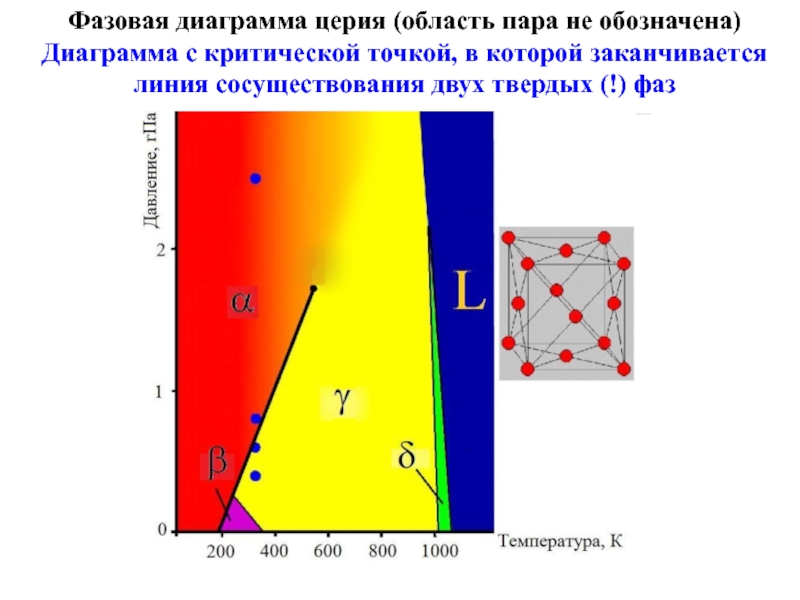
Слайд 21Фазовая диаграмма церия (область пара не обозначена)
Диаграмма с критической точкой,
в которой заканчивается линия сосуществования двух твердых (!) фаз
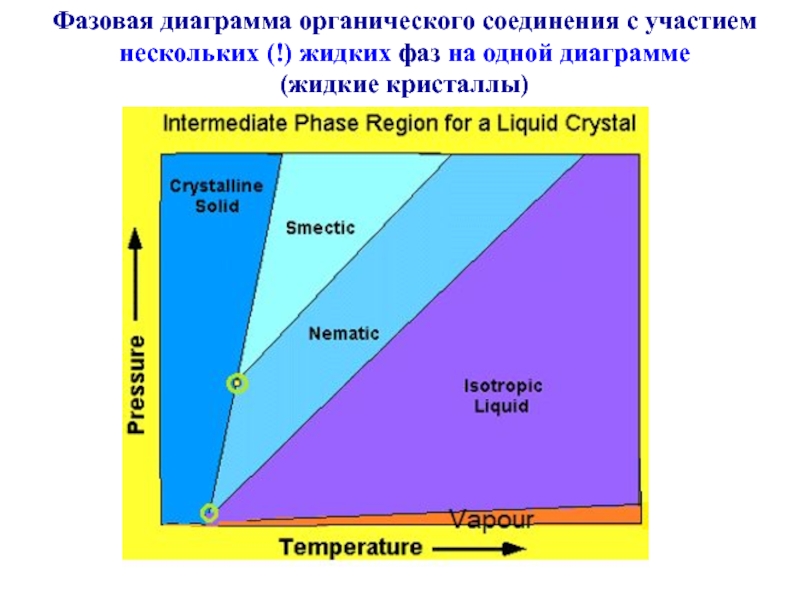
Слайд 22Фазовая диаграмма органического соединения с участием
нескольких (!) жидких фаз
на одной диаграмме
(жидкие кристаллы)
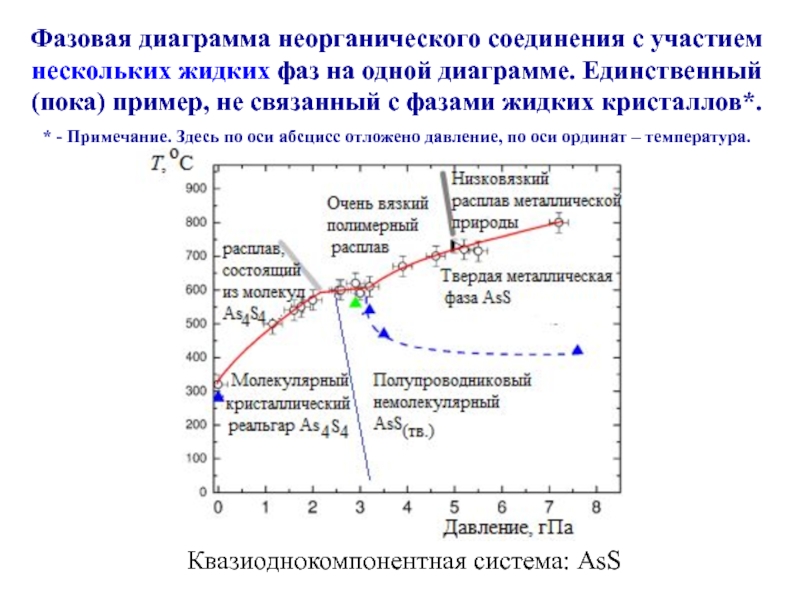
Слайд 23Квазиоднокомпонентная система: AsS
Фазовая диаграмма неорганического соединения с участием
нескольких жидких
фаз на одной диаграмме. Единственный (пока) пример, не связанный с
фазами жидких кристаллов*.* - Примечание. Здесь по оси абсцисс отложено давление, по оси ординат – температура.
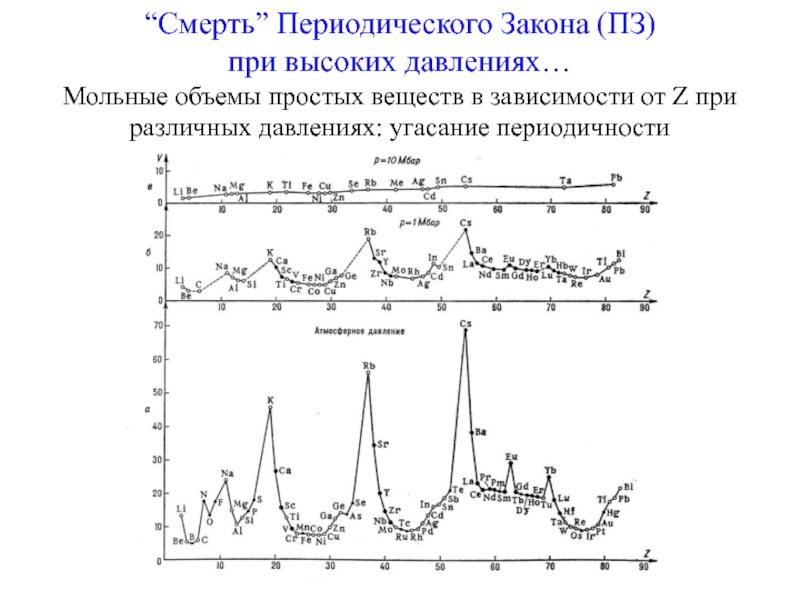
Слайд 24“Смерть” Периодического Закона (ПЗ)
при высоких давлениях…
Мольные объемы простых веществ
в зависимости от Z при различных давлениях: угасание периодичности
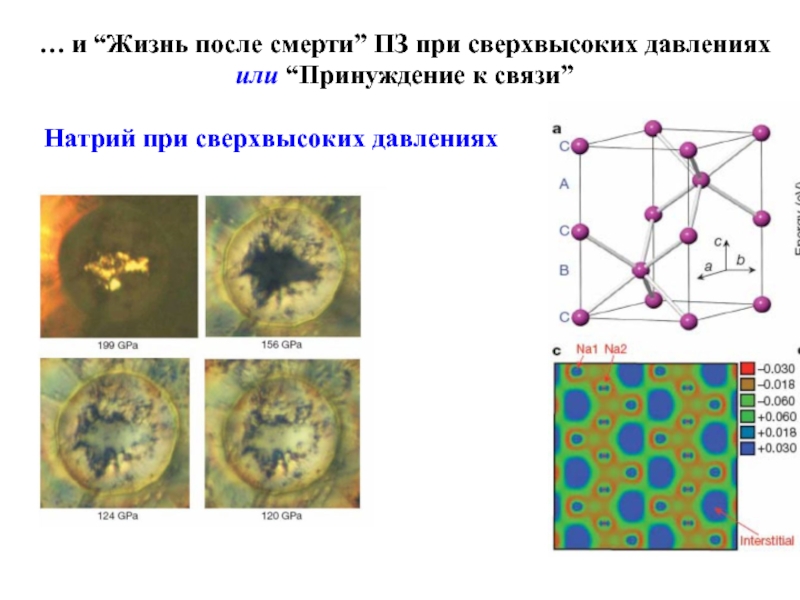
Слайд 25… и “Жизнь после смерти” ПЗ при сверхвысоких давлениях или
“Принуждение к связи”
Натрий при сверхвысоких давлениях
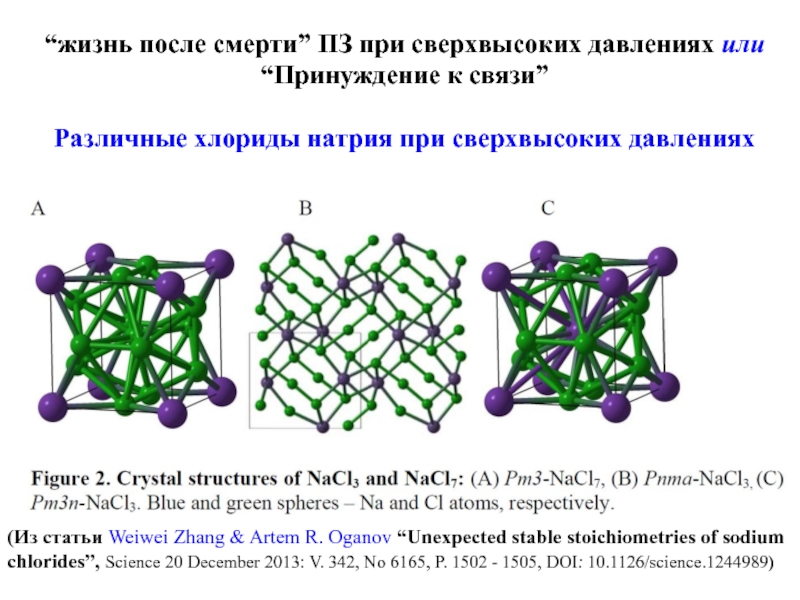
Слайд 26“жизнь после смерти” ПЗ при сверхвысоких давлениях или “Принуждение к
связи”
Различные хлориды натрия при сверхвысоких давлениях
(Из статьи Weiwei Zhang
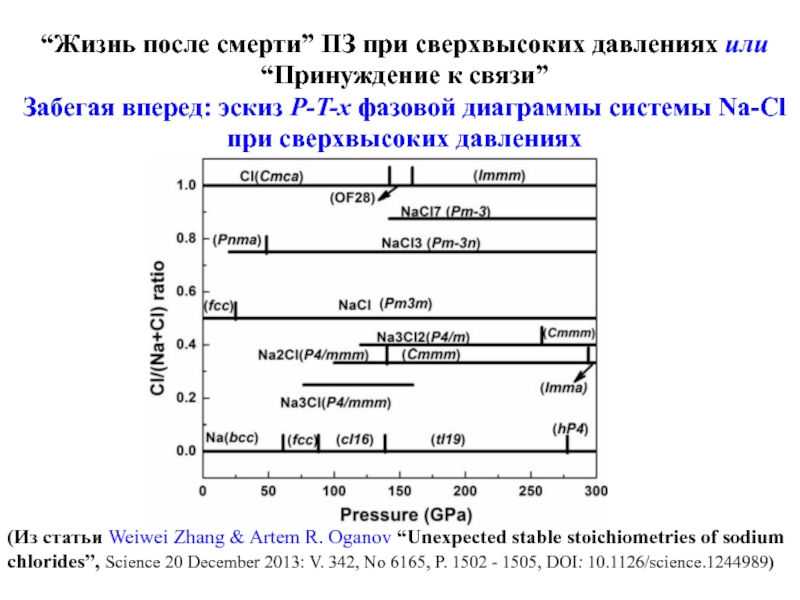
& Artem R. Oganov “Unexpected stable stoichiometries of sodium chlorides”, Science 20 December 2013: V. 342, No 6165, P. 1502 - 1505, DOI: 10.1126/science.1244989)Слайд 27“Жизнь после смерти” ПЗ при сверхвысоких давлениях или “Принуждение к
связи”
Забегая вперед: эскиз P-T-x фазовой диаграммы системы Na-Cl при сверхвысоких
давлениях(Из статьи Weiwei Zhang & Artem R. Oganov “Unexpected stable stoichiometries of sodium chlorides”, Science 20 December 2013: V. 342, No 6165, P. 1502 - 1505, DOI: 10.1126/science.1244989)