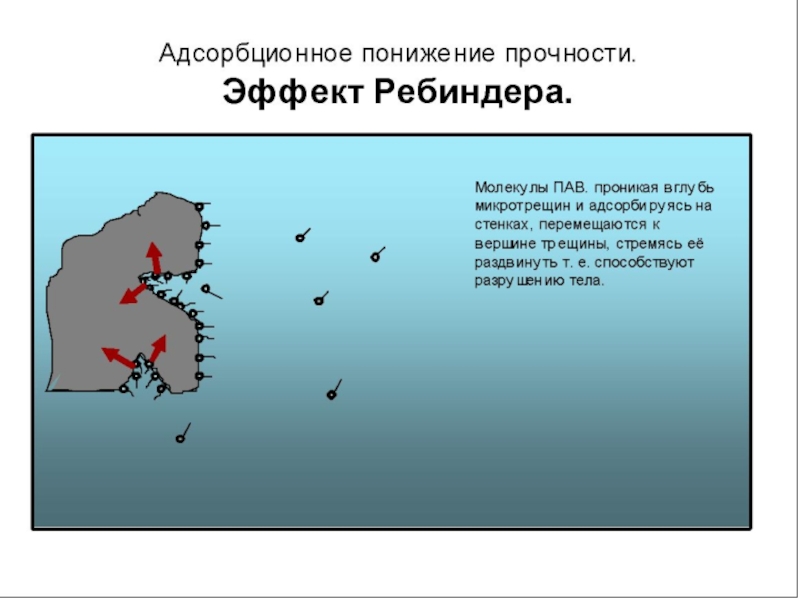
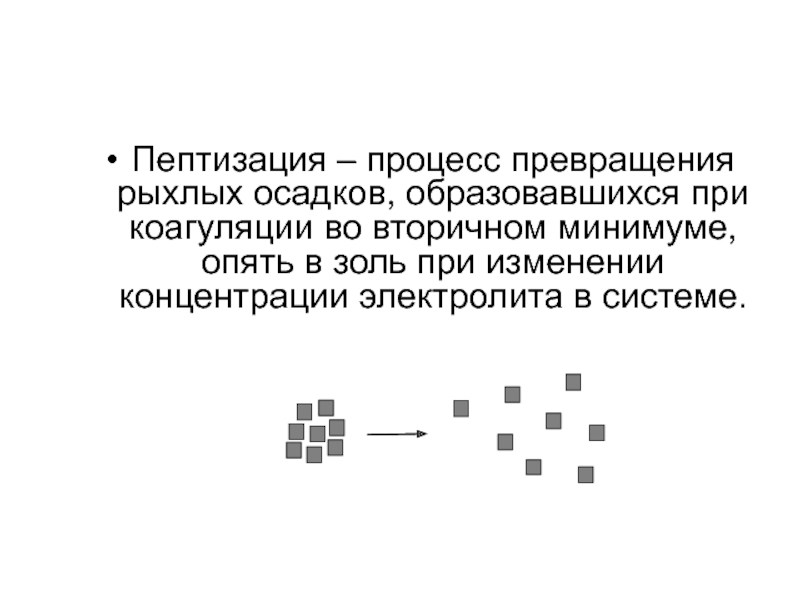
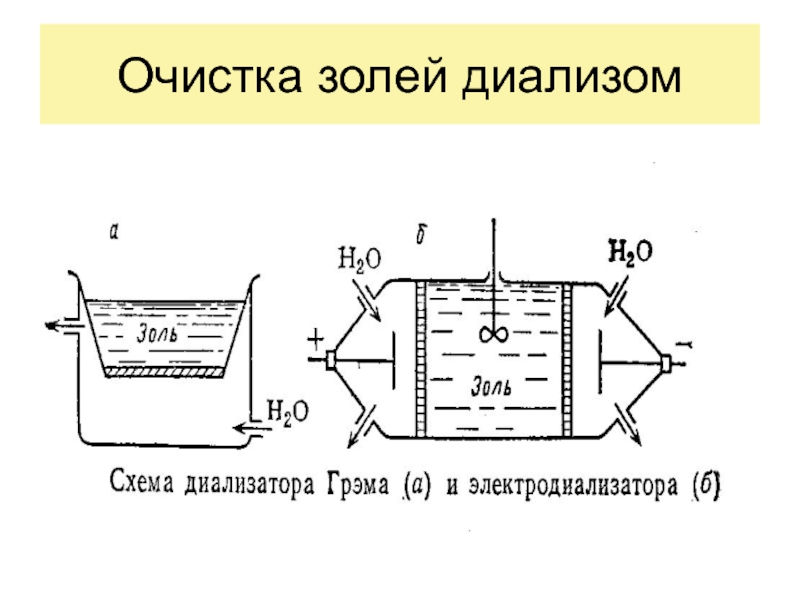
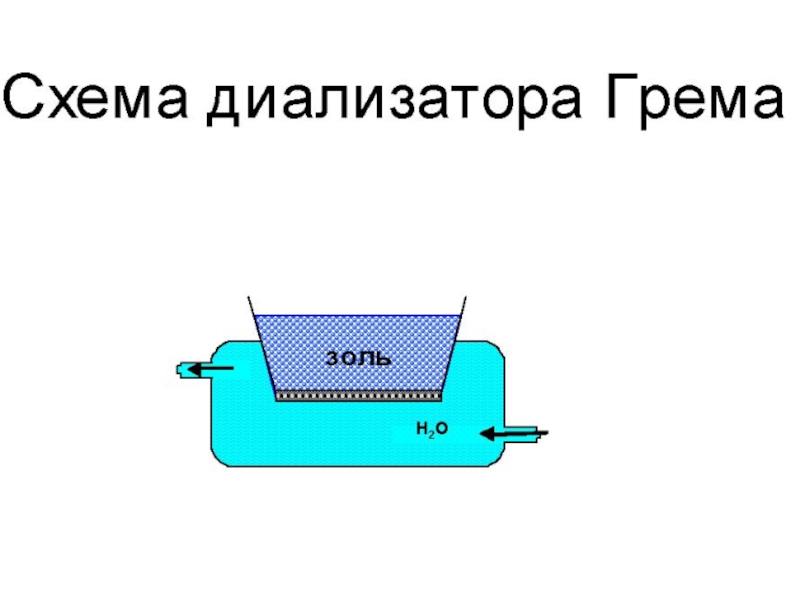
Из (17) следует, что свободная энергия Гиббса при образовании
зародышей в гомогенной конденсации для критического состояния составляет 1/3 поверхностной энергии зародыша, а 2/3 этой энергии приходится на долю объемной составляющей.
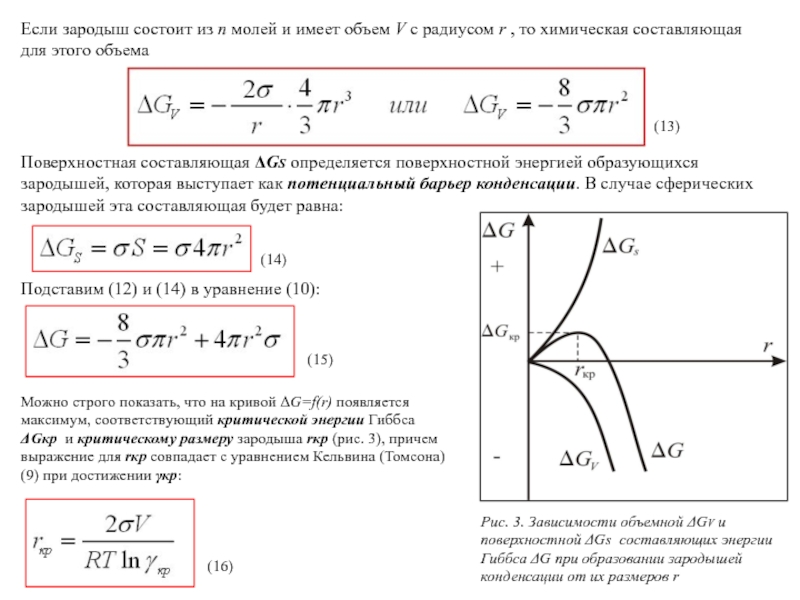
При r rкр, где G увеличивается, зародыши самопроизвольно не растут, а растворяются, поскольку работа, необходимая для образования их поверхности растет быстрее, чем энергия при фазовом переходе. При r rкр, G уменьшается, идет самопроизвольный рост зародышей, то есть, чем больше размер зародыша, тем в большей мере выигрыш энергии при фазовом переходе компенсирует работу увеличения поверхности зародыша.
Найдем зависимость Gкр от степени пересыщения кр, подставив rкр из (16) в (17):
(18)
Из уравнения (18) следует, что чем выше степень пересыщения кр, тем меньше Gкр, и тем меньше, согласно (16), rкр. Это означает, что максимум кривой на рис. 3. будет ближе к началу координат. Если кр уменьшится, то rкр и Gкр возрастут, и положение максимума отодвинется вправо. Уменьшению Gкр способствует также снижение поверхностного натяжения. Например, появление заряда на поверхности зародыша снижает поверхностное натяжение, поэтому зародыши, несущие заряд, образуются при меньших степенях пересыщения.
(18)