Слайд 1Очистка газов от химических примесей
Слайд 2 К числу нежелательных химических примесей, содержащихся в природных газах,
относятся токсичные и коррозионноагрессивные серосодержащие соединения, а также негорючие инертные
газы, снижающие теплоту сгорания углеводородного газа.
Среди серосодержащих примесей чаще всего присутствуют сероводород (H2S), серооксид углерода (COS), сероуглерод (CS2) меркаптаны (CnH2n-1-SH), а в газовом конденсате - также сульфиды (R-S-R) и дисульфиды (R-S-S-R).
В состав газов входят также диоксид углерода, азот и гелий.
Слайд 3Характеристика химических примесей
Сероводород (H2S). Из сернистых соединений, входящих в состав
природных газов, сероводород является наиболее активным. В нормальных условиях -
это бесцветный газ с запахом тухлого яйца. Сероводород - сильный нервно-паралитический яд: острое отравление человека наступает при концентрации 0,2-0,3 мг/л, а концентрация 1 мг/л - смертельна. При вдыхании сероводорода в этой концентрации отравление развивается почти мгновенно: судороги и потеря сознания оканчиваются смертью от остановки дыхания. Индикатором на повышение концентрации сероводорода являются глаза- жжение, покраснение, опухание век. Его токсичность проявляется также в раздражающем действии на слизистые оболочки верхних дыхательных путей. Предельно-допустимая концентрация его в воздухе рабочих помещений составляет 0,01 мг/л
Слайд 4Сероводород обладает также высокой коррозионной агрессивностью, наличие влаги в газе
усиливает коррозионное действие сероводорода и других кислых компонентов. В настоящее
время добыча сероводородсодержащего природного газа в странах СНГ составляет около 10% всего объема потребляемого газа. Такой газ перед подачей потребителю подвергают очистке ввиду ядовитости сероводорода, его коррозионной агрессивности, отравляющему действию на многие катализаторы, применяемые при химической переработке природных газов.
Слайд 5От сероводорода очищают природный газ, газы различных нефтеперерабатывающих и нефтехимических
процессов (гидроочистки, крекинга, риформинга, пиролиза и др.). Газы различаются содержанием
сероводорода. Природные газы могут быть бессернистыми или содержать значительные количества сероводорода. Например, природные газы Оренбургского месторождения содержат 4-6% сероводорода, Астраханского - до 25%, а в некоторых природных газах содержание сероводорода достигает 50-70% (об.), например, в месторождениях Харметтен, Пантер- Ривер и Барберри в Канаде, Миссисипи в США, Жаолангиуанг в КНР и др. Газы нефтепереработки и нефтехимии могут содержать от 0,5 до 15% сероводорода.
Слайд 6Требования к степени очистки от сероводорода зависят от назначения газа.
При очистке газов, выбрасываемых в атмосферу, содержание сероводорода должно соответствовать
ПДК. При очистке технологического газа содержание сероводорода регламентируется требованиями процессов дальнейшей переработки. В частности, для химических синтезов содержание сероводорода в технологическом газе иногда может находиться в пределах от 1 до 50 мг/м3. Природный газ очищают даже при малых количествах в нем сероводорода, поскольку его допустимое содержание в газе, закачиваемом в магистральные газопроводы, не должно превышать 20 мг/м3.
Слайд 7В большинстве случаев очистку газов предпринимают не только для доведения
содержания в нем вредных примесей до установленных норм, но и
для их извлечения с целью промышленной утилизации. Сероводород, выделяемый при очистке, перерабатывают в элементарную серу или серную кислоту. Так, например, более 30% мирового производства серы - из природных газов, богатых сероводородом; более 5 млн. т/год серы производят в настоящее время Оренбургский и Астраханский ГПЗ.
Слайд 8Сероуглерод (дисульфид углерода, CS2) - летучая бесцветная жидкость плотностью 1,29
г/см3, кипящая при температуре 46,3°С. В воде не растворяется, но
придает ей запах, хорошо растворим в этаноле и хлороформе. В воздухе легко воспламеняется. При повышенных температурах реагирует с водородом, образуя сероводород.
Сероуглерод ядовит, вызывает острые отравления при концентрациях в воздухе даже 0,001 мг/м3.
Слайд 9Серооксид углерода (COS) - бесцветный легко воспламеняющийся очень ядовитый газ,
не имеющий запаха, конденсирующийся при температуре 50,2°С, ПДК серооксида углерода
- не более 1 мг/м3 в производственных помещениях, не более 0,15 мг/м3 - в населенных пунктах. При нагревании разлагается с образованием диоксида углерода, сероуглерода, оксида углерода и серы.
Слайд 10Меркаптаны (тиолы, RSH) - аналоги спиртов, в которых кислород замещен
атомом серы. В связи с тем, что энергия диссоциации связей
S-Н меньше, чем связей О-Н, меркаптаны химически более активны, чем спирты. Эти соединения с резким неприятным запахом нерастворимы в воде, но хорошо растворимы в органических растворителях. Резкий запах меркаптанов используется при применении их в качестве одорантов природного газа. При контакте с металлами меркаптаны реагируют с ними с образованием меркаптидов металлов, то есть протекает так называемая меркаптановая коррозия. При нагревании до 300°С меркаптаны разлагаются с образованием сероводорода и сульфидов. Для большинства катализаторов меркаптаны являются ядами.
Слайд 11Сульфиды и дисульфиды (R-S-R, R-S-S-R) - хорошо растворимы в углеводородах,
но практически нерастворимы в воде. Они нейтральны, но реагируют со
щелочью. При нагревании до 400°С сульфиды разлагаются с образованием сероводорода и алкенов, а дисульфиды - дополнительно к этим соединениям и меркаптанов. По сравнению с сульфидами дисульфиды более реакционноспособны.
Слайд 12Диоксид углерода - бесцветный негорючий газ, обладающий кислыми свойствами. При
температуре -78,5°С при нормальном давлении образует «сухой лед», минуя жидкое
состояние. Термически устойчив, диссоциирует при температурах выше 200°С. В воде растворим ограниченно.
Слайд 13Азот и гелий - негорючие инертные газы, снижающие теплоту сгорания
природных газов. Гелий, хотя и содержится в газе в небольших
количествах, но специально извлекается для целевого использования.
Слайд 14Методы очистки газов от кислых компонентов
В настоящее время для очистки
газа от кислых компонентов используют три группы методов: абсорбционные, адсорбционные
и каталитические.
Слайд 15Абсорбционные методы включают три различные группы методов очистки в зависимости
от природы взаимодействия кислых компонентов с активной частью абсорбента:
-Процессы физической
абсорбции, в которых извлечение кислых компонентов происходит за счет их растворимости в органическом абсорбенте.
-Хемосорбционные процессы основаны на химическом взаимодействии сероводорода и диоксида углерода с активной частью абсорбента.
-Процессы физико-химической абсорбции используют комбинированные абсорбенты - смесь физического абсорбента с химическим.
Слайд 16Адсорбционные методы очистки газов основаны на селективном извлечении кислых компонентов
твердыми поглотителями - адсорбентами. В том случае, когда извлекаемый компонент
удерживается адсорбентом только физическими силами, имеет место физическая адсорбция. Если извлекаемый
компонент вступает с адсорбентом в химическое взаимодействие говорят о химической адсорбции.
Слайд 17Каталитические методы очистки газов применяют в тех случаях, когда в
газе присутствуют соединения, недостаточно полно удаляемые с помощью жидких или
твердых поглотителей, например сероуглерод, серооксид углерода, сульфиды, дисульфиды, тиофен, а также в тех случаях, когда требуется тонкая очистка газа.
Слайд 18В промышленности нашли применение два вида каталитических процессов - окислительные
и восстановительные.
Окислительные методы заключаются в проведении реакций каталитического окисления сероводорода
до элементной серы или каталитического окисления меркаптанов до дисульфидов.
Восстановительные методы заключаются в восстановлении сернистых соединений при взаимодействии их с водородом (гидрирование) или с водяным паром (гидролиз), а также в гидрировании диоксида углерода до метана. При восстановлении сернистых соединений все они превращаются в сероводород.
Слайд 19После проведения любых каталитических процессов очистки от сернистых соединений требуется
последующее отделение продуктов каталитических превращений, например, после каталитического гидрирования газ
направляют на очистку от сероводорода.
Кроме перечисленных промышленных методов очистки газов от кислых примесей, разрабатываются новые методы: микробиологические, мембранные, фотохимического разложения. Выбор процесса очистки природного газа от кислых компонентов зависит от многих факторов: состава и параметров сырьевого газа, требуемой степени очистки, путей использования товарного газа и др.
Слайд 20Очистка газов от диоксида углерода
Методы очистки газов от диоксида углерода
можно разделить на следующие группы:
-физическая абсорбция, основанная на растворимости диоксида
углерода в полярных растворителях (вода, метанол);
-хемосорбция, основанная на химическом связывании диоксида углерода при взаимодействии его с соединениями щелочного характера (щелочь, этаноламины, растворы карбонатов);
-адсорбция, основанная на поглощении диоксида углерода твердыми сорбентами (например, цеолитами);
-каталитическое гидрирование.
Слайд 21Физическая абсорбция
Абсорбция водой — распространенный метод улавливания диоксида углерода из
газов. Основные преимущества метода— доступность и дешевизна абсорбента, недостатки —
невысокая поглотительная способность водой диоксида углерода (8 кг С02 на 100 кг абсорбента) и небольшая селективность. Наряду с диоксидом углерода в воде в малых количествах растворяются водород, оксид углерода, азот и др. Поэтому выделяющийся диоксид углерода недостаточно чистый.
Слайд 22Схема установки очистки газа от диоксида углерода этим методом весьма
проста. Г аз промывают холодной водой в башнях с насадкой
(скрубберах) под давлением 1,5-2,5 МПа, так как растворимость диоксида углерода в воде возрастает с повышением давления. При этом из газа удаляется частично и сероводород, растворимость которого также увеличивается под давлением. Затем давление снижают, и из воды выделяется (десорбируется) газ, содержащий до 85% диоксида углерода (остальное - водород, азот, сероводород), который используют для получения сухого льда, карбамида, соды и других продуктов.
Слайд 23Абсорбция метанолом («ректизол»-процесс) - более выгодный промышленный метод, его можно
использовать при температуре до -60°С, когда резко повышается поглотительная способность
метанола. Так, при минус 60°С и давлении около 0,4 МПа в 1 г метанола может раствориться до 600 см3 диоксида углерода. Растворимость С02 в метаноле значительно выше, чем в воде. Диоксид углерода из раствора выделяют понижением давления и повышением температуры. Кроме метанола можно использовать и другие органические растворители: N-метилпирролидон, сульфолан, пропиленкарбонат. Однако широкого распространения они пока не получили.
Слайд 24Хемосорбционные методы
Очистка газов водными растворами этаноламинов. При подготовке различных технологических
газов к переработке (в частности, пирогаза к разделению) используют хемосорбцию
диоксида углерода этаноламинами.
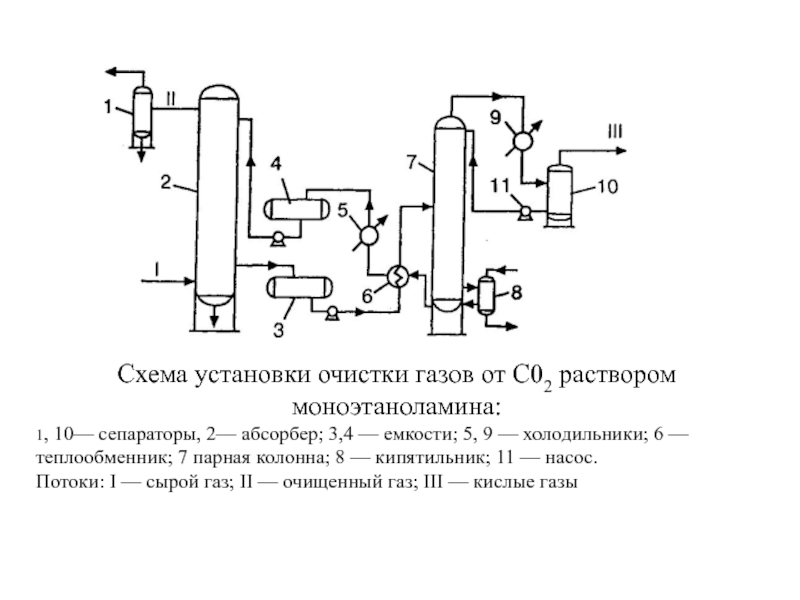
Слайд 25
Схема установки очистки газов от С02 раствором моноэтаноламина:
1, 10— сепараторы,
2— абсорбер; 3,4 — емкости; 5, 9 — холодильники; 6
— теплообменник; 7 парная колонна; 8 — кипятильник; 11 — насос.
Потоки: I — сырой газ; II — очищенный газ; III — кислые газы
Слайд 26Максимальной абсорбционной способностью по отношению к диоксиду углерода обладает моноэтаноламин
(МЭА):
С02 + Н20 + HOCH2CH2NH2 = (H0CH2CH2NH3)HC03
Равновесная растворимость диоксида углерода
зависит от давления газа, температуры абсорбции и концентрации раствора. Обычно используют 15-20%-ные растворы моноэтаноламина. Абсорбция протекает при 40-45°С и давлении 1,5-3,0 МПа (в зависимости от схемы производства). Образовавшиеся в результате хемосорбции карбонаты и бикарбонаты разлагаются в десорбере с выделением диоксида углерода при нагревании потока до 120°С.
Слайд 27Получаемый при этом высококонцентрированный диоксид углерода (99%-ный) используют для производства
соды, карбамида, сухого льда. Этот процесс с экономической и экологической
точек зрения - один из лучших.
Слайд 28Сырой газ подается в низ, а поглотитель кислых газов -
в верх абсорбера 2. Выйдя из колонны, очищенный газ поступает
в сепаратор 1 для отделения унесенных капель раствора МЭА. Насыщенный раствор поглотителя поступает в ёмкость 3 для отделения от растворенных углеводородных газов, проходит через теплообменник 6 и попадает в отпарную колонну 7. Кислые газы, пары воды и МЭА сверху отпарной колонны 7 после охлаждения поступают в сепаратор 10, откуда конденсат откачивается на орошение колонны. Регенерированный раствор из низа колонны проходит через теплообменник 6, холодильник 5 и поступает в ёмкость 4, откуда направляется на орошение абсорбера2.
Слайд 29Основной недостаток - значительный расход тепла на регенерацию сорбента, возрастающий
с увеличением концентрации диоксида углерода в очищенном газе, а также
потери относительно летучего абсорбента.
Слайд 30Очистка растворами карбонатов. Основана на взаимодействии диоксида углерода с водными
растворами карбонатов натрия и калия (обычно поташа) с активирующими добавками
оксидов поливалентных металлов. Для повышения растворимости карбонатов в воде и скорости хемосорбционного процесса используют горячие растворы карбонатов (110—120°С). Обычно применяют 25%-ный водный раствор поташа, активированный мышьяком.
Слайд 31Давление на стадии абсорбции 1-2 МПа. Раствор регенерируют снижением давления
при близких с процессом хемосорбции температурах. Степень очистки газа от
диоксида углерода несколько ниже, чем при очистке раствором моноэтаноламина. Остаточное содержание диоксида углерода - 0,05-0,1% (масс.), но поташ дешевле, чем моноэтаноламин.
Слайд 32Адсорбционные методы
Эффективные адсорбенты диоксида углерода — цеолиты. Молекулы диоксида углерода
довольно малы. Их диаметр составляет около 0,31 нм (3,1 А),
что позволяет им проникать во внутреннюю структуру большинства цеолитов. Наиболее часто для адсорбции используют цеолит СаА. Вместе с диоксидом углерода цеолиты поглощают и пары воды. Поэтому одновременно с очисткой газов от диоксида углерода происходит их осушка. Десорбцию поглощенных компонентов осуществляют понижением давления и повышением температуры.
Слайд 33Каталитическое гидрирование.
Этот метод применяют для удаления небольших количеств (порядка долей
процента) диоксида и оксида углерода, кислорода (т.е. каталитических ядов). Метод
основан на следующих реакциях:
СО + ЗН2 -► Н20 + СН4
С02 + 4Н2 -► 2Н20 + СН4
02 + 2Н2 -► 2Н20
Реакции протекают при давлениях 0,1-30 МПа, температуре 300-350°С (катализатор Fe) и 200°С (катализатор Ni-Cr или Ni-Al).
Слайд 34Очистка газов от сероводорода
Состав сернистых соединений и их концентрации в
природном и попутных нефтяных газах различных месторождений варьируются в очень
широких пределах.
Методы очистки газов от сероводорода можно разделить на две основные группы: сорбционные и каталитические.