Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные реакции (ОВР)
Содержание
- 1. Окислительно-восстановительные реакции (ОВР)
- 2. Правила вычисления степени окисления (СО) элементов:
- 3. Определите степени окисления атомов химических элементов по
- 4. Слайд 4
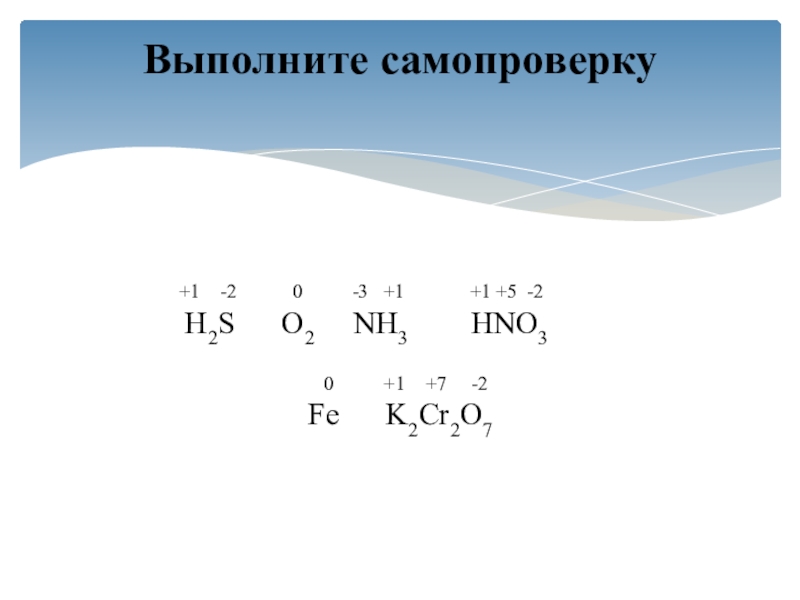
- 5. Определите, что происходит со степенью окисления серы
- 6. А) H2S-2 → S+4 O2 → S+6
- 7. Окислительно-восстановительные реакции (ОВР) – реакции, которые протекают
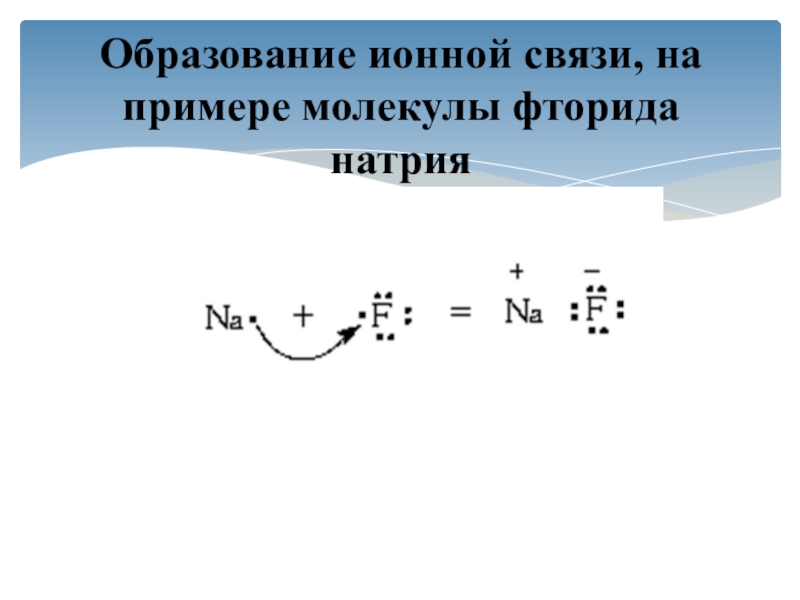
- 8. Образование ионной связи, на примере молекулы фторида натрия
- 9. Что можно сказать о завершённости внешнего уровня
- 10. Окисление – процесс отдачи электронов атомом.Окислитель –
- 11. Изучите алгоритм составления уравнений ОВР методом электронного баланса РАССТАНОВКА КОЭФФИЦИЕНТОВ В ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
- 12. Расставьте коэффициенты в УХРAl2O3 + H2 =
- 13. Ответьте на вопросы Какова была тема урока?Какая
- 14. Скачать презентанцию
Правила вычисления степени окисления (СО) элементов:
Слайды и текст этой презентации
Слайд 5Определите, что происходит со степенью окисления серы при следующих переходах:
А)
H2S → SO2 → SO3
Б) SO2→ H2SO3 → Na2SO3
Какой можно
сделать вывод после выполнения второй генетической цепочки?На какие группы можно классифицировать химические реакции по изменения степени окисления атомов химических элементов?
Выполните задание
Слайд 6А) H2S-2 → S+4 O2 → S+6 O3
Б) S+4 O2→
H2S+4 O3 → Na2S+4O3
В первой цепочке превращений сера повышает свою
СО от (-2) до (+6).Во второй цепочке степень окисления серы не меняется.
Проверяем
Слайд 7Окислительно-восстановительные реакции (ОВР) – реакции, которые протекают с изменением степени
окисления атомов, входящих в состав реагирующих
Запишем определение
Слайд 9Что можно сказать о завершённости внешнего уровня атомов фтора и
натрия?
Какому атому легче принять, а какому легче отдать валентные электроны
с целью завершения внешнего уровня?Как можно сформулировать определение окисления и восстановления?
Ответьте на вопросы
Слайд 10Окисление – процесс отдачи электронов атомом.
Окислитель – атом, принимающий электроны
и понижающий свою степень окисления, в процессе реакции – восстанавливается.
Восстановитель
– атом, отдающий электроны и повышающий свою степень окисления, в процессе реакции – окисляется. Восстановление – процесс принятия электронов атомом.
Запишем определения
Слайд 11Изучите алгоритм составления уравнений ОВР методом электронного баланса
РАССТАНОВКА КОЭФФИЦИЕНТОВ
В ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
Слайд 12Расставьте коэффициенты в УХР
Al2O3 + H2 = H2O + Al
методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель), выполните
самопроверку.Закрепление
Слайд 13
Ответьте на вопросы
Какова была тема урока?
Какая цель стояла перед
тобой на уроке?
Как работали на уроке твои одноклассники?
Как работал ты
на уроке?Сегодня я узнал…
Теперь я умею…
Рефлексия